28. El valor de ∆H de vaporización del agua es 539.4cal/g en el
Anuncio

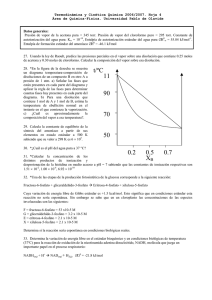
Termodinámica y Cinética Química 2005/2006. Hoja 5 Área de Química-Física. Universidad Pablo de Olavide 28. El valor de ∆H de vaporización del agua es 539.4cal/g en el punto de ebullición normal. a) Algunos hongos pueden sopotar los 100ºC formando esporas. Sin embargo, la mayor parte de las esporas resisten hasta los 120ºC. Por esta razón en las autoclaves usadas para esterilizar instrumental médico y de laboratorio, se aumenta la presión para elevar el punto de ebullición del agua a 120ºC. A qué presión hierve el agua a 120ºC? b) Cuál es el punto de ebullición del agua en lo alto del pico de Pike (altitud=14100 pies), donde la presión atmosférica es normalmente 446 torr ? 29. Algunas presiones de vapor de mercurio líquido son: a) Calcular el valor medio de de vaporización en este intervalo de temperaturas. b) Calcular la presión de vapor a 160ºC. 30. Calcule el calor de evaporación del agua a 373.15K y presión de 101.325KPa de la ecuación de Clausius- Clayperon. La presión de vapor del agua es 3.17KPa a 298.15K . 31. La presión de vapor del n-propanol es 1.94KPa a 293K y 31.86KPa a 343K . Cuál es la entalpía de evaporación? 32. La entropía molar de evaporación del agua es de 108.72J/K a 760torr . Las densidades correspondientes del agua líquida y del vapor del agua son: 0.958 y 5.98 10-4 Kg/dm3 respectivamente. Calcule el cambio de presión para una variación de temperatura de 1 grado 33. El m-dinitrobenceno se funde a 89.8ºC con una presión de una atmósfera, y a 114.8ºC con una presión de 98 atm . Si el ∆Hf vale 24.7cal/g cuál será el cambio de volumen en la fusión? 34. Usando la Ley de Raoult, predice las presiones parciales en el vapor sobre una disolución que contiene 0.25 moles de acetona (Ppuro = 345 torr) y 0.30 moles de cloroformo (Ppuro = 295 torr). Calcular la composición del vapor sobre esa disolución. 35. En la figura de la izquierda (hoja 6) se muestra un diagrama presión-composición de disoluciones de un compuesto B en otro A. a) Señalar las fases que están presentes en cada parte del diagrama y aplicar la regla de las fases. b) Para una disolución que contiene 1 mol de A y 1 mol de B, estima la presión de vapor a 70 oC en el instante en el que comienza la vaporización. c) ¿Cuál es la presión de vapor de la disolución a 70 oC cuando queda la última gota de líquido? 36. En la figura de la derecha se muestra un diagrama temperatura-composición de disoluciones de un compuesto B en otro A a presión de 1 atm. a) Señalar las fases que están presentes en cada parte del diagrama y aplicar la regla de las fases para determinar cuantas fases hay presentes en cada parte del diagrama. b) Para una disolución que contiene 1 mol de A y 1 mol de B, estima la temperatura de ebullición normal en el instante en el que comienza la vaporización. c) ¿Cuál es aproximadamente la composición del vapor a esa temperatura?.