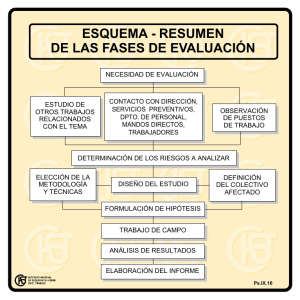
Á TERMODINÁMICA T m 7 C n pt s F nd m nt l s Tema 7: Conceptos
Anuncio

TERMODINÁMICA Á T m 7: Tema 7 Conceptos C n pt s Fundamentales F nd m nt l s Fundamentos Físicos de la Ingeniería 1er Curso Ingeniería Industrial Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 1 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico C d Coordenadas d ttermodinámicas di á i Equilibrio q Procesos termodinámicos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 2/27 Introducción Termodinámica: rama de la Física que estudia los fenómenos inherentes a las transformaciones energéticas y sus efectos sobre el estado de la materia Origen: estudio de la producción de trabajo a partir de fuentes de calor Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 3/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico C d Coordenadas d ttermodinámicas di á i Equilibrio q Procesos termodinámicos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 4/27 Sistema y entorno Sistema: región del universo que aislamos para estudiarla Frontera Sistema Entorno Curso 2009/10 masa y energía Joaquín Bernal Méndez Dpto. Física Aplicada III 5/27 Clasificación de los sistemas Abierto: existe transferencia de materia y energía entre sistema y entorno Cerrado: sólo hay transferencia de energía Ejemplos: turbina; organismo vivo. Ejemplo: gas encerrado en recipiente con paredes móviles Aislado: no hay intercambio de materia ni energía í Ejemplos: universo; sistema junto con su entorno Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 6/27 Clasificación de los sistemas Homogéneos: propiedades físicas y químicas iguales en todo punto del sistema Ejemplos: gas, disolución diluida, sólido puro Heterogéneos: formado por subsistemas homogéneos (fases) de propiedades distintas Ejemplo: disolución saturada saturada, agua y hielo En este bloque nos limitaremos al estudio de sistemas homogéneos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 7/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico C d Coordenadas d ttermodinámicas di á i Equilibrio q Procesos termodinámicos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 8/27 Criterios macroscópico p y microscópico Descripción del estado de un sistema: Mecánica: coordenadas espaciales p y de velocidad Electromagnetismo: valores de los campos eléctricos y magnéticos en todos los puntos del espacio En Termodinámica se trata de describir el estado “interno” de un sistema Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 9/27 Criterio microscópico p Método de la Termodinámica estadística Es p preciso establecer una hipótesis p sobre estructura de la materia Se describe el estado del sistema con muchas variables: Peso No iintuitivas N t iti No medibles • Velocidad media Pistón Gas Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III • Tiempo promedio entre colisiones • etc.. 10/27 Criterio macroscópico p Método de la Termodinámica clásica No se p parte de hipótesis p sobre estructura de la materia Se describe el estado del sistema con unas pocas variables: Sugeridas S id por llos sentidos tid Medibles P, V, T Curso 2009/10 Peso Pistón Gas Joaquín Bernal Méndez Dpto. Física Aplicada III 11/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico C d Coordenadas d ttermodinámicas di á i Equilibrio q Procesos termodinámicos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 12/27 Coordenadas termodinámicas Magnitudes macroscópicas útiles para determinar el estado de un sistema Ej Ejemplos: l presión, ió volumen, l masa, ttemperatura… t También: propiedades del sistema Normalmente un subconjunto de estas coordenadas termodinámicas es suficiente para caracterizar el estado del sistema: Coordenadas de estado ó variables de estado Joaquín Bernal Méndez Dpto. Física Aplicada III Curso 2009/10 13/27 Coordenadas termodinámicas P, T, V, , m P, T, P, T, V/2 V/2 m/2 m/2 Propiedades extensivas: su valor depende de las dimensiones del sistema Propiedades intensivas: su valor no depende de la masa ni del volumen del sistema Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 14/27 Coordenadas termodinámicas Las propiedades extensivas pueden expresarse por unidad de masa: magnitudes específicas Ejemplo: volumen específico: v V m También T bié pueden d expresarse por unidad id d molar: magnitudes molares específicas Ejemplo: volumen molar: v V 0 n Las magnitudes específicas son intensivas Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 15/27 Coordenadas termodinámicas Tienen un significado Ti i ifi d macroscópico ó i Carece de sentido aplicarlas a sistemas con un reducido número de moléculas o átomos ¡ Una molécula carece de T ó P ! Cuando se usan en forma diferencial: dP, p dV… denotan cambios macroscópicos. Ejemplo: Un dV es un cambio de volumen pequeño respecto a V, pero suficientemente grande para contener un número muy elevado de moléculas Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 16/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico C d Coordenadas d ttermodinámicas di á i Equilibrio q Procesos termodinámicos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 17/27 Equilibrio q Se dice que un sistema se encuentra en equilibrio termodinámico si no es capaz de experimentar un cambio espontáneo de estado sin un cambio de su entorno El equilibrio q termodinámico implica: p Equilibrio térmico Equilibrio mecánico Equilibrio de fases Equilibrio químico Las propiedades de un sistema solamente están definidas con claridad dentro del equilibrio Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 18/27 Equilibrio: q ecuación de estado Relación entre las coordenadas termodinámicas de un sistema en equilibrio Pueden obtenerse mediante experimentación ó estudio teórico (ajeno a la Termodinámica) Sistema PVT PVT: f ( P,V , T ) 0 Peso Ejemplos: Pistón Gas ideal: PV nRT Gas de Van a de der Waals: aa s 2 a P n V nb nRT 2 V Gas Joaquín Bernal Méndez Dpto. Física Aplicada III Curso 2009/10 19/27 Equilibrio: q ecuación de estado Ejemplo: sistema hidrostático puro puro, sistema simple compresible ó sistema PVT Peso Pistón Gas Coordenadas termodinámicas: P, P V, T, ,… Ecuación de estado: f ( P,V , T ) 0 Dos coordenadas describen el estado del sistema Coordenadas de estado Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 20/27 Equilibrio: q ecuación de estado Ejemplo: hilo estirado L F Curso 2009/10 Coordenadas termodinámicas: F, L, T, densidad lineal… Ecuación de estado: f ( F , L, T ) 0 Dos coordenadas describen el estado del sistema Coordenadas de estado Joaquín Bernal Méndez Dpto. Física Aplicada III 21/27 Índice Introducción Sistema y entorno Criterios macroscópico y microscópico C d Coordenadas d ttermodinámicas di á i Equilibrio q Procesos termodinámicos Funciones de estado Procesos cuasi-estáticos Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 22/27 Procesos termodinámicos Cuando cambia alguna propiedad del sistema, el estado del sistema cambia Proceso termodinámico Tipos especiales de procesos: Isotermo: la temperatura permanece constante Isóbaro: la p presión p permanece constante Isocoro: el volumen permanece constante Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 23/27 Funciones de estado Toda magnitud cuya variación en un proceso depende exclusivamente del estado inicial y el estado final: Y Y2 Y1 Matemáticamente: toda magnitud que puede expresarse como una función de las variables de estado Y Y ( P, T ) Ejemplos: energía interna interna, entalpía, entalpía volumen,… volumen No son funciones de estado el calor y el trabajo Las propiedades L i d d d de un sistema i t son, por definición, funciones de estado Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 24/27 Procesos cuasi-estáticos Infinitamente lentos (irrealizables) El sistema se considera en equilibrio en cualquier punto del proceso La ecuación de estado se cumple en cualquier punto del proceso Tienen gran importancia teórica y práctica en Termodinámica Joaquín Bernal Méndez Dpto. Física Aplicada III Curso 2009/10 25/27 Procesos cuasi-estáticos Un proceso cuasi-estático U i táti puede d representarse t en una gráfica (sucesión de puntos de equilibrio): P 2 P 2 1 1 V Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III T 26/27 Resumen La termodinámica clásica estudia el estado macroscópico de los sistemas y cómo les afectan las transformaciones energéticas El estado del sistema viene determinado por el valor de sus propiedades ó coordenadas termodinámicas E un sistema En i t en equilibrio ilib i existe i t una ecuación ió d de estado: t d propiedades no son independientes Las propiedades necesarias y suficientes para determinar el estado del sistema: coordenadas de estado Cuando un sistema cambia de estado sufre un proceso termodinámico L funciones Las f i de d estado t d son aquellas ll magnitudes it d cuya variación i ió en un proceso sólo depende del estado inicial y el estado inicial, pero no de la forma en que se realiza el proceso L propiedades Las i d d d de un sistema i t son ffunciones i d de estado t d Un proceso cuasi-estático es aquel en el que el sistema se encuentra siempre en equilibrio (irrealizable en la práctica) Curso 2009/10 Joaquín Bernal Méndez Dpto. Física Aplicada III 27/27