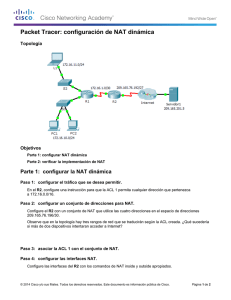
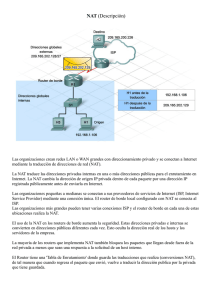
INTRODUCCIÓN A LAS TÉCNICAS NAT
Anuncio

INTRODUCCIÓN A LAS TÉCNICAS DE DETECCIÓN DE ÁCIDOS NUCLÉICOS (N.A.T.) BIOQ. LILIANA DI TULLIO BUDASSI FAC. CS .BIOQUÍMICAS Y FARMACÉUTICAS UNIVERSIDAD NACIONAL DE ROSARIO lilianadt2003@yahoo.com.ar INFECCIONES TRANSMISIBLES POR TRANSFUSIÓN Patógenos transmisibles por transfusión Virus Parásitos Bacterias Agentes no convencionales-Priones Virus de la Hepatitis B (HBV) Virus de la Hepatitis C (HCV) Virus de la Inmunodeficiencia Humana 1 y 2 (HIV1/2) Virus Linfotrópico Humano I/II (HTLV I/II) otros: H1N1, virus del Dengue, West Nile Virus Trypanosoma cruzi (Enf. de Chagas-Mazza) otros: Plasmodium malariae, Pl falciparum Treponema pallidum (Sífilis) Brucella abortus (Brucelosis) otros 2 TAMIZAJE DE INFECCIONES TRANSMISIBLES POR TRANSFUSIÓN EN ARGENTINA (LEY 22.990 - LEY NACIONAL DE SANGRE ) HVB: Enzimoinmunoensayos HBsAg y anti-HBc total HCV :Enzimoinmunoensayo anti- HCV y Ag HCV HIV1/2 : Enzimoinmunoensayo ag-p24 y anti-HIV1/2 HTLV I/II: Enzimoinmunoensayo anti-HTLV I/II Chagas : Enzimoinmunoensayo y Hemaglutinación indirecta, ambos anti- Tripanosoma cruzi Sífilis: Test de VDRL anti- Treponema pallidum Brucelosis: Reacción de Huddlesson, anti-Brucella abortus 3 TAMIZAJE DE INFECCIONES TRANSMISIBLES POR TRANSFUSIÓN Métodos indirectos: detección en la sangre (suero o plasma) del donante de la presencia de una respuesta inmune contra un patógeno dado Diagnóstico serológico mediante diferentes técnicas de laboratorio Ej: análisis en búsqueda de anticuerpos específicos contra HIV en el suero del donante (EIA anti-HIV 0/1/2) Métodos directos: detección directa de la presencia del patógeno (genoma o antígenos) en la sangre del donante Ej: EIA para detectar p24 HIV, HBsAg o HCV ag Técnicas de biología molecular: buscan el DNA o RNA viral 4 FACTORES DE RIESGO EN LA TRANSMISIÓN DE INFECCIONES A TRAVÉS DE LAS TRANSFUSIÓN Errores humanos o de laboratorio Problemas en los sistemas de análisis/equipos Insuficiencias en la calidad de los análisis Entrenamiento deficitario Seroconversiones atípicas Variantes o genotipos del patógeno no detectadas Cambios epidemiológicos Periodo de “ventana” serológico 5 PERÍODO VENTANA TIEMPO ENTRE EL MOMENTO DE LA INFECCIÓN Y EL DESARROLLO DE MARCADORES SEROLÓGICOS Período Ventana: NAT Eclipse Reacción inmune Reactivo Serológico 6 Infección Tiempo Riesgo de infección por unidad transfundida EVOLUCIÓN DEL RIESGO EN LA PROVISIÓN DE SANGRE 1/100 HCV 1/1000 HBV 1/10,000 1/100,000 HIV 1/180,000 1/1.600,000 1/1000,000 1/1.900,000 Ac Anti-HIV 1985 Ac Anti-HCV 1990 p24 1996 Año NAT 1999 2001 Bacterial Contamination of Blood Components: Risks, Strategies, and Regulation Hillyer et al. Joint ASH and AABB Educational Session in Transfusion Medicine. Hematology 2003 7 NUCLEIC ACID TESTING Ventajas de NAT Importante avance teconológico en screening de sangre Altamente sensible & específico dirigido especificamente a las secuencias nucléicas virales Detección directa del RNA or DNA viral Ayuda a la prevención de transfusión enfermedades transmisibles por Provee una etapa adicional de seguridad a la provisión de sangre segura 8 Reduce el Período Ventana desde la infección hasta la detección OBJETIVO DE NAT O DGV: DISMINUCIÓN DEL PERÍODO DE VENTANA NAT positivo Eclipse Período Ventana Virus Reacción inmune Reactividad Serológica Infección Tiempo Detección más temprana 9 EJ: EVOLUCIÓN CLÍNICA DE HIV: DÓNDE ACTÚA NAT? 10 EVOLUCIÓN EN LA IMPLEMENTACIÓN DE LAS TÉCNICAS NAT EN LOS BANCOS DE SANGRE 1993 se considera formalmente la utilización de NAT para el tamizaje en bancos de sangre, luego que la Food and Drug Administration (FDA) reportara diversos casos de infección por el VHC como consecuencia del uso de inmunoglubulina intravenosa manufacturada. 1995 Comité Europeo para Productos Medicinales Manufacturados (CPMP) se adhirió a este lineamiento, haciéndolo extensivo a todos los productos medicinales derivados del plasma. 1997 Organización Mundial de la Salud (OMS) se establecen estándares para el ADN del VHB, el ARN del VHI-1, el ARN del VHC y el ADN del Parvovirus B19. 2000-2001 diferentes países incorporan paulatinamente NAT para HCV y HIV en el tamizaje de donaciones. 2009 OMS en su documento “Recommendations: Screening Donated Blood for Transfusion-Transmisibles Infection” sugiere que junto a los ensayos de tamizaje serológicos para VHC, VIH y VHB, dirigidos a los marcadores serológicos de antígenos y/o anticuerpos, se realice la búsqueda de ácidos nucléicos virales para 11 estos patógenos. PERÍODO VENTANA MODEL TESTING DATA Fuente: Busch et al. Transfusion.2005;45(2):254-264. Kleinman and Busch. Transfusion. 2006;36:S23-S29 . 12 VENTAJAS NAT VIRUS Pruebas serológicas NAT MP NAT ID (Minipool) (Individual) VIH (incluye p24) 16 días 10 días 7 días VHC 70 días 9 días 7 días VHB 59 días 49 días 38 días Acortamiento del período de ventana inmunológico Disminución del riesgo residual 13 TÉCNICAS BASADAS EN BIOLOGÍA MOLECULAR Involucran tres etapas: 1. Extracción o captura del genoma viral 2. Amplificación 3. Detección Ejemplos: PCR(Polymerase Chain Reaction) RT-PCR (Real Time PCR) NASBA (Nucleic Acid Based on Amplification) TMA (Transcriptional Mediated Amplification) 14 PCR Real Time PCR TMA NASBA Nuclisens Easy Q system TMA: pasos principales del ensayo Detección EasyQ Instrument & Reagents NucliSens EasyQ Incubator Desktop computer Strip centrifuge Amplificación Captura del blanco o diana (target) NucliSens EasyQ Analyzer 15 MODELOS DE PROCESAMIENTO DE LAS TÉCNICAS NAT Técnicas “in house” Técnicas comerciales Técnicas Cualitativas Técnicas Cuantitativas Procesamiento de las muestras individuales (ID) o en mini-pools (MP) POOL 48 POOL 24 UNIDADES POOL 8 POOL 8 POOL 24 UNIDADES POOL 8 POOL 8 POOL 8 POOL 8 16 NAT DETECTA INFECCIÓN HCV MÁS TEMPRANO QUE EL TEST DE ANTICUERPOS HCV GEq/mL HCV GEq/mL 10,000,000 10,000,00 S/CO 5 7 días 4 28 días 100,000 3 10,000 2 NAT ID test 1,000 0 10 20 30 0 Días Fuente: Susan Stramer, Ph.D., American Red Cross, 1999 40 1 NAT pool HCV Ac 0 50 17 PUNTOS IMPORTANTES A CONSIDERAR EN CUANTO AL ORIGEN DEL MÉTODO A ELEGIR: Sensibilidad Especificidad Detección de variantes/subtipos Reproducibilidad Trazabilidad de reactivos y resultados Software adecuado Control Interno Control de Contaminación Ensayos discriminatorios/confirmatorios Identificación de su uso: RUO o IVD Marca CE, FDA, ANMAT 18 PARA ASEGURAR LA CALIDAD DEL RESULTADO, CADA SISTEMA NAT DEBE POSEER CONTROLES ADECUADOS EN SUS DIFERENTES ETAPAS: Controles de Reactivos: para evaluar la presencia de ADN/ARN foráneo o productos de amplificaciones precedentes. Control Negativo: para evaluar los riesgos de contaminación (en la organización del espacio físico, en los métodos de trabajo, posible aerozolización durante el alicuotado de reactivos) Control Positivo: para controlar la presencia de inhibidores y el buen desarrollo de las diferentes etapas. Control Interno: para verificar la idoneidad de la amplificación y/o la presencia de inhibidores de la misma. 19 Marca (s) COBAS Ampliscreen HIV-1 Test Procleix UltraQual HIV-1 RT-PCR Assay UltraQual HCV RTPCR Assay COBAS AmpliScreen HCV Test COBAS AmpliScreen HBV Test Formato PCR HIV-1/HCV Nucleic Acid Test (TMA) PCR Muestra Plasma Plasma Uso habilitado Donor Screen Expanded Indications Roche Molecular For Use: Source Systems, Inc Plasma donors, other living donors, and organ donors Donor Screen Expanded Indications For Use: Source Plasma donors, living organ donors and cadaveric samples Donor Screen Plasma Donor Screen PCR Plasma PCR Plasma PCR Plasma Procleix WNV Assay Nucleic Acid Test (TMA) ID Plasma Fabricante Gen-Probe San Diego, CA 92121 National Genetics Institute Los Angeles, CA 92121 National Genetics Institute Los Angeles, CA 92121 Fecha de Aprobación 12/20/2002 02/08/2002 09/18/2001 09/18/2001 Donor Screen Expanded Indications For Use: Source Plasma donors, other living donors, and organ donors Donor Screen Indications For Use: Source Plasma donors, other living donors, and organ donors Roche Molecular Systems, Inc 12/3/2002 Roche Molecular Systems, Inc 04/21/2005 Qualitative detection of West Nile Virus (WNV) RNA from volunteer donors Gen-Probe San Diego, CA 92121 20 12/01/2005 COMPARACIÓN DE LA SENSIBILIDAD ANALÍTICA DE LOS TEST NAT 95% Límite de Detección (95% CI) HIV (IU/ml) HCV (IU/ml) HBV (IU/ml) WNV** (Copies/ml) Procleix TMA* 19.62 (17.15-23.16) 2.78 (2.44-3.37) 7.46 (6.43-8.97) 3.4 AmpliScreen* Std preparation 323.4 (284.9-387.3) 41.9 (28.0-111.8) 15.99 (13.78-20.06) Taq Screen AmpliScreen* Multiprep 78.4 (68.4-94.4) 28.8 (20.5-85.8) 4.41 (3.56-6.13) Ensayo 15 21 * Roche’s COBAS AmpliScreen US Package Inserts or Procleix Ultrio CE Package Insert ** From Busch et al. 2000.Transfusion 45, 492-499 DISEÑO, ACONDICIONAMIENTO E INFRAESTRUCTURA DEL LABORATORIO DE BIOLOGÍA MOLECULAR Metas principales para la instalación: Proporcionar el espacio suficiente para el flujo de trabajo y mantenimiento de equipos Evitar la contaminación Mantener la correcta temperatura , humedad y presión del ambiente 22 CONDICIONES GENERALES Nivel de seguridad 2 : BSL2 Paredes con pintura resistente a la descontaminación (ácidos o álcalis) Pisos con bordes sanitarios, antideslizante o de vinilo. Presión relativa ambiente: neutra o ligeramente negativa en área de post-amplificación Divisorios: gabinetes modulares a base de metal, con bordes sanitarios y puertas corredizas Mesadas: resistentes a agentes químicos Iluminación: compartimiento estanco Electricidad: UPS de soporte / grupo electrógeno 23 ÁREAS DEL LABORATORIO DE BIOLOGÍA MOLECULAR Área de preparación de reactivos y muestras Área de pre-amplificación Área de post-amplificación y detección Se definen las diversas áreas mediante barreras físicas o protocolo de barreras entre un área de trabajo y otra. Objetivo: evitar la contaminación entre áreas de trabajo diferentes 24 BIOSEGURIDAD EN EL LABORATORIO DE BIOLOGIA MOLECULAR Principal objetivo: minimizar la contaminación a través de… Diseño del ensayo Disposición del laboratorio Control del flujo de trabajo 25 ÁREAS DEL LABORATORIO DE BIOLOGÍA MOLECULAR Post-Amplificación Pre-Amplificación 26 GESTIÓN DE LA CALIDAD EN EL LABORATORIO DE BIOLOGIA MOLECULAR Manuales de Gestión de la Calidad Manuales de procedimientos Manual de Bioseguridad Estándares y normativas: Norma ISO 9001:2000 Norma ISO /IEC17025 /1999 Estándar Paul Erlich Institute Organismos internacionales: OMS “Collaborative Study Group” (provee CCE y establece la unidad de medida: UI/ml) Acreditación 27 CONCLUSIONES (1) Disminución del período ventana Otras aplicaciones: tests que permiten una detección directa de otros virus. Ej: WNV, otros virus emergentes Progresar desde analizar mini-pooles a analizar muestras individuales. Lograr la implementación de automatización total de las técnicas de NAT: -disminución de los errores del operador. -mejor estandarización operativa. -optimización de los tiempos de reacción. -trazabilidad de los productos liberados. 28 CONCLUSIONES (2) Necesidad de lograr un consenso nacional acerca de temas puntuales referentes a la implementación de NAT en Argentina: la obligatoriedad de las técnicas NAT en Medicina Transfusional, creación de comités de expertos que evalúen la necesidad de legislar el tema definición de la logística de centralización de muestras para lograr un tamizaje de manera uniforme y a un costo razonable evaluación de resultados obtenidos hasta el momento mediante las técnicas in house y comerciales, en pool o ID, con el objeto de definir si la sensibilidad de dichas técnicas y su ejecución son útiles en nuestro sistema de salud consolidación en la formación de los recursos humanos dedicados 29 a la aplicación de NAT.