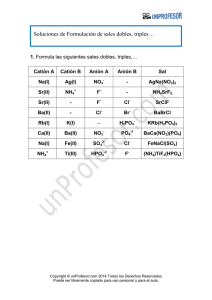
5.- El sulfato de amonio, (NH4)2 SO4, se utiliza como fertilizante en
Anuncio

ANDALUCÍA / SEPTIEMBRE 00. LOGSE / QUÍMICA / ESTEQUIOMETRÍA / OPCION A / CUESTIÓN 5 5.- El sulfato de amonio, (NH4 )2 SO4 , se utiliza como fertilizante en agricultura. Calcule: a) El tanto por ciento en peso de nitrógeno en el compuesto. b) La cantidad de sulfato de amonio necesaria para aportar a la tierra 10 kg de nitrógeno. Masas atómicas: H = 1; N = 14; O= 16; S = 32. Solución: a) En primer lugar calculamos el peso molecular del compuesto. Mm (NH4 )2 SO4 = 2· (14 + 4) + 32 + (4·16) = 132 g/mol Como en cada molécula de sulfato amónico hay 2 átomos de nitrógeno, se deduce que por cada 132 gramos de compuesto hay 28 gramos de Nitrógeno. De manera que se puede obtener el % en peso de N: Composición centesimal de N = (28 / 132) · 100 = 21,21 % (en peso) b) Se calcula el abono necesario para nitrogenar la tierra con 10 Kg: 100 Kg (NH4 )2 SO4 ------ 21,21 Kg N x ----------------------- 10 Kg N x = 10· (100 / 21,21) m fertilizante = 47,14 Kg de (NH4 )2 SO4 www.profes.net es un servicio gratuito de Ediciones SM