Acción de la nicotina como antidepresivo y regulador del sueño en
Anuncio

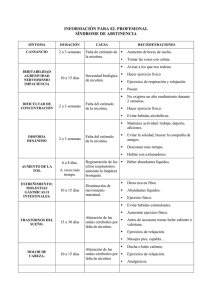
REVISIÓN Acción de la nicotina como antidepresivo y regulador del sueño en sujetos deprimidos P. Vieyra-Reyes a, A. Venebra-Muñoz b, B. Rivas-Santiago c, F. García-García b ACCIÓN DE LA NICOTINA COMO ANTIDEPRESIVO Y REGULADOR DEL SUEÑO EN SUJETOS DEPRIMIDOS Resumen. Introducción. La depresión es un trastorno heterogéneo crónico que se manifiesta por irregularidades en el humor y sueño que pueden llevar al suicidio. Individuos deprimidos tienden a fumar más que los no deprimidos y la interrupción de este hábito produce una depresión mayor que se revierte con el uso de antidepresivos o terapias de reemplazo de nicotina. Basándonos en estos hallazgos, explicaremos cómo actúa posiblemente la nicotina sobre dos neurotransmisores principales (serotonina y dopamina), y como neuroprotector en procesos depresivos, además de exponer el efecto de la nicotina como regulador de sueño en sujetos deprimidos. Objetivo. Describir y discutir las evidencias que han demostrado que la nicotina tiene propiedades antidepresivas. Desarrollo. Se presenta el orden de los hallazgos que demuestran que la nicotina puede utilizarse como antidepresivo: aspectos generales de la nicotina (farmacología, metabolismo y receptores nicotínicos), características generales de la depresión, mecanismo de interacción de la nicotina en los trastornos depresivos, y nicotina y regulación del sueño. Conclusiones. A pesar de que la base neurobiológica de esta asociación ‘nicotina-depresión’ no es clara, el mecanismo antidepresivo sugerido para la nicotina involucra su acción directa sobre la actividad dopaminérgica y serotoninérgica o su posible acción indirecta como neuroprotector, lo que origina efectos terapéuticos sobre la calidad de sueño y mejora de los síntomas depresivos. [REV NEUROL 2009; 49: 661-7] Palabras clave. Antidepresivo. Depresión. Dopamina. Nicotina. Receptores de acetilcolina nicotínicos. Serotonina. Sueño. INTRODUCCIÓN La depresión es un trastorno psiquiátrico que afecta a más del 21% de la población mundial, y se considera como un problema de salud pública [1]. Se manifiesta con sentimientos de desesperanza, inhabilidad para sentir placer (anhedonia), culpa y pesimismo, lo que puede conducir al suicidio [2]. Los pacientes deprimidos presentan, además, alteraciones del sueño, y la latencia corta a la aparición del primer período de sueño de movimientos oculares rápidos (sueño REM) es la principal característica de este trastorno [3,4]. Neuroquímicamente, se ha detectado disminución de la actividad noradrenérgica y serotoninérgica, e incremento de los niveles plasmáticos de cortisol, lo que se correlaciona con presencia de estrés en sujetos deprimidos. En años recientes, se ha sugerido que la nicotina puede desempeñar un papel importante como antidepresivo [5-9]. La nicotina es un alcaloide y el principal agente psicoactivo del tabaco. Su efecto sobre el sistema nervioso central resulta de la interacción con los receptores nicotínicos de la acetilcolina. Como es sabido, la acetilcolina es un neurotransmisor relacionado con una multitud de funciones, entre las que destacan la regulación del apetito, la motilidad muscular y el ciclo vigila-sueño. Se ha comunicado que individuos deprimidos tienden a fumar un mayor número de cigarrillos en comparación con los sujetos no deprimidos [10,11]. Además, si se interrumpe el consuAceptado tras revisión externa: 21.09.09. a Departamento de Neuroquímica. Facultad de Medicina. Universidad Autónoma del Estado de México. Toluca. b Departamento de Biomedicina. Laboratorio de Biología de Sueño. Instituto de Ciencias de la Salud. Universidad Veracruzana. Xalapa, Veracruz. c Unidad de Investigación Médica Zacatecas. Instituto Mexicano del Seguro Social. Zacatecas, Zacatecas, México. Correspondencia: Dra. Patricia Vieyra Reyes. Departamento de Neuroquímica. Facultad de Medicina. Universidad Autónoma del Estado de México. P. Tollocan, esq. J. Carranza, s/n. CP 50180 Toluca, México. Fax: 52 722 2 17 35 52. E-mail: pvieyra8@gmail.com © 2009, REVISTA DE NEUROLOGÍA REV NEUROL 2009; 49 (12): 661-667 mo de tabaco, se manifiesta un síndrome de abstinencia [12] y el trastorno depresivo se acentúa [13]. Se ha sugerido que los pacientes deprimidos fuman como una forma de ‘automedicación’ para aliviar algunos de los síntomas generados por su estado depresivo [10,14]. También se ha encontrado que el uso de parches transdérmicos de nicotina mejora el humor en pacientes deprimidos no fumadores de acuerdo con la valoración obtenida usando la escala de Hamilton [6,8]. Se han comunicado resultados similares con la administración transdérmica crónica de nicotina (más de un mes) y la administración oral de fluoxetina (antidepresivo tricíclico) en pacientes no fumadores y con trastorno depresivo [6]. Los registros de sueño en estos pacientes mostraron que la administración de nicotina disminuye la vigilia e incrementa la latencia al primer período de sueño REM [6, 7,15]. En modelos animales de depresión se han notificado resultados similares [16-21]. Aunque se ha demostrado claramente el efecto antidepresivo de la nicotina desde la perspectiva conductual, aún no está claro el mecanismo celular por el cual la nicotina produce estos efectos de mejora del humor en pacientes deprimidos. Existen indicios de que la nicotina actúa como neuroprotector contra el desarrollo de enfermedades neurodegenerativas, como Parkinson y Alzheimer [22]. En primates no humanos y en roedores, se ha demostrado mejoría en la capacidad de desarrollar actividades cognitivas [23]; por tal motivo se ha sugerido que la nicotina y sus agonistas podrían estar favoreciendo la síntesis o liberación de factores neurotróficos, como el factor de crecimiento neural, el factor de crecimiento fibroblástico 2 y el factor neurotrófico derivado del cerebro (BDNF) [24,25]. Dichos factores tróficos tienen un papel completamente demostrado como neuroprotectores. Sin embargo, no existen por el momento estudios que demuestren la acción neurotrófica o neuroprotectora de la nicotina en sujetos deprimidos. Por tal razón, el objetivo de la presente revisión es discutir los principales hallazgos respecto a la nicotina y su acción sobre 661 P. VIEYRA-REYES, ET AL el sistema serotoninérgico y dopaminérgico, candidatos potenciales de acción de esta sustancia con propiedades antidepresivas y reguladoras del sueño. a b ASPECTOS GENERALES DE LA NICOTINA Farmacología Cuando se fuma tabaco, la nicotina se c absorbe rápidamente, aunque la cantidad absorbida depende del volumen e intensidad de succión, la dilución con el aire y la profundidad de la inhalación. Después de la calada, altos niveles de nicotina alcanzan el cerebro en 10-20 s, más rápido que con administración intravenosa [26]. Las concen- Figura 1. Esquema que representa un receptor nicotínico. a) Mecanismo de acción del receptor nicotraciones de nicotina en la sangre arte- tínico tipo canal ante el acoplamiento de nicotina o de acetilcolina; b) Receptor nicotínico homopentamérico (α7), con cinco sitios de unión para acetilcolina o nicotina; c) Receptor heteropentamérico (α4β2), rial después de fumar un cigarro son con dos sitios de unión. Las estrellas señalan los sitios de unión. usualmente entre 20-60 ng/mL, y las concentraciones después de la primer calada son de 7 ng/mL [27]. aerosol, goma de mascar) puede provocar una sobredosis, que La absorción de nicotina a través de las membranas biológi- se manifiesta por la presencia de náuseas, vómitos y el posible cas depende del pH. La absorción es rápida en los pulmones, fallecimiento; sin embargo, no existe evidencia de efectos tóxipresumiblemente por la amplia área que presentan los alvéolos cos serios cuando se combina cualquier terapia de reemplazo o y por el pH pulmonar (7,4). Se absorbe cerca de 1 mg (0,3-2 mg) varias terapias juntas (p. ej. uso de múltiples parches) [37]. de nicotina en el momento de fumar [28,29]. Posteriormente a su absorción, la nicotina entra en el torrente sanguíneo, donde, Receptores nicotínicos a un pH de 7,4, el 65% se ioniza, el 30% se desioniza y el 5% se Los receptores nicotínicos son receptores presinápticos en su une a proteínas plasmáticas [30]. Estudios realizados en anima- mayoría, pero también los hay postsinápticos; son de tipo canal, les y necropsias de personas fumadoras muestran que los tejidos de naturaleza catiónica (Na+ o Ca++) [38] y de conformación con más afinidad por la nicotina son riñón, hígado, pulmón, ce- pentamérica, con al menos dos sitios de unión-ligando en la inrebro y corazón; el músculo esquelético tiene moderada afini- terfaz entre las subunidades [39,40]. Cuando la acetilcolina o la dad, y el tejido adiposo, una afinidad más baja [31]. La nicotina nicotina se unen a estos sitios, se produce un cambio estructural también se acumula en la leche materna y cruza la barrera pla- de las subunidades que lo forman y el canal se abre, lo que permite el flujo de iones y la liberación de neurotransmisores (Fig. 1). centaria con facilidad [28]. Se ha notificado que la unión nicotina-receptor induce la liMetabolismo beración de dopamina [41,42], ácido γ-aminobutírico [43], gluLos niveles más altos de nicotina en sangre se alcanzan al termi- tamato [44], serotonina (5-HT) [45] y péptidos opioides [46, nar de fumar un cigarro y declinan rápidamente en los siguien- 47]. Los genes que codifican para las diferentes subunidades tes 20 minutos por la amplia distribución en los tejidos corpora- que forman el receptor nicotínico se han identificado y clonado. les. El volumen de distribución en humanos es 2,6 veces el peso Se han caracterizado varias subunidades, entre las que encontramos: α1-α10 y β1-β9 [48]. Algunas de estas subunidades se excorporal [32]. La nicotina es metabolizada por el hígado y se han identifi- presan en el sistema nervioso central: α2-α7 y β2-β4 [48,49] (Tacado seis metabolitos primarios, de los cuales cuantitativamente bla). El ensambleje de estas subunidades determina diferentes el más importante es la cotinina [33]. La nicotina se excreta vía subtipos de receptores nicotínicos (heteropentámeros), que direnal por filtración glomerular y tubular con reabsorción varia- fieren en sus propiedades farmacológicas y biofísicas. Las subble, dependiendo del pH de la orina. En orina ácida, la nicotina unidades α1, β1, γ, δ y ε se considera que representan el recepse ioniza y la reabsorción tubular se minimiza; en orina alcalina, tor muscular; α2-α6 y β2-β4 representan el receptor neuronal, y una mayor cantidad de nicotina se desioniza, seguida por la re- α7-α10, el receptor neuronal homopentamérico [49]. La activación del receptor α4β2 se ha asociado a la presencia absorción tubular. La excreción de cotinina está poco influida por el pH urinario, debido a que es más básica y, además, es de- de depresión y conductas adictivas, como el consumo de tabaco. pendiente de la tasa de flujo urinario [34]. Un estudio demostró, Los subtipos α6 y β3 regulan la liberación de dopamina. por medio de nicotina marcada radiactivamente, que al menos el 1% de la nicotina consumida se excreta en las heces [35]. Se ha observado también que mayores cantidades de nicotina que CARACTERÍSTICAS GENERALES DE LA DEPRESIÓN de cotinina se excretan en el sudor de fumadores; sin embargo, La depresión es definida por la Asociación Americana de Psiquiatría (1994) [2] como un trastorno heterogéneo crónico que a las cantidades no se han contabilizado [36]. Se especula que el continuo consumo de cigarro adicional- menudo se manifiesta con síntomas psicológicos, conductuales mente al uso de terapias de reemplazo (parches transdérmicos, y fisiológicos, tales como: humor decaído por más de un día (en 662 REV NEUROL 2009; 49 (12): 661-667 NICOTINA Y DEPRESIÓN Tabla. Distribución de subtipos de receptores acetilcolina nicotínicos según el área cerebral. Corteza cerebral α7, α4β2 Hipocampo α7, α4β2 Cuerpo estriado Núcleo del rafe dorsal α3β4, α4β2, α6β2, α4α6 α7, α4β2 Hábenula α3β4 Locus coeruleus α3β4 Cerebelo α3β4 Núcleo accumbens Núcleo interpeduncular α4β2, α6β2 α3β4 Hipotálamo α7 Septo α7 Sustancia negra Tracto óptico α4β2, α6β2 α3β4 niños y adolescentes la irritabilidad puede significar humor deprimido), disminución de interés o placer en las actividades diarias, incremento o disminución del apetito, insomnio o exceso de sueño, alteraciones psicomotoras (ya sea retraso o agitación), fatiga, indecisión, falta de concentración, sentimientos de culpa o pesimismo, recurrentes pensamientos de muerte o suicidio, disminución de la libido y falta de aseo personal. La depresión es dos veces más común en mujeres que en hombres [50]. Estudios epidemiológicos muestran que alrededor del 40 al 50% de riesgo de padecer depresión es genético [51]. Esto la convierte en un trastorno altamente heredable; sin embargo, los genes que interfieren en la depresión no se han determinado completamente. Factores no genéticos, como el estrés, traumas emocionales, infecciones, etc., durante el desarrollo del cerebro se han implicado en la etiología de la depresión [50]. Por su parte, pacientes deprimidos víctimas de suicidio presentan un volumen reducido de corteza prefrontal y orbitofrontal, estriado ventral, amígdala e hipocampo (véanse detalles en [52]). Neuroquímicamente, se ha observado una disminución de la actividad en el sistema noradrenérgico y serotoninérgico, así como un incremento de los niveles plasmáticos de cortisol [53]. MECANISMOS DE INTERACCIÓN DE LA NICOTINA EN LOS TRASTORNOS DEPRESIVOS Como ya se hizo mención, varios laboratorios en el mundo han notificado las propiedades antidepresivas de la nicotina cuando se administra por diferentes vías y dosis, tanto en humanos [3,4] como en modelos animales de depresión [17,18,21], e incluso en ratas normales [54]. Uno de los efectos antidepresivos inmediatos de la administración de nicotina es que induce un incremento significativo de serotonina en varias regiones del cerebro, entre las cuales podemos citar: corteza, hipocampo, estriado, septo lateral, núcleo dorsal del rafe (NDR) y médula espinal [15,45,55,56]. El efecto fisiológico de la 5-HT liberada por la nicotina depende del tipo de receptor serotoninérgico que se estimula, así como de la región cerebral donde se liberó [57-59]. REV NEUROL 2009; 49 (12): 661-667 Para el caso de la depresión, los subtipos de receptores 5-HT1A y 5-HT2 son los directamente involucrados [60]. Estudios in vitro han comunicado que neuronas del NDR, al ser estimuladas con nicotina (10-300 μM), disminuyen su frecuencia de disparo; sin embargo, de manera simultánea, se incrementa la liberación de serotonina en el medio extracelular [61]. Dicho resultado ha llevado a sugerir que la nicotina induce la liberación de 5-HT de las terminales presinápticas del NDR tal como lo hacen los antidepresivos tricíclicos, como la fluoxetina, uno de los antidepresivos más usados actualmente. Este mecanismo de liberación de 5-HT podría estar mediado no sólo por la acción de la nicotina administrada exógenamente, sino también, de manera endógena, por la estimulación que proviene de las fibras colinérgicas del núcleo laterodorsal (LDT) y del núcleo pedunculopontino tegmental (PPT) del tallo cerebral. Asimismo, se ha sugerido que la nicotina actúa sobre las neuronas serotoninérgicas del NDR de dos maneras: la primera, utilizando un mecanismo directo de tipo excitatorio, que llevaría a la liberación de 5-HT; y la segunda, utilizando un mecanismo indirecto de naturaleza inhibitoria que provocaría la hiperpolarización de las neuronas del NDR [61,62]. Además, se ha demostrado que la liberación de 5-HT por parte del NDR es mediada por la activación de receptores 5-HT2C presentes en las neuronas del NDR [63] y en otras regiones corticales y límbicas involucradas en la etiología de la depresión [64,65]. Se ha demostrado que no hay efectos sinérgicos cuando se administra nicotina y fluoxetina simultáneamente en ratas deprimidas por el modelo de clomipramina neonatal [21]. Experimentos usando microdiálisis in vivo han descrito que una sola inyección de fluoxetina induce un paulatino incremento de 5-HT extracelular, mientras que la repetida administración incrementa los niveles base de 5-HT [66]. Recientemente, se notificó que el efecto antidepresivo de la nicotina es inmediato desde la primera administración, lo que no se observa con la administración de fluoxetina, ya que su efecto se da cuando se toma de manera crónica [21]. Como una segunda hipótesis, se ha sugerido que el efecto antidepresivo de la nicotina puede ser a través de la liberación de dopamina. Neuronas dopaminérgicas del área tegmental ventral y de la sustancia negra pars compacta expresan una gran variedad de receptores nicotínicos [67]. Inhibidores de la recaptura de 5-HT aumentan la respuesta postsináptica a dopamina en las terminales del sistema mesolímbico [68,69], al igual que lo hace la administración de nicotina en dicha región [70,71]. Evidencias adicionales indican que los receptores nicotínicos que se expresan en neuronas del área tegmental ventral se desensibilizan por la exposición crónica a nicotina, aun usando dosis semejantes a las encontradas en el plasma de fumadores [72]. Se han notificado resultados similares cuando se miden los niveles de dopamina en el núcleo accumbens o se registra su frecuencia de disparo en ratas que recibieron una inyección de nicotina en una dosis similar a la encontrada en el plasma de fumadores [73]. Por su parte, la administración de antagonistas de receptores nicotínicos como la mecamilamina, en animales crónicamente expuestos a nicotina, induce síndrome de abstinencia y disminución de la liberación de dopamina por parte del núcleo accumbens [74]. Esta reducción en la liberación de dopamina se ha interpretado como el correlato neuronal de la anhedonia o disforia experimentada por fumadores cuando intentan dejar este hábito [75]. 663 P. VIEYRA-REYES, ET AL Otra hipótesis sobre el posible mecanismo de interacción de la nicotina en trastornos depresivos puede estar mediada a través de sus efectos neuroprotectores. Un número creciente de resultados han demostrado que agonistas nicotínicos son candidatos potenciales para el tratamiento de enfermedades neurodegenerativas, como Alzheimer o Parkinson, y también para el tratamiento de trastornos cognitivos asociados a la esquizofrenia [22], ya que la activación de receptores nicotínicos muestra efectos neuroprotectores y neurotróficos [76]. Por ejemplo, se ha comunicado que la exposición prenatal en ratas a nicotina induce el desarrollo prematuro de proyecciones colinérgicas en el cerebro medio, tallo y corteza [77]. Además, se ha observado que los receptores α7, los cuales se expresan en etapas tempranas del desarrollo y son importantes para el crecimiento de neuritas, intervienen en fenómenos de remodelación sináptica [78]. Dichos receptores se expresan más en el hipocampo que en otras regiones del cerebro. El hipocampo es un área importante para la formación de memoria, lo que se relaciona directamente con la inducción de plasticidad neuronal [79]. Se sabe que tratamientos antidepresivos promueven varias formas de plasticidad, incluyendo neurogénesis, sinaptogénesis y maduración neuronal en el hipocampo [80]. Particularmente, se ha notificado que la síntesis de BDNF se incrementa en el hipocampo y la corteza prefrontal de pacientes deprimidos tratados con antidepresivos [80]. El estrés agudo o crónico disminuye los niveles de BDNF en el giro dentado y la capa de células piramidales del hipocampo en roedores [81]. Esta reducción parece ser mediada parcialmente por glucocorticoides, y posiblemente por el incremento de la transmisión serotoninérgica [81]. De ahí que se sugiera que los antidepresivos favorecen la síntesis de factores tróficos que, a su vez, impactan de manera importante en la mejoría observada en el humor de los sujetos deprimidos. Asimismo, la administración de nicotina mejora la ejecución de tareas cognitivas en primates no humanos y en roedores [23], al igual que cuando se administran agonistas de receptores nicotínicos, como epibatidina [82], GTS-21 (agonista selectivo para α7) [83], SIB-1508Y (selectivo para α4β2) y SIB-1553ª (selectivo de β4) [84]. En contraste, el bloqueo de los receptores de acetilcolina nicotínicos deteriora la memoria [85]. In vitro, la nicotina también ha manifestado efectos protectores en neuronas expuestas a dosis citotóxicas de glutamato, β-amiloide o 6-(OHDA) [86]; en la citotoxicidad inducida por la activación de receptores NMDA y AMPA [87]; y en la neurotoxicidad inducida por ácido caínico [88]. Estas evidencias en conjunto apoyan la hipótesis de que la nicotina pudiera estar ejerciendo su efecto antidepresivo a través de la liberación de factores tróficos [89]. Aunque las evidencias apoyan esta hipótesis, aún es necesario esclarecer con detalle los mecanismos tróficos que la nicotina podría tener sobre la depresión. NICOTINA Y REGULACIÓN DE SUEÑO El sueño es un estado conductual reversible, de disociación perceptual y de baja respuesta hacia los estímulos ambientales. En los mamíferos, el sueño se divide en dos etapas: el sueño de ondas lentas (no REM) y el sueño REM. En humanos, el sueño no REM está constituido por cuatro fases, y la etapa 3 y 4 son los estados más profundos del sueño. En el registro electroencefalográfico, el sueño no REM se caracteriza por presentar una actividad cerebral sincrónica, con predominio de ondas de baja 664 PPT y LDT NDR Nicotina WAY-100635 Figura 2. Inhibición de neuronas en el núcleo laterodorsal (LDT) y el núcleo pedunculopontino tegmental (PPT) por nicotina; la nicotina, además, incrementa el rango de disparo de neuronas serotoninérgicas en el núcleo dorsal del rafe (NDR). La inhibición de las neuronas en el LDT y el PPT se elimina cuando se añade WAY-100635, un antagonista del receptor 5-HT1A. frecuencia (0,5-2 Hz) y alto voltaje (> 200 µV). Además, durante la fase 2 del sueño no REM, aparecen ondas de alto voltaje (> 100 µV y de 0,5 s de duración), denominadas complejo K porque aparecen en respuesta a un estimulo auditivo (Klap, palabra de origen alemán que significa ‘aplauso’). En contraste, la etapa de sueño REM se caracteriza por la presencia de un electroencefalograma desincronizado con frecuencias rápidas y de bajo voltaje, actividad semejante a la que se presenta durante la etapa de vigilia. Una característica del sueño REM es la atonía muscular y la presencia de movimientos oculares rápidos [90]. Adicionalmente, se ha notificado la presencia de espigas de alto voltaje, las ondas pontogeniculooccipitales (PGO), las cuales tienen su origen en el puente, el cuerpo geniculado y la corteza occipital. La presencia de estas ondas se acompaña de movimientos rápidos de los ojos, contracciones rápidas de los músculos distales y actividad del músculo medio de la oreja. La actividad mental elevada y los movimientos oculares rápidos que ocurren durante el sueño REM se han asociado con la generación de ensoñaciones [90]. Con respecto al papel que desempeña la nicotina en la regulación de este fenómeno, se ha descrito que la administración de nicotina por vía subcutánea, intravenosa o por microinyección directa en la formación reticular pontina incrementa el tiempo total de sueño REM en gatos [91]. Sin embargo, las espigas PGO se suprimen por la administración transdérmica de nicotina en dosis de 17,5, 35 y 52,5 mg, con efectos menores en el sueño y un incremento general en la vigilia [92]. Estudios realizados en ratas han revelado que, cuando se administra nicotina REV NEUROL 2009; 49 (12): 661-667 NICOTINA Y DEPRESIÓN subcutánea (0,1 mg/kg), se incrementa en un 362,61% la frecuencia de descarga de las neuronas serotoninérgicas del NDR durante el período de sueño REM, sin afectar al sueño no REM o a la vigilia [47]. Estudios in vitro han demostrado que la administración de nicotina (2 µM) en rebanadas del NDR incrementa en un 81% la frecuencia de disparo de las neuronas, así como la liberación de serotonina. De manera interesante, la frecuencia de disparo de las neuronas del núcleo LDT y del PPT se reduce un 80,8 y 81,8%, respectivamente. Además, la inhibición de las neuronas del núcleo LDT se bloquea cuando se administra WAY-100635 (140 nm), un antagonista del receptor de serotonina 5-HT1A [55]. Estos resultados indican que la nicotina inhibe la actividad de las neuronas colinérgicas del núcleo LDT y del PPT mediante la liberación de serotonina por parte del NDR. En consecuencia, se suprimen las ondas PGO (Fig. 2). En humanos, el efecto de la nicotina sobre el patrón de sueño es un poco distinto. Los informes señalan que la administración transdérmica de nicotina en sujetos sanos no fumadores induce un aumento en el tiempo total de sueño REM, pero este efecto es dependiente de la dosis [93]. Se han obtenido resultados similares cuando la nicotina se administra usando la misma vía, pero por largos períodos (seis meses), en pacientes que presentaban depresión mayor [6]. Asimismo, los registros de sueño en pacientes deprimidos no fumadores tratados con nicotina y fluoxetina por un período mayor a un mes mostraron que la administración de nicotina disminuye la vigilia y la etapa 1 de sueño no REM, e incrementa la latencia al primer período de sueño REM [7]. En contraste, la administración de fluoxetina induce el efecto opuesto sobre la vigilia y la etapa 1 del sueño lento; sin embargo, la latencia al primer período de sueño REM se mantiene alargada [94]. Estas discrepancias observadas entre las etapas del ciclo de sueño después del tratamiento con ambas sustancias sugieren la existencia de mecanismos de acción independientes en la regulación del sueño, pero que, al final, convergen con un mismo efecto, en este caso sobre su naturaleza antidepresiva [49]. En conclusión, los resultados descritos aquí sugieren que la nicotina tiene propiedades antidepresivas, aunque algunas de ellas aún no son claras. Sin embargo, resulta evidente que el posible mecanismo de acción sea a través de la liberación de serotonina por parte de las células del NDR, por la liberación de dopamina en el sistema mesolímbico y por su efecto neuroprotector. Las propiedades terapéuticas que la nicotina pudiera tener en el tratamiento de la depresión aún deben explorarse con detalle. BIBLIOGRAFÍA 1. Wong ML, Licinio J. Research and treatment approaches to depression. Nat Rev Neurosci 2001; 2: 343-51. 2. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4 ed. Washington: American Psychiatric Press; 1994. 3. Moreno-Coutino A, Calderón-Ezquerro C, Drucker-Colín R. Longterm changes in sleep and depressive symptoms of smokers in abstinence. Nicotine Tob Res 2007; 9: 389-96. 4. Salin-Pascual RJ, De la Fuente JR, Galicia-Polo L, Drucker-Colín R. Effects of transderman nicotine on mood and sleep in nonsmoking major depressed patients. Psychopharmacology (Berl) 1995; 121: 476-9. 5. Glassman AH, Helzer JE, Covey LS, Cottler LB, Stetner F, Tipp JE, et al. Smoking, smoking cessation, and major depression. JAMA 1990; 264: 1546-9. 6. Haro R, Drucker-Colín R. Effects of long-term administration of nicotine and fluoxetine on sleep in depressed patients. Arch Med Res 2004; 35: 499-506. 7. Haro R, Drucker-Colín R. A two-year study on the effects of nicotine and its withdrawal on mood and sleep. Pharmacopsychiatry 2004; 37: 221-7. 8. Salin-Pascual RJ, Drucker-Colín R. A novel effect of nicotine on mood and sleep in major depression. Neuroreport 1998; 9: 57-60. 9. Salin-Pascual RJ, Rosas M, Jiménez-Genchi A, Rivera-Meza BL, Delgado-Parra V. Antidepressant effect of transdermal nicotine patches in nonsmoking patients with major depression. J Clin Psychiatry 1996; 57: 387-9. 10. Breslau N, Peterson EL, Schultz LR, Chilcoat HD, Andreski P. Major depression and stages of smoking. A longitudinal investigation. Arch Gen Psychiatry 1998; 55: 161-6. 11. Covey LS. Tobacco cessation among patients with depression. Prim Care 1999; 26: 691-706. 12. Contreras M, Ceric F, Torrealba F. El lado negativo de las emociones: la adicción a drogas de abuso. Rev Neurol 2008; 47: 471-6. 13. Covey LS, Glassman AH, Stetner F. Major depression following smoking cessation. Am J Psychiatry 1997; 154: 263-5. 14. Markou A, Kosten TR, Koob GF. Neurobiological similarities in depression and drug dependence: a self-medication hypothesis. Neuropsychopharmacology 1998; 18: 135-74. 15. Guzmán-Marín R, Alam MN, Mihailescu S, Szymusiak R, McGinty D, Drucker-Colin R. Subcutaneous administration of nicotine changes dorsal raphe serotonergic neurons discharge rate during REM sleep. Brain Res 2001; 888: 321-5. 16. Martínez-González D, Prospéro-García O, Mihailescu S, Drucker-Colín R. Effects of nicotine on alcohol intake in a rat model of depression. Pharmacol Biochem Behav 2002; 72: 355-64. 17. Tizabi Y, Overstreet DH, Rezvani AH, Louis VA, Clark E Jr, Janowsky REV NEUROL 2009; 49 (12): 661-667 DS, et al. Antidepressant effects of nicotine in an animal model of depression. Psychopharmacology (Berl) 1999; 142: 193-9. 18. Semba J, Mataki C, Yamada S, Nankai M, Toru M. Antidepressantlike effects of chronic nicotine on learned helplessness paradigm in rats. Biol Psychiatry 1998; 43: 389-91. 19. Ferguson SM, Brodkin JD, Lloyd GK, Menzaghi F. Antidepressantlike effects of the subtype-selective nicotinic acetylcholine receptor agonist, SIB-1508Y, in the learned helplessness rat model of depression. Psychopharmacology (Berl) 2000; 152: 295-303. 20. Djuric VJ, Dunn E, Overstreet DH, Dragomir A, Steiner M. Antidepressant effect of ingested nicotine in female rats of Flinders resistant and sensitive lines. Physiol Behav 1999; 67: 533-7. 21. Vázquez-Palacios G, Bonilla-Jaime H, Velázquez-Moctezuma J. Antidepressant effects of nicotine and fluoxetine in an animal model of depression induced by neonatal treatment with clomipramine. Prog Neuropsychopharmacol Biol Psychiatry 2005; 29: 39-46. 22. Kem WR. The brain alpha7 nicotinic receptor may be an important therapeutic target for the treatment of Alzheimer’s disease: studies with DMXBA (GTS-21). Behav Brain Res 2000; 113: 169-81. 23. Buccafusco JJ, Letchworth SR, Bencherif M, Lippiello PM. Long-lasting cognitive improvement with nicotinic receptor agonists: mechanisms of pharmacokinetic-pharmacodynamic discordance. Trends Pharmacol Sci 2005; 26: 352-60. 24. Maggio R, Riva M, Vaglini F, Fornai F, Molteni R, Armogida M, et al. Nicotine prevents experimental parkinsonism in rodents and induces striatal increase of neurotrophic factors. J Neurochem 1998; 71: 2439-46. 25. Rattray M. Is there nicotinic modulation of nerve growth factor? Implications for cholinergic therapies in Alzheimer’s disease. Biol Psychiatry 2001; 49: 185-93. 26. Benowitz NL. Pharmacology of nicotine: addiction and therapeutics. Annu Rev Pharmacol Toxicol 1996; 36: 597-613. 27. Lunell E, Molander L, Ekberg K, Wahren J. Site of nicotine absorption from a vapour inhaler –comparison with cigarette smoking. Eur J Clin Pharmacol 2000; 55: 737-41. 28. Gori GB, Lynch CJ. Analytical cigarette yields as predictors of smoke bioavailability. Regul Toxicol Pharmacol 1985; 5: 314-26. 29. Lee EM, Malson JL, Moolchan ET, Pickworth WB. Quantitative comparisons between a nicotine delivery device (Eclipse) and conventional cigarette smoking. Nicotine Tob Res 2004; 6: 95-102. 30. Benowitz NL, Jacob P III, Jones RT, Rosenberg J. Interindividual variability in the metabolism and cardiovascular effects of nicotine in man. J Pharmacol Exp Ther 1982; 221: 368-72. 31. Benowitz NL. Clinical pharmacology of inhaled drugs of abuse: implications in understanding nicotine dependence. NIDA Res Monogr 1990; 99: 12-29. 665 P. VIEYRA-REYES, ET AL 32. Rose JE, Behm FM, Westman EC, Coleman RE. Arterial nicotine kinetics during cigarette smoking and intravenous nicotine administration: implications for addiction. Drug Alcohol Depend 1999; 56: 99-107. 33. Benowitz NL, Jacob P III. Metabolism of nicotine to cotinine studied by a dual stable isotope method. Clin Pharmacol Ther 1994; 56: 483-93. 34. Benowitz NL, Jacob P III. Trans-3’-hydroxycotinine: disposition kinetics, effects and plasma levels during cigarette smoking. Br J Clin Pharmacol 2001; 51: 53-9. 35. Armitage AK, Dollery CT, George CF, Houseman TH, Lewis PJ, Turner DM. Absorption and metabolism of nicotine from cigarettes. Br Med J 1975; 4: 313-6. 36. Kintz P, Henrich A, Cirimele V, Ludes B. Nicotine monitoring in sweat with a sweat patch. J Chromatogr B Biomed Sci Appl 1998; 705: 357-61. 37. Benowitz NL. Toxicity of nicotine: implications with regard to nicotine replacement therapy. Prog Clin Biol Res 1988; 261: 187-217. 38. Lindstrom JM. Acetylcholine receptors and myasthenia. Muscle Nerve 2000; 23: 453-77. 39. Noda M, Takahashi H, Tanabe T, Toyosato M, Kikyotani S, Hirose T, et al. Primary structures of beta- and delta-subunit precursors of Torpedo californica acetylcholine receptor deduced from cDNA sequences. Nature 1983; 301: 251-5. 40. Changeux JP, Bertrand D, Corringer PJ, Dehaene S, Edelstein S, Lena C, et al. Brain nicotinic receptors: structure and regulation, role in learning and reinforcement. Brain Res Brain Res Rev 1998; 26: 198-216. 41. Pontieri FE, Passarelli F, Calo L, Caronti B. Functional correlates of nicotine administration: similarity with drugs of abuse. J Mol Med 1998; 76: 193-201. 42. Pontieri FE, Tanda G, Orzi F, Di Chiara G. Effects of nicotine on the nucleus accumbens and similarity to those of addictive drugs. Nature 1996; 382: 255-7. 43. Kalivas PW, Churchill L, Klitenick MA. GABA and enkephalin projection from the nucleus accumbens and ventral pallidum to the ventral tegmental area. Neuroscience 1993; 57: 1047-60. 44. McGehee DS, Heath MJ, Gelber S, Devay P, Role LW. Nicotine enhancement of fast excitatory synaptic transmission in CNS by presynaptic receptors. Science 1995; 269: 1692-6. 45. Ribeiro EB, Bettiker RL, Bogdanov M, Wurtman RJ. Effects of systemic nicotine on serotonin release in rat brain. Brain Res 1993; 621: 311-8. 46. Boyadjieva NI, Sarkar DK. The secretory response of hypothalamic beta-endorphin neurons to acute and chronic nicotine treatments and following nicotine withdrawal. Life Sci 1997; 61: 59-66. 47. Pierzchala K, Houdi AA, Van Loon GR. Nicotine-induced alterations in brain regional concentrations of native and cryptic Met- and Leuenkephalin. Peptides 1987; 8: 1035-43. 48. Picciotto MR, Caldarone BJ, King SL, Zachariou V. Nicotinic receptors in the brain. Links between molecular biology and behavior. Neuropsychopharmacology 2000; 22: 451-65. 49. Le Novere N, Corringer PJ, Changeux JP. The diversity of subunit composition in nAChRs: evolutionary origins, physiologic and pharmacologic consequences. J Neurobiol 2002; 53: 447-56. 50. Nestler EJ, Barrot M, DiLeone RJ, Eisch AJ, Gold SJ, Monteggia LM. Neurobiology of depression. Neuron 2002; 34: 13-25. 51. Detera-Wadleigh SD, Badner JA, Berrettini WH, Yoshikawa T, Goldin LR, Turner G, et al. A high-density genome scan detects evidence for a bipolar-disorder susceptibility locus on 13q32 and other potential loci on 1q32 and 18p11.2. Proc Natl Acad Sci U S A 1999; 96: 5604-9. 52. Aan het Rot M, Mathew SJ, Charney DS. Neurobiological mechanisms in major depressive disorder. CMAJ 2009; 180: 305-13. 53. Maes M, Meltzer HY, D’Hondt P, Cosyns P, Blockx P. Effects of serotonin precursors on the negative feedback effects of glucocorticoids on hypothalamic-pituitary-adrenal axis function in depression. Psychoneuroendocrinology 1995; 20: 149-67. 54. Vázquez-Palacios G, Bonilla-Jaime H, Velázquez-Moctezuma J. Antidepressant-like effects of the acute and chronic administration of nicotine in the rat forced swimming test and its interaction with fluoxetine [correction of flouxetine]. Pharmacol Biochem Behav 2004; 78: 165-9. 55. Mihailescu S, Guzmán-Marín R, Drucker-Colin R. Nicotine stimulation of dorsal raphe neurons: effects on laterodorsal and pedunculopontine neurons. Eur Neuropsychopharmacol 2001; 11: 359-66. 56. Westfall TC, Grant H, Perry H. Release of dopamine and 5-hydroxytryptamine from rat striatal slices following activation of nicotinic cholinergic receptors. Gen Pharmacol 1983; 14: 321-25. 57. Mannucci C, Tedesco M, Bellomo M, Caputi AP, Calapai G. Longterm effects of nicotine on the forced swimming test in mice: an experimental model for the study of depression caused by smoke. Neurochem Int 2006; 49: 481-6. 58. Cheeta S, Irvine EE, Tucci S, Sandhu J, File SE. In adolescence, female rats are more sensitive to the anxiolytic effect of nicotine than are male rats. Neuropsychopharmacology 2001; 25: 601-7. 666 59. Slotkin TA, Tate CA, Cousins MM, Seidler FJ. Prenatal nicotine exposure alters the responses to subsequent nicotine administration and withdrawal in adolescence: serotonin receptors and cell signaling. Neuropsychopharmacology 2006; 31: 2462-75. 60. Arango V, Underwood MD, Boldrini M, Tamir H, Kassir SA, Hsiung S, et al. Serotonin 1A receptors, serotonin transporter binding and serotonin transporter mRNA expression in the brainstem of depressed suicide victims. Neuropsychopharmacology 2001; 25: 892-903. 61. Mihailescu S, Palomero-Rivero M, Meade-Huerta P, Maza-Flores A, Drucker-Colín R. Effects of nicotine and mecamylamine on rat dorsal raphe neurons. Eur J Pharmacol 1998; 360: 31-6. 62. Li X, Rainnie DG, McCarley RW, Greene RW. Presynaptic nicotinic receptors facilitate monoaminergic transmission. J Neurosci 1998; 18: 1904-12. 63. Suemaru K, Araki H, Kitamura Y, Yasuda K, Gomita Y. Cessation of chronic nicotine administration enhances wet-dog shake responses to 5-HT2 receptor stimulation in rats. Psychopharmacology (Berl) 2001; 159: 38-41. 64. Kennedy SH, Evans KR, Kruger S, Mayberg HS, Meyer JH, McCann S, et al. Changes in regional brain glucose metabolism measured with positron emission tomography after paroxetine treatment of major depression. Am J Psychiatry 2001; 158: 899-905. 65. Mayberg HS, Brannan SK, Tekell JL, Silva JA, Mahurin RK, McGinnis S, et al. Regional metabolic effects of fluoxetine in major depression: serial changes and relationship to clinical response. Biol Psychiatry 2000; 48: 830-43. 66. Kreiss DS, Lucki I. Effects of acute and repeated administration of antidepressant drugs on extracellular levels of 5-hydroxytryptamine measured in vivo. J Pharmacol Exp Ther 1995; 274: 866-76. 67. Livingstone PD, Wonnacott S. Nicotinic acetylcholine receptors and the ascending dopamine pathways. Biochem Pharmacol 2009; 78: 744-55. 68. Ainsworth K, Smith SE, Zetterstrom TS, Pei Q, Franklin M, Sharp T. Effect of antidepressant drugs on dopamine D1 and D2 receptor expression and dopamine release in the nucleus accumbens of the rat. Psychopharmacology (Berl) 1998; 140: 470-7. 69. Collu M, Poggiu AS, Devoto P, Serra G. Behavioural sensitization of mesolimbic dopamine D2 receptors in chronic fluoxetine-treated rats. Eur J Pharmacol 1997; 322: 123-7. 70. Imperato A, Mulas A, Di Chiara G. Nicotine preferentially stimulates dopamine release in the limbic system of freely moving rats. Eur J Pharmacol 1986; 132: 337-8. 71. Nomikos GG, Damsma G, Wenkstern D, Fibiger HC. Chronic desipramine enhances amphetamine-induced increases in interstitial concentrations of dopamine in the nucleus accumbens. Eur J Pharmacol 1991; 195: 63-73. 72. Pidoplichko VI, DeBiasi M, Williams JT, Dani JA. Nicotine activates and desensitizes midbrain dopamine neurons. Nature 1997; 390: 401-4. 73. Benwell ME, Balfour DJ, Birrell CE. Desensitization of the nicotineinduced mesolimbic dopamine responses during constant infusion with nicotine. Br J Pharmacol 1995; 114: 454-60. 74. Hildebrand BE, Nomikos GG, Hertel P, Schilstrom B, Svensson TH. Reduced dopamine output in the nucleus accumbens but not in the medial prefrontal cortex in rats displaying a mecamylamine-precipitated nicotine withdrawal syndrome. Brain Res 1998; 779: 214-25. 75. Epping-Jordan MP, Watkins SS, Koob GF, Markou A. Dramatic decreases in brain reward function during nicotine withdrawal. Nature 1998; 393: 76-9. 76. Mudo G, Belluardo N, Fuxe K. Nicotinic receptor agonists as neuroprotective/neurotrophic drugs. Progress in molecular mechanisms. J Neural Transm 2007; 114: 135-47. 77. Navarro HA, Seidler FJ, Eylers JP, Baker FE, Dobbins SS, Lappi SE, et al. Effects of prenatal nicotine exposure on development of central and peripheral cholinergic neurotransmitter systems. Evidence for cholinergic trophic influences in developing brain. J Pharmacol Exp Ther 1989; 251: 894-900. 78. Pugh PC, Berg DK. Neuronal acetylcholine receptors that bind alphabungarotoxin mediate neurite retraction in a calcium-dependent manner. J Neurosci 1994; 14: 889-96. 79. Huerta PT, Lisman JE. Heightened synaptic plasticity of hippocampal CA1 neurons during a cholinergically induced rhythmic state. Nature 1993; 364: 723-5. 80. Castren E, Voikar V, Rantamaki T. Role of neurotrophic factors in depression. Curr Opin Pharmacol 2007; 7: 18-21. 81. Smith MA, Makino S, Kvetnansky R, Post RM. Stress and glucocorticoids affect the expression of brain-derived neurotrophic factor and neurotrophin-3 mRNAs in the hippocampus. J Neurosci 1995; 15: 1768-77. 82. Jonnala RR, Buccafusco JJ. Relationship between the increased cell surface alpha7 nicotinic receptor expression and neuroprotection induced by several nicotinic receptor agonists. J Neurosci Res 2001; 66: 565-72. REV NEUROL 2009; 49 (12): 661-667 NICOTINA Y DEPRESIÓN 83. Arendash GW, Sengstock GJ, Sanberg PR, Kem WR. Improved learning and memory in aged rats with chronic administration of the nicotinic receptor agonist GTS-21. Brain Res 1995; 674: 252-9. 84. Schneider JS, Tinker JP, Van Velson M, Menzaghi F, Lloyd GK. Nicotinic acetylcholine receptor agonist SIB-1508Y improves cognitive functioning in chronic low-dose MPTP-treated monkeys. J Pharmacol Exp Ther 1999; 290: 731-9. 85. Rezvani AH, Bushnell PJ, Levin ED. Effects of nicotine and mecamylamine on choice accuracy in an operant visual signal detection task in female rats. Psychopharmacology (Berl) 2002; 164: 369-75. 86. Ryan RE, Ross SA, Drago J, Loiacono RE. Dose-related neuroprotective effects of chronic nicotine in 6-hydroxydopamine treated rats, and loss of neuroprotection in alpha4 nicotinic receptor subunit knockout mice. Br J Pharmacol 2001; 132: 1650-6. 87. Kaneko S, Maeda T, Kume T, Kochiyama H, Akaike A, Shimohama S, et al. Nicotine protects cultured cortical neurons against glutamate-induced cytotoxicity via alpha7-neuronal receptors and neuronal CNS receptors. Brain Res 1997; 765: 135-40. 88. Semba J, Miyoshi R, Kito S. Nicotine protects against the dexamethasone potentiation of kainic acid-induced neurotoxicity in cultured hippocampal neurons. Brain Res 1996; 735: 335-8. 89. Belluardo N, Mudo G, Blum M, Amato G, Fuxe K. Neurotrophic effects of central nicotinic receptor activation. J Neural Transm Suppl 2000; 60: 227-245. 90. García-García F. Bases biológicas del ciclo vigilia-sueño. In Caba M, ed. Bases celulares y moleculares de los ritmos biológicos. Veracruz: Ediciones Universidad Veracruzana; 2008. p. 126-38. 91. Velázquez-Moctezuma J, Shalauta MD, Gillin JC, Shiromani PJ. Microinjections of nicotine in the medial pontine reticular formation elicits REM sleep. Neurosci Lett 1990; 115: 265-8. 92. Vázquez J, Guzmán-Marín R, Salin-Pascual RJ, Drucker-Colín R. Transdermal nicotine on sleep and PGO spikes. Brain Res 1996; 737: 317-20. 93. Gillin JC, Lardon M, Ruiz C, Golshan S, Salin-Pascual R. Dose-dependent effects of transdermal nicotine on early morning awakening and rapid eye movement sleep time in nonsmoking normal volunteers. J Clin Psychopharmacol 1994; 14: 264-7. 94. Trivedi MH, Rush AJ, Armitage R, Gullion CM, Grannemann BD, Orsulak PJ, et al. Effects of fluoxetine on the polysomnogram in outpatients with major depression. Neuropsychopharmacology 1999; 20: 447-59. NICOTINE AS AN ANTIDEPRESSANT AND REGULATOR OF SLEEP IN SUBJECTS WITH DEPRESSION Summary. Introduction. Depression is a chronic and heterogeneous disorder manifesting itself by mood and sleep irregularities which ultimately can lead to suicide. Depressed individuals have a higher tendency to smoking compared to non-depressed people, and the interruption of this dependence produces even more depression. This situation may be reverted by the administration of anti-depressives and/or the use of nicotine replacement therapies. Taking into account these observations it will be explained how nicotine possibly acts in relation to two main neurotransmitters: serotonin and dopamine; and as a neuroprotective agent under a depressive condition. The effect of nicotine as a sleep regulator in depressed subjects will also be presented. Aim. To describe and discuss the evidences showing that nicotine has anti-depressive properties. Development. In order of finding are presented in the following pages evidences showing that nicotine therapeutically can be used as an antidepressive agent: general aspects of nicotine action (pharmacology, metabolism, nicotinic receptors), general features of depression, nicotine interactions in depressive disorders, and nicotine and the regulation of sleep. Conclusions. Even though the basis of the relationship ‘nicotine-depression’ is not clear, the suggested anti-depressive role of nicotine involves a direct action over dopaminergic and serotoninergic activity or a possible indirect action as a neuroprotective agent, events which may have therapeutic effects on the quality of sleep and enhancement of depressive symptoms. [REV NEUROL 2009; 49: 661-7] Key words. Antidepressant. Depression. Dopamine. Nicotine. Nicotinic acetylcholine receptors. Serotonin. Sleep. REV NEUROL 2009; 49 (12): 661-667 667