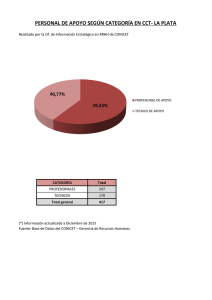
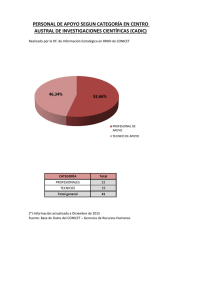
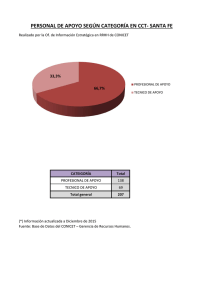
Síntesis de ciclopentanos polisustituidos mediante reacciones de
Anuncio

Seminario de Química Orgánica Síntesis de ciclopentanos polisustituidos mediante reacciones de cascada Florencia Gillanders Centro de Investigaciones en Bionanociencias (CIBION), CONICET, Ciudad de Buenos Aires, Argentina. florencia.gillanders@cibion.conicet.gov.ar Resumen La síntesis de ciclopentanos constituye un importante desafío para la química orgánica, siendo de interés en la síntesis de grandes grupos de productos naturales. El desarrollo de metodologías para la generación de ciclopentanos con múltiples sustituciones con estereoquímica definida ha avanzado especialmente en los últimos 15 años. A pesar de la variedad de reacciones y rutas disponibles para encarar la síntesis de algún derivado de ciclopentano propuesto, no abundan soluciones, particularmente para generar más de dos estereocentros simultáneamente. Este seminario estará enfocado en trabajos realizados recientemente1‐3 por el grupo del Profesor Huw Davies en la Universidad de Emory, EEUU; un químico altamente distinguido por su contribución a la síntesis de moléculas orgánicas. Su más reciente contribución al área de los ciclopentanos consiste en una reacción en cascada promovida por un reordenamiento sigmatrópico de carbenos estabilizados y alcoholes alílicos catalizado por un complejo quiral de rodio.1 Se describirán en detalle los reordenamientos producidos durante la reacción en cascada y se presentará la justificación estructural para cada centro quiral generado y su alta selectividad enantiomérica. La compatibilidad de esta metodología tipo one‐pot con diversos grupos funcionales junto con las condiciones suaves y limpias en las que se realiza convierte a este camino de síntesis en una muy interesante alternativa para la producción de ciclopentanos con cuatro estereocentros definidos. Referencias 1. Z. Li y H.M.L. Davies, J. Am. Chem. Soc., 2010, 132, 396‐401 2. B.T. Parr, Z. Li y H.M.L. Davies, Chem. Sci., 2011, 2, 2378‐2382 3. B.T. Parr y H.M.L. Davies, Nat. Commun., 2014, 5, 5455