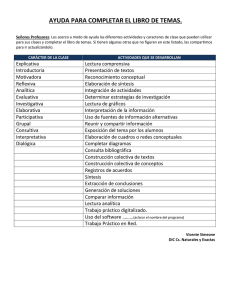
descargar documento
Anuncio

Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica INTRODUCCION A LA QUIMICA ANALITICA La Química como ciencia básica tiene multiplicidad de ramas que permiten el estudio de la totalidad del entorno que rodea al hombre. Es por ello, que los nuevos enfoques de enseñanza deben tender a visualizar el papel fundamental que cumple la cultura científica y tecnológica en el desarrollo social. Ahora bien, en particular, la Química Analítica que tiene por objeto lograr una real comprensión de los fenómenos físico-químicos que ocurren en los diferentes ecosistemas, debe estudiarse en profundidad. Para ello es fundamental la formación de profesionales e investigadores en áreas de indudable importancia y significación social como lo son la Bioquímica, Biología, Geología, entre otras. Cabe destacar que la interdisciplinariedad debe ser una meta a alcanzar, por cuanto la química no solamente utiliza y alimenta otras áreas de las ciencias naturales y de las matemáticas, sino que es una conjunción, en constante crecimiento, de teoría elegante, técnica precisa y pertinencia práctica. Definición “La química Analítica es una ciencia metrológica que desarrolla, optimiza y aplica herramientas (materiales, metodológicas y estratégicas) de amplia naturaleza, que se concretan en procesos de medida encaminados a obtener información (bio)química de calidad, tanto parcial (presencia/concentración en muestra de especies-analitos (bio)químicos) como global sobre materias o sistemas de amplia naturaleza (química, bioquímica, biológica) en el espacio y en el tiempo para resolver problemas científicos, técnicos, económicos y sociales.” Miguel Balcarcel Las características relevantes de esta definición son: 1- Se trata de una ciencia metrológica. 2- Tiene un doble carácter: básico (desarrollo) y práctico (aplica). 3- Genera información sobre la materia (o sistema) en estudio, diferenciando la misma en global o parcial (componentes) y teniendo en cuenta donde y cuando existe. 4- Considera a los procesos analíticos como vías genéricas de conseguir información. 5- Tiene en cuenta las denominadas Herramientas Estratégicas (planificación, diseño, optimización, adaptación, etc.), metodológicas y materiales (aparatos, instrumentos, reactivos, etc.). 6- Incluye y diferencia los problemas analíticos y los problemas científicos, técnicos, económicos y sociales. Área de Química Analítica 1 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica 7- Incorpora la calidad en forma directa, referida a información generada, e indirecta, referida a herramientas y procesos. Información Químico-Analítica De la definición de química analítica se infiere de forma inmediata que es trata de una ciencia de información (bio)química y circunstancialmente biológica, de la materia o sistema de interés científico, técnico, industrial o social. Como en toda ciencia informativa, el objetivo prioritario de la química analítica es la reducción de la incertidumbre acerca de la composición cualitativa, cuantitativa y estructural de la materia de interés. La materia tiene una información intrínseca que puede ser constante o variable (en el tiempo y/o el espacio) y que es la que en una situación ideal debe ofrecer el químico analítico. Esta situación intrínseca carece de incertidumbre, equivale al máximo nivel de calidad analítica y se caracteriza por una propiedad ideal, inalcanzable, como la veracidad. El siguiente nivel de información analítica es la que se considera como referencia; es ya una información real caracterizada por un buen nivel de exactitud y una pequeña incertidumbre. Se obtiene en circunstancias técnicas no ordinarias (participan muchos laboratorios empleando diferentes procesos analíticos) y se usa como referencia para obtener la información analítica ordinaria y contrastar su bondad. Esta última constituye el último escalón de la jerarquía de calidad informativa, que se caracteriza por ser real y tener menor exactitud y más incertidumbre que la referencial. Referencias Químico Analíticas Como ciencia metrológica la Química Analítica se basa en la medición de parámetros. Medir es comparar y para comparar es preciso tener referencias denominadas patrones o estándares. Al igual que para medir dimensiones existe el metro, para realizar medidas químico analíticas es preciso tener hitos referenciales a los cuales deben referirse y expresarse los resultados analíticos. Cuando se quiere conocer la concentración de un pesticida en el agua potable es necesario disponer de la sustancia pura (o de una muestra patrón que la contiene) que, sometida al correspondiente proceso analítico, nos origine una respuesta (cuali y cuantitativa) que sirva de referencia para identificar y cuantificar al pesticida en el agua sometida al análisis. Si el instrumento de medida es el cuerpo humano, como en el caso del análisis cualitativo clásico, previamente al análisis el analista debe haber grabado en su mente la respuesta al análisis de un referente (estándar o patrón). Así pues, la química analítica carece de fundamentos si no se dispone de los patrones o estándares adecuados para cada fin informativo perseguido. Área de Química Analítica 2 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Clasificación de la Química Analítica Entre las clasificaciones mencionadas en la bibliografía actual, las más significativas son: Análisis Cualitativo Según su finalidad y el tipo de información requerida Análisis Cuantitativo Análisis Estructural Análisis Clásico Según la técnica empleada Métodos de Separación Análisis Instrumental El Problema Analítico Introducción Tal como se ha indicado la Química Analítica es una ciencia o disciplina que tiene como meta la extracción de la información (bio)química latente de un objeto o sistema para tomar decisiones fundamentadas, eficaces y a tiempo. El problema analítico representa la faceta aplicada de la Química Analítica, ejemplo de problemas analíticos son: Aceptación/rechazo de una partida de vino embotellado. Decisión sobre la potabilidad de un agua Confirmación del apelativo light de un alimento Área de Química Analítica 3 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Los datos analíticos suministrados deben ser claros y contundentes, para tomar decisiones fundamentadas en los pertinentes contextos económicos sociales. Además esta información debe cumplir requisitos tales como rapidez, bajos costes, etc. Definición Integral del Problema Analítico El problema analítico puede considerarse como una interface activa entre el “cliente” que solicita la información y el químico analítico que la genera. La calidad se define de forma práctica y contundente como satisfacción del “cliente”; es obvia pues la importancia estratégica del problema analítico. Químico Analítico Cliente Problema Económico Social Requisitos informativos a satisfacer Calidad Externa Problema Analítico Proceso Analítico Problema Analítico Propiedades Analíticas Problema Analítico Calidad Analítica Calidad Resultado s Área de Química Analítica 4 Calidad Del PMQ Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Elementos de un Problema Analítico Un problema analítico presenta dos tipos de elementos, tangibles e intangibles, siendo los dos necesarios para su definición correcta e integral. Problema Económico, Social, Científico o Técnico Problema Analítico Intangibles Planificación Tangibles Objeto Diseño Muestra Evaluación Mesurando Corrección Analito Etapas en la Resolución de un Problema Analítico Primera Etapa Formulación clara del problema analítico y las características requeridas por el “cliente”. Ejemplos: 1- Problema: Contaminación de un río por vertidos orgánicos tóxicos de factorías aledañas. Información requerida: - Tipo de industria o materias primas, productos, etapas productivas, sistemas de descontaminación, temporalidad en la producción, ubicación de los vertidos en la margen del río. 2- Problema: Deterioro de un entorno forestal producido por la lluvia ácida. Objetivo: reducir el nivel de contaminantes atmosféricos (SO2, NO, NO2) producidos en industrias cercanas y conservar los árboles. Información requerida: Evolución de los niveles de azufre, fósforo, nitrógeno, etc., en las hojas de los árboles y niveles de contaminantes en la atmósfera. Área de Química Analítica 5 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Segunda Etapa Transformación de la información (bio)química genérica en información analítica específica. Ejemplo: Una ONG en defensa del consumidor plantea la comprobación de la veracidad del contenido graso especificado por los fabricantes de diversos Yogourt ligth. Este es el problema económico-social. El problema analítico se concreta con los siguientes aspectos: 1. Muestras de los diferentes tipos de Yogourt ligth que hay en el mercado (naturales, frutados, etc.) 2. Analitos: família de analitos: grasa total (análisis global). 3. Muestreo: aspecto crítico del problema analítico. Las muestras deben ser representativas de las diversas marcas comerciales existentes. 4. Tipo de análisis: cualitativo (si/no hay grasa), cuantitativo proporción de grasa en porcentaje. 5. Propiedades analíticas: Buen nivel de exactitud y precisión (fiabilidad en la respuesta binaria). Tercera Etapa Planificación de la estrategia analítica, esta implica la decisión sobre los Procesos de Medida Química (PMQ) necesarios para obtener la información analítica. Los factores que influyen en la selección del PQM dependerán: - De los medios materiales y humanos disponibles. - De la exactitud de la información requerida. - Si la información requerida es global o discriminada. - De los costos estipulados por el “cliente” - Si los analitos son pocos o muchos, de la misma o diferente naturaleza, si son macro componentes o vestigios. - De las características físicas de las muestras y de la cantidad que se disponga de ellas. Cuarta Etapa Monitorización de los resultados generados. Ejemplo: Presencia de Cd en juguetes amarillos importados. Después de desarrollar el PMQ, se observa que la concentración final en la muestra tratada está fuera o cercana al límite de cuantificación del intervalo de la recta de calibrado. Es evidente que no puede validarse la metodología con fines cuantitativos, ya que la incertidumbre del resultado en esta zona de concentración es muy elevada. Si la demanda informativa era solo cualitativa, es válida la respuesta binaria. Quinta Etapa Desarrollo de acciones correctoras. Si el resultado no ha sido validado en la cuarta etapa, se deberán desarrollar acciones correctoras a la estrategia analítica diseñada en la tercera etapa. Área de Química Analítica 6 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Coherencia entre la Información Requerida y la Suministrada Un problema analítico está bien planteado o resuelto, si existe coherencia entre la información que pide el cliente y la que suministra el laboratorio. Ejemplo: Para conocer a toxicidad de un agua, debido a especies metálicas potencialmente presentes, la información sobre la concentración total de cada uno de ellos es insuficiente, pues cada metal puede estar en diversas formas (estados de oxidación, formación de complejos, quelatos, compuestos organometálicos) que tienen un nivel de toxicidad muy diferente. Solo la concentración discriminada entre las posibles especies sería una información coherente con el problema económico social planteado. El Proceso de Medida Químico (PMQ) Definición Un proceso de medida química (PMQ) se define como conjunto de operaciones que separan a la muestra (sin tomar, sin medir, sin tratar) de los resultados generados y expresados según los requerimientos del problema analítico planteado. Muestra - sin tomar - sin medir - sin trazar Proceso de medida química (PMQ) Resultados Los factores que condicionan el número de etapas y el grado de dificultad de un PMQ se esquematizan a continuación: Información Requerida Muestra Proceso de medida Química Herramientas disponibles Área de Química Analítica Metodología de medida 7 Analito/s Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Las operaciones previas constituyen la primera etapa genérica de un PMQ, su objetivo es la adecuación de la muestra a la medición propiamente dicha. La segunda etapa es la medida y transducción de la señal analítica, directamente relacionada con las características/concentración de los analitos e implica el uso de un instrumento (técnica analítica). La adquisición de señales y tratamiento de datos para ofrecer los resultados según lo requerido, constituye la tercera etapa de un PMQ. Las tres etapas de PMQ, con frecuencia se integran entre sí, siendo difícil poder establecer claras diferencias entre las mismas. Operaciones Previas Con el nombre genérico de operaciones previas se pretende describir una amplia variedad de operaciones que constituyen el nexo de unión entre la muestra (sin tomar, sin medir, sin tratar) y el empleo del instrumento principal de medida, que constituye la segunda etapa del PMQ. Representación esquemática de algunas sub-etapas de las operaciones previas: Muestra bruta Técnicas de separación Reacciones no analíticas Muestreo Destrucción materia orgánica Medida de masa/volumen (Alícuotas) Disolución Disgregación Reacciones analíticas Medida volumen (masa) Homogeinización Conservación Transporte introducción al instrumento Secado Triturado Tamizado Instrumento Medida y Transducción de la Señal Analítica La segunda etapa del proceso de medida química se lleva a cabo mediante la utilización de un instrumento de medida. Estas señales pueden ser de naturaleza variada: óptica, electroquímica, másica, térmica, entre otras, lo que da lugar a instrumentos muy diferentes. Esta señal primaria es transducida (y amplificada) a otra señal generalmente eléctrica. El instrumento puede ser el cuerpo humano (los Área de Química Analítica 8 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica sentidos) o un instrumento propiamente dicho que mida diferentes señales (óptica un espectrofotómetro, masa una balanza, etc.) Adquisición de Señales y Tratamiento de Datos La tercera etapa es el nexo de unión entre el instrumento (2ª etapa) y los resultados expresados según requerimientos. Esta etapa implica dos subetapas secuenciales: 1) Adquisición de las señales transducidas, que son los datos primarios. La adquisición de los datos puede hacerse: a) Manualmente: ver el color de un precipitado, leer en la escala graduada de una bureta, leer la posición de una aguja. etc. b) Semiautomático: el instrumento origina una señal informativa y de esta se extraen los datos, por ejemplo de un espectro, grafica señal tiempo, cromatograma, etc. c) Automáticamente: un ordenador recibe la señal y la procesa obteniéndose directamente el dato analítico. 2) Tratamiento de datos se realiza los cálculos necesarios, para expresar los resultados en la forma requerida. Se presentan a continuación algunos ejemplos de variedad de muestras, analitos y operaciones previas. Muestras Analitos Estado de Naturaleza agregación Matriz Analito Tratamiento más frecuente Metales S I I - Lixiviación - Disgregación Suelos Pesticidas S I O - Extracción con disolventes Trazas metálicas L I I - Cambio iónico - Extracción S-L Aguas Contaminantes L I O - Extracción L-L Ácido ascórbico L B O - No son necesarias Zumo de naranja Edulcorantes L B O - Extracción L-L natural artificiales L B I - Cambio iónico / elusión orgánicos Trazas metálicas Área de Química Analítica 9 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica REACCIONES ANALITICAS Una reacción química es utilizable en la Química Analítica porque origina fenómenos fácilmente observables que, de alguna manera se relacionan con la sustancia -elemento o grupo químico- que se analiza, entonces recibe el nombre de REACCIÓN ANALÍTICA. Estas reacciones pueden verificarse por vía húmeda que, generalmente, tienen lugar entre iones en disolución y por vía seca que se verifican entre sólidos. Las reacciones analíticas por vía húmeda pueden clasificarse según los cuatro tipos fundamentales que se indica a continuación: a) Reacciones ácido-base, que implican una transferencia de protones. b) Reacciones de formación de complejos, en las que se produce una transferencia de iones o de moléculas. c) Reacciones de precipitación, en las que además de haber un intercambio de iones o de moléculas tienen lugar la aparición de una fase sólida. d) Reacciones redox, que implican un intercambio de electrones. Expresión de las Reacciones Analíticas Al expresar, mediante formulación química, lo que ocurre en una reacción analítica se procura que la ecuación se corresponda con lo que ha acontecido en el fenómeno. Así, cuando se añade una disolución de una sal de bario sobre otra que contiene el anión sulfato procedente, bien de una disolución de ácido sulfúrico o de cualquier sulfato soluble, se obtiene un precipitado blanco de sulfato de bario. Han reaccionado exclusivamente e1 anión S04=, y el catión Ba2+, con independencia de que el primero proceda de la disociación del ácido sulfúrico o de algún sulfato soluble, y que el catión Ba2+ provenga del nitrato, del cloruro, o del acetato. Como han reaccionado iones, la formulación sería iónica, en la que intervienen únicamente los iones reaccionantes: SO 4= + Ba 2+ → BaSO4 ↓ Los productos poco disociados (precipitados, substancias covalentes típicas, electrolitos muy débiles) se escribirán en forma molecular, como así mismo las reacciones que tienen lugar entre sólidos. Por ejemplo: el reactivo amoniaco es una disolución acuosa del gas amoniaco NH3. En esta disolución existen gran concentración de moléculas de amoniaco más los iones OH- y NH4+ procedente de la débil reacción del amoniaco con el agua: NH 3 + H 2 O ←→ NH 4+ + OH − Así pues, en las reacciones en las que interviene el amoniaco como reactivo tomarán parte, o las moléculas de amoniaco, o el catión amonio o el anión oxhidrilo, o simultáneamente, algunas de Área de Química Analítica 10 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica estas especies, según la especial afinidad de los grupos químicos existentes sobre ellas. Por ejemplo, si se añade un exceso de disolución acuosa de amoniaco sobre otra de sulfato de cobre se obtiene un intenso color azul porque la apetencia del Cu2+ por las moléculas de amoniaco hace que se forme el complejo azul Cu(NH3)42+, La reacción, se escribirá: Cu 2 + + 4 NH 3 ← →[Cu (NH 3 ) 4 ] 2+ Si la misma disolución de amoniaco se adiciona sobre otra de cloruro férrico, se obtiene un precipitado pardo rojizo de Fe(OH)3 debido a que la escasa solubilidad de esta especie condiciona que el Fe3+ reaccione preferentemente con los iones oxhidrilo. Fe 3+ + 3OH − → Fe(OH )3 ↓ Si un poco de la citada disolución de amoniaco se añade sobre otra que contiene el complejo (HgI 4 )2− se obtiene un precipitado pardo de un compuesto, para cuya formación es necesario que reaccionen moléculas de NH3 y grupos OH- : 2(HgI 4 ) + 3OH − + NH 3 → I − Hg − O − Hg − NH 2 + 7 I − + 2H 2 O 2− Estas ecuaciones deben estar debidamente ajustadas, aunque para muchos aspectos puramente cualitativos no sea preciso, de tal manera que el número de especies atómicas de un miembro sea igual que el del otro y que la suma algebraica de las cargas positivas y negativas, sea, asimismo, igual en ambos miembros. E1 ajuste de las ecuaciones que expresan una reacción analítica es en general sencillo, se logra por simple tanteo. Las reacciones que implican un proceso de oxidación-reducción (redox), se ajustan fácilmente por el proceso de cambio de valencia modificado. En este procedimiento, una vez escrito todas las especies que reaccionan y los productos resultantes de la reacción, se indica cual es el número de electrones que ha perdido el elemento (o elementos) que actúa como oxidante en la molécula o grupo iónico considerado como tal y ese número es el que se pone como coeficiente del grupo que obra como reductor. Se hace lo mismo respecto al número de electrones que gana el elemento (o elementos) de la especie reductora y ese número se pone como coeficiente del grupo oxidante. Con esos dos números claves, el resto del ajuste de la ecuación resulta sencillo por simple tanteo: E1 dicromato potásico, Cr2O7K2 en medio ácido, oxida el catión ferroso a férrico, mientras que él se 3+ reduce a catión Cr . Cr2 O 7= + 6Fe 2+ + 14H + → 2Cr 3+ + 6Fe 3+ + 7H 2 O El cromo, número de oxidación (VI) en el dicromato pasa a número de oxidación (III) en el 3+ catión Cr , ganando 3 electrones por cada átomo de cromó como hay dos átomos de cromo en el Área de Química Analítica 11 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica dicromato el número total de electrones ganados es 6 y éste será el coeficiente del Fe2+; como este Fe2+ pierde un solo electrón para pasar a Fe3+, será la unidad el coeficiente del Cr2O72=; todo el oxígeno del dicromato ha pasado a formar agua con los protones del medio ácido, cuyo coeficiente será 14 para poder formar 7 moléculas de agua con los 7 átomos de oxígeno, quedando por lo tanto una ecuación ajustada atómica y electrónicamente. También se acepta formular las ecuaciones expresando las variaciones experimentadas en el número de oxidación, en lugar de hacerlo iónicamente. Este tipo de formulación se utiliza cuando no se conoce con exactitud la especie o especies iónicas resultantes de la reacción. Por ejemplo, las disoluciones ácidas de molibdeno (VI) son reducidas a azul de molibdeno por el Sn (II). Como el azul formado resulta de la coexistencia de varios grados de oxidación del molibdeno, se formula el que es predominante, el Mo (V). 2Mo(VI) + Sn (II) → 2Mo(V) + Sn (IV) En ocasiones, se pone una flecha hacia abajo para resaltar la formación de un precipitado, u otra hacia arriba para indicar la evolución de gases o vapores. Por ejemplo: CO 3 Ba ↓ +SO =4 + 2H + → SO 4 Ba 2 ↓ + CO 2 ↑ + H 2 O Condiciones de una Reacción para la Identificación y la Cuantificación El Análisis Cualitativo Clásico se fundamenta en el empleo de reacciones químicas (ácidobase, redox, formación de complejos o precipitación), bioquímicas o inmunológicas, que generan un producto identificado por los sentidos humanos, a través de un cambio bien definido (formación de un gas, un precipitado, un color diferente). La identificación de un analito en análisis cualitativo clásico se basa en la comparación del comportamiento del sistema químico entre un estándar del analito, un blanco y la muestra Muchas reacciones usadas en el análisis cualitativo pueden servir para el desarrollo de métodos cuantitativos, se preferencia las condiciones operativas; sin embargo, no debe creerse que siempre una reacción útil en el análisis cualitativo puede ser aplicada en el análisis cuantitativo. El Análisis Cuantitativo Clásico se basa en el empleo de dos instrumentos usados desde hace siglos: la bureta y la balanza, para desarrollar las técnicas analíticas gravimétricas y volumétricas, respectivamente. Una reacción para ser usada como base de un método volumétrico deberá cumplir con los siguientes requisitos: 1- Rapidez 2- Estequiometría y ausencia de reacciones laterales 3- Presencia de un sistema de indicación adecuado para evidenciar el punto final. Área de Química Analítica 12 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Para el desarrollo de procedimientos gravimétricos aceptables es imprescindible que el producto de la reacción cumpla con los siguientes requisitos: 1- Deberá ser poco soluble, de tal forma que el analito a determinar precipite cuantitativamente. 2- Deberá ser fácilmente filtrable. 3- Deberá tener una alta pureza, en lo posible debe estar libre de sustancias coprecipitantes y de insolubles provenientes de otros constituyentes de la muestra. 4- Deberá tener una estequiometría conocida o ser susceptible de adquirirla mediante tratamientos adecuados. EQUILIBRIO QUIMICO El Estado de Equilibrio Las reacciones utilizadas en química analítica nunca proporcionan como resultado una conversión completa de reactivos a productos, más bien, van hacia un estado de equilibrio químico en el cual la relación de concentraciones de reactivos y de productos es constante. Considere el siguiente equilibrio químico: H3AsO4 + 3I─ + 2H+ ↔ H3AsO3 + I3─ + H2O La velocidad de reacción y la magnitud a la que avanza hacia la derecha se puede juzgar rápidamente mediante la observación del color rojo naranja del ión triyoduro I3─ (los otros reactivos participantes en la reacción son incoloros). Si se agrega, por ejemplo, 1 mol de ácido arsénico H3AsO4 a 100 mL de una solución que contiene 3 moles de yoduro de potasio, casi de inmediato aparece el color rojizo del ión triyoduro, y en pocos segundos la intensidad del color se hace constante, lo cual indica que la concentración del ión triyoduro se ha vuelto constante. Una de las leyes fundamentales de la naturaleza es que cualquier sistema físico o químico, cuando no se encuentra en estado de equilibrio, tiende a experimentar un cambio espontáneo e irreversible hacia un estado final de equilibrio; una vez que se ha alcanzado el equilibrio no se observan cambios en el sistema a menos que se modifiquen las condiciones. Concepto Termodinámico del Equilibrio Para describir el equilibrio desde un punto de vista termodinámico se debe definir una propiedad del sistema químico que pueda relacionarse con las concentraciones de las diferentes especies involucradas en el estado de equilibrio. Suele utilizarse el parámetro G, energía libre de Gibbs. Área de Química Analítica 13 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Un sistema químico que inicialmente se encuentre en estado de no equilibrio tiene una tendencia a cambiar espontáneamente hasta que la energía libre del sistema alcance un valor mínimo, momento en el que el sistema alcanza el equilibrio. Se ha utilizado el término tendencia porque la termodinámica no ofrece información sobre la velocidad con que tiende a alcanzarse el equilibrio. Por otra parte, se puede tener información sobre la magnitud de esta tendencia hacia el equilibrio determinando el cambio de energía libre entre los estados inicial y final; este cambio se denomina ∆G, esto es: ∆G = Gfinal - Ginicial Dado que, en general, la energía libre de una especie química depende de factores tales como temperatura, presión, cantidad y naturaleza de la especie; se han establecido unas condiciones que determinan el estado de referencia o normal para los distintos tipos de especies químicas. Todos los estados normales están referidos siempre a una temperatura de 298 °K (25 °C) y a una presión de una atmósfera. Para especies gaseosas, si se comportan como gas ideal, se considera estado normal cuando está pura y a presión unidad. En líquidos y sólidos se considera el estado normal cuando están en estado puro y también a presión unidad. Para solutos o especies disueltas su estado normal está determinado cuando sus actividades son la unidad. Por convenio se le ha asignado a los elementos, en su forma estable, a presión unidad y 298 °K, una energía libre de cero. Para cualquier compuesto o especie iónica el cambio de energía libre que lleva involucrada la reacción por la cual se puede obtener un compuesto o ion a partir de los elementos, cuando tanto reactivos como productos de reacción se encuentran en sus estados normales; se denominan energías libres normales de formación, ∆G of . Energía Libre Normal de Reacción Es la variación de energía libre que tiene lugar en una reacción química cuando reactivos y productos están en su estado normal o de referencia. Se denomina ∆Go y se calcula a partir de las energías libres normales de formación: ∆G o = ∑ ∆G of (productos ) − ∑ ∆G of (reactivos ) Así para la reacción: aA + bB ⇔ cC + dD la expresión de la energía libre normal de reacción quedaría de la siguiente forma: [ ] [ ] [ ] [ ∆G o = c ∆G of C + d ∆G of D − a ∆G of A − b ∆G of B Área de Química Analítica 14 ] Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Sin embargo, en la mayoría de los sistemas químicos, tanto reactivos como productos de reacción se encuentran en concentraciones diferentes a las especificadas para sus estados normales o de referencia. En ese caso, se puede expresar la variación de energía libre de la reacción de manera semejante a la utilizada en la ecuación anterior, pero empleando ∆G y ∆Gf en lugar de ∆G0 y ∆G of . [ ] [ ] [ ] [ ∆G = c ∆G C + d ∆G D − a ∆G A − b ∆G B f f f f ] Restando una de otra las ecuaciones anteriores y reordenando términos se llega a la expresión: ∆G − ∆G o = c [∆G f − a [∆G C − ∆G f o f A − ∆G C ] + d [∆G o f A f D − ∆G ] − b [∆G f o f B − ∆G D o f ] B ] A partir del segundo principio de la Termodinámica se puede obtener la expresión que relaciona ∆G, energía libre de formación a cualquier actividad, con ∆G o ∆G − ∆G o = RT ln a Donde: R es la constante universal de los gases; T la temperatura absoluta y a la actividad en moles/litro. Aplicando esta expresión a las especies A, B, C y D y sustituyendo en 1a última ecuación se tiene: ∆G − ∆G o = cRTln C + dRTln D − aRTln A − bRTln B A , B, C, D siendo 1as actividades de cada una de las especies. Reagrupando los términos logarítmicos se llega a la ∆G = ∆G o − RT ln C d a b C D A B expresión: Según esta ecuación, la energía libre de una reacción depende de la energía libre normal relacionada con las energías libres de formación, y de las actividades de reactivos y productos de reacción. Energía Libre y Constante de Equilibrio Cuando un sistema llega al equilibrio su incremento de energía libre es cero: Área de Química Analítica 15 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica ∆G = 0 , por lo tanto ∆G = − RTln o C d a b C D A B Como el término logarítmico contiene la relación de actividades de reactivos y productos en estado de equilibrio, esta relación se denomina constante termodinámica de equilibrio: C Kt = y por tanto C D a A B d b ∆Gº = − RT ln Kt Como la actividad de una especie química se define como el producto de su concentración por un coeficiente de actividad, ai=Ci.fi, la expresión de la constante termodinámica de equilibrio puede transformarse para concentraciones: Kt = C C a D A B d b c d [ [ C ] f C ] [[D ] f D ] = [[A] f A ]a [[B ] f B ]b c d [ C ] [D ] = [A]a [B]b f Cc f Dd f Cc f Dd × a b = K× a b fA fB fA fB siendo K la constante de equilibrio, que se expresa en unidades de concentración. Dado que Kt es una constante termodinámica, no depende de factores tales como interacciones ion-ion, ion-disolvente, etc.; por consiguiente, también es constante el producto: K× f Cc f Dd f Aa f Bb Sin embargo, el hecho de que los factores de actividad se modifiquen con la composición de la disolución y la fuerza iónica [µ] de la misma, hace que la constante de equilibrio K no sea verdaderamente constante. Si se desean realizar cálculos de equilibrio de forma rigurosa debe utilizarse la constante termodinámica Kt, lo que lleva consigo el conocimiento exacto de los factores de actividad de cada una de las especies involucradas en la reacción. Desgraciadamente, en las disoluciones de interés analítico, que frecuentemente contienen más de un electrolito y las concentraciones pueden ser considerables, es difícil el cálculo preciso de los coeficientes de actividad debido a que las interacciones soluto-soluto y solutos-disolvente no pueden ser cuantitativamente evaluadas. Por consiguiente, en la mayoría de los tratamientos matemáticos sobre equilibrios se ignorarán los coeficientes de actividad y no se hará distinción entre Kt y K; se supondrá que K es constante y se utilizarán concentraciones y no actividades. Se entiende que las conclusiones que se obtengan con esta simplificación son aproximadas no exactas. Área de Química Analítica 16 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Por otra parte, teniendo en cuenta que a las actividades de los disolventes puros y de las especies sólidas se les asigna convencionalmente el valor unidad, las concentraciones de estas especies no figuran en las ecuaciones de equilibrio. Así, por ejemplo, para la disolución del BaSO4 BaSO4 ← →SO=4 + Ba2+ la expresión de la constante de equilibrio será: [ ][ K = SO4= Ba 2+ ] Igualmente, cuando interviene el agua en reacciones, siempre que las disoluciones sean diluidas, su actividad es la unidad y no figura en la expresión de la constante de equilibrio. Fe 3+ + H 2 O ↔ FeOH 2+ + H + [FeOH ][H ] K= [Fe ] 2+ + 3+ Expresión de las Concentraciones Las energías libres están calculadas para concentraciones molares; en consecuencia, en la ecuación del equilibrio se deben expresar, tanto las actividades como las concentraciones, en moles/litro, esto es, en molaridades. Nomenclatura de las Diferentes Constantes de Equilibrio Definida la constante de equilibrio para una reacción química en general, se indica a continuación la nomenclatura particular que se utilizará en los distintos sistemas químicos. Equilibrios ácido-base Se utilizará Ka para la constante de disociación de ácidos monopróticos (reacción de un ácido con agua) y Kb para la reacción de una base con el agua: [A ][H ] [AH ] − Ka = AH↔A─ + H+ + [A ][H O ] = [AH ] − ó AH + H2O ↔A + H3O ─ Área de Química Analítica + 17 Ka + 3 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Kb = A + H2O ↔AH +OH ─ ─ [AH ] [OH − ] [A ] − Para ácidos polipróticos se utilizarán K1,K2,K3,...,Kn para indicar las constantes sucesivas de disociación: AHn↔An-1+ H+ K1 = [An−1 ][H + ] [AH n ] AHn-1↔An-2+ H+ K2 = [An−2 ] [H + ] [AH n−1 ] La constante de autoprotólisis del agua (producto iónico del agua) se denominará Kw. H20 + H20 ↔ H30+ + OH─ Kw = [H30+] [OH─] H2O ↔ H+ + OH─ Kw = [H] [OH─] Equilibrios de Precipitación Para la expresión del producto de solubilidad se utilizará KPs ↓AB ↔ A─ + B+ KpS = [A─] [B+] Equilibrios de Formación de Complejos Se utilizarán constantes de formación denominando k1, k2, ..., kn a las sucesivas constantes parciales y β1, β2, ···,βn a las constantes globales: K1 = M + L ↔ ML K2 = ML + L ↔ ML2 Área de Química Analítica [ML] [M ][ L] 18 [ML2 ] [ML][ L] Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica β= M + 2L ↔ ML2 [ML2 ] [M ][L]2 Según esta nomenclatura, la relación entre constantes parciales y globales es la siguiente: βn = k1· k2 · k3,.....,· kn Equilibrios de óxido-reducción En estos equilibrios sólo se utilizarán constantes de reacción de forma esporádica; normalmente se utilizarán los potenciales de Nernst, E y Eo que serán definidos en el apartado correspondiente. Expresión logarítmica de las constantes Para evitar la escritura de formas exponenciales frecuentemente se utilizan formas logarítmicas para expresar los valores de las constantes de equilibrio. Se define como pK el logaritmo cambiado de signo de la constante K pK = -log K En las constantes de formación de complejos se suele emplear el logaritmo, log K y log de β. Ejemplos: NH4+ ↔ NH3 + H+ Ka = 10-9,2 Ag C1↓ ↔ CL─ + Ag+ Kps =10- pKps = 9,7 Ag+ + 2NH3 ↔ Ag(NH3)2+ β = 107,2 logβ = 7,2 9,7 pKa = 9,2 Factores que Afectan al Equilibrio Los distintos factores que pueden modificar la relación de concentraciones en el equilibrio se pueden clasificar en dos grupos: los que modifican el valor de la constante de equilibrio K, y los que inciden directamente sobre las concentraciones de los reactivos o de los productos de reacción. Modificación del Valor de K En apartados anteriores se ha visto la relación entre constante de equilibrio y energía libre de reacción. Dado que la energía libre depende de la presión y de la temperatura del Área de Química Analítica 19 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica sistema, también dependerá la constante de equilibrio. Termodinámicamente puede encontrarse la relación cuantitativa entre K y presión y temperatura, pero también puede preverse de forma sencilla y cualitativa por el principio de Le Chatelier que establece que cuando se modifica alguna variable en un sistema químico este evoluciona en el sentido de atenuar o anular dicha modificación. En los equilibrios en disolución tiene poco efecto una variación de presión dado que la modificación de volumen en la reacción es despreciable; sin embargo, en equilibrios en fase gaseosa, o cuando alguno de los reactivos o productos sea un gas, una variación de presión puede modificar sustancialmente la constante de equilibrio: un aumento de presión desplaza el equilibrio en el sentido de disminuir el volumen (y por consiguiente la presión) del sistema, y viceversa. Por ejemplo, en la descomposición térmica del CaCO3 para dar CaO y el gas CO2 CO3Ca↓↔ CaO↓ + CO2↑ el volumen de los productos de reacción (debido al CO2 ) es mucho mayor que el del reactivo CaCO3, sólido; por consiguiente, un aumento de presión desplaza el equilibrio de derecha a izquierda. Inversamente, una disminución de la presión favorece la descomposición del CaCO3. La modificación de la temperatura afecta a un sistema químico dependiendo del balance calorífico de la reacción. En las reacciones endotérmicas el aumento de temperatura favorece el desplazamiento de la reacción, mientras que una disminución de la misma disminuye la extensión de la reacción. Semejantes consideraciones pueden hacerse cuando se produce una disminución de temperatura; se favorecen las reacciones exotérmicas y se entorpecen las endotérmicas. En el caso de la reacción: 2H2O ↔ H3O+ + OH─ , la velocidad de esta reacción aumenta 100 veces, cuando se incrementa la temperatura de 0 a 100ºC, y en el caso de H2 + 2I─ ↔ 2HI, es de 0,6 veces cuando se aumenta la temperatura de 300 a 400ºC. Como ya se ha indicado, estas apreciaciones cualitativas pueden ser perfectamente cuantificadas mediante las relaciones termodinámicas que creemos caen fuera del objeto de este texto y que pueden encontrarse en manuales especializados. Aunque se están tratando los factores que afectan al valor de la constante de equilibrio, quizás no esté de más indicar que la presencia de catalizadores no afecta de ninguna manera al equilibrio ni a la constante. Los catalizadores modifican la velocidad de reacción y hacen que se alcancen antes las condiciones de equilibrio, pero la presencia del catalizador no altera los valores de las concentraciones de las especies en el equilibrio. Lo que puede ocurrir es que, en ausencia del catalizador, la condición de equilibrio se alcance en un tiempo extremadamente largo, tiempo que puede ser reducido considerablemente por la presencia del catalizador. Área de Química Analítica 20 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Influencia de la Fuerza Iónica (µ) Si en el tratamiento matemático de los equilibrios se utiliza la constante termodinámica Kt, ésta no se modifica con la fuerza iónica ya que es estrictamente constante e independiente de los factores de actividad. Sin embargo, la constante de equilibrio K, no termodinámica, está relacionada con Kt por los factores de actividad de especies que intervienen en el equilibrio. Ya se ha visto que para la reacción aA + bB ↔ cC + dD la relación entre K y Kt es f Cc f Dd Kt = a b .K fAfB Siendo Kt constante, sólo lo será K si se mantiene constante el término de los factores de actividad. Si en una reacción química sólo intervienen especies moleculares, no cargadas, al tener sus factores de actividad valor unidad, la constante de equilibrio será igual a la termodinámica y no dependerá de la fuerza iónica. Pero si en la reacción intervienen especies iónicas, sus factores de actividad serán normalmente diferentes a la unidad, dependiendo de la fuerza iónica de la disolución. El hecho de que K sea mayor, menor o igual a Kt dependerá del valor que tome el término de los factores de actividad en cada equilibrio en concreto y para una fuerza iónica dada. Así, por ejemplo, en un equilibrio de disociación en que una molécula neutra genera iones: AB ↔ A─ + B+ K t = fA . fB . K a bajos valores de fuerza iónica [µ] el producto fA . fB será menor que la unidad y por tanto K > Kt, el electrolito se disocia más que lo esperado a partir de la constante termodinámica. A valores elevados de fuerza iónica los factores de actividad alcanzan valores superiores a la unidad, en cuyo caso al ser fA . fB > 1 la constante K es menor que Kt . En este sentido tiene importancia el efecto de los electrolitos fuertes, aumentando la fuerza iónica, sobre los electrolitos débiles, dando lugar a las variaciones de K, y por tanto de la disociación, indicada en el párrafo anterior. Este es el denominado efecto salino de electrolitos fuertes sobre débiles. Área de Química Analítica 21 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica En otros casos el efecto de la fuerza iónica es más difícil de predecir. Por ejemplo, en la formación del complejo Ag(NH3)2+ Ag+ + 2NH3 ↔ Ag(NH3)2+ f Ag ( NH 3 ) 2+ .K Kt = f Ag + la constante de equilibrio K tomará valores superiores o inferiores a Kt dependiendo de como varía la relación f Ag(NH3 )2+ /f Ag+ con la fuerza iónica. Modificación de las Concentraciones Cuando en una reacción química se ha alcanzado la situación de equilibrio se tienen unos valores de las concentraciones que permanecerán constantes, mientras no se modifiquen las condiciones de equilibrio. Una forma de alterar el equilibrio es cambiando las concentraciones de las especies que intervienen en el mismo. E1 cambio puede consistir en aumentar o en disminuir estas concentraciones. El sistema evolucionará hasta alcanzar de nuevo el estado de equilibrio, produciéndose una reestructuración de las concentraciones. Aumento de la Concentración La forma de aumentar la concentración de una especie es añadirla de alguna forma al sistema en equilibrio, que evolucionará en el sentido de anular o contrarrestar este aumento de concentración. Por ejemplo, supongamos la disociación del electrolito débil AB AB ↔ A─ + B+ AAB B+ Si en el equilibrio se tienen las concentraciones que se indican en el esquema, la posterior adición de AB altera el equilibrio: AAB NO EQUILIBRIO AB añadido Área de Química Analítica 22 B+ Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica El sistema evoluciona; se desplaza hacia la derecha (nueva disociación) hasta alcanzar una nueva situación de equilibrio, disminuyendo la concentración total de AB y aumentando la de A─ y B+ AAB NUEVO EQUILIBRIO B+ AB Hay que manifestar que, respecto al aumento de concentraciones, no tiene ningún efecto cuando la especie que se añade no interviene en la ecuación del equilibrio. Por ejemplo, en un equilibrio de precipitación el aumento del sólido no modifica el equilibrio de solubilidad, ya que la actividad del sólido, independientemente de su cantidad, es la unidad. Un aumento de la cantidad de agua (actividad también unidad) tampoco modifica la actividad de esta especie, pero actúa indirectamente en el equilibrio al modificar 1as concentraciones del resto de especies. Interacción de electrolitos. Efecto de ion común Más importante analíticamente es el desplazamiento que experimenta el equilibrio al aumentar la concentración de alguno de los iones, A─ ó B+, que se ha producido en la disociación. Es el denominado efecto de ion común. Supongamos que mediante un electrolito fuerte AM (no necesariamente tiene que ser fuerte, aunque su efecto es mayor) se añade una concentración adicional del ion A─, el sistema pierde la situación de equilibrio A- A- añadido M+ AB NO EQUILIBRIO B+ y evoluciona desplazándose hacia la izquierda (se retrograda la disociación) disminuyendo las concentraciones de A─ y B+ y aumentando la de AB Área de Química Analítica 23 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica A- A- AB A- añadido A- añadido M+ M+ NUEVO A B EQUILIBRIO B+ B+ A efectos de simplificar el esquema se ha mantenido constante la concentración de A─ añadido, al reajustarse el equilibrio; en realidad la disminución de la especie A─ se produce a partir de todos los iones A─ en disolución, incluyendo A─ añadido. Lo que disminuye es la concentración total de A─. Efecto semejante tendría la adición de iones B+. Hay que indicar que la presencia del electrolito débil AB, no afecta en absoluto la disociación del fuerte AM. Veamos un caso concreto determinando la variación que experimenta la disociación del ácido acético CH3─COOH al añadirle el electrolito fuerte, HCl. Supongamos que se tiene una disolución de CH3─COOH 0,1 M. CH3─COOH ↔ CH3─COO─ + H+ 0,1 - x Ka = [CH x ][ ] - COO - H + [CH 3 - COOH ] 3 x 10 −4 ,8 = x2 0,1 − x suponiendo que x es despreciable frente a 01 , x2 = 10-5,8 x = 10-2,9 Quedan las siguientes concentraciones: [CH3─COOH] = 0,1- 102,9 2,9 [CH3─COO─] = 102,9 [H+] =10- Área de Química Analítica M M 24 = 0,0987 M = 0,0013 M = 0,0013 M Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Si sobre esta solución conteniendo CH3─COOH se añade HCI de forma que su concentración final sea también 0,1 M CH3─COOH ↔ CH3─COO─ + H+ 0,1- y y y HCl → Cl─ + H+ 0,1 0,1 Ahora la concentración total de iones H+ en solución será la que deja el CH3─COOH en su disociación, más toda la que procede de la disociación del HCl, 0,1 M. Ka = [CH ][ ] - COO - H + [CH 3 - COOH ] 3 10−4,8 = ( y) ( y + 0,1) (0,1 − y) Suponiendo, como en el caso anterior, pero ahora con más razón, que y = 0,1 se obtiene 4,8 que y =10- , quedando las siguientes concentraciones: [CH3─COOH] = 0,1- 10-4,8 ≅ 0,1 M ≅ 0,1 M [CH3─COO─] = 10-4,8 M [H+] = 0,1 - 10-4,8 M Puede observarse como la disociación del CH3─COOH ha disminuido considerablemente por efecto de ion común de los protones aportados por el HCl. Se ha visto cómo la presencia de un electrolito fuerte, que contiene un ion común, afecta notablemente a la disociación de un electrolito débil, no estando alterada la disociación del fuerte. Cuando en una disolución coexisten dos o más electrolitos débiles, conteniendo algún ion común entre ellos, disminuye la disociación de todos y cada uno de los electrolitos, por efecto de que globalmente aumenta la concentración del ion común. Este efecto se refleja en cada electrolito en particular, con mayor extensión cuanto más débil sea ese electrolito con respecto a los demás que coexisten con él. Área de Química Analítica 25 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Supongamos dos ácidos débiles AH y BH, en igual concentración, siendo AH más débil que BH. Representando las concentraciones que dejarían en disolución cuando estuvieran aislados A- B- AH BH H+ H+ Electrolitos aislados: AH ↔ A- + H+ BH ↔ B- + H+ c–x c–y x Ka = x x2 c−x y y K a′ = y2 c−x Electrolitos juntos: AH ↔ A- + H+ BH ↔ B- + H+ c – x´ c – y´ x´ Ka = x´ x′( x′ + y ′) c − x′ y´ K a′ = y´ y ′( x′ + y ′) c − y′ Si coexisten en la misma disolución, a igual concentración, los protones liberados por AH afectan al equilibrio de BH, y los de BH en AH, modificándose ambos equilibrios en el sentido de disminuir la disociación. Tanto en el equilibrio de AH como en el de BH hay que considerar los protones totales en disolución. En este caso será más importante el efecto de BH sobre AH que viceversa, debido a que el ácido BH libera más protones a la disolución y por consiguiente el efecto de ion común es mayor. Cuanto más fuerte sea BH mayor será su efecto sobre AH y menor el de AH sobre él. El caso límite sería cuando BH fuese fuerte, en cuyo caso e1 efecto de AH sobre BH sería nulo, como se ha indicado en el apartado anterior. Los distintos casos de interacción entre electrolitos por efecto de ion común se estudiarán con más detalle al tratar los distintos tipos de equilibrios químicos. Área de Química Analítica 26 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Disminución de la Concentración Se puede modificar una situación de equilibrio químico, disminuyendo la concentración de alguna de las especies que intervienen en él mediante una reacción química que se podrá denominar parásita o colateral. Si se tiene el electrolito AB, en equilibrio con A y B y se disminuye mediante una reacción química, cualquiera de las especies AB, A ó B, el equilibrio se desplaza en el sentido de compensar la disminución de dicha especie. Supongamos que AB es un precipitado y que se retira la especie B por formación de un complejo con el ligando L (para simplificar se omiten las cargas de los iones) A- AB nL BLn B+ Al disminuir B en solución por formación del complejo BL se rompe el equilibrio entre A, B y el precipitado AB; en consecuencia AB se tiene que disolver más para reestablecer el equilibrio: A- AB BLn B + E1 desplazamiento del equilibrio será tanto mayor cuanto mayor sea la extensión de la reacción parásita que lo provoca. Así, por ejemplo, el precipitado de AgBr aumenta su solubilidad en presencia de los complejantes del ion Ag, NH3 y CN-; el aumento de solubilidad es mucho mayor con cianuro porque la reacción: AgBr + 2CN- ↔ Ag(CN)2- + Brestá más desplazada que la reacción AgBr + 2NH3 ↔ Ag(NH3 ) 2+ + Bral ser el complejo Ag(CN) 2─ más estable que el Ag(NH3 ) 2+ Área de Química Analítica 27 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Se podrán indicar otros ejemplos de desplazamiento de equilibrios por reacción ácidobase, redox, precipitación, etc., Hay que tener en cuenta que en todos los casos estudiados en que la adición de un electrolito modifica en alguna forma los equilibrios en disolución por efecto de ión común, por reacción química, etc., tiene lugar, además una modificación de la fuerza iónica que afectará a los coeficientes de actividad y por consiguiente el valor de la constante de equilibrio. Este efecto tiene una considerable importancia, como ya se ha visto, en el caso de la adición de electrolitos fuertes a electrolitos débiles. Nota: Los esquemas han sido tomados de “Química Analítica Cualitativa” ; F. Burriel, S. Arribas, F. Lucenas, J. Hernandez, Duodécima Edición. Paraninfo, Madrid, 1985. Área de Química Analítica 28 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica ASPECTOS CUALITATIVOS DE LA QUIMICA ANALITICA El análisis cualitativo identifica una propiedad del analito o sus productos de reacción, el análisis cuantitativo lo mide numéricamente y el análisis estructural lo interpreta. Para llevar a cabo un análisis cuantitativo es preciso tener un conocimiento cualitativo previo, no solo sobre el analito sino sobre las otras especies presentes en la muestra (matriz) que pueden ser interferentes en el proceso analítico. ANÁLISIS ESTRUCTURAL ANÁLISIS CUANTITATIVO ANÁLISIS CUALITATIVO Tomado de Principios de “Principios de Química Analítica”; Miguel Valcárcel, Editorial Springer-Verlag Ibérica, S.A., Barcelona, 1999. Análisis Cualitativo Este es el primer eslabón de las tres finalidades de la Química Analítica, según la información requerida. No se puede cuantificar sin conocer previamente si está o no presenta el analito en la muestra. El análisis cualitativo tiene como objetivo la identificación del analito (átomos, iones, moléculas o grupos químicos) presente en la muestra sometida al proceso analítico. La palabra identificación se emplea comúnmente para describir el proceso analítico cualitativo, implica un reconocimiento a través de las características químicas o físico-químicas del analito o su producto de reacción. La palabra determinación es empleada usualmente en el ámbito del análisis cuantitativo. La forma más habitual de información cualitativa es la que origina una respuesta binaria Si/No, la cual reduce considerablemente la incertidumbre, según sea su nivel informativo. La demanda de información (bio)química se concreta en importantes respuestas binarias tales como: ¿ está o no contaminada esta muestra? ¿hay o no hay aditivo prohibido? ¿ha ingerido o no drogas el atleta? etc. Esta respuesta binaria, aparentemente tan simple, tiene siempre connotaciones cuantitativas. En definitiva, se trata de comparar datos que corresponden a cantidades del analito. Debe tenerse presente que la posibilidad de detectar pequeñas concentraciones, está marcada por el límite de detección, por lo que la respuesta es Si/No existe el analito por encima o por debajo de la concentración límite característica del proceso analítico aplicado. Área de Química Analítica 29 Química Analítica General Conceptos Teóricos y Guía de Estudio Estu Licencia cenciatura en Bioquímica El proceso de medidaa química quím (PMQ) para generar información cualitativa itativa toma en la práctica diferentes denominaciones, tales como c “test”, “ensayo”, “screening”, en lugar ar de análisis. a Tipos de Respuesta binaria El nivel informativo de una un respuesta binaria puede variar significativamen ivamente. Si se representa el nivel creciente de información ación cualitativa, puede verse que la respuesta ta binaria bin más simple se concreta en la identificación ción de d un analito en la NIVEL DE INFORMACIÓN RESPUESTA A BIN BINARIA muestra. La información cualitativa cualita puede requerir Identificación simple que se tenga en cuenta la existencia existe del analito por Identificación y estimación ación cuantitativa encima o por debajo de un n límite límit de concentración, Identificación discriminada inada químicamente en este caso el nivel de inform nformación es mayor. Es Identificación discriminada inada en el espacio cada vez más frecuente la necesidad ne de ofrecer Identificación discriminada inada en el tiempo información cualitativa discriminada discri sobre las diferentes formas en quee puede pue encontrarse un analito en la muestra (especiaci iación). Características de la respuesta esta Binaria B Tomado de Princip rincipios de “Principios de Química Analítica”; Miguel Valcárce árcel, Editoria ditorial Springer-Verlag Ibérica, S.A., Barcelona, 1999. Área de Química Analítica 30 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Representatividad La respuesta SI/NO debe ser representativa de la muestra ensayada, del objeto del que procede, del planteamiento del problema analítico y de la demanda informativa. Exactitud – Precisión Si en el ámbito genérico ambas propiedades están relacionadas, en Análisis Cualitativo esta relación es más intensa. Ello da lugar a que surja una nueva propiedad denominada fiabilidad, que puede definirse como porcentaje de aciertos de los ensayos realizados en alícuotas de la misma muestra al identificar un analito, que depende críticamente de dos propiedades básicas: sensibilidad y selectividad Sensibilidad y Selectividad de las reacciones Un ensayo analítico está caracterizado, en cuanto a su calidad, por dos conceptos fundamentales: sensibilidad y selectividad. La sensibilidad hace referencia a la cantidad o concentración mínima de especie química detectable en un ensayo. La selectividad a la interferencia de unas especies químicas en la detección de otras. ♦ Sensibilidad La sensibilidad expresa la cantidad o concentración mínima de una sustancia que se puede identificar con una determinada reacción. Se puede cuantificar mediante dos parámetros: límite de identificación y concentración límite. Nunca podrá identificarse una analito cuya concentración se encuentre por debajo del límite de detección característico del Proceso de Medida Químico (PMQ). El límite de identificación es la cantidad mínima de sustancia, normalmente expresada en µg, que puede reconocerse en un ensayo. Esta forma de expresar la sensibilidad es poco significativa ya que no se hace referencia al volumen de disolución en el que se realiza el ensayo, siendo evidente que para un mismo límite de identificación la sensibilidad será mayor cuanto mayor sea el volumen que ocupe la cantidad identificada. Por ello es preferible indicar la sensibilidad mediante una concentración. Concentración limite es la mínima concentración de especie a la cual un ensayo aún resulta positivo. Suele expresarse en gramos por mililitro o en partes por millón, ppm. Al valor inverso de la concentración límite se llama dilución límite y expresa una dilución por encima de la cual la reacción ya no es positiva. La definición más general de la sensibilidad S, es la relación de la señal con la concentración o variación de la señal analítica, x, con la concentración, C, de analito: S = x/C Área de Química Analítica 31 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Factores que influyen sobre la sensibilidad Son numerosos y entre ellos exponemos aquéllos cuya influencia es más notable. En general con el control de estos factores, se pretende un aumento de la sensibilidad, bien por eliminación de los factores negativos que la disminuyen o bien utilizando procedimientos químicos o físicos que la incrementen. En la sensibilidad influyen factores químicos como el grado de desplazamiento y la velocidad de la reacción; factores físicos como el color, la forma cristalina de precipitados, y también las condiciones en que se realiza la reacción, como temperatura, acción de la luz, soporte físico, etc. 1- Influencia del desplazamiento de la reacción Si se va a identificar una especie E mediante la adición de un reactivo R que origine e1 producto de reacción P E+R P Es evidente que la sensibilidad de la reacción dependerá de la estabilidad termodinámica de P, esto es, del grado de desplazamiento de la reacción. Cuanto más estable sea P (precipitado más insoluble, complejo más estable, etc.) más fácil será obtenerlo con pequeñas concentraciones de la especie E. Por lo tanto, en principio, serán deseables reacciones muy desplazadas que originen productos de reacción muy estables. Sin embargo, la mayoría de las veces, más importante que la estabilidad del producto formado es su perceptibilidad, ya que de poco sirve obtener un producto muy estable o en elevada concentración si no es fácilmente perceptible. Más importante que la cantidad o concentración de especie obtenida son las propiedades físicas que permiten su percepción. Así, por ejemplo, el ion SCN- forma con el Fe3+ complejos color rojo, muy poco estable; y con el Hg2+ un complejo incoloro, muy estable. El complejo con Fe es muy poco estable, pero permite identificar al Fe3+ debido a su intenso color rojo, aún cuando esté en pequeña concentración. Por el contrario, el complejo con Hg, muy estable, no tiene ninguna utilidad para fines de identificación debido a que es incoloro y no es perceptible. 2- Influencia del color Cuanto mejor se distinga el color del producto de reacción (precipitado, complejo, producto redox) del color de los reactivos más sensible será la reacción de identificación; de ahí que siempre se procuren elegir aquellas reacciones que originan productos fuertemente coloreados, o buscan procedimientos para que aquellos productos incoloros o con débil color como hidróxidos de aluminio o magnesio, resulten más perceptibles por la formación de lacas coloreadas. Área de Química Analítica 32 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica 3- Influencia de la técnica empleada La sensibilidad de una reacción puede variar según sea el soporte empleado para su realización, aunque se mantengan invariables los restantes factores experimentales. En general, las reacciones efectuadas sobre papel de filtro son más sensibles que las realizadas en tubo o placa de gotas, y esta sensibilidad aún se acrecienta más si el papel previamente se impregna con el reactivo. Este hecho es debido a que sobre el papel se ponen de manifiesto fenómenos de adsorción que no ocurren en otros soportes no porosos. En los papeles reactivos una gota de problema reacciona inmediatamente, y si el producto de la reacción es sólido, al quedar excluida la difusión capilar, el enriquecimiento local hace apreciables muy pequeñas cantidades de sustancia a identificar. 4- Influencia de la extracción La extracción líquido-líquido, utilizando disolventes orgánicos no polares, constituye uno de los mejores medios de aumentar la sensibilidad de una reacción cuyo producto es susceptible de ser extraído. Desplazamiento del equilibrio y estabilización: Al extraerse una especie y disminuir su concentración en la fase acuosa, todos los equilibrios se desplazan hacia su formación, aumentando consiguientemente su estabilidad. Concentración de la especie: Si el volumen de extractante es inferior al de la fase acuosa, y el coeficiente de reparto es favorable, la fase orgánica contiene ahora una concentración de ion metálico superior a la que había en la fase acuosa. Cambio y aumento de color: E1 color de la especie extraída es diferente y más intenso que el que tenía la mezcla de complejos en fase acuosa. 5- Influencias de sustancias extrañas En general, las sustancias que acompañan al producto que se identifica, disminuyen la sensibilidad del ensayo de identificación, aún cuando estas no reaccionen con el reactivo. Pero si reaccionan con él, originando productos análogos en color o forma a la reacción de identificación, es necesaria su separación previa, o su inactivación por enmascaramiento. Si reaccionan con el reactivo pero sin originar productos perturbadores, entonces es necesaria la adición de un exceso de reactivo. ♦ Selectividad de las reacciones La selectividad expresa el grado de interferencia de unas especies químicas en la identificación de otras. Las técnicas analíticas de separación de especies de forma individual o por Área de Química Analítica 33 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica grupos, es una alternativa bastante frecuente en el PMQ con fines cualitativos; en este contexto la selectividad se refiere a la separación en sí. E1 caso más favorable de selectividad es aquél en el que ninguna otra especie interfiere una reacción de identificación y ésta es completamente característica de la sustancia con la que reacciona, se dice entonces, que dicha reacción es especifica. Cuando la reacción es común y característica de pocas sustancias se la denomina reacción selectiva. Los reactivos selectivos y específicos se engloban en la denominación común de reactivos especiales. Esta clasificación de los reactivos tiene cierta flexibilidad. Así, según las condiciones del ensayo, una reacción selectiva puede hacerse específica y otra general puede ser selectiva e incluso específica. Por ejemplo, e1 amoníaco en disolución, es un reactivo general porque precipita numerosos hidróxidos y sales básicas; pero también es selectivo de los iones Cu2+ y Ni2+; con lo que forma complejos aminados de fuerte color azul, y puede constituir una reacción específica para el ion cúprico en ausencia de níquel. Enmascaramiento de iones: Las reacciones específicas son muy pocas, en la realidad casi siempre existen iones perturbadores de la reacción. Una manera de eliminar esta acción perturbadora es la eliminación de los iones interferentes separándolos como precipitado insoluble. Este es el proceso seguido en los métodos clásicos de análisis: precipitación en grupos mediante reactivos de selección para que la presencia de sus iones no moleste la identificación de los siguientes. Pero en Química Analítica existen otros recursos que puede aprovecharse con eficacia como son la extracción, e1 intercambio iónico o las separaciones por cromatografía. E1 proceso mediante el cual se aumenta la selectividad de las reacciones eliminando las interferencias de los iones molestos por medios sencillos y rápidos que aventajen a la clásica separación por precipitación, recibe el nombre de enmascaramiento, ocultación o inmovilización de iones. Una especie puede enmascararse por cualquier procedimiento que disminuya su concentración en tal medida que dicha especie ya no reaccione o que su producto de reacción no sea apreciable. Para ello se pueden utilizar reacciones ácido-base, de oxidación-reducción y de formación de complejos, siendo estas últimas las más utilizadas. En el enmascaramiento por formación de complejos la especie interferente se incorpora a un complejo suficientemente estable. Por ejemplo, en la reacción de VOGEL para cobalto, en la que se forma el complejo azul Co(SCN)42-, perturba el Fe3+ que por formar el complejo Fe(SCN)2+, de color rojo, que impide la apreciación del azul del compuesto de cobalto. Sin embargo, basta adicionar fluoruro, tartrato, fosfato o pirofosfato, ligandos con los que el Fe3+ forma complejos más estables que con el tiocianato, para que desaparezca el color rojo y sea perfectamente apreciable el color azul del cobalto. Área de Química Analítica 34 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica TIPOS DE IDENTIFICACION CUALITATIVA Las técnicas analítica implicadas en el análisis cualitativo pueden ser los sentidos humanos (Análisis Clásico) o un instrumento (Análisis Instrumental), la diferencia entre estos se basa en el tipo de instrumento empleado para producir / adquirir la señal. CLÁSICO ANÁLISIS CUALITATIVO INTRUMENTAL El análisis cualitativo clásico se fundamenta en el empleo de los sentidos humanos, principalmente vista y olfato, para poner de manifiesto la presencia de un analito mediante el empleo de reacciones químicas (ácido-base, oxido-reducción, formación de complejos o precipitación), bioquímicas o inmunológicas, que generan un producto identificado por los sentidos humanos, a través de un cambio bien definido (formación de un gas, un precipitado, un color diferente). La identificación de un analito en análisis cualitativo clásico se basa en la comparación del comportamiento en el sistema químico de un estandar del analito, de un blanco y de una muestra en la que puede estar o no estar el analito. El análisis cualitativo clásico puede clasificarse atendiendo a diferentes criterios, según se muestar en el siguiente esquema: Con separaciones Según el procedimiento Sin separaciones ANALISIS CUALITATIVO CLÁSICO De grupo Reconocimiento Enmascarantes Según los reactivos empleados Inorgánicos Orgánicos Bioquímicos Inmunológicos Según naturaleza de los analitos - Inorgánicos - Orgánicos - Bioquímicos Área de Química Analítica 35 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica En el análisis cualitativo instrumental las características físisco-químicas del analito o de su producto de reacción son transformadas en señales medibles por instrumentos ópticos, electroanalíticos, térmicos, magnéticos, etc., que son utilizadas para su identificación. El potencial de la instrumentación confiere al análisis cualitativo instrumental una mayor fiabilidad y campo de aplicación. La identificación depende de la comparación de la señal que se obtiene del instrumento al someter al proceso analítico a tres alícuotas de: 1- Un estandar, que contiene al analito. 2- Un blanco que no contiene al analito. 3- Una muestra que puede o no contener al analito. En la figura 1 se muestran los espectros de emisión de fluorescencia de dos especies A y B que permiten ser identificadas midiendo la radiación emitida a diferentes longitudes de onda, 420 nm para A y 565 nm para B. Intensidad de Fluorescencia Figura 1 B A 200 300 400 500 600 λ nm Estándares en Análisis Cualitativo Clásico Como ciencia metrológica la Química Analítica se basa en la medición de parámetros. Medir es comparar y para comparar es preciso tener referencias denominadas patrones o estándares. Si el instrumento de medida es el cuerpo humano, como en el caso del análisis cualitativo clásico, previamente el analista debe haber grabado en su mente la respuesta de un referente (estandar). Estándares cualitativos: el análisis cualitativo clásico se basa en la relación señal/propiedad del analito. El producto de una reacción química es identificado previamente por el operador mediante el empleo de estándares puros del analito, una vez grabado en el cerebro del operador las características del producto, se realiza el test de reconocimiento en una muestra que finalmente se basa en la decisión humana de si este producto es igual o no al que ha originado el estandar. Área de Química Analítica 36 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Ejemplo: el olor característico del ácido sulfhídrico (H2S) debe conocerse para identificar la presencia de sulfuros en una muestra, para lo cual se añade ácido clorhídrico a la misma, originándose como producto ácido sulfhídrico que es volátil, generando un olor muy típico. S2- + 2 H+ H2S Si el químico analítico no hubiera conocido previamente este olor, no podría haberlo identificado en la muestra tratada. Para ello, ha debido realizar un ensayo con sulfuro sódico (estandar) al que ha añadido HCl. Calibración en Análisis Cualitativo Calibración instrumental: se realiza con estándares que no contienen el analito para asegurar el perfecto funcionamiento del instrumental a usar con fines cualitativos. Calibración metodológica: se lleva a cabo con estándares que contienen el analito para establecer una relación clara entre la característica físico-química que se va a detectar en el analito o su producto de reacción y la señal. La identificación implícita en análisis cualitativo se soporta a través de estandares, mediante la calibración metodológica. a) Cuando el análisis se basa en la relación señal/propiedades del analito (o producto), como en el caso del análisis cualitativo clásico, el producto de una reacción química (gas o sólido) es previamente identificado por el operador mediante el empleo de estándares puros del analito. Una vez grabado en el cerebro, las características del producto (olor, color, textura, etc.) se realiza el “test” de reconocimiento en una alícuota de la muestra. b) En análisis cualitativo instrumental se obtienen dos conjuntos de datos (parámetros instrumental/señal) con el estandar y la muestra, que se comparan entre sí. La identificación es tanto más fiable cuanto más completa es la similitud y mayor es el número de datos implicados. Área de Química Analítica 37 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica DISOLUCION DE MUESTRAS SÓLIDAS La mayoría de los métodos separativos y determinativos utilizados en el análisis químico, se llevan a cabo en solución, por lo que las sustancias sólidas se deben disolver convenientemente para poner en solución los elementos de interés. Esta solución por lo general es acuosa, sobre todo si se trata de materiales inorgánicos. Por otra parte, el hecho de conocer la solubilidad de una muestra, parcial o total, es un dato importante para dilucidar la naturaleza del material. La manera de poner un material en solución depende fundamentalmente de la NATURALEZA de la muestra y la CARACTERISTICA del componente a determinar. Puede ocurrir que se desee determinar el contenido de Na en una muestra heterogénea donde este elemento está contenido solamente en una sal como el NaCl. Entonces, nos debe preocupar únicamente la puesta en solución del NaCl y en dicha solución hacer la determinación correspondiente. Las sustancias empleadas habitualmente como disolventes incluyen: 1. agua 2. ácidos concentrados y diluidos 3. mezclas de ácidos ( agua regia ) 4. sustancias sólidas ( fundentes ) Algunos autores denominan DISOLUCION de una muestra, al proceso que utiliza un solvente líquido (generalmente acuoso), y a temperaturas inferiores a los 100 °C, para poner en solución los elementos deseados. El término DISGREGACION se utiliza para expresar una acción más enérgica, tanto en relación a la temperatura y presión, como a la característica de la sustancia empleada en tal caso. Habitualmente se emplean en este procedimiento ácidos fuertes concentrados, solos y en mezclas, a temperaturas por encima de los 120 °C, mientras que en el caso de los sólidos fundidos, las temperaturas pueden sobrepasar los 1000°C. Con ambas sustancias, las cantidades del reactivo empleadas son muy altas. En este término se incluye también el tratamiento de la muestra con sustancias gaseosas, tal es el caso del uso de Cl2. También corresponde mencionar aquí el uso de sistemas cerrados bajo presión (bombas Parr) donde se utilizan ácidos como disgregantes a temperaturas moderadas y elevadas presiones (aproximadamente entre 70 y100 atm y hasta 300 atm). DISOLUCION Un orden creciente de severidad de una técnica de disolución sería: agua, agua caliente, ácidos diluidos, ácidos concentrados y agua regia. Cada sustancia empleada como disolvente se la debe utilizar primero en frío y después en caliente, y para cuando se trata de ácidos, primero diluido y posteriormente concentrado. Si se desea comprobar que se ha disuelto parte del material, se evaporan unas gotas de la solución obtenida. Si aparece algún depósito quiere decir entonces que efectivamente parte del material se disolvió. Cuando la solución se ha hecho con ácidos concentrados, es necesario eliminar el exceso de ácido por cuanto puede ser perjudicial en el procedimiento posterior. Procedimiento Una vez pesada la muestra se la coloca en un vaso de precipitación, el que debe cubrirse con un vidrio reloj con el lado convexo hacia abajo. El solvente se agrega con mucho cuidado, utilizando para ello una varilla de vidrio apoyada contra la pared del vaso a efectos de evitar salpicaduras. Área de Química Analítica 38 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica ENSAYOS DE SOLUBILIDAD 1. Agua Al tratar de disolver una sustancia en agua y posteriormente calentar, además de observar la disolución en si, se debe verificar el desprendimiento de gases tales como: O2, H2S, HCl , HBr, HI, H3N; puede haber, además, un cambio de pH y formación de un compuesto insoluble. 2. HCl Algunas sales (y compuestos naturales) desprenden gases cuando son tratados con HCl. Dichas sales provienen de ácidos débiles, como es el caso del CaCO3. Los volátiles producidos en estos casos son CO2, H2S. El reconocimiento de carbonatos en muestras naturales se hace habitualmente por reacción con HCl, para observar el deprendimiento de CO2. La disolución con HCl puede producir también compuestos insolubles: cloruros de Ag+, Pb2+, Hg22+. En general, el HCl es un buen disolvente de los óxidos. 3. HNO3 El ácido nítrico, además de disolvente es un agente oxidante muy utilizado y en especial cuando la muestra contiene materia orgánica. El HNO3 es un buen disolvente de los metales por cuanto se combina la acción oxidante y la de ácido propiamente dicho. Cu + 2 HNO3 + 2 H+ ⇒ Cu2+ + 2 NO2 + 2 H2O 4. HCl - HNO3 (3 volúmenes de HCl ∼ 12 M + 1 volumen de HNO3 ∼ 15 M ) Esta mezcla conocida con el nombre de agua regia, es un importante disolvente de sulfuros metálicos, Au y Pt. Es una combinación de poder oxidante y complejante, al que se suma el de ácido propiamente dicho. En algunos casos se puede reemplazar la acción oxidante del HNO3 por KClO3 DISGREGACION DE RESIDUOS INSOLUBLES EN ACIDOS En algunos casos puede quedar un residuo insoluble después de tratar una muestra con agua o ácidos. En tal caso debe procederse a una disgregación, lo que permitirá una posterior disolución en agua o ácidos. Hay sustancias a las que inicialmente deben disgregarse en forma enérgica por cuanto el agua o los ácidos no tienen efectos sobre ellas. Se incluyen aquí muchas muestras de origen natural (óxidos de Al, Fe, Cr, etc y silicatos en general ). La disgregación es un procedimiento por medio del cual, una muestra o residuo insoluble se pone en contacto con otras sustancias sólidas, por lo general mezclas salinas, o con ácidos fuertes o sus mezclas en condiciones muy enérgicas. En general, los disgregantes son sustancias muy reactivas a lo que se le agrega la acción de la temperatura y en algunos casos de la presión (bombas Parr). En las disgregaciones que utilizan sustancias sólidas como fundentes, la efectividad de la operación se debe a las elevadas temperaturas de la misma, como también a la alta concentración de reactivo. Los fundentes alcalinos (Na2CO3, NaOH, Na2O2 ), se emplean para disgregar sustancias de naturaleza ácida (ej. silicatos). Los fundentes de naturaleza ácida (KHSO4) con sustancias alcalinas (Fe2O3). Para las sustancias anfóteras, se emplean fundentes ácidos y básicos. Área de Química Analítica 39 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Los fundentes oxidantes (Na2O2) se emplean frente a sustancias oxidables (FeO). PRINCIPALES AGENTES DISGREGANTES 1. DISGREGACIÓN ALCALINA I Alcalina simple Disgregante: Na2CO3 o Na2CO3 - K2CO3 ( 1:1 ) Las sustancias que se disgregan en este caso son: sulfatos alcalinos térreos ( SrSO4 - BaSO4 ), silicatos y SiO2, entre otros. Si se emplea Na2CO3, la temperatura de fusión debe sobrepasar los 850 °C (punto de fusión del carbonato). En cambio cuando se usa la mezcla Na2CO3 - K2CO3, la temperatura de fusión es 750 °C, pues forman un eutéctico con ese punto de fusión. Disgregante: KOH - NaOH Estos hidróxidos pueden emplearse como sólidos o soluciones concentradas. Las sustancias que se disgregan son: halogenuros de Ag, cianuros, silicatos minerales que no se pueden atacar con mezclas de ácidos. II Alcalino-oxidante Disgregante: Na2CO3 + KNO3 ( 5 : 2 ) Na2CO3 + Na2O2 ( 1 : 1 ) Con estas sustancias se disgregan: sulfuros y arsenosulfuros, sales de Cr anhidras o calcinadas 2. DISGREGACION ACIDA Ácidos concentrados Se emplean en este caso, H2SO4, HClO4, HCl, HF, solos o mezclados con otros ácidos. Las sustancias que se pueden disgregar incluyen: mezclas inorgánicas y orgánicas, fosfatos naturales, carbono, fósforo, fluoruros y fluorsilicatos El H2SO4 concentrado y en caliente, solo o mezclado con otros ácidos (HNO3) se utiliza en la disgregación de sistemas con materia inorgánica y orgánica, como los materiales biológicos, para la determinación de iones metálicos. El ataque se hace en matraces tipo Kjeldahl, calentando directamente a la llama. Este procedimiento es el que se conoce habitualmente como mineralización, y es utilizado siempre que hay materia orgánica en cantidades importantes en la muestra. El HClO4 también se usa en casos similares solo que al contacto con la materia orgánica puede producir explosiones debido a la liberación violenta de gases, particularmente CO2. Por tal razón es común usar inicialmente HNO3 o H2SO4, y una vez eliminado el reductor (materia orgánica ), proseguir el ataque con HClO4. MATERIALES EMPLEADOS Cuando se realizan disgregaciones utilizando ácidos concentrados en caliente, los elementos apropiados son: Vidrio: si entre los ácidos no se encuentra el HF ( recordar que este ácido ataca el vidrio). La temperatura con este material no debe superar los 500 °C (vidrio pyrex ). Área de Química Analítica 40 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Teflón: utilizado en sistema abierto (vaso) o cerrado (tipo bomba Parr). Este material es muy importante cuando la disgregación con ácidos emplea HF, ya que a diferencia del vidrio, no es atacado. La temperatura máxima a que se puede usar el teflón es de 250 °C, por encima de la cual el material se descompone. Las bombas tipo Parr, son vasos de teflón con tapa hermética, conjunto al que se le coloca una cubierta de acero inoxidable que posee un cierre a rosca. Las disgregaciones se realizan en medio ácido con HF y se utiliza fundamentalmente cuando se desea disolver silicatos. Admite temperaturas de 120 °C, aunque hay algunas más robustas que toleran hasta 250 °C. No se deben incluir entre los ácidos aquellos que reaccionen con el teflón, cual es el caso del HClO4. Platino: Se puede utilizar con cualquier mezcla ácida excepto el agua regia que lo ataca . Entre los crisoles empleados para las fusiones encontramos: porcelana y cuarzo: disgregaciones con fundentes alcalinos, sean estos oxidantes, reductores o sulfurantes. platino: (punto de fusión: 1774 °C ) se realizan fusiones con Na2CO3; Na2CO3 + K2CO3; Na2CO3 + KNO3. No debe aparecer cloruro en el medio puesto que ataca el Pt por formación de K2PtCl6. Las disgregaciones ácidas con KHSO4 o con ácidos concentrados incluyendo el uso de HF, se llevan a cabo también en crisoles o cápsulas de Pt. Por su importancia en el análisis y elevado precio, los crisoles de Pt deben utilizarse con el debido cuidado. DIGESTION DE MUESTRAS BIOLOGICAS La cantidad de minerales en los alimentos se determinan mediante procedimientos analíticos sobre las cenizas de las muestras incineradas. El proceso de incineración destruye los compuestos orgánicos y libera los minerales existentes. Estos métodos no incluyen el contenido de nitrógeno de las proteínas, ni otros elementos que se convierten en gases cuando se incineran los alimentos. Los elementos vestigio que se consideran clínicamente relevantes en materiales biológicos pueden clasificarse en tres grandes grupos: 1. Elementos vestigio esenciales: Ca, Cr, Cu, F, Fe, I, Mn, Mo, Se, Si, Sn, V y Zn. 2. Elementos vestigio no-esenciales usados terapéuticamente: Al, Au, B, Bi, Co, Ge, Li y Pt. 3. Elementos vestigio tóxicos y no-esenciales: Ag, As, Ba, Be, Cd, Hg, Ni, Pb, Sb, Te y Tl. En el caso particular del cuerpo humano, los elementos que juegan un rol metabólico también pueden dividirse en varios grupos: 1. Elementos presentes en grandes concentraciones: Na, K, Ca ,Mg 2. Elementos presentes en el nivel de ppm o más bajos, que actúan como carriers de enzimas: Zn, Cu, Ni, Mn, Se, entre otros. 3. Elementos presentes en concentraciones variables y que se comportan como contaminantes: Pb, Cd y Hg. 4. Elementos introducidos como parte de un tratamiento. Área de Química Analítica 41 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Los elementos en sistemas biológicos están presentes en forma ligada a un compuesto orgánico, el que está en “exceso” en forma apreciable. La eliminación de materia orgánica y mineralización de estos elementos no solo es deseable sino que forma parte de una etapa crucial que precede a las de separación y medida analítica. Los constituyentes orgánicos por lo general interfieren tanto en la separación como en la medida. Los elementos vestigio son eluidos desde la matriz orgánica hacia una solución acuosa o son separados por volatilización de la materia orgánica. Esta última etapa, usualmente denominada calcinación (ashing) comprende la eliminación de la materia orgánica por conversión a una forma gaseosa. El residuo inorgánico contiene los elementos de interés. Los métodos más importantes para transformar muestras biológicas como tejidos y fluidos adaptables a los sistemas de nebulización y por ende apropiadas para técnicas instrumentales como espectrometrías atómicas, se basan especialmente en la destrucción de la materia orgánica la que puede ser mediante procedimientos por vía seca o húmeda. En cualquier caso el método empleado debe hacerlo evitando todo tipo de contaminación, reteniendo los analitos en el residuo inorgánico y extrayendo los componentes orgánicos de la muestra. PROCEDIMIENTOS POR VIA SECA Este procedimiento se lleva a cabo según dos procedimientos: a. Elevadas temperaturas Se realiza en un horno mufla y en varias etapas. La primera consiste en un secado a temperaturas que oscilan entre 105 y 150 ºC, luego una precalcinación entre 200 y 400 ºC para finalmente proceder al calcinado principal entre 450 y 550 ºC. Si no se desean determinar elementos volátiles, el calcinado principal se puede realizar a temperaturas próximas a los 800 ºC. Se debe poner especial cuidado en no elevar la temperatura en demasía puesto que se pueden formar compuestos refractarios difíciles de disolver posteriormente por los métodos tradicionales. Las cenizas resultantes se pueden disolver en ácidos o mezclas de ellos. Se emplean habitualmente HCl, HNO3 y H2SO4. Cuando la muestra tiene cantidades importantes de fosfatos y uratos, es recomendable el empleo final de agua regia como disolvente. La principal ventaja de este método es su simplicidad y las desventajas están relacionadas con las pérdidas por volatilización, largos tiempos de calcinación y contaminación causada por las impurezas introducidas por el aire y el container empleado para la calcinación como es el caso del vidriado con óxido de Ti y Zn en los crisoles de porcelana. b. Bajas temperaturas Las temperaturas empleadas son de 100 a 200 ºC y se calcinan entre 1 y 5 g de muestra en una atmósfera de oxígeno generada por un campo magnético de alta frecuencia. Es útil para aquellos casos en que se desea evitar pérdidas de elementos volátiles como Pb y Cd. PROCEDIMIENTOS POR VIA HUMEDA Estos procedimientos incluyen la descomposición de muestras empleando ácidos oxidantes, solos o en mezclas, en sistemas abiertos a presión atmosférica o en sistemas cerrados bajo presión. Área de Química Analítica 42 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica Esto último se hace con el fin de emplear temperaturas mayores que aquellas correspondientes al punto de ebullición de los reactivos y originar presiones elevadas que aceleran el proceso. Se suelen emplear además, agentes oxidantes auxiliares, tal es el caso del peróxido de hidrógeno, los que destruyen la materia orgánica transformado la muestra en un residuo compuesto por sales que son fácilmente solubles en ácidos diluidos. a. Sistemas Abiertos En estos sistemas se emplean los vasos comunes tipo erlenmeyer y Kjeldahl, con o sin condensadores de reflujo. Cuando la muestra posea elementos volátiles a determinar, es conveniente el empleo de frascos cuello largo a fin de evitar pérdidas. El H2O2 es un reactivo de fuerte poder oxidante que se lo emplea comunmente en combinación con el H2SO4. b. Sistemas cerrados En los sistemas cerrados, los ácidos utilizados se pueden calentar a temperaturas mayores incrementando con ello el poder oxidante. Sin embargo, es limitado por la cantidad de muestra que puede utilizarse, puesto que hay una liberación importante de gases con un incremento de la presión. La cantidad de muestra que se emplea habitualmente es 500 mg. En algunos casos se puede hacer una pre-digestión en la misma bomba con lo que se produce la destrucción de gran parte del material orgánico. Esto permite a su vez incrementar la cantidad de muestra. Un aspecto importante de la digestión en sistemas cerrados es que se pueden determinar aquellos elementos volátiles, los que bajo otras circunstancias pueden perderse. Esto se aplica en especial a elementos formadores de hidruros como As, Sb, Se y Te. PROCEDIMIENTO Un procedimiento por “ vía húmeda “ adecuado para descomposición de muestras biológicas consiste en la colocación de la muestra en un tubo de digestión (42 mm de diámetro y 300 mm de alto) o en un matraz tipo Kjeldahl y agregar 50 mL de ácido nítrico concentrado. Se coloca un tubo refrigerante de aire y se calienta a 60 ºC durante 12 horas. Se eleva luego la temperatura hasta 120 ºC durante una hora y finalmente a 140 ºC pero sin el refrigerante para evaporar hasta unos 10 mL aproximadamente. Se deja enfriar y se agrega con mucho cuidado ácido perclórico calentando posteriormente hasta 220 ºC durante media hora y con el refrigerante colocado. Finalmente se retira el refrigerante y se evapora hasta unos 2 ml aproximadamente. El residuo final se lleva a volumen con agua destilada. El tiempo total empleado en esta digestión lleva 18 horas. El periodo de digestión y el aumento progresivo del poder oxidante, combinando ácidos y temperaturas, evita la formación de compuestos volátiles (especialmente de As, Se y Sb) al mismo tiempo nos da las condiciones enérgicas para romper los órgano compuestos más resistente. El único elemento que se pierde con este método de digestión es el Hg. DIGESTIÓN POR MICROONDAS En el espectro electromagnético la radiación comprendida entre 300 y 300.000 MHz corresponde a la energía de microondas. De estas frecuencias la más empleada para microondas científico e industriales es 2450 MHz. Área de Química Analítica 43 Química Analítica General Conceptos Teóricos y Guía de Estudio Licenciatura en Bioquímica La importancia de esta técnica es que se logran temperaturas y presiones elevadas en periodos de tiempo muy cortos. Se conocen dos tipos de equipos: 1) industriales y 2) domésticos. Los primeros pueden ser totalmente automáticos, mientras que en los segundos no por lo que se transforman en equipos de mucho cuidado por los accidentes. Los reactores empleados se construyen de materiales transparentes a las microondas como PTFE, policarbonato y polietileno. Las VENTAJAS de ésta técnica pueden resumirse así: 1. Es muy eficiente 2. Es muy escasa la pérdida de volátiles 3. Se reducen considerablemente los tiempos 4. Permite la automatización. Dentro de las DESVENTAJAS podemos citar: 1. Requiere equipo especial (incluidos los reactores). 2. Es un sistema riesgoso. 3. Se procesan pocas muestras. 4. Se requiere personal experimentado. Un procedimiento típico para disgregación de muestras orgánicas con microondas es: 0,250 g de muestra más 1 mL de H2O2 y 3 mL de HNO3 concentrado se deja en reposo por 3 horas. Se expone a las microondas a mitad de su potencia por unos pocos minutos (2 a 5 minutos). Se destapa el reactor para liberar presión (por seguridad) y se procede a entregar más energía por microondas en periodos de 2 minutos hasta disolución total. BIBLI0GRAFIA P.W.J.M. Boumans. Inductively Coupled Plasma Emision Spectroscopy. Part 2. Applications and Fundamentals. John Wiley & Sons. 1987. R.F.M. Herber and M. Stoeppler. Trace Element Analysis in Biological Specimens. Elsevier, Amsterdan, 1994, pag 21-52. A. Taylor, S. Branch, H. Crews, D.J. Halls, L.. M. M. Owen and M White. Atomic Spectrometry Update- Clinical and Biological Materials, Food and Beverages. J. Anal. At. Spectrom. April 1997, Vol 12 ( 119R-221R ). K.S. Subramanian. Determination of metals in biofluids and tissues: sample preparation methods for atomic spectroscopic techniques. Spectrochim. Acta Part B, 1996, 51 291-319. E. Prichard, G.M. Mackay and J. Points. Trace Analysis: a structured approach to obtaining reliable results. The Royal Society of Chemistry.1996. Área de Química Analítica 44