Soluciones
Anuncio

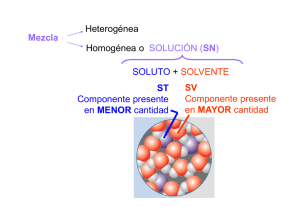
Soluciones Soluciones • Solución – mezcla homogénea • Mezcla homogénea – mezcla con composición y propiedades uniformes a través de la muestra, pero varía de muestra a muestra. • Soluto – componente de la solución que se disuelve, usualmente está en menor cantidad. En una solución, soluto está dispersado uniformemente a través del solvente. • Solvente – componente de la solución que disuelve, usualmente está en mayor cantidad Ejemplos de Soluciones Soluciones • Solución diluida – solución que relativamente contiene poca cantidad de soluto • Solución concentrada – solución que relativamente contiene una alta cantidad de soluto • Solución saturada – solución que contiene la cantidad máxima de soluto disuelta • Concentración – describe la preparación de la solución, indica la composición de la misma. Concentración Molaridad (M) M= moles de soluto L de solución Concentración molalidad (m) m= Moles de soluto kg de solvente Concentración Porciento por masa de A % (w/w)A = masa de A en solución masa total de solución 100 Concentración ppm A: partes por millón de A ppm A = masa de A en solución masa total de solución 106 ppm A = mg/L (para soluciones diluidas y el solvente es agua) Concentración Porciento por volumen de A volumen de A en solución 100 % (v/v)A = volumen total de solución Concentración Porciento (masa / volumen) de A masa de A en solución % (m/v)A = volumen total de solución 100 Concentración • Fracción molar (mole fraction) de A, XA XA = moles de A moles totales en solución • Porciento molar de A, %XA %XA = XA x 100 Concentración Función pX pX = -log [X] Problema Una solución se preparó mezclando 10.0 ml de etanol (EtOH), d=0.789 g/ml y el resto agua hasta un volumen final de 100.0 ml. La densidad de esta solución es 0.982 g/ml. Calcular: a) %(v/v) EtOH b) %(w/w) EtOH c) %(w/v) EtOH d) M EtOH e) m EtOH f) XEtOH g) pEtOH