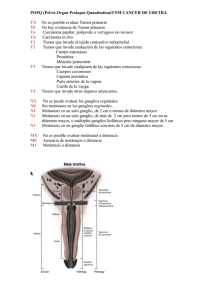
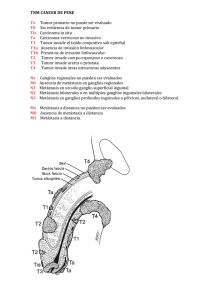
LA METÁSTASIS SUBCLÍNICA EN LOS PACIENTES CON
Anuncio

LA METÁSTASIS SUBCLÍNICA EN LOS PACIENTES CON CARCINOMA EPIDERMOIDE DE LA CAVIDAD BUCAL Autor: Dr. Elier Morales Moreira. Dr. en Estomatología. Especialista de Segundo grado en Cirugía Maxilofacial. Master en Salud Bucal Comunitaria. Profesor Asistente. Hospital General Docente Enrique Cabrera. La Habana. Correo: elierm@infomed.sld.cu RESUMEN Introducción: La diseminación metastásica ganglionar del Carcinoma Escamoso de la cavidad bucal es un factor que influye en el pronóstico y reduce claramente la supervivencia de los pacientes, es por ello que se plantea que la causa principal del fracaso en el tratamiento es la falta del control a nivel loco-regional. Objetivo: determinar la frecuencia de metástasis subclínicas después de una disección cervical. Material y métodos: se realizó una estudio observacional descriptivo retrospectivo en el servicio de Cabeza y Cuello del Instituto de Oncología y Radiobiología de La Habana que abarcó 44 pacientes tratados en 2 años (20122013) con el diagnóstico de carcinoma epidermoide de la cavidad bucal y cuello clínicamente negativo. Resultados: Predominó el carcinoma epidermoide de la lengua en edades superiores a los 60 años y en pacientes del sexo masculino con una relación 3:1. La metástasis subclínicas estuvo presente en el 31.8% de los casos los cuales se beneficiaron con la cirugía electiva de cuello. Predominaron los pacientes con carcinomas entre 2 y 4 cm y se determinó una asociación entre los tumores voluminosos, la variante infiltrante y la afectación ganglionar. Prevalecieron los carcinomas bien diferenciados y no se encontró asociación significativa entre diferenciación histológica y la presencia de metástasis subclínicas. Los factores de mal pronóstico identificados en la pieza quirúrgica: infiltración vascular, linfática y perineural, estuvieron presentes en 11 pacientes, solo 3 de ellos desarrollaron enfermedad ganglionar cervical. Palabras clave: metástasis, neoplasma, carcinoma epidermoide, cavidad bucal INTRODUCCIÓN Las metástasis constituyen implantes tumorales que no guardan continuidad con la lesión primaria y definen claramente a una neoplasia como maligna. 1, 2 Desde hace varios años ha sido aceptado el estadio ganglionar cervical metastásico como el factor pronóstico más importante en pacientes con carcinoma escamoso de Cabeza y Cuello, y los hallazgos patológicos, como resultado del estudio de la disección cervical, como una muestra más exacta del pronóstico que refuerzan el estadio clínico.3 Cuando exploramos un cuello para determinar la presencia de enfermedad metastásica, es importante saber si la ausencia de ganglios linfáticos significa que realmente el cuello es sano. El mayor problema de los cuellos clínicamente negativos es que no existe un método diagnóstico completamente certero. 4 La diseminación del carcinoma epidermoide de la cavidad bucal a los ganglios linfáticos del cuello tiene un patrón predecible y secuencial debido al drenaje linfático preestablecido constituyendo un evento relativamente común que impacta en el pronóstico de cada. 5-7 La intervención quirúrgica temprana del cuello clínicamente negativo con metástasis subclínicas permitirá erradicar la enfermedad precoz antes de que se desarrolle extensión extracapsular, o bien identificar este grupo de pacientes que se beneficiarán con radioterapia posoperatoria. Sin embargo en años recientes ha crecido el interés por la posible presencia de extensión extracapsular en pequeñas adenopatías metastásicas subclínicas en cuellos N0 de pacientes con CECC. 8 Los estudios comparativos actuales plantean que ante un paciente con un carcinoma de cabeza y cuello, sin adenopatías evidentes y que la posibilidad de metástasis supera el 20%, se pueden tomar 2 conductas posibles: Esperar y observar o el tratamiento electivo del cuello mediante cirugía o radioterapia. En el primer caso se controlan los pacientes y solo se tratan aquellos que desarrollan enfermedad ganglionar, con la ventaja de reducir los costos y la morbilidad del tratamiento, que muchas veces resultaría innecesario. En el segundo caso son tratados electivamente todos los pacientes con cuellos N0, con la supuesta ventaja de tratar las metástasis ganglionares en un estadio más incipiente y mejorar la sobrevida. 50 La desventaja del tratamiento electivo es que más de la mitad de los pacientes recibirán cirugía sobre el cuello sin tener metástasis, con el consiguiente aumento del tiempo quirúrgico y de la morbilidad, aún más en disecciones bilaterales. 9,10 Como tratamiento estándar del cuello N0 en el cáncer oral con riesgo de metástasis subclínicas (T2-T4), se ha propuesto el vaciamiento supraomohioideo. Esta técnica no satisface los requerimientos de la radicalidad oncológica frente a metástasis clínicamente establecidas, pero es capaz de proveer similares índices de sobrevida que operaciones más radicales frente a cuellos clínicamente negativos. 10, 11 Mucho se ha discutido a lo largo de los años sobre cuál es la mejor alternativa en el tratamiento de los tumores de cavidad bucal con cuello clínicamente negativo. Sin embargo son muy escasos los estudios controlados donde se comparan aquellos 2 grupos de pacientes. El objetivo de este trabajo es determinar la presencia de metástasis subclínicas en los pacientes con carcinomas de células escamosas de la cavidad bucal y cuello clínicamente negativo, identificando los factores que guardan relación con este evento: Localización del tumor primario, forma clínica de presentación, grado histológico, tamaño del tumor según clasificación TNM, presencia de factores pronósticos adversos en la pieza quirúrgica (Permeación vascular, linfática e infiltración perineural). MATERIAL Y MÉTODOS Se realizó un estudio observacional descriptivo retrospectivo para determinar la frecuencia de metástasis subclínicas en los pacientes sometidos a intervenciones quirúrgicas con cuello clínicamente negativo. Se utilizó como universo todos los pacientes tratados en el servicio de Cabeza y Cuello del Instituto de Oncología Y Radiobiología (INOR) de La Habana con el diagnóstico de carcinoma epidermoide de la cavidad bucal y cuello clínicamente negativo cuyo tratamiento inicial fue la cirugía sobre el tumor primario y el cuello, durante el período comprendido desde enero del 2012 hasta diciembre del 2013. En la selección de los pacientes se tuvieron en cuenta los siguientes criterios de inclusión: 1. Pacientes de ambos sexos con edades comprendidas entre 20 y 80 años con diagnostico histológico de Carcinoma Epidermoide de la cavidad bucal que no habían recibido tratamiento oncoespecífico previo. 2. Pacientes con cuello negativo cuya modalidad terapéutica incluyó la disección cervical. 3. Documentos oficiales completos y actualizados que contribuyan al esclarecimiento de la información (Historia Clínica Hospitalaria). Se excluyeron a los pacientes con Carcinoma Epidermoide de la cavidad bucal y cuello donde no se trató el cuello. El método para obtener la información fue la revisión de la historia clínica. Los datos se procesaron en una computadora IBM compatible a través del procesador estadístico SPSS para Windows. Se le realizó distribución de frecuencia a todas las variables en estudio presentando los resultados en cantidades absolutas y/o relativas. Dentro de la estadística inferencial se realizaron tablas de contingencia y test de hipótesis de proporciones, entre las variables para determinar la existencia o no de diferencias significativas entre los valores comparados, que estuvo dada por una probabilidad (P) <0.05 con una confiabilidad € del 95% y un error € de 0.05 como se establece internacionalmente. Se expresaron los resultados en cuadros y gráficos para mejor análisis y comprensión. RESULTADOS Y DISCUSIÓN Tabla 1. Distribución de los pacientes según la localización anatómica de la lesión y la relación con las metástasis subclínicas. Localización anatómica de la lesión Pacientes con cáncer bucal No % Presencia de metástasis subclínicas SI n=14 NO n=30 Labio 2 4.5 No 1 Lengua 20 45.4 7 50 13 43.3 Suelo de boca 14 31.8 4 28.6 10 33.3 Reborde alveolar y Encía 2 4.5 - - 2 6.7 Trígono retromolar 2 4.5 - - 2 6.7 Mucosa del carrillo. 4 9.1 2 14.3 2 6.7 TOTAL 44 100 14 31.8 30 68.2 Fuente: La historia clínica % 7.1 No 1 % 3.3 La tabla No 1 muestra los sitios anatómicos de la lesión más afectados por carcinomas epidermoides y su relación con las metástasis ganglionares ocultas. Se evidencia que los carcinomas localizados en la lengua fueron los más frecuentes representando el 45.4% de los pacientes seguido por el suelo de boca con el 31.8%. Se halló un 31.8% de metástasis ocultas, cifra que justifica el tratamiento cervical; no tenerlo en cuenta impacta como factor pronóstico adverso, incrementándose la recurrencia regional. Estos resultados coinciden con los estudios nacionales realizados por Ferbeyre Pugazhendi 11 10 y otros trabajos internacionales de Massano 12 y donde todos encontraron que la lengua es el subsitio de la cavidad bucal más afectado por el carcinoma epidermoide. Gallegos7 concluye que la localización del tumor tiene un impacto en la supervivencia directamente proporcional a su capacidad para producir metástasis ganglionares y esta capacidad a su vez se relaciona en forma inversa a la distancia del tumor a la lengua; entre más alejado está el tumor de la lengua la posibilidad de metástasis ganglionares es menor; los tumores del piso de la boca tienen mayor porciento metástasis que los de la encía y éstos más que los de la mucosa yugal y así sucesivamente. La tasa de ganglios metastásicos ocultos en los pacientes con cáncer de lengua y piso de boca son representativos pues superan el 20%. El pronóstico de los pacientes con cáncer en esta localización es peor que el de los carcinomas originados en la mucosa de la cavidad oral, fenómeno principalmente relacionado con la mayor frecuencia de metástasis ganglionares cervicales, mayor infiltración en el espesor muscular y mayor facilidad de extensión por los haces musculares linguales. Los originados en la mucosa del paladar tienen la menor tasa de metástasis ganglionares y el mejor pronóstico en la cavidad bucal. 13 El tratamiento del tumor primario y de las posibles metástasis ganglionares al inicio de la terapéutica es un factor pronóstico fundamental en el carcinoma epidermoide de cabeza y cuello (CECC). La disección cervical rutinaria supraomohioidea ofrece información pronóstica y de riesgo de estos pacientes. 14, 15 Tabla 2. Distribución de los pacientes según el tamaño tumoral (clasificación TNM) y la relación con las metástasis subclínicas. Tamaño de la lesión según Pacientes con Presencia de metástasis clasificación TNM cáncer bucal subclínicas No % SI NO No % No % T1 4 9.1 - - 4 13.3 T2 28 63.6 6 21.4 22 78.6 T3- T4 12 27.3 8 66.7 4 33.3 TOTAL 44 100 14 31.8 30 68.2 Fuente: La historia clínica La tabla No 2 muestra la relación entre el tamaño del tumor y la presencia de metástasis ocultas. El 63.6% de los pacientes fueron tratado por tumores entre 2 cm y 4 cm (T2). Solo 12 pacientes se incluyeron en un estadio avanzado (T3-T4). El diagnóstico de metástasis en los especímenes quirúrgicos correlacionó con el tamaño tumoral y el estadio T. Los pacientes con tumores T3 y T4 experimentaron la mayor riesgo de metástasis representado por el 66.7% del grupo. Estos resultados coinciden con trabajos realizados por Patel 16 donde plantea que el tamaño del tumor primario tiene una relación directamente proporcional con la presencia de ganglios cervicales metastáticos y que la posibilidad tener metástasis ganglionares en tumores T3 y T4 se incrementa hasta 70%. Los tumores voluminosos provocan invasión de las estructuras vecinas lo cual impacta de forma negativa en el pronóstico de los tumores de cabeza y cuello. Por tanto la invasión a estructuras adyacentes se considera un factor pronóstico adverso que depende de la estructura adyacente invadida.17 Tabla 3.Distribución de los pacientes según el grado de diferenciación histológica y su relación con las metástasis subclínicas. Grado de diferenciación Carcinoma epidermoide Pacientes con Presencia cáncer bucal subclínicas No SI % de metástasis NO No % No % bien 32 72.7 11 34.4 21 65.6 epidermoide 11 25 3 27.3 8 72.7 1 2.3 - - 1 100 Carcinoma indiferenciado. - - - - - - TOTAL 44 100 14 31.8 30 68.2 diferenciado Carcinoma moderadamente diferenciado Carcinoma epidermoide pobremente diferenciado. La tabla No 3 muestra el grado de diferenciación de los tumores y la relación con las metástasis subclínicas. Se encontró que los carcinomas bien diferenciados fueron los más frecuentes representando el 72.7% del total. De ellos solo 11 experimentaron metástasis cervical (34.4%). Gonzáles García y col 18 encontraron una asociación estadística significativa entre la pobre diferenciación histológica de los carcinomas de lengua y la presencia de metástasis y concluyen que los tumores más diferenciados se asocian con una menor frecuencia de afectación linfática y con una tasa menor de recurrencia tumoral. Estos resultados no coinciden con los encontrados en nuestro estudio. El grado de diferenciación tumoral ha sido considerado como un factor pronóstico de eficacia controvertida. Los estudios desarrollados a partir de características biológicas del tumor no han alcanzado este grado de certeza, posiblemente reflejando el hecho de que existe una elevada complejidad a nivel molecular en los carcinomas de cabeza y cuello que justificaría la disparidad en los resultados.14 En estudios realizados por O-charoenrat y col 19 no se demostró correlación estadística entre el grado de diferenciación y la presencia de metástasis ocultas en carcinomas de lengua en estadios iniciales de la enfermedad. Tabla 4. Distribución de los pacientes según la forma clínica de la lesión y su relación con las metástasis subclínicas. Forma clínica de la lesión Pacientes con Presencia de metástasis cáncer bucal subclínicas No % SI NO No % No % vegetante 12 27.3 1 8.3 11 91.6 Infiltrante 32 72.7 13 40.6 19 59.4 TOTAL 44 100 14 31.8 30 68.2 Fuente: La historia clínica n=44 La tabla No 5 expone la forma clínica de la lesión y la relación con las metástasis ocultas. Se determinó que la forma infiltrante fue la más frecuente representada por el 72.7% de los pacientes, de ellos el 40.6% experimentó metástasis cervicales subclínicas. Estos resultados coinciden con lo encontrado en la literatura internacional consultada donde Yang A 20, Losi-Guembarovski 21 y Santos 22, plantean que los tumores profundamente infiltrativos conllevan un pronóstico mucho más pobre que los exofíticos por su crecimiento invasivo en profundidad y por sus límites poco precisos, por lo que son consideradas lesiones biológicamente más agresivas. Tabla 5. Presencia de factores pronósticos desfavorables y su relación con las metástasis subclínicas. Factores pronósticos Metástasis ocultas desfavorables Infiltración vascular, linfática y perineural Fuente: La historia clínica SI TOTAL NO No % No % No % 3 27.3 8 72.7 11 25 n=11 La tabla No 6 muestra la presencia de factores de mal pronóstico (Infiltración vascular, linfática y perineural) en la pieza quirúrgica y la relación con las metástasis ocultas encontradas. De los 44 pacientes incluidos en el estudio, 11 de ellos representados por el 25% tuvieron factores pronósticos desfavorables en la pieza quirúrgica. Solo 3 pacientes, de los 11 que presentaron factores pronósticos adversos estuvieron asociados con metástasis subclínicas representando un 27.3%. No se encontró asociación entre estas dos variables. Se ha demostrado que los factores secretados por las células neoplásicas activan o atraen a las células endoteliales linfáticas, promoviéndose la interacción entre ambos tipos celulares, lo que facilita la entrada de las células tumorales a los vasos linfáticos. Diversos trabajos indican que estas interacciones están mediadas por factores de crecimiento, moléculas de la matriz extracelular y moléculas de adhesión. Audet 25 23,24 Por el contrario, sugiere en su estudio que ciertas neoplasias se diseminan a través de vasos linfáticos de neoformación pues se ha encontrado una asociación entre la densidad de vasos linfáticos intratumorales y las metástasis a ganglios linfáticos en el carcinoma de células escamosas de cabeza y cuello y en el carcinoma papilar de tiroides bien diferenciado. El incremento de superficie de contacto entre las células tumorales invasoras y el endotelio linfático hiperplásico, el aumento de permeabilidad vascular y la presión baja del líquido linfático, son factores que podrían explicar el papel de la linfangiogénesis en el desarrollo del cáncer. 26 Numerosos estudios coinciden que la presencia de invasión perineural en el carcinoma de cabeza y cuello es una característica patológica importante predictiva de metástasis cervical, recurrencia cervical, pobre supervivencia libre de enfermedad y supervivencia global. La invasión del espacio perineural esta facilitado por las proximidades de las fibras nerviosas a la capa submucosa con el incremento del grosor tumoral. 27, 28 Shyh-Kuan y coll 29 realizaron una profunda investigación en el periodo desde 2001 a 2009 en un total de 190 pacientes con carcinoma de lengua evaluado el riesgo y las implicaciones clínicas de la infiltración perineural en esta enfermedad en el departamento de ORL del Hospital de Veteranos Retirados de Taipéi de China, demostraron que la invasión perineural no fue un indicador en la recurrencia local, pero si fue un indicador independiente para la metástasis cervical, compatible con el concepto de que la invasión perineural representa un proceso de metástasis distinto, no la sencilla migración celular del tumor a través de un plano más resistente. Por otra parte demostraron una estrecha relación entre grosor tumoral e infiltración perineural. CONCLUSIONES. • Predominó el cáncer localizado en la lengua experimentando la mayor cantidad de metástasis subclínicas. • Se relacionó el mayor tamaño tumoral y la variedad clínica infiltrante con la mayor cantidad de metástasis ocultas. • Predominó el carcinoma bien diferenciado y no se encontró asociación estadística significativa entre la pobre diferenciación histológica y la presencia de metástasis subclínicas. • No se precisó relación entre la presencia de factores pronósticos histopatológicos y el desarrollo de metástasis. REFERENCIAS BIBLIOGRÁFICAS 1- Al kassam Martínez D. Marcadores tumorales en la predicción de metástasis en el carcinoma escamoso de cabeza y cuello. [Tesis Doctoral] Oviedo: Universidad de Oviedo: Departamento de Cirugía y Especialidades Médico-Quirúrgicas [Internet] 2009[citado el 25 de marzo de 2010]. 2- Harish K. Neck dissections: radical to conservative. World J SurgOncol.2005; 3:21 3- Jones AS, Goodyear PW, Ghosh S, Husband D, Helliwell TR, Jones TM. Extensive Neck Node Metastases (N3) in Head and Neck Squamous Carcinoma: Is Radical Treatment Warranted? Otolaryngol Head Neck Surg 2010; 144(1):29-35 4- Albert Cabrera M.J., Hechavarría Toledo S., García López deVillavicencio R.A., Luis Rodríguez A., Rodríguez González A.E. Guía básica para la confección de una Historia Clínica. El Examen Físico Regional. La exploración de la cabeza, el cuello y el torax. Portalesmédicos [online]. Nov. 2007 [citado 14 Diciembre 2009]. Disponible en:URL: http://www.portalesmedicos.com/images/publicaciones/0907historia_clinica//examen_ ganglios_linfaticos.jpg 5- Knegjens JL, Hauptmann M, Pameijer FA, Balm AJ, et all. Tumor volume as prognostic factor in chemoradiation for advanced head and neck cancer. Head Neck 2011; 33: 375–382 6- Rocha Buelvas Anderson. Cáncer oral: el papel del odontólogo en la detección temprana y control. Rev Fac Odontol Univ Antioq [serial on the Internet]. 2009 July [cited 2013 Dec 02]; 21(1): 112-121. Available from: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0121246X2009000200011&lng=en. 7- Gallegos Hernández JF, Ortiz Maldonado AL, Rojas Orellana S, Minauro Muñoz G. Factores pronóstico en cáncer de boca. Acta Méd Gpo Áng. 2010; 8(2):92 8- Coatesworth AP, MacLennan K. “Squamous cell carcinoma of the upper aerodigestive tract: the prevalence of microscopic extracapsular spread and soft tissue deposits in the clinically N0 neck” Head Neck. 2002 Mar; 24(3):258-61 9- Kopczyński P, Flieger R. Pol Merkur Lekarski. Tumor markers used in the diagnosis, monitoring, treatment, and prognosis head and neck cáncer. 2013 Jul; 35(205):37-8. http://www.ncbi.nlm.nih.gov/pubmed/23984603 10- Ferbeyre Binelfa L, Vazquez Cimadevilla JM, Cruz González P, Correa Pablos T. vaciamiento electivo lateral para el tratamiento electivo del cuello en el cáncer laríngeo.Rev cubana oncol. 2001; 17: 84-9. 11- Pugazhendi SK, Thangaswamy V, Venkatasetty A, Thambiah L. The functional neck dissection for lymph node neck metastasis in oral carcinoma. J Pharm BioallSci [serial online] 2012 [cited 2013 Nov 24]; 4:245-7. Available from: http://www.jpbsonline.org/text.asp?2012/4/6/245/100222 12- Massano J, Regateiro FS, Januario G, Ferreira A. Oral squamous cell carcinoma: Review of prognostic and predictive factors. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 141(2):1-8 13- Shaw RJ, McGlashan G, Woolgar JA, Lowe D, B rown JS, V aughan ED et al. Prognostic importance of site in squamous cell carcinoma of the buccal mucosa. Br J Oral Maxillofac Surg 2009; 47: 356-359. 14- Montoro JR, Hicz HA, Souza L, Livingstone D, Melo DH, Tiveron RC et al. Prognostic factors in squamous cell carcinoma of the oral cavity. Braz J Othorhinolaryngol 2008; 74: 861-866. 15- Sun GW, Tang EY, Yang XD, Hu QG. Salvage treatment for recurrent oral squamous cell carcinoma. J Craniofac Surg 2009; 20: 1093-1096. 16- Patel RS, Clark JR, Dirven R, Wyten R, Gao K O’Brien CJ. Prognostic factors in the surgical treatment of patients with oral carcinoma. ANZ J Surg 2009; 79: 19-22. 17- Destefano Urrutia VA, Torres Solano JL, Travezan Carvo R, Postigo Diaz J, Sánchez e Ingunza P, Salas Hurtado A, Torres Vega F, Travezán Carvo R. Resultados del tratamiento del carcinoma epidermoide temprano de lengua oral: 70 casos. Acta Cancerológica. 2002: 31 (1).Disponible en: http://sisbib.unmsm.edu.pe/bvrevistas/acta_cancerol%f3gica/v31_n1/resultados_carci noma.htm 18- González García R, Naval GiasL, Rodríguez Campo F.J, Sastre Pérez J, Muñoz Guerra M, Díaz González F.J. Metástasis cervical contralateral en el carcinoma epidermoide de la cavidad oral: estudio clínico analítico retrospectivo en 315 pacientes primariamente tratados con cirugía. Rev española de Cirugía Oral y Maxilofacial, 2008; 30(3):157-171 19- O-charoenrat P, Pillai G, Patel S, Fisher C, Archer D, Eccles S, Rhys-Evans P. Tumour thickness predicts cervical nodal metastases and survival in early oral tongue cancer. Oral Oncol. 2003 Jun; 39(4):386-90. 20- Yang A, Liu T, Chen F, Ma X, Guo Z, Song M, Li Q, Zeng Z. Survival analysis of 229 patients with advanced squamous cell carcinoma of the oral tongue. Chinese Journal of Cancer [revista en la Internet]. 2008 [citado 2014 Mar 22]; 27:12, 562-567. Disponble en: http://www.cjcsysu.cn/cn/article.asp?id=14318 21- Losi-Guembarovski Roberta, Menezes Rodrigo Paes de, Poliseli Fernando, Chaves Vivian Nappi, Kuasne Hellen, Leichsenring Andrei et al. Oral carcinoma epidemiology in Paraná State, Southern Brazil. Cad. Saúde Pública [revista en la Internet]. 2009 Feb [citado 2014 Mar 22]; 25(2): 393-400. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102311X2009000200018&lng=es. doi: 10.1590/S0102-311X2009000200018. 22- Santos, Fabiano de Sant'Ana; Tanimoto, Hélio Massaiochi; Isper, Miguel Alfredo; Isper, Felipe Gai; Andrade, Renata Barcelo. Carcinoma espinocelular invasivo de boca: relato de caso Rev. ABO nac; 18(1):59-62, fev.-mar. 2010 23- Lim SC, Zhang S, Ishii G, Endoh Y, Kodama K, Miyamoto S, et all. Predictive markers for late cervical metastasis in stage I and II invasive squamous cell carcinoma of the oral tongue. Clin Cancer Res. 2004 Jan 1; 10(1 Pt 1):166-72. http://link.springer.com/chapter/10.1007/978-94-007-5827-8_32 24- Sánchez López JD, Chamorro Santos C, López-Cuervo JE, Valencia Laseca E. Factores histopatológicos en el carcinoma lingual de células escamosas. Rev esp patol 2006; 39 25- Audet N, Beasley NJ, MacMillan C, Jackson DG, Gullane PJ, Kamel-Reid S. Lymphatic vessel density, nodal metastases, and prognosis in patients with head and neck cancer. Arch Otolaryngol Head Neck Surg 2005; 131:1065- 1070. 26- Utrera-Barillas MD, Castro-Manrreza ME, Gutiérrez-Rodríguez M, Benítez-Bribiesca L. Linfangiogénesis en el cáncer y su papel en la diseminación metastásica. Gac Méd Méx 2009; 145 :(1)51-60 27- Liebig C, Ayala G, Wilks JA, Berger DH, Albo D. Perineural invasion in cancer: a review of the literature. Cancer 2009; 115:3379–3391. 28- Marchesi F, Piemonti L, Mantovani A, Allavena P. Molecular mechanisms of perineural invasion, a forgotten pathway of dissemination and metastasis. Cytokine Growth Factor Rev 2010; 21:77–82 29- Shyh-Kuan T, Wing-Yin L, Pen-Yuan C, Shyue-Yih C. Risks and clinical implications of perineural invasion in t1-2 oral tongue squamous cell Carcinoma. Head Neck 2011; 14:16–25