GRADO EN FARMACIA Asignatura: FISICA
Anuncio

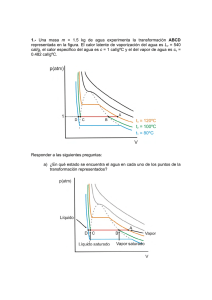
GRADO EN FARMACIA Asignatura: FISICA APLICADA Año académico: 2013-2014 UNIDAD 1. ENERGIA Y TERMODINÁMICA CUESTIONES 1. Cuando nos encontramos con los datos de la siguiente reacción: A + B → 2C, ∆Hº = 20000 cal, esto quiere decir que la reacción ha tenido lugar a 0ºC y 2 atm, ha necesitado calor para producirse y el dato numérico es el calor de formación estándar por mol de C. Justificar la respuesta. Sol.: Falso. 2. En un proceso reversible de un gas ideal monoatómico en condiciones isotérmicas no se cumple que el calor sea igual al trabajo pero de signo contrario. Sol.: Verdadero. 3. Un cilindro encierra un gas ideal a una presión y volumen determinados. A lo largo de un proceso adiabático, el gas se comprime hasta la mitad de su volumen inicial. Entonces, en un proceso isotérmico el gas se expande hasta su volumen inicial, ¿qué tipo de proceso devolverá el sistema a su estado inicial? Sol.: isócoro. 4. Para un proceso isóbaro, en condiciones estándar, con una variación de entalpía igual a 65 kcal/mol y una variación de entropía de 45 cal/mol.K. a) ¿A qué temperatura dicho proceso pasará de ser espontáneo a no serlo? b) ¿Puede darse en un proceso espontáneo una disminución de entropía? Justifica la respuesta utilizando el 3º principio de la termodinámica. Sol.: 1444 K; no. 5. En una expansión isotérmica, un gas ideal a presión inicial P0 se expansiona hasta duplicar su volumen inicial. Luego, el gas se comprime adiabáticamente hasta su volumen original y en ese momento su presión vale 1,32 P0. a) Hallar su presión después de la expansión. b) Calcular la capacidad calorífica molar a volumen constante para el gas, ¿es monoatómico o diatómico? Sol.: 0,5P0; 2,5nR (=7/2nR), diatómico. 6. Si un sistema a temperatura constate de 300 K absorbe 10000 J de calor y no realiza trabajo, tiene una variación de energía interna, de entropía y de entalpia nulas. ¿Es correcta dicha afirmación? Justifica tu respuesta. Sol.: Falso. 7. a) En un proceso a volumen constante se cumple que ∆U = n CV ∆T, pero en un proceso a presión constante no se cumple que ∆U = n CP ∆T. ¿Es correcto? b) ¿Es correcto utilizar la siguiente expresión matemática para calcular la variación de entalpia en un sistema ∆H = n Cp ∆T? Sol.: No; Si. 8. Hallar ∆U y ∆S que se produce al fundir 1 kg de hielo a la presión normal (considérese que la densidad del 3 3 hielo es 0,9 g/cm y la del agua 1 g/cm ) Sol.: 334,4 kJ; 1225 J. GRADO EN FARMACIA Asignatura: FISICA APLICADA Año académico: 2013-2014 9. ¿A qué temperatura las escalas Celsius y Fahrenheit ofrecen la misma lectura? Sol.: -40. 10. ¿Es cierto que un gas se calienta al expandirse adiabáticamente? Justifica la respuesta. Sol.: Falso. 11. En un libro de texto para niños el concepto de energía se explica mediante el uso de viñetas que representan una niña pedaleando en su bicicleta, subiendo una colina, desciendo sin pedalear y, finalmente, frenando hasta parar. Bajo las viñetas se indica ¿Qué es lo que la hace funcionar?.... la energía. Describa si existe algún cambio en la energía a lo largo de las viñetas y si ello implica una violación de la ley de conservación de la energía. Sol.: química en cinética; química en cinética y potencial; potencial en cinética; cinética en térmica. 12. El poder calorífico de los alimentos (en realidad la entalpía de combustión del alimento por unidad de masa) puede ser determinada midiendo el calor producido al quemarse una cantidad del alimento. El calor total desprendido en la combustión total de 1 g (3,10.10-3 moles) de una muestra de grasa de pollo a volumen constante, dada por la reacción C20H32O2 (s) + 27 O2 (g) → 20 CO2 (g) + 16 H2O (l), es de 10000 cal a 37ºC. Calcular el poder calorífico de la grasa de pollo a 37 ºC y presión constante. Sol.: 9987 cal/g. 13. Si un sistema absorbe 10000 J de calor, ¿de qué tipo de proceso debe tratarse para que su entalpia sea nula? Sol.: isobaro o isocoro. 14. Indica, razonadamente, si las siguientes afirmaciones son correctas. Para una reacción química con una entalpia de 10,2 kJ y una entropía de 45,8 J/K, se cumple que: a) Se trata de una reacción espontánea porque aumenta su entropía. b) Se trata de una reacción que libera energía en forma de calor. c) Es una reacción en que los productos están más ordenados que los reactivos. d) A 25ºC la reacción es no espontánea Sol.: Todas Falsas. 15. En sus muchas participaciones en el Tour de Francia, el pentacampeón Miguel Induráin consumía una potencia media de 400 W, durante 5 horas diarias a lo largo de 20 días. ¿Qué cantidad de agua, inicialmente a 24 ºC, podría llevarse hasta su punto de ebullición si se aprovechase completamente toda esa energía? Datos: calor especifico del agua y del hielo son de 1 y 0,5 ca/gºC, respectivamente, y el calor latente de vaporización es de 2257 J/g. Sol.: 453 kg. GRADO EN FARMACIA Asignatura: FISICA APLICADA Año académico: 2013-2014 PROBLEMAS 16. Un deportista amateur (60 kg) decide presentarse a una prueba de triatlón urbano carrera-ciclismoescalada. Tras varios meses de preparación realiza la prueba de la siguiente manera: (1) Recorre 1 km por las calles de la ciudad a una velocidad de 10 m/s. (2) En bici (8 kg) asciende una colina de una altura de 25 m y una inclinación de 35º, con una velocidad de 5 m/s. (3) Alcanza la meta, situada en la parte alta del castillo (120 m) escalando la pared principal de la edificación. a) Calcula la cantidad de trabajo realizado durante la prueba. b) Si la forma en que el cuerpo almacena energía por periodos largos es a base de polímeros de glicógeno formados a partir de glucosa, (glu + glyn + 2 ATP → glyn+1 + 2 ADP + 2 P) con una energía libre de 5000 cal/mol y una entalpia de 44300J. Teniendo en cuenta que solo el 22% de la energía consumida se utiliza para realizar la contracción muscular, ¿cuántos moles de polímero ha sido necesario hidrolizar para realizar dicha prueba? Sol.: 91070 J; 9,3 moles. 17. La forma en que el cuerpo almacena energía por periodos largos es a base de polímeros de glicógeno formados a partir de glucosa, mediante la reacción: glu + glyn → glyn+1 (el subíndice se refiere al número de monómeros en cada polímero) con una energía libre de 5000 cal/mol y una entalpia de 44300J. Dicha reacción realmente transcurre con un consumo de ATP como se refleja en la reacción global: glu + 2 ATP + glyn → 2 ADP+ 2 P + glyn+1. Teniendo en cuenta que la reacción de fosforilación del ADP para dar ATP transcurre con una energía libre de 7,3 kcal/mol, a) ¿Cuántas cal/mol se pierden cuando la reacción tiene lugar en equilibrio? b) Si para reír (contracción músculos de la cara) se empleará el 17% de la energía útil generada en la hidrólisis de dos monómeros de glicógeno ¿cuál sería el rendimiento de dichos músculos? Sol.: -9600 cal/mol; 23%. 18. Una maratonista de 50 kg sube corriendo las escaleras de la Torre Sears de Chicago de 443 m de altura en un tiempo record de 15 min. Durante el esfuerzo realizado es capaz de eliminar en forma de sudor aprox. 0,5 L de agua. Calcular: a) Energía total consumida por la maratonista. b) Teniendo en cuenta que los músculos utilizan la glucosa a modo de combustible con un rendimiento del 50% aprox., ¿qué cantidad de glucosa deberá ingerir la maratonista, una vez finalizada la prueba, para reponer las reservas energéticas consumidas? Datos: Calor especifico y calor latente de evaporación del agua son de 1 cal/gºC y 2257 kJ/kg. El peso molecular de la glucosa es de 180 g/mol y su entalpia de combustión es de 673 kcal/mol. La energía libre de la reacción de formación del ATP es de 33 kJ/mol. Sol.: 1477 kJ; 62,3 g. 19. Cuando un sistema pasa del estado a al b a lo largo de la transformación acb recibe una cantidad de calor de 20000 cal y realiza 7500 cal de trabajo.Calcular: a) ¿Cuánto calor recibe el sistema a lo largo de la transformación adb, si el trabajo es de 2500 cal?, b) Cuando el sistema vuelve de b hacia a, a lo largo de la transformación en forma de curva, el trabajo es de 5000 cal. ¿Cuánto calor absorbe o libera el sistema? c) Si Ua= 0 y Ud=10000 cal, hállese el calor absorbido en los procesos ad y db. Nota: Tener en cuenta el convenio de signos. Sol.: 15000 cal; -17500 cal; 12500 y 2500 cal. GRADO EN FARMACIA Asignatura: FISICA APLICADA Año académico: 2013-2014 20. Dos moles de un gas ideal (γ =1,4) tienen una presión inicial de 4 atm y un volumen de 10,4 L. se obliga al gas a realizar el siguiente proceso cíclico: se expansiona a temperatura constante hasta un volumen 2V 0. Luego se calienta hasta 50ºC a presión constante y finalmente se comprime adiabáticamente hasta su estado inicial. a) Calcular el calor y el trabajo realizado en cada uno de los procesos. b) Comprobar que el ciclo cumple el primer principio de la termodinámica. c) Demostrar que la energía interna es función de estado. Sol.: 2923 y 2923 J, 4031 y 1155 J, 0 y 2888 J; 0. 21. Los Estados Unidos producen unos 2.1016 J de energía eléctrica por día. Esta energía es equivalente a trabajo porque se puede convertir en trabajo con un rendimiento del 100% por medio de un motor eléctrico. a) Si esta energía es producida por centrales con un rendimiento medio del 0,30, ¿cuánto calor se vierte al medio ambiente cada día? b) ¿Cuánta agua se necesita para absorber este calor si la temperatura del agua no ha de aumentar más de 2 ºC y el calor especifico del agua es de 4,18 J/g.K? 16 12 Sol.: 4,7.10 J; 5,57.10 kg. 22. En las jornadas de bienvenida de la universidad se organizan diferentes juegos y competiciones para potenciar la sociabilidad y adaptación de los nuevos estudiantes. Uno de los juegos consiste en mover un bloque de 30 kg desde el suelo hasta una altura de 20 m en el menor tiempo posible, tres alumnos (masa media de 60 kg) realizan la prueba: (1) arrastra el bloque con una fuerza de 225 N (paralela al plano) por una rampa de madera inclinada 37º; (2) Carga el bloque en una mochila y sube en vertical hasta los 20 m con un aporte energético equivalente a 5,2 g de glucosa con un rendimiento muscular del 22%; (3) Se sitúa en el punto más alto y con ayuda de una cuerda eleva el bloque desde el suelo aplicando una fuerza de 300 N. ¿Qué estudiante realiza la prueba en menor tiempo? Aplicar la ley de conservación de la energía. Datos: El coeficiente rozamiento (madera-bloque) es 0,2; el peso molecular de la glucosa es 180 g/mol; la entalpia de la reacción de combustión total de la glucosa es 2840 kJ/mol. Sol.: 37s, 13s, 14 s (estudiante 2). 23. Un cochecillo de niños incontrolado se desliza sin rozamiento, por un lago helado, hacia un agujero en el hielo. Una persona que se encuentra patinando intenta alcanzar el cochecillo. Cuando lo consigue, esta persona y el cochecillo siguen deslizándose hacia el agujero con una velocidad de 11 m/s. El coeficiente de rozamiento entre los patines (posición de frenado) y el suelo helado es de 0,4. Si el patinador tiene una masa de 60 kg y el cochecillo de 30 kg, y la distancia al agujero en el momento de agarrar el cochecito es de 23 m, calcular: a) ¿Fuerza ejercida por el patinador sobre el cochecillo?¿será capaz de detener el cochecillo antes de llegar al agujero? b) Teniendo en cuando que la contracción muscular tiene un rendimiento del 22% y que en la combustión de la glucosa (C6H12O6) genera 673 kcal/mol, ¿qué cantidad de glucosa habrá quemado el patinador en el apartado anterior? Aplicar la ley de conservación de la energía para resolver el ejercicio. Sol.: 77,4 N, No; 0,05 g.