Estudio de la oxidación de la matriz del combustible irradiado en
Anuncio
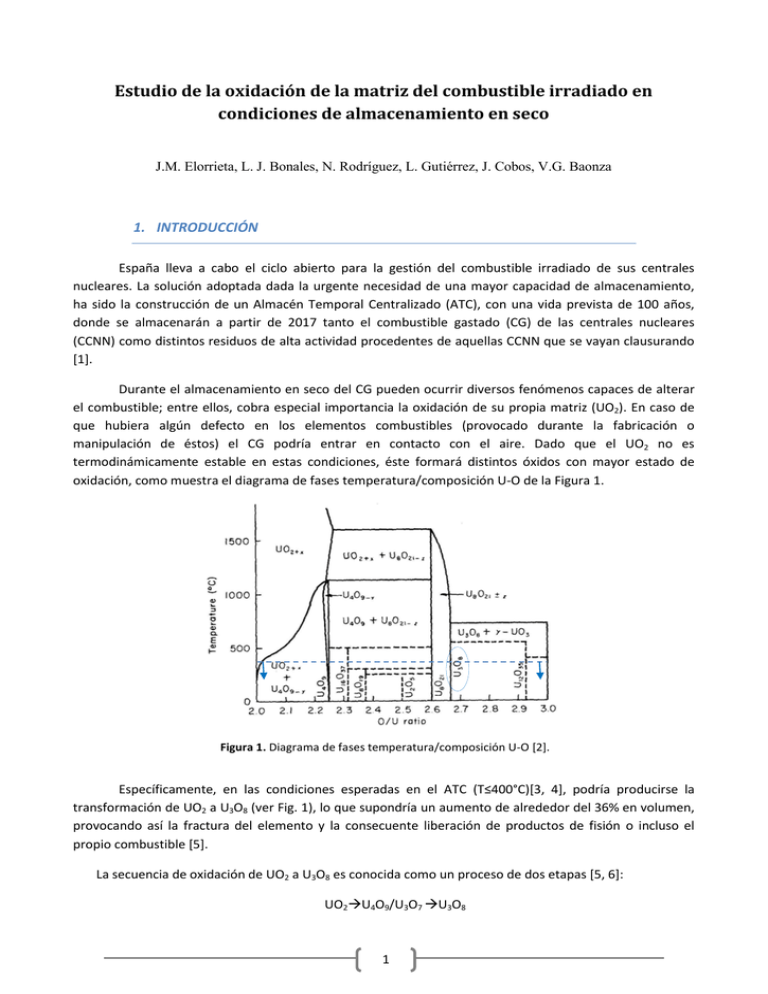
Estudio de la oxidación de la matriz del combustible irradiado en condiciones de almacenamiento en seco J.M. Elorrieta, L. J. Bonales, N. Rodríguez, L. Gutiérrez, J. Cobos, V.G. Baonza 1. INTRODUCCIÓN España lleva a cabo el ciclo abierto para la gestión del combustible irradiado de sus centrales nucleares. La solución adoptada dada la urgente necesidad de una mayor capacidad de almacenamiento, ha sido la construcción de un Almacén Temporal Centralizado (ATC), con una vida prevista de 100 años, donde se almacenarán a partir de 2017 tanto el combustible gastado (CG) de las centrales nucleares (CCNN) como distintos residuos de alta actividad procedentes de aquellas CCNN que se vayan clausurando [1]. Durante el almacenamiento en seco del CG pueden ocurrir diversos fenómenos capaces de alterar el combustible; entre ellos, cobra especial importancia la oxidación de su propia matriz (UO2). En caso de que hubiera algún defecto en los elementos combustibles (provocado durante la fabricación o manipulación de éstos) el CG podría entrar en contacto con el aire. Dado que el UO2 no es termodinámicamente estable en estas condiciones, éste formará distintos óxidos con mayor estado de oxidación, como muestra el diagrama de fases temperatura/composición U-O de la Figura 1. Figura 1. Diagrama de fases temperatura/composición U-O [2]. Específicamente, en las condiciones esperadas en el ATC (T≤400°C)[3, 4], podría producirse la transformación de UO2 a U3O8 (ver Fig. 1), lo que supondría un aumento de alrededor del 36% en volumen, provocando así la fractura del elemento y la consecuente liberación de productos de fisión o incluso el propio combustible [5]. La secuencia de oxidación de UO2 a U3O8 es conocida como un proceso de dos etapas [5, 6]: UO2U4O9/U3O7 U3O8 1 La incorporación de oxígeno en el UO2 causa una leve distorsión en la red cristalina cúbica de estructura fluorita, dando paso al UO2+x hiperestequiométrico. Éste consiste en la misma estructura pero con una mayor contracción de la red, debida al exceso de oxígeno. De este modo, en el momento en el que se alcanza x=0.25 se forma la fase U4O9, estequiometría límite con estructura cúbica de tipo fluorita. Asimismo, la incorporación de oxígeno más allá de U4O9 da lugar a distorsiones que provocan el cambio del sistema cristalográfico cúbico a tetragonal. Este es el caso de la fase U3O7. Por último, una mayor oxidación da lugar a la estructura del U3O8, la cual pertenece al sistema cristalográfico ortorrómbico y posee una densidad mucho menor a la del UO2 (mayor volumen). Las características de los distintos óxidos de uranio mencionados se describen en la Tabla I [6]. Tabla I. Características de los óxidos de interés [6]. FASE SISTEMA CRISTALOGRÁFICO CELDA UNIDAD (nm) DENSIDAD (g/cm3) UO2 Cúbico a=0.547 10.96 U4O9 Cúbico a=0.544 11.30 U3O7 Tetragonal a=0.547; c=0.539 11.40 U3O8 Ortorrómbico a=0.415; b=1.197; c=0.672 8.35 Cabe destacar que la diferente progresión de la oxidación del combustible depende fuertemente del grado de quemado. De este modo, el óxido intermedio observado por varios autores durante la oxidación de UO2 a U3O8 se trata del U3O7 tanto en el caso del combustible fresco [3, 4] como para un grado de quemado bajo [5]. No obstante, sólo se detecta el U4O9 en el caso del combustible nuclear irradiado [7, 8]. 2. MATERIALES Y MÉTODOS Material Los experimentos de oxidación se han realizado sobre polvo de UO2, compuesto por partículas con diverso grado de oxidación. Este polvo ha sido producido a partir de la pulverización de pastillas de UO2 proporcionadas por ENUSA. El área superficial de la muestra (10.0930 m2g-1) se ha obtenido mediante análisis BET con N2 (Micromeritics ASAP 2020) y ésta se ha utilizado sin ningún tratamiento previo a su caracterización. Técnicas de caracterización La espectroscopía Raman se ha llevado a cabo utilizando el espectrómetro Horiba LabRam HR Evolution (Tecnología Jobin Yvon). Como fuente de excitación, se ha empleado un láser rojo de HeNe con una longitud de onda de 632.81 nm y una potencia nominal de 20 mW. Dicho láser se ha enfocado a la 2 muestra por medio de un objetivo 100x del microscopio BX4, con 800 mm de confocal. La luz dispersada ha sido recolectada por el mismo objetivo, difractada posteriormente por un espectrómetro Jobin Yvon con una red de 600 líneas/mm y finalmente recogida por un detector CCD (256 x 1024 pix.) refrigerado mediante Peltiers. La resolución espectral ha sido de alrededor de 1 cm-1. Los diagramas de difracción de rayos X (XRD) se han obtenido mediante un difractómetro PANalytical modelo X’PERT MPD de PHILIPS, por radiación Kα del Cu con geometría convencional Bragg-Brentano. Su análisis se ha llevado a cabo por comparación con la base de datos Powder Diffraction File 2002 [9]. Las imágenes de microscopía electrónica de barrido (SEM) han sido obtenidas por un equipo HITACHI S2500 que opera a 25 kV. Al tratarse de muestras en polvo ha sido necesario incorporarlas en una resina Tempfix (TED PELLA INC.) y metalizarlas, a pesar de su carácter semiconductor, para evitar la contaminación del equipo. Metodología de los estudios de oxidación por calentamiento con láser La metodología empleada para la oxidación y caracterización del UO2 por espectroscopía Raman se puede resumir en los siguientes pasos: Dado que la muestra está compuesta por una mezcla de partículas de UO2 con distinto grado de oxidación, se analizan por espectroscopía Raman distintas partículas utilizando tiempos cortos de adquisición (10 s) y un 1% de la potencia del láser, hasta encontrar una partícula cuyo espectro posea las bandas características del UO2. Una vez seleccionada la partícula de interés, se procede a su oxidación. Al enfocar el láser a través del objetivo del microscopio confocal, se logra que el tamaño de spot sea de unos 200 µm. Por ello, al transmitir casi toda la energía del láser a una zona muy limitada de la muestra, se produce un calentamiento notable, el cual puede conducir a la oxidación de dicha zona si ésta se encuentra expuesta al aire. Con este fin, se hace incidir el láser sobre la partícula seleccionada, durante 5 segundos al 25% de potencia, tras lo cual, y mediante la obtención del espectro adquirido a tiempos largos (3 x 300s) y baja potencia (1%), se observa que la muestra ha sufrido una oxidación hasta el U3O7. Se prosigue con la siguiente etapa de oxidación, realizando los mismos pasos que en la etapa anterior, salvo que el tiempo de exposición al láser se amplía a 10 segundos y se comprueba que el espectro a tiempos largos de adquisición corresponda esta vez al del U3O8. 3. RESULTADOS Y DISCUSIÓN 3.1. Caracterización del polvo de óxido de uranio La caracterización previa del material de partida se ha realizado haciendo uso de las técnicas XRD y SEM. 3.1.1. Difracción de Rayos X La Figura 2 muestra el difractograma de rayos X correspondiente a la muestra de partida. Tras la evaluación de los resultados y comparando éstos con los patrones correspondientes a cada fase pura [9], se han identificado partículas tanto de UO2 ( 55%) como de U3O8 ( 45%). 3 Figura 2. Difractograma de rayos X de la muestra de partida (línea roja), donde se identifican UO2 (líneas naranjas) y U3O8 (líneas rosas) por comparación con [9]. 3.1.2. Microscopía electrónica de barrido En la Figura 3 se presenta el estudio morfológico de la muestra inicial. En primer lugar, puede apreciarse la diversidad en tamaño del polvo depositado sobre la resina (Fig. 3.a), lo que indica la poca homogeneidad de la muestra. Por otro lado, al analizar una zona concreta de la muestra (Fig. 3.b), con mayor amplificación, se distinguen dos fases con bastante claridad: UO2, en forma de granos relativamente ordenados y U3O8, ubicado generalmente en los límites de grano del UO2 y con un volumen notablemente mayor. a) b) U3O8 UO2 Figura 3. Imágenes SEM de la muestra de partida. (a) Polvo a analizar dispuesto sobre la resina. (b) Morfología de las distintas partículas encontradas (UO2 y U3O8). 4 3.2. Oxidación y caracterización mediante espectroscopía Raman: Laser Heating La Figura 4 se muestra a modo de ejemplo los espectros Raman de los óxidos obtenidos tanto antes como después del proceso de oxidación para el caso concreto de dos ensayos realizados con partículas de tamaño similar. 419 Ensayo 1 346 I (a.u.) b) 483 632 633 137 502 330 345 468 752 384 247 239 U3O8 166 635 135 a) 812 465 167 U3O7 481 241 I (a.u.) U3O8 Ensayo 2 417 810 248 811 384 505 331 U3O7 631 451 752 810 450 UO2 1151 1149 UO2 0 200 400 600 800 1000 1200 1400 0 200 400 600 800 1000 1200 1400 -1 -1 Raman shift (cm ) Raman shift (cm ) Figura 4. Espectros Raman de los distintos óxidos analizados antes (UO2) y después del proceso laser heating (U3O7 y U3O8), correspondientes al ensayo 1 (a) y 2 (b). Los números indican la frecuencia central de cada banda del espectro. Los espectros obtenidos se corresponden con los espectros característicos de UO2, U3O7 y U3O8, presentando las mismas bandas detectadas por otros autores [10-14]. Las frecuencias características observadas en estos espectros Raman (ver Fig. 4.a) se recogen y comparan de forma esquemática en la Tabla II, en la que se han añadido las asignaciones realizadas por [10] y [14]. El espectro inicial previo a la oxidación (línea azul en la Fig. 4.a) presenta las dos bandas características del UO2: La primera a 445 cm-1 corresponde al modo activo triplemente degenerado T2g (asociado con la tensión simétrica del U-O), y la segunda banda ancha observada alrededor de 1150 cm-1 se atribuye a una de las vibraciones de toda la red cristalina (fonón 2L-O) [10, 15]. El espectro obtenido tras la primera etapa de oxidación (línea roja en la Fig. 4.a) se corresponde con el espectro de U3O7 (ver Tabla II). En este espectro se puede observar cómo la intensidad de la banda T2g decrece de forma notable respecto a la del UO2 y el pico se ancha y se desplaza hacia frecuencias mayores. Esto comportamiento puede ser explicado por las desviaciones de la estructura fluorita perfecta debidas a la incorporación de oxígeno en la red. Del mismo modo, aparece una banda muy ancha en torno a 630 cm-1, la cual viene asociada a distorsiones en la red, mientras que la banda a 1150 cm-1 exhibe una caída notable en intensidad, hasta el punto de encontrarse prácticamente ausente [15]. Al concluir el proceso de oxidación, se ha obtenido un espectro (línea morada en la Fig. 4.a) con diversas bandas que no se corresponden con las detectadas en los dos espectros anteriores. Dicho espectro se identifica como el característico del U3O8 (ver Tabla II). La banda característica del enlace U-O (T2g) sigue estando presente, aunque muy desplazada ( 481 cm-1), y ya no se trata de la banda más intensa del espectro. La banda situada a 419 cm-1 pasa a ser la banda más intensa y la banda a 812 cm-1, aumenta en intensidad respecto a la misma banda en el espectro de U3O7. La banda correspondiente a distorsiones en la red ( 635 cm-1) apenas se distingue al haberse acomodado la red tras pasar de sistema tetragonal a ortorrómbico. 5 Tabla II. Asignación de bandas de los espectros Raman de los óxidos identificados en el ensayo 1 [10, 14]. No se ha encontrado asignación para todas ellas. La Figura 4.b muestra los espectros obtenidos en el ensayo 2, siguiendo la misma metodología que en el ensayo 1 (mismos tiempos de calentamiento y potencia del láser). Éstos son similares a los obtenidos en el ensayo anterior, con lo que queda demostrada la reproducibilidad del método en partículas de tamaño equivalente. 3.2.1. Temperatura inducida por el láser Figura 5. Variación con el tiempo de la temperatura inducida en la muestra, obtenida con una potencia del láser del 25%. Los puntos abiertos muestran los datos experimentales de cada óxido encontrado y la línea discontinua representa la tendencia de calentamiento. 6 Mediante la comparación de los óxidos obtenidos por calentamiento láser con los resultados de la oxidación de UO2 en aire de otros autores [16, 17], donde se pone de manifiesto que la obtención del U3O7 se alcanza en torno a los 250°C y que se requiere un mínimo de 300°C para obtener el U3O8, hemos construido la Figura 5. Esta comparación nos permite estimar la temperatura alcanzada por la muestra debido al calentamiento láser. 4. CONCLUSIONES En este trabajo se muestra la oxidación de partículas de UO2 mediante calentamiento láser. Este procedimiento se ha llevado a cabo utilizando el láser del equipo de espectroscopía Raman, lo que permite, además de realizar dicha oxidación, la caracterización in situ de la muestra. Además de la puesta a punto de esta técnica novedosa, se han aportado a la base de datos Raman nuevos espectros de calidad de UO2, U3O7 y U3O8. Para completar el estudio, y mediante la comparación de los resultados de oxidación del mismo material, hemos estimado la temperatura inducida por el láser en la muestra. Este estudio nos permitirá llevar a cabo, utilizando la misma metodología, la oxidación y caracterización mediante láser de espectroscopía Raman de pastillas de UO2 y SIMFUEL. 5. AGRADECIMIENTOS Esta investigación se encuentra enmarcada dentro del proyecto ACESCO, financiado por ENRESA, y todos los experimentos mencionados se han llevado a cabo en las instalaciones del Centro de Investigaciones Energéticas, Medioambientales y Tecnológicas (CIEMAT). Especial agradecimiento a todos los que en mayor o menor medida han colaborado en el desarrollo de este trabajo: Y. Álamo, J. Alcaide, L. Anta, A. Cazaña, J. M. Cobo, S. Durán, S. Fernández, H. Galán, J. M. Nieto, A. Núñez, S. Royuela y L. Serrano. 6. REFERENCIAS [1] [2] [3] [4] [5] [6] [7] http://www.enresa.es/actividades_y_proyectos/atc. ENRESA, "Evaluación del comportamiento y de la seguridad de un almacén geológico profundo de residuos radiactivos de alta actividad en arcilla. Criterios seguidos para la selección del inventario genérico de radionucleidos para ENRESA 2003," Enero 2003. Banniste.Mj, "STORAGE BEHAVIOUR OF URANIUM DIOXIDE POWDERS - REVIEW ARTICLE," Journal of Nuclear Materials, vol. 26, pp. 174-&, 1968. J. Nakamura, T. Otomo, and S. Kawasaki, "OXIDATION OF UO2 UNDER DRY STORAGE CONDITION," Journal of Nuclear Science and Technology, vol. 30, pp. 181-184, Feb 1993. R. J. McEachern and P. Taylor, "A review of the oxidation of uranium dioxide at temperatures below 400 degrees C," Journal of Nuclear Materials, vol. 254, pp. 87-121, 1998. B. D. Hanson, "The Burnup Dependence of Light Water Reactor Spent Fuel Oxidation," Pacific Northwest National Laboratory, U.S. Department of Energy1998. R. E. Einziger and J. A. Cook, "BEHAVIOR OF BREACHED LIGHT WATER-REACTOR SPENT FUEL-RODS IN AIR AND INERT ATMOSPHERES AT 229-DEGREES-C," Nuclear Technology, vol. 69, pp. 55-71, 1985. 7 [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] J. Cobos, D. Papaioannou, J. Spino, and M. Coquerelle, "Phase characterisation of simulated high burn-up UO2 fuel," Journal of Alloys and Compounds, vol. 271, pp. 610-615, 1998. "Powder Diffraction File ", ed. International Center for Diffraction Data (ICDD), 2002. H. M. He and D. Shoesmith, "Raman spectroscopic studies of defect structures and phase transition in hyper-stoichiometric UO2+x," Physical Chemistry Chemical Physics, vol. 12, pp. 8108-8117, 2010. F. Pointurier and O. Marie, "Identification of the chemical forms of uranium compounds in micrometer-size particles by means of micro-Raman spectrometry and scanning electron microscope," Spectrochimica Acta Part B-Atomic Spectroscopy, vol. 65, pp. 797-804, Sep-Oct 2010. E. A. Stefaniak, A. Alsecz, I. E. Sajó, A. Worobiec, Z. Máthé, S. Török, et al., "Recognition of uranium oxides in soil particulate matter by means of μ-Raman spectrometry," Journal of Nuclear Materials, vol. 381, pp. 278-283, 11/15/ 2008. G. C. Allen, I. S. Butler, and T. Nguyen Anh, "Characterisation of uranium oxides by micro-Raman spectroscopy," Journal of Nuclear Materials, vol. 144, pp. 17-19, 1// 1987. M. L. Palacios and S. H. Taylor, "Characterization of uranium oxides using in situ micro-Raman spectroscopy," Applied Spectroscopy, vol. 54, pp. 1372-1378, Sep 2000. D. Manara and B. Renker, "Raman spectra of stoichiometric and hyperstoichiometric uranium dioxide," Journal of Nuclear Materials, vol. 321, pp. 233-237, 2003. J. Belle, Uranium dioxide: properties and nuclear applications: United States Atomic Energy Commission, 1961. H. Ohashi, E. Noda, and T. Morozumi, "Oxidation of uranium-dioxide," Journal of Nuclear Science and Technology, vol. 11, pp. 445-451, 1974. 8



