Equilibrio químico con retroproyector
Anuncio

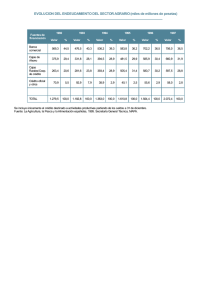
EL EQUILIBRIO QUÍMICO EN RETROPROYECCIÓN INTRODUCCIÓN Dos años antes de su muerte, Enrique de Le Chatelier fue nombrado en 1934, Doctor Honoris Causae por la Universidad de Madrid, cincuenta años después de que su famoso principio viera la luz. Su mayor éxito fue la publicación el 10 de noviembre de 1884, en Comptes Rendus con el título “Sur les lois de la disolution”, las leyes que regulan las modificaciones de los equilibrios químicos que completaban la “Ley del equilibrio móvil “ de Van’t Hoff, de ese mismo año y la ley de Robín publicada cinco años antes, y referida específicamente a la presión de sistemas en equilibrio1. Este principio postulaba que un sistema en equilibrio sometido a una acción capaz de deformarlo, experimentaba modificaciones que tendían a producir una reacción semejante pero de signo contrario a la acción a la que había sido sometido, y recíprocamente2. Tres años después de este hecho leyó su tesis doctoral; durante sus cuarenta años de enseñanza de la Química, en la Escuela de Minas y en la Sorbonne parisina, dirigiría unas treinta . Vamos a tratar de estudiar a través de reacciones químicas retroproyectables, los factores externos que modifican un equilibrio, y cómo la reacción reversible actúa en el sentido de contrarrestarlos. Lo haremos en disolución y en fase gaseosa. En el retroproyector se deberá tratar con reaccionantes que produzcan un color diferente que los productos, para así darnos cuenta del sentido en el que se desplaza. Las concentraciones deberán ser pequeñas, procurando no producir precipitados que con su opacidad, anulan la posibilidad de analizar los colores, y dejando siempre un testigo de color para comparar. MATERIAL El material y reactivos empleados para todas las demostraciones que se presentan, a parte de las cajas petri y un juego de jeringuillas, son únicamente: sulfato cúprico, cloruro sódico, sulfato sódico, cromato y dicromato potásico, los ácidos sulfúrico, clorhídrico y nítrico en diferentes concentraciones, al igual que los hidróxidos amónico y sódico, además de una moneda “rubia” de peseta. EL DESPLAZAMIENTO DEL EQUILIBRIO EN DISOLUCIÓN: EL CASO DEL SULFATO CÚPRICO. El desplazamiento de un equilibrio a través de la modificación de la concentración de los reaccionantes, es muy fácil de conseguir a través del intercambio de ligandos en compuestos complejos, pues como veremos, éstos al alterar la energía de desdoblamiento, producen una modificación en el color a través de tránsitos dd. El sulfato de cobre, ese compuesto cristalizado de color azul que originará, junto con otros sulfatos metálicos cristalinos el primitivo nombre del sulfúrico (óleo de vitriolo), forma disoluciones del mismo color. Si se sitúa una disolución de sulfato cúprico 0,2M ( se puede hacer disolviendo 50g de CuSO4.5H2O por litro de agua), en cuatro cajas petri cubriendo apenas sus fondos, al echar en tres de ellas, unos cristalitos de cloruro sódico, el color pasa de azul a verde. Al agregar en dos de las tres unos cristalitos de sulfato sódico, el color pasa de verde a azul. Añadiendo gotas de HCl concentrado en una, otra vez vuelve el color verde. La reacción primera sería: CuSO4 (aq) + 4NaCl (aq) = Na2[CuCl4](aq) + Na2SO4 (aq) Azul Verde La justificación de los procesos anteriores, se haría por aplicación del “Principio de Le Chatelier”. Al agregar NaCl, aumenta la concentración de esta especie y para contrarrestar dicha acción externa, el equilibrio se desplaza a la derecha, mientras que si se añade sulfato sódico lo hará hacia la izquierda. Al añadir HCl, el equilibrio se desplazará hacia la derecha, por introducir iones Cl-. La apariencia que tomarían las cajas petri en los diferentes desplazamientos, sería la que se indica a la derecha: 1 2 En ese mismo sentido, e independientemente, F.Braun, publicó en la revista alemana Z.Physik.Chem en 1887, unas leyes similares. El texto dice:”Tout système en équilibre soumis à une action capable de le déformer ne peut éprouver que des modifications qui tenden à produire une réaction de nature semblable, mais de signe contraire à l’action qu’il subit, et réciproquement”. Si ahora se añaden unas gotas de hidróxido amónico concentrado al sistema, se forma un complejo amoniacal, intercambiándose los ligandos cloro (Cl-) por amoniaco (NH3), y volviendo el color azul, aunque algo más oscuro que el original del sulfato cúprico. Este equilibrio se podría desplazar nuevamente hacia la izquierda echando HCl concentrado, recuperándose el color verdoso. Los procesos serían : CuCl4 -2 + 4H2O Verde CuCl4 -2 + 4NH3 Cu(H2O)4 2+ + 4ClAzul = Cu(NH3)4 2+ + 4ClAzul oscuro = Como el hidróxido amónico presenta menor densidad, la capa azul oscura, puede situarse encima de la capa verde, en una retroproyección vertical. Es conveniente tener tres cajas petri como testigos, aparte de la de reacción; una para fijar el color azul inicial, otra el color verdoso del complejo clorado, y por fin otra azul más oscuro del complejo amoniacal. La apariencia en las cajas petri sería la dada a la derecha: Vamos a explicar los cambios de color en función de la energías de desdoblamiento, que podemos evaluar para el ión central y los respectivos ligandos, siguiendo los parámetros de Jørgensen, y teniendo en cuenta que el color que se observará será el complementario del absorbido según la energía de desdoblamiento, tal como indica el siguiente cuadro: . Los parámetros de Jørgensen (g y f) aplicados el ion cúprico (g), con los ligandos que intervienen (f) y su intercambio, indicarán una energía de desdoblamiento orbital dada por el producto de ambos parámetros (fg). Así, según lo mencionado y los valores de dichos parámetros incluidos en la tabla, tendremos: Central( Cu2+):g. (cm-1) ligando: parámetro f energía desdoblamiento (cm-1) fg color que se ve 15700 H2O = 1 15700 AZUL Br- = 0,72 11304 VERDE Cl- = 0,78 12246 VERDE NH3 = 1,1 17270 AZUL OSCURO Este mismo proceso sirve para demostrar el desplazamiento del equilibro a través del calentamiento o enfriamiento. Así, si se prepara una disolución disolviendo 5g de NaCl en 100ml de CuSO4 0,1M, tendremos un sistema que en caliente es verde mientras que en frío es azul, al intercambiarse los ligandos por acción del calor. Para ello se introducen las cajas, sobre otras mayores que tendrán el respectivo baño, sobre el que flotarán. CuCl4 -2 + 4H3N = Verde»Calentando CuCl4 -2 + 6H2O = Verde»Calentando Cu(H2O)6 2+ + 4ClEnfriandoºAzul Cu(H3N)4 2+ + 4ClEnfriandoºAzul También este hecho se puede reforzar agregando unas gotas de hidróxido amónico concentrado a la disolución, por desplazamiento de los complejos amoniacales. El proceso presenta múltiples variaciones a gusto del profesor que lo explica en la clase. De esta forma si a una disolución diluida de sulfato cúprico se le echan gotas de hidróxido amónico concentrado, se formará un pequeño precipitado azul del complejo amoniacal, que se puede desplazar por calefacción o por efecto del ión común. Igualmente se podría visualizar el desplazamiento del equilibrio a partir de la opacidad del complejo amoniacal, haciendo resurgir otra vez la coloración azul por disolución del precipitado, añadiendo más hidróxido amónico (realmente si la concentración es pequeña no aparecerá el precipitado, y sí, la coloración azul un poco más oscura). Las cajas petri tomarían en el retro la apariencia esquematizada en el dibujo de la derecha en las que se incluyen las especies químicas existentes, responsables de los cambios de color. UN DESPLAZAMIENTO FÁCIL Y RÁPIDO: EL EQUILIBRIO CROMATO/DICROMATO. Es muy conocido y empleado el desplazamiento del equilibrio ácido base cromato/dicromato, porque resulta muy rápido, lo cual siempre se valora en una clase experimental, para que los alumnos no se impacienten, presentando colores intensos que captan enseguida su atención. Para hacerlo, se preparan 4 cajas petri, en dos de ellas se dispone una disolución de cromato (amarillo), indicándolo así a través de una transparencia que se intercala entre el cristal protector y la caja petri respectiva y en otras dos , dicromato (anaranjado), una de cada servirá como testigo de color. Sobre la otra se añaden respectivamente, gotas de hidróxido sódico 6N en una y gotas de H2SO4 6N en la otra, observándose el cambio de color. Al agregar protones sobre el cromato amarillo, el equilibrio se desplaza hacia la izquierda formándose el dicromato naranja. De la misma forma, al añadir OH, sobre el dicromato naranja, el desplazamiento del equilibrio hacia la derecha producirá el cromato amarillo. Por este motivo se intercambian los contenidos de las dos cajas petri, como se puede apreciar al comparar el color con las muestras. Cr2O7 2- + H2O = 2CrO42- + 2H+ naranja amarillo El origen de la diferencia de colores está en la estructura de los propios iones cromato tetraédrico, y dicromato, con dos tetraedros unidos por un puente de oxígeno con una distancia mayor de lo normal (1,78D) frente los 1,60D, de cada unidad tetraédrica, esta mayor distancia, hace que la separación de las bandas de valencia y conducción en el caso del sólido dicromato sea ligeramente menor que el cromato; 2eV frente a 2,4eV. En disolución no se forman complejos acuosos, porque lo que se conserva la estructura iónica discreta de los iones cromato y dicromato, por todo ello, en el dicromato se intensifica la absorción en los 370nm o 27000cm-1(violeta) que aparecía en el cromato y que provocaba el color amarillo, surgiendo un nuevo pico de absorción sobre los 450nm o 20800cm-1 (azul)(Véase la tabla de energías de desdoblamiento y colores), lo que hace que sea anaranjado y de color más intenso, mientras que el cromato es de un amarillo más pálido. EL DESPLAZAMIENTO DEL EQUILIBRIO EN FASE GASEOSA El equilibrio en fase gaseosa más fácilmente proyectable es el NO2/N2O4. Para llevarlo a cabo, se prepara un montaje adicional con un embudo de decantación con algo de ácido nítrico concentrado y una moneda de peseta de las retiradas recientemente con bastante contenido en cobre, en el fondo de un tubo conectado al embudo y que disponga de una salida lateral, o cualquier montaje similar. Se gotea el ácido nítrico (unas gotas) sobre la moneda, produciéndose un gas marrón oscuro que va desplazando al aire. Cuando comienza a salir por la boca del tubo de desprendimiento, se conecta sucesivamente a varias jeringuillas, absorbiendo con el émbolo y cerrándolas con una goma y una pinza de Mohr. De esta manera se dispone de varias jeringuillas cargadas con un gas marrón que en retroproyección vertical se pueden disponer en un baño de hielo o de agua caliente, observándose el cambio de color. Según la reacción: 2NO2 (gas) = marrón oscuro N2O4 (gas) incoloro, marrón pálido dH= - 58 kJ/mol. Al calentar, dado que la reacción es exotérmica, el equilibrio se desplaza hacia la izquierda, oscureciéndose la jeringuilla, mientras que con el baño de hielo lo hace hacia la derecha quedándose incoloro. La jeringuilla presenta un problema en la retroproyección y es que al ser cilíndrica puede actuar como una lente, distorsionando la visión. En proyección horizontal, la visión es mejor pero el montaje es más difícil porque se debe disponer del recipiente que pueda contener el baño adecuado (una caja petri mayor, o un cristalizador pequeño), sobre el que se montan las cajas petri menores. Se puede conseguir con dos cajas petri acopladas, de forma que una sea la tapa de la otra, introduciendo el gas con una gomita, tapando rápidamente e introduciendo en el baño preparado y presionándolas con un pequeño cristal para impedir que el gas escape. De esta forma se puede mantener el gas durante media hora como máximo, lo cual es suficiente. Se debe disponer así de tres juegos de dobles cajas petri, uno de testigo y dos para enfriar o calentar con un baño de hielo o de agua caliente (se pueden llevar al aula donde se realiza la clase retroproyectable en dos termos). Es evidente que este mismo equilibrio sirve teóricamente para justificar su desplazamiento al modificar la presión, pero no es tan fácil como parece, en el retroproyector. Aunque un aumento de la presión desplazaría el equilibrio hacia la derecha, y en teoría debería producirse un debilitamiento del color marrón, el efecto en el retroproyector es inicialmente el contrario, porque el nivel de absorción es mayor al aumentar la concentración según la ley de Beer, y aparece más oscuro. Sólo se puede apreciar ligeramente, si se actúa rápidamente sobre la jeringuilla comprimiendo el émbolo lo que se pueda, una vez que se asegura que está herméticamente cerrada, y esperando a que se reestablezca el equilibrio. Se deben tener en este caso, dos muestras de gas, tomadas en jeringuillas pequeñas al principio de su producción para comparar los colores, una como testigo, sin comprimir, y la otra, sobre la que actuaremos empujando el émbolo. Primero oscurece más debido a la ley de Beer, pero después se aclara algo como debería ser, al desplazarse el equilibrio hacia la derecha. El aspecto de la retroproyección del contenido de las jeringuillas es el dado en los dibujos.