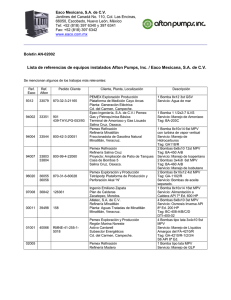
GEM09MAS65 National, Multicenter, Phase II, randomized trial in
Anuncio

GEM09MAS65 National, Multicenter, Phase II, randomized trial in newly diagnosed multiple myeloma patients older than 65 years Schedule of therapy Symptomatic newly diagnosed MM pt > 65 y First randomization (1:1) VelcadeMelphalan-Prednisone VelcadeMelphalan-Prednisone X9 followed by Lenalidomide-dexamethasone X9 X9 alternating with Lenalidomide-dexamethasone X 9* * Pts will be randomized to start by VMP or Rd N: 240 pts Arm A: VMP followed by Rd • One-6 weeks cycle 1 2 3 4 █ █ 8 █ 11 █ █ ████ 1 1 2 3 4 8 15 █ █ █ 32 █ 33–42 █ Day 22 23–28 █ ████ ████ Dexamethasone, 40 mg 8 15 1 74 weeks 29 Rest period • Nine-4 weeks cycles █ ████ • Eight-4 weeks cycles Bortezomib 1,3 mg/m2 Melphalan 9 *mg/m2 Prednisone 60 mg/m2 25 Rest period Bortezomib 1,3 mg/m2 Melphalan 9* mg/m2 Prednisone 60 mg/m2 Días 22 22 21 Lenalidomide 25 mg days 1-21 28 *>75a: 6mg/m2 Arm B: VMP alternating with Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd Grupo B de tratamiento alternante: MPV alternando con Rd Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Rd MPV Grupo B de tratamiento alternante: Rd alternando con MPV 74 weeks Primary efficacy objectives • Supervivencia libre de progresion (PFS) de MPV y Rd administrados en un esquema secuencial vs. alternante • Seguridad y tolerancia de los dos esquemas de inducción propuestos • Analizar la eficacia en términos de respuestas, TTP, SG, TNT. • Identificar las características biológicas (incluyendo un análisis genómico) de aquéllos pacientes que fueran resistentes a uno u otro esquema o a ambos esquemas propuestos. • Evaluar la sensibilidad a los tratamientos de rescate Planned enrollment: 240 EVALUACIONES DE EFICACIA • Muestra de suero y Orina de 24 h En la visita de selección, el D1 de cada ciclo de inducción • Serum FLC En la visita de selección en los MM oligo/no secretores y en el D1 de cada ciclo Para todos los pacientes, en el momento de la RC • Serie ósea y radiología En la visita de selección y, luego, a criterio del PI si la clínica lo requiere • Aspirado de MO (lab central) y suero En la visita de selección (CMF, FISH y BM), tras el 9 y 18 ciclos, así como en el momento en que se constate la RC (CMF y BM) Respuesta segú según los criterios del IMW actualizados Puntos importantes del estudio • Bisfosfonatos Estudio paralelo de JM Hernández: iniciar si es posible a partir del mes 3 • Profilaxis antibiótica Levofloxacino a dosis de 500 mg/día durante los primeros 4 meses de tto • Profilaxis antiviral Aciclovir, 400 mg/12 horas o Valaciclovir/Famciclovir, 500 mg/8h durante la admon de Velcade • Profilaxis antitrombótica AAS o heparina de bajo peso molecular, en función de los factores de riesgo • G-CSF Para garantizar el cumplimiento del protocolo, sobre todo VMP, ciclos 2 a 9 (de 4 semanas) Recruitment • • • • 240 pts 63 centers 19 months of recruitment 12 pts per month • 240 pts • 63 centers • 4 patients per center Survival according to minimal residual disease (MRD) by immunophenotyping in bone marrow in elderly patients (n=153)* TTP OS MRD negative (n=34) 100 100 Median: NR MRD negative (n=34, 22%) 80 80 MRD positive (n= 119) 60 60 40 MRD positive (n= 119) Median: NR 40 Median: 31m 20 20 P = .07 P < .001 0 0 0 10 20 30 40 50 Months *Results after induction therapy of phase 3 trial VMP + maintenance vs VTP + maintenance in elderly patients 0 10 20 30 40 50 Months Mateos et al. ASH 2009 (abstract 3) MRD by Flow Cytometry (% of tumor cells) MRD: FCM vs. PCR R=0.853 P < .00001 1,00 0,1 0,01 0 0 -0,01 0,1 1,0 MRD by ASO-RT-PCR (% of tumor cells) 5,0 MRD IN MYELOMA: PFS ASO-RQ-PCR Qualitative-NESTED-PCR N=32 N=32 P=0.032 P=0.011 MRD studies in GEM2010 (GEM09MAS65) • • • • • Immunofixation (CR) FLC (sCR) Immunophenotype (iCR) PCR (mCR) Image (iconografic CR): – CT-PET – MRI ¿TOTAL CR? Other studies: Proposals • Gene expression microfluidic card validation Low density arrays in MM: RT-PCR, 93+3 genes • • • • • • • Genes “de Mieloma” (traslocaciones, deleciones, sobreexpresiones asociadas): CCND1, CCND2, CCND3, FGFR3, RB1, TP53, WHSC1, MAF, MAFB, CDKN2A, GAPDH, CDKN2B, CDKN2C, CDKN1A, CDKN2D, CDKN1B, ZHX2, SFRP2, DKK1, IL6, IGF1, EGFR, IGF1R, Genes de proliferación: TYMS, TK1, CCNB1, MKI67, CKS1B, TOP2A, UBE2C, ZWINT, TRIP13, KIF11, MAPK1, JUN, FOS, MAPK14, NRAS, KRAS, MAPK3, AKT1 Genes de pronóstico (Grupo de Arkansas): AHCYL1, AIM2, ASPM, KIF14, SLC19A1, BMI1, JAG2, BIK, DLC1, BCL2, BAX, ABL1, WT1, KIT, MYC, VEGFA, MAGEC1, CTAG1B, CTAG1A, CTBS, LARS2, LTBP1, CLCC1, MPHOSPH1, NADK, TBRG4, TMPO, YWHAZ Genes de Pronóstico (Grupo Francés): AFG3L2, ALDH2, ATF4, CNDP2, CPSF6, CTSF, FAM49A, FLJ21438, FRY, SKP2 Genes de la vía de las caspasas (Apoptosis): CASP2, CASP3, CASP7, CASP8, Genes relacionados con NFKB: TNFRSF11A, NFKB1, NFKB2, Otros, asociados a patogenia del mieloma: XIAP, AHSA1, DDIT3, PIK3CA, HDAC6, RELA, PSMB5, HSP90AA1, HSPB2, EIF2AK3 y TSPO. SCORE = ( CASP2 + FRY + MAPK1 + TNFRSF11A) - ( CLCC1_50 + HSP90AA1) . RISK FACTORS -2 -1 PROTECTIVE FACTORS 0 1 2 Intermediate Risk Low Risk EVENT FREE SURVIVAL 1,0 44±2.5 Low Risk n= 49 PERCENTAGE ALIVE 0,8 29±2.1 0,6 43.24±2.6 Low Risk n= 49 0,8 28.4±2.1 0,6 Intermediate Risk n= 39 0,4 Intermediate Risk n= 39 0,4 15.6±2.3 0,2 16.2±2.2 High Risk n= 27 p=2,5e-011 0,0 0 12 24 4 High Risk TIME TO PROGRESSION 1,0 3 36 48 0,2 High Risk n= 27 p=1,01 e-9 0,0 0 MONTHS FROM DIAGNOSIS 12 24 36 48 Other studies: Proposals • Gene expression microfluidic card validation • Total Cytogenetics: – CGH arrays – SNP arrays (Copy Number Variation) – Ultrasequencing • Methylation arrays studies • Epidemiology risk studies: – To suffer myeloma – To suffer certain complications – Pharmacogenomics: probability of response • Subgroup specific studies Samples: BM (tumor cells) • At diagnosis – Flow cytometry: • Plasma cell count, normal/abnormal ratio, pattern for MRD • DNA aneuploidy and S-phase calculation – CD138+ selection J Purified Plasma cells • Cyrtogenetics: FISH (-13q, t(14q32;-), p53, 1q, 1p. • DNA extraction, IgH rearrangement identification • Cryopreservation: mRNA/DNA (expression, Copy number variation, sequencing, methylation) – CD138 ̶ selection J Residual normal cells • Cryopreservation Samples: BM (tumor cells) • After 9 cycles: – Flow cytometry: • MRD evaluation – Molecular biology: • MRD: IgH rearrangement • After 18 cycles: – FCM & Molecular biology • At CR attainment (if different to above) – FCM & Molecular biology Samples: PB (normal cells) • At diagnosis: – 5 ml in EDTA – Cryopreservation for mRNA/DNA estudies • mRNA: control for expression estudies • DNA: – Epidemiological studies for risk assessments – Controls for Copy number variation analysis and LOH • At follow-up: – If we failed at diagnosis MRD evaluation of the Spanish multi-center protocol GEM-2000: PROBLEMS Patient achieving CR, Dx sample and CR sample 49 DNA quality: 4 cases not enough 45 Detectable clonal rearrangement: no in 4 41 VDJH: 38 DJH: 20 Both: 17 Complete VDJH/DJH sequence identified: 35 6 cases: low BMPC infiltration, faint band. ASO-primer designed with enough quality 32 Three cases did not allow a good design (short N region) No DNA to allow dilution for standard curve: 8 cases. 24 HU Salamanca Madrid 12 Octubre Valencia La Fe HU Salamanca Madrid 12 Octubre Valencia La Fe Salamanca: n=28 • • • • • • • • • Aragón (2) Canarias (2) Cantabria (1) Castilla-León (4) Cataluña (10) Extremadura (1) Galicia (1) Navarra (3) País Vasco (3) Ramón García-Sanz (N. Gutiérrez, MB Vidriales) Laboratorio de Hematología, Biología molecular Hospital Universitario de Salamanca Paseo de San Vicente 58-182 Salamanca 37007 Tel: 923 291629 (923 291375, 923 291384) Fax: 923 9294624 Email: rgarcias@usal.es 12 Octubre de Madrid (n=21) • Castilla-la Mancha (5) • Madrid (16) Dr. Joaquín Martínez López Servicio de Hematología (Edificio General, S1, Laboratorio de Biología Molecular). Hospital Universitario 12 de Octubre. Avda de Córdoba s/n. 28041-Madrid. Teléfono 913908495. Correo: jmartinezlo@hematologia12octubre.com La Fe de Valencia (n=15) • • • • Andalucía (5) Baleares (2) Murcia (2) Valencia (6) Dra. Lourdes Cordón. Laboratorio de Citometría de Flujo. Edificio de Consultas Externas, 2º sótano. Servicio de Hematología y Hemoterapia. Hospital Universitario La Fe Avda Campanar 21 46009 Valencia Teléfono: +34 96 386 27 00 ext: 50290 Correo-e: lou.cordon@gmail.com Muestras • Solicitar contenedores de muestras (con tiempo): Rocío Aguirre, teléfono 629853789 • Ideal: 3 tubos con 5 ml. de médula ósea cada uno: – 1 EDTA: citometría de flujo – 1 hepatina sódica: Citogenética (FISH) – 1EDTA: Biología molecular • Si se extraen más tubos: – Mejor: criopreservación • 1 tubo con 5 ml de SP en EDTA Transporte • Solicitar el trasporte antes de las 10:30 para entregar al día siguiente a primera hora (¡¡¡Viernes excluidos!!!) • El teléfono de MRW es el 915 341 924: • Decir que es el transporte es a cargo de PETHEMA, • Código de protocolo: GEM10mas65 • Indicar que es para Salamanca, Madrid o Valencia (ellos ya tendrán la dirección de los laboratorios) Resumen de muestras Diagnóstico Médula SP Orina Post-9 ciclos Post-18 ciclos Al alcanzar RC Heparina | EDTA | (x2) | | | Suero | | | | EDTA | + + + +