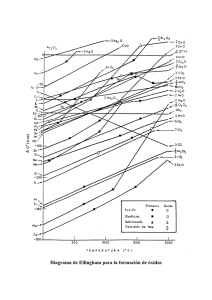
Reacciones químicas
Anuncio

Física y Química C. La Presentación. 1º Bachillerato Curso 2013/14 Reacciones químicas Tipos de Reacciones Combinación o síntesis (x+y N2 + 3 H 2 Dos no metales dan un compuesto covalente Fe + S 2 NH3 FeS x y ) Varias sustancias reaccionan para dar otra más compleja. Un metal y un no metal dan una sal CaO + H2O Ca(OH)2 Un óxido metálico y agua dan un hidróxido SO2 + H2O H2SO3 Un óxido no metálico y agua dan un oxoácido CaO + SO2 CaSO3 Un óxido metálico y uno no metálico dan una sal S + O2 SO2 * Oxidación: Un elemento y oxígeno dan un óxido Descomposición o análisis ( x y MgCO3 MgO + CO2 x + y ) Una sustancia forma varias simples. Carbonatos dan óxidos metálicos y dióxido de carbono al calentarse Ca(OH)2 CaO + H2O Hidróxidos dan óxidos metálicos y agua al calentarse 2 KClO3 2 KCl + 3 O2 Cloratos dan cloruro y oxígeno al calentarse H2SO3 SO2 + H2O Oxoácidos dan óxidos no metálicos y agua al calentarse 2 HgO 2 Hg + O2 Óxidos metálicos dan metal y oxígeno al calentarse 2 H2O 2 H2 + O2 * Electrólisis: Descomposición al paso de una corriente eléctrica Desplazamiento o sustitución ( x y + z x z + y ) Un elemento sustituye a otro en un compuesto. CuSO4 + Zn ZnSO4 + Cu Un metal desplaza a otro (menos activo) de una sus sales 2 H2O + 2 K 2 KOH + H2 Metales (activos, gr. 1 y 2) desplazan al hidrógeno del agua y dan hidróxido H2SO4 + Zn ZnSO4 + H2 Metales (activos) desplazan al hidrógeno de ácidos y dan sal 2 KBr + Cl2 2 KCl + Br2 Halógenos desplazan a otros (menos activos) de sus compuestos CH4 + 2 O2 CO2 + 2 H2O * Combustión: Compuestos orgánicos y oxígeno dan dióxido de carbono y agua Intercambio o doble descomposición ( x y + z t 2 NaCl + H2SO4 FeCl3 + 3 NaOH 2 HCl + Na2SO4 3 NaCl + Fe(OH)3 x t + z y ) Normalmente en disoluciones de iones. Obtención de ácidos (más débiles) Obtención de hidróxidos (insolubles) AgNO3 + NaCl AgCl + NaNO3 Obtención de sales (que precipitan) Na2CO3 + 2 HCl 2 NaCl + CO2 + H2O Carbonato y ácido dan sal, dióxido de carbono y agua HCl + NaOH NaCl + H2O * Se deben estudiar más profundamente. * Neutralización: Ácido y base dan sal y agua