Extrapolacion de Tafel
Anuncio

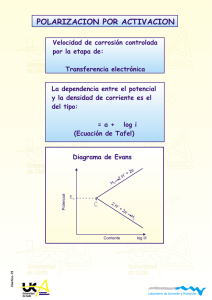
TÉCNICAS ELECTROQUÍMICAS DE CORRIENTE DIRECTA PARA LA DETERMINACIÓN DE LA VELOCIDAD DE CORROSION TÉCNICA DE EXTRAPOLACIÓN DE TAFEL O DE INTERSECCIÓN J. Genescá. Dpto. Ingeniería Metalúrgica. Facultad Química. UNAM. Ciudad Universitaria. 04510 México D.F. genesca@servidor.unam.mx COEFICIENTES DE TAFEL Si la concentración de los reactivos y de los productos es uniforme en el electrolito, la ecuación de Butler-Volmer toma la forma η j = j 0 exp a βa η − j 0 exp c βc Donde β a y β c, son los coeficientes de Tafel anódico y catódico respectivamente: βa = RT αnF βc = RT (1 − α ) nF Esta ecuación se aplica a las reacciones electródicas en las cuales la velocidad está controlada por el proceso de transferencia de carga en la interfase electrodo/electrolito. Esta situación se conoce a menudo como control por activación o control activacional y el sobrepotencial correspondiente como sobrepotencial de activación, ηA. El valor de los coeficientes de Tafel , β a y β c, depende del mecanismo de las reacciones que tiene lugar en los electrodos, los cuales comprenden muy a menudo varias etapas. Sin embargo, no es necesario conocer este mecanismo para poder utilizar la ecuación de Butler-Volmer, ya que ésta describe la cinética del proceso de transferencia de cargas de una manera global, independientemente del mecanismo, a partir de tres magnitudes fácilmente medibles: j0 , β a y β c. Las siguientes fórmulas definen los coeficientes de Tafel anódico y catódico. βa = dE d ln j a βc = − dE d ln j c RECTAS DE TAFEL Para determinar experimentalmente los parámetros cinéticos j0 , βa y β c , es recomendable una representación gráfica en la que la densidad de corriente esté en una escala logarítmica, ya que así se pone en evidencia la relación lineal existente entre el logj y el sobrepotencial, η, especialmente cuando este último, en valor absoluto, tiene un valor grande. Se denomina región ó dominio de Tafel anódico (zona Tafeliana), aquella región en la cual el potencial que corresponde a η/β a >> 1. La ecuación se convierte en η j = j a = j 0 exp a βa Tomando logaritmos se obtiene: η = − β a ln j 0 + β a ln j Pasando a logaritmos de base diez y definiendo las constantes de Tafel anódicas, aa y ba se obtiene la ecuación de Tafel de una reacción anódica, también llamada recta de Tafel anódica: η = a a + ba log j a a = −2.303β a ln j 0 ba = 2.303β a De manera análoga, para el dominio catódico de Tafel, η/βc <<1: η j = jc = − j 0 exp − c βc η = β c ln j 0 − β c ln j Lo cual permite expresar las constantes de Tafel catódicas, ac y bc de la ecuación de Tafel de una reacción catódica: η = a c − bc log i a c = 2.303β c ln j 0 bc = 2.303 β c Las ecuaciones de Tafel describen los límites anódico y catódico de la ecuación de Butler-Volmer. Su descubrimiento a principios del siglo veinte, en el año de 1904, por Tafel al estudiar el comportamiento del sobrepotencial para la reacción de desprendimiento de H2 en función de la densidad de corriente, precedió durante muchos años a la ecuación de Butler-Volmer. Cuando se obtiene una curva de polarización experimental, la extrapolación de la recta que aparece en el dominio Tafeliano al valor del potencial de equilibrio, permite determinar la densidad de corriente de intercambio, j0 , Figura 1. El inverso del valor de la pendiente de estas rectas proporciona el valor de los coeficientes de Tafel, β a y β c. ECUACION DE BUTLER-VOLMER DE UN ELECTRODO MIXTO La ecuación de Butler-Volmer se puede aplicar a un electrodo mixto, por ejemplo, al caso concreto de la corrosión del acero en HCl, en ausencia de gradientes de concentración. Tienen lugar simultáneamente dos reacciones: Fe → Fe2+ + 2e reacción anódica 2H+ + 2 e → H2 reacción catódica Si se toma al acero como electrodo de trabajo en una celda electroquímica y se aplica un determinado potencial, resulta en una densidad de corriente medible, cuyo valor corresponde a la suma de las densidades de corriente parciales j = jFe + jH = ja,Fe + jc,Fe + ja,H +jc,H Figura 1. Esquema de una reacción anódica en un diagrama de Tafel. E0 a : potencial de equilibrio, j0 a: densidad corriente intercambio, b: pendiente de Tafel = 2.303β Los subíndices Fe e H se refieren a las reacciones parciales. Cerca del potencial de corrosión, Ecorr, la contribución de jc,H y ja,H se puede considerar despreciable. (jc,H ≅ ja,H ≅ 0) lo que permite simplificar la ecuación: j = jFe + jH = ja,Fe +jc,H En el potencial de corrosión (E = Ecorr), la densidad de corriente j es cero. j = ja,Fe(Ecorr) +jc,H(Ecorr) = 0 Se ha supuesto por una parte que la transferencia de carga en la interfase metal/solución constituye la etapa limitante y por otra, que las cinéticas de las dos reacciones parciales son independientes. La densidad de corriente parcial de cada reacción obedece entonces a la ecuación de Butler-Volmer. η j Fe = j a , Fe + j c , Fe = j 0 , Fe exp Fe β a , Fe η j H = j a , H + j c , H = j 0 , H exp H β a, H − j 0 , Fe exp − η Fe β c , Fe − j 0 , H exp − η H β c ,H Las mediciones de polarización llevaron al desarrollo, en 1930, de la teoría del potencial mixto, con el objeto de poder explicar los resultados experimentales obtenidos. La Figura 2a muestra una representación esquemática de una reacción anódica y catódica, típicas de un proceso de corrosión, así como, Figura 2b, la correspondiente curva de polarización experimental que se puede derivar de las mismas. METODOS ELECTROQUIMICOS DE ESTIMACION DE LA VELOCIDAD DE CORROSION Cuando toman parte en la reacción especies cargadas, como es el caso de los procesos de corrosión, la barrera de energía que debe vencerse en la transferencia de carga es afectada por el campo eléctrico y puede demostrarse, a partir de la teoría de la cinética electroquímica que las densidades de corriente de los procesos parciales Me ⇔ Men+ + neO2 + 2 H2O + 4 e- ⇔ 4 OHSe ajustan a las expresiones αnFη j a = j corr exp RT − (1 − α )nFη j c = − j corr exp RT Donde T representa la temperatura absoluta, R la constante de los gases perfectos, F la constante de Faraday, n el número de electrones intercambiados en el proceso redox, α y (1-α) los coeficientes de transferencia de carga, relacionados con la caída de potencial a través de la doble capa que rodea el electrodo (normalmente el valor de ambos es próximo a 1/2), η la polarización (sobrepotencial) aplicada y jcorr la densidad de corriente de corriente de corrosión buscada, que puede transformarse en pérdida de peso o de espesor a partir de la segunda ley de Faraday. El equilibrio eléctrico existente en el potencial de corrosión libre, expresado como: It = Ia + Ic = 0 Ia = Ic = Icorr impide la determinación directa de jcorr. Cuando se rompe dicho equilibrio, imponiendo una polarización al electrodo, se aprecia experimentalmente una corriente externa, resultante de la suma algebraica de las correspondientes a los procesos parciales: αnFη a − (1 − α ) nFη c j t = j a + j c = j corr exp − exp RT RT Partiendo de esta ecuación, conocida como de Wagner y Traud (1), se consigue, a través de dos casos límite, la aproximación de alto campo o alto sobrepotencial (extrapolación de Tafel o intersección) y la de bajo campo o bajo sobrepotencial (método de resistencia de polarización), una estimación de jcorr, es decir, de la velocidad de corrosión. METODO DE EXTRAPOLACIÓN DE TAFEL O DE INTERSECCION Para polarizaciones suficientemente grandes: η ≥ RT α nF o bien −η ≥ RT (1 − α ) nF la ecuación general de Wagner y Traud se reduce a las ecuaciones de las semireacciones anódica y catódica que se corresponden con las rectas de Tafel respectivas, con pendientes ba = 2.3 RT αnF o bien bc = − 2.3 RT (1 − α ) nF Para comprobarlo basta tomar logaritmos en cualquiera de las citadas ecuaciones, por ejemplo en la reacción anódica log j a = log j corr + de donde: αnF η 2.3RT η= − 2.3RT 2.3 RT log j corr + log j a = a + ba log j a αnF αnF Entonces, para un sistema metal/electrolito dado, jcorr tiene un valor determinado y el primer término del segundo miembro puede englobarse en la constante a de la ley de Tafel. En las proximidades de Ecorr, para polarizaciones pequeñas, los procesos anódicos y catódicos se influyen mutuamente y las curvas de polarización experimentales se apartan del curso semilogarítmico previsto por la ley de Tafel. Sin embargo, para η=0 (es decir, cuando E = Ecorr), de cualquiera de las ecuaciones resulta: ja = |jc| = jcorr lo cual permite determinar la jcorr buscada sin mas que extrapolar cualquiera de las rectas de Tafel obtenidas a polarizaciones grandes hasta el valor E=Ecorr, tal como se esquematiza en la Figuras 2b y 3a. En la Figura 3a se presenta el diagrama de Tafel para el proceso de corrosión de un metal en un medio ácido con oxígeno disuelto, mientras que en la Figura 3b se reproduce el mismo diagrama, pero tomando en consideración lo que suele ocurrir frecuentemente en los casos reales, cuando el proceso catódico de reducción del O2 está controlado por difusión. La Figura 4 reproduce un diagrama de Tafel experimental correspondiente al proceso de corrosión de un acero dulce en una salmuera. La principal ventaja y desventaja de este método, derivado en principio por Wagner y Traud (1) y Evans y Hoar (2), y que tiene una amplia aplicabilidad en la práctica, reside en la necesidad del trazado completo de las curvas de polarización que por una parte posibilita un análisis electroquímico de la cinética del proceso de corrosión y, por otra, puede dar lugar a modificaciones de la superficie del electrodo por efecto de las elevadas polarizaciones aplicadas. Inversamente, si se llega a una concordancia entre los valores de las velocidades de corrosión derivadas de los ensayos gravimétricos de pérdidas de peso y las obtenidas con la utilización de este método, puede concluirse que el proceso de corrosión se realiza según un mecanismo electroquímico característico. El cálculo de la velocidad de corrosión por el método de extrapolación de Tafel, conocido también como método de intersección, se basa en la extrapolación de la zona lineal o de Tafel en un diagrama experimental E vs. log j. Según este método se puede obtener la jcorr sin más que extrapolar cualquiera de las rectas de Tafel hasta el valor del Ecorr, tal como se representa en la Figura 1. Para un buen desarrollo experimental de esta técnica se recomienda consultar las siguientes normas ASTM: • • ASTM G 3 - 89. Standard Practice for Conventions Applicable to Electrochemical Measurements in Corrosion Testing. ASTM G 5 - 94. Standard Reference Test Method for making Potentiostatic and Potentiodynamic Anodic polarization Measurements. • • ASTM G 59 - 97. Standard Test Method for Conducting Potentiodynamic Polarization Resistance Measurements. ASTM G 102 - 89. Standard Practice for Calculation of Corrosion rates and Related Information from Electrochemical Measurements. Figura 3a. Diagrama de Tafel correspondiente a la corrosión de un metal, M, en un electrolito ácido en presencia de oxígeno disuelto. En la práctica se acostumbra a la representación gráfica del log I versus E que también se conoce como diagrama de Tafel. El diagrama de Tafel de la Figura 1 se puede generar directamente a partir de la ecuación de Butler-Volmer. En la práctica, muchos sistemas de corrosión están controlados cinéticamente por la polarización de activación y obedecen por tanto a la ecuación de Butler – Volmer. Si éste es el caso, la representación gráfica del logaritmo de la corriente respecto al potencial aplicado debe presentar un comportamiento lineal (Tafeliano) en sentido anódico y catódico que indica precisamente el control cinético del sistema bajo estudio. Sin embargo, pueden existir complicaciones, como por ejemplo: 1. Polarización por concentration, cuando la velocidad de la reacción está controlada por la velocidad a la que llegan las especies reactivas a la superficie metálica. A menudo las reacciones catódicas presentan una polarización por concentración para altos valores de corriente, cuando la difusión del O2 o de los iones H+ no es lo suficientemente rápida como para mantener un control cinético activacional. 2. La formación de óxidos, los cuales pueden llevar o no a la pasivación del metal, pero alteran la superficie de la muestra metálica ensayada. El estado de la superficie puede afectar los valores de las constantes de la ecuación. Oxide formation, which may or may not lead to passivation, can alter the surface of the sample being tested. The original surface and the altered surface may have different values for the constants in Equation 12. 3. Otros efectos que puedan modificar la superficie, tales como la disolución preferencial de un componente de una aleación son también causa de problemas. 4. Un control mixto del proceso de corrosión cuando mas de una reacción, anódica o catódica, pueden ocurrir simultáneamente, puede complicar el modelo. Un ejemplo de control mixto es la reducción simultánea del O2 y H+. 5. Por último, otra causa de error en el modelo cinético controlado únicamente por activación necesario para la validez de la ecuación de Tafel es la caída de potencial que tiene lugar como resultado del paso de la corriente que circula por la celda a través de la resistencia eléctrica del electrolito de la misma celda. Si este efecto no es muy severo puede llegar a corregirse (compensarse) con el dispositivo de compensación de IR del propio potenciostato. Finalmente, las caídas de potencial resultado del paso de una corriente a través de la resistencia de la solución en la celda produce errores en el modelo cinético. Este último efecto, si no es muy severo, puede ser corregido mediante la compensación IR del propio potenciostato. En muchos casos, las complicaciones como las indicadas anteriormente, pueden ser la causa de la no-linealidad en las gráficas de Tafel. Todos los resultados derivados de una gráfica de Tafel que no tenga una bien definida región lineal deben ser utilizados con mucha precaución.. Como ya se ha indicado anteriormente, el análisis clásico de Tafel se lleva a cabo mediante la extrapolación de la porción lineal de la curva de polarización (log j vs E), anódica y/o catódica, al valor del potencial de corrosión, como se muestra en la Figura 2b. El valor tanto de la corriente anódica como de la catódica en la intersección, es decir la correspondiente al Ecorr, es Icorr . Desafortunadamente, los sistemas de corrosión reales no presentan, muy a menudo, en sus curvas de polarización, una región lineal lo suficientemente extensa que permita una extrapolación con garantías. La mayoría de los equipos modernos disponen de un software adecuado para este tratamiento. Por ejemplo, el Gamry Instruments' DC105 DC Corrosion Techniques software, puede llevar a cabo un ajuste numérico de la ecuación de Butler – Volmer. Los valores experimentales se ajustan a la ecuación de Butler – Volmer, modificando los correspondientes valores del Ecorr, Icorr , ba, and bc. Este método de ajuste de la curva tiene la ventaja que no requiere una bien definida porción lineal en la correspondiente curva de polarización. Figura 3b. Curva de polarización (diagrama de Tafel) correspondiente al proceso de corrosión del acero en un medio ácido con oxígeno disuelto, estando el proceso catódico controlado por la difusión del O2 . After 24 hr, 0 rpm -0.35 A 25ppm -0.40 C 25ppm E (V vs SCE) -0.45 -0.50 -0.55 -0.60 -0.65 1E-06 1E-05 1E-04 1E-03 1E-02 -2 i (A cm ) Figura 4. Curva de polarización de un acero 1018 en una solución de salmuera con inhibidor tipo imidazolina (25 ppm) a temperatura ambiente (3). REFERENCIAS 1. C. Wagner y W. Traud, Z. Elektrochem. 44, 391 (1938). 2. U.R. Evans y T.P. Hoar, Proc. Roy. Soc. A., 137, 343 (1932). 3. J. Mendoza, R. Duran and E. Garcia, Corrosion’2002, Paper # 02491. Houston (2002).