Descargar en
Anuncio

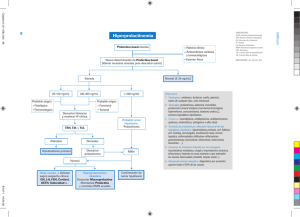
REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 ARTÍCULO Evaluación clínica de la paciente con anovulación crónica Sócrates Aedo M1, Katherina Villa P2, Jaime Apara S3. RESUMEN A diferencia de otras especies, en la mujer el fenómeno de la ovulación, es más bien la regla que la excepción. Dentro de la ginecología endocrinológica, la anovulación crónica es un motivo frecuente de consulta, manifestándose como alteración menstrual y/o alteración reproductiva. Las causas de anovulación crónica son múltiples y heterogéneas y su manejo dependerá, obviamente, de la causa originaria del trastorno. En el presente artículo se plantean las posibles alternativas etiológicas y su adecuado algoritmo diagnóstico. Palabras clave: Síndrome del ovario poliquístico, hiperprolactinemia, amenorrea hipotalámica funcional, falla ovárica. SUMMARY Unlike other species, the ovulation process in women is the rule rather than the exception. In the Gynecology Endocrine field, the chronic anovulation becomes a frequent motive for medical consult, some initial symptoms such as menstrual disorders, and/or reproductive alterations. Some of the causes for chronic anovulation could be both multiple and heterogeneous, and its control will absolutely depend on the origin of the disorder. This article will expose the possible etiologic alternatives and the appropriate diagnosis algorithm. Key words: Polycystic ovary syndrome, hyperprolactinemia, functional hypothalamic amenorrhea, ovarian failure. 1 Departamento de Obstetricia y Ginecología, Facultad de Medicina, Campus Oriente, Universidad de Chile. Hospital Dr. Luis Tisné Brousse. 2 Interna Medicina. Universidad de Chile. 3 Médico pasantía capacitación de Obstetricia y Ginecología, Facultad de Medicina, Campus Oriente, Universidad de Chile. Hospital Dr. Luis Tisné Brousse E mail: saedo@vtr.net 175 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 ANOVULACIÓN CRÓNICA Y TRASTORNOS MENSTRUALES El ciclo menstrual normal posee 3 características, regularidad, ciclicidad y espontaneidad1. La ciclicidad se refiere a la repetición de eventos hormonales y endometriales característicos con una periodicidad determinada. La regularidad, a la semejanza en la duración de ciclos sucesivos, que en general, no deben variar más de 3 días entre ellos. La espontaneidad tiene relación con la ocurrencia natural de los eventos involucrados en el ciclo ovulatorio. Estas tres características implican una coordinación adecuada de la secreción hormonal del eje hipotálamo-hipófisis-ovarios y una respuesta consecuente a ello. Las características normales de los ciclos menstruales se muestran en la Tabla 1. La menstruación se define como el flujo sanguíneo vaginal de origen uterino cíclico, que ocurre como consecuencia de ciclos ovulatorios1, por lo que el interrogatorio acerca de su menstruación tiene un valor que es comparable al de exámenes endocrinológicos muy complejos y costosos. En las mujeres que menstrúan y por tanto ovulan, es posible asumir con seguridad que la producción de gonadotropinas hipofisiarias, así como de estrógenos, andrógenos y progesterona, es normal. Es posible hallar excepciones a esta regla, como las mujeres con deficiencia en la fase lútea y en aquellas que con abetalipoproteinemia2,3. Por tanto, el sangrado cíclico y regular que ocurre como consecuencia del uso de anticonceptivos hormonales no debe ser considerado menstruación. En consecuencia, cualquier alteración del patrón de sangrado con el uso de anticonceptivos hormonales debe ser considerado metrorragia por anticonceptivo y en ningún caso debiera estudiarse, ni menos manejarse, como una anovulación crónica. Los trastornos menstruales corresponden a alteraciones en la regularidad, cantidad, frecuencia, duración o volumen del flujo menstrual y las causas pueden ser fisiológicas, patológicas o farmacológicas4. Afectan entre 10% y 30% de las mujeres en edad reproductiva5-7, aumentando su incidencia hasta cifras cercanas al 50% en las edades cercanas a la menopausia y menarquia5-9, generando trastornos sociales, psicológicos y sexuales significativos en las mujeres que los padecen. Visto en forma individual, la percepción del ciclo menstrual por cada mujer varía en forma considerable. Se ha demostrado poca confiabilidad en estudios que evalúan la percepción de la regularidad, frecuencia, duración y cantidad del flujo menstrual10-16, lo cual debe ser tenido en cuenta al momento de definir un trastorno menstrual. En base a lo anterior, no sólo debe considerarse un trastorno menstrual a aquél en que existe alteración de las condiciones básicas de una menstruación normal (Tabla 2), sino también debe considerarse patológico aquel sangrado que a pesar que cumpla estas condiciones, presente las siguientes variaciones respecto a su patrón previo17: 1. Uso de 2 toallas higiénicas extras por día. 2. Prolongación de la menstruación sobre 3 días de lo usual. 3. Sangrado entre menstruaciones. 4. Variación del intervalo entre menstruación mayor a 4 días. El término anovulación crónica23 abarca las condiciones asociadas a la ausencia de ovulación repeti- Tabla 1. Características de los ciclos menstruales normales, alteraciones que deben ser consideradas patológicas y forma de designación de cada alteración1-7 Tipo de alteración Patrón normal Considerar patológico Designación patología Regularidad Variación no mayor a 3-4 días Mayor de 3 días Metrorragia Frecuencia 28 ± 7días Menor de 21 días o mayor de 35 días Polimenorrea Oligomenorrea Duración 2 a 7 días Mayor de 7 días Menorragia Cantidad (volumen) 40 ± 20 ml Mayor de 60-80 ml <20 ml Hipermenorrea Hipomenorrea * Volúmenes mayores se asocian a anemia por déficit de hierro, parece razonable usar como límite los 60 ml por mes, el problema es que sobre el 50% del flujo menstrual es transudado del endometrio7. 176 EVALUACIÓN CLÍNICA DE LA PACIENTE CON ANOVULACIÓN CRÓNICA Tabla 2. Tipos de patrón según alteración de condiciones básicas de una menstruación normal1,17-22 Alteración Definición Patrón Oligomenorrea Disminución frecuencia del sangrado uterino Regular en intervalos mayores a 36-40 días Amenorrea Ausencia de menstruación Depende si es primaria o secundaria Hipomenorrea Disminución de la cantidad flujo menstrual Regular con duración menor a 2 días Sangrado intermenstrual Sangrado uterino leve (manchado) entre periodos menstruales normales Entre períodos habitualmente suave Menorragia Aumento de la cantidad (>80 ml) o duración prolongada del flujo menstrual (>7 días) Ocurre en intervalos regulares Hipermenorrea Aumento de la cantidad del flujo menstrual (>80 ml) Regular Metrorragia Sangrado uterino que ocurre de manera irregular pero en intervalos frecuentes y cantidad variable Irregular Menometrorragia Sangrado uterino irregular, prolongado y abundante Irregular Polimenorrea Sangrado uterino frecuente pero regular Regular en intervalos de menos de 21 días da, que se manifiesta habitualmente con la clínica de amenorrea o irregularidad del ciclo menstrual (metrorragia disfuncional). En principio, estos trastornos menstruales pueden relacionarse desde el punto de vista fisiopatológico, con alteraciones de la función integrada del eje hipotálamo-hipófisis-ovarios, ya sea por trastornos inherentes a éste o secundarios a una disfunción endocrina periférica. Durante los ciclos menstruales, puede considerarse natural que una mujer tenga 1 ó 2 ciclos anovulatorios al año2,3. Al no ser un fenómeno repetido, no debemos considerarlo en la definición de anovulación. Los trastornos menstruales no debieran ser considerados sinónimos de anovulación23, pues en su etiología puede haber causas diferentes a la falta de ovulación repetida. Ejemplos de esto son: 1. La metrorragia producida por pólipos, miomas, etc. 2. Cuadros de amenorrea por himen imperforado, síndrome de Asherman, etc. 3. La menorragia (frecuente en edades cercanas a la menopausia y menarquia)18 en que la causa más frecuente del trastorno es una alteración a nivel endometrial, denominada disfunción endometrial y que habitualmente es ovulatoria24,25. Es frecuente observar que la patología endometrial (hiperplasia endometrial o cáncer de endometrio) habitualmente se asocia a fenómenos de anovulación crónica. Por consiguiente, si estamos estudiando una metrorragia con hiperplasia endometrial, tenemos la obligación, en conjunto con el manejo de dicha patología, de descartar las probables causas de anovulación crónica. También es habitual, que a las pacientes con anovulación crónica, se asocien manifestaciones ecográficas como presencia de quistes ováricos funcionales y/o fenómenos de persistencia del cuerpo lúteo2,3,23. El sangrado uterino disfuncional (SUD), para la Sociedad Europea de Reproducción Humana, corres- 177 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 ponde a un sangramiento excesivo (muy intenso, prolongado o frecuente), de origen uterino, en el cual no se demuestra ninguna enfermedad pélvica, complicación de embarazo ni enfermedad sistémica26,27. En esta definición se incluyen la menorragia (sangrado prolongado y/o abundante) y la metrorragia (sangrado irregular) en las que no hay causa uterina ni sistémica y/u obstétrica asociada, es decir, se incluyen tanto patrones ovulatorios como anovulatorios. En cambio en EE.UU., la definición de SUD se refiere a los sangrados uterinos coincidentes con anovulación (metrorragia disfuncional)27,28. CAUSAS FRECUENTES DE ANOVULACIÓN CRÓNICA Respecto de las causas de anovulación crónica más frecuentes, de acuerdo a nuestra experiencia se encuentran el síndrome del ovario poliquístico (70%), la amenorrea hipotalámica funcional (10%), la falla ovárica (10%) y la amenorrea asociada a hiperprolactinemia (10%). Sin embargo sus causas pueden ser muy variadas (Tabla 3)23. I. Insuficiencia ovárica23,29: En esta categoría los pacientes en general, aunque no de manera invariable, presentan elevación de las gonadotropinas. No obstante, no toda elevación de gonadotropinas es necesariamente una falla ovárica23 (Tabla 4). La presencia de caracteres sexuales secundarios indica que en épocas pasadas hubo cierto grado de actividad ovárica. La causa más frecuente dentro de este tipo de trastorno, es la disgenesia gonadal. Esta categoría abarca la insuficiencia ovárica prematura secundaria a enfermedades autoinmunes y alteraciones de los receptores para gonadotropinas. Importante en este caso, es la realización de una ultrasonografía ginecológica transvaginal (USTV), que de acuerdo al tamaño ovárico y presencia de folículos, nos permite asegurar la presencia de una falla ovárica y entrega un pronóstico reproductivo. II. Hiperprolactinemia30-32: El 75% de las mujeres con amenorrea y galactorrea tienen hiperprolactinemia y dado que el 15% de las Tabla 3. Clasificación etiológica según mecanismo fisiopatológico en el síndrome de anovulación crónica23 1. Anovulación crónica hipotalámica. I. II. Alteración secreción pulsátil de GnRH. Alteración de la función integrada del componente SNC del eje hipotálamo-hipófisis-ovario. 2. Anovulación crónica hipofisiaria. I. Defectos o disfunción de los gonadotropos. 3. Anovulación crónica debida a una retroalimentación inapropiada. I. Uso de esteroides anticonceptivos o exposición a dosis constante de estrógenos. II. Producción extraglandular excesiva de estrógenos. III. Sistema de amortiguación anormal. IV. Exceso de andrógenos funcionales (suprarrenales u ováricos). V. Tumores productores de andrógenos o estrógenos. VI. Síndromes con exceso o deficiencia de aromatasa. VII. Mutaciones de los genes receptores para FSH, LH y estrógenos. VIII. Trastornos autoinmunes. 4. Anovulación crónica debida a una retroalimentación inapropiada secundaria a una disfunción central-periférica combinada. I. II. 178 Síndrome del ovario poliquístico. Producción excesiva de cortisol y andrógenos (ectópica/eutópica) en síndrome de Cushing. III. Deficiencia o exceso de hormona tiroidea y síndrome de resistencia a la hormona tiroidea. IV. Exceso de prolactina u hormona del crecimiento (ectópico o eutópico). V. Desnutrición. EVALUACIÓN CLÍNICA DE LA PACIENTE CON ANOVULACIÓN CRÓNICA Tabla 4. Causas de amenorrea con aumento de gonadotropinas23,29. Incluye pacientes con síndrome de anovulación crónica e insuficiencia ovárica primaria Disgenesia gonadal a) Síndrome Turner clásico (45XO) b) Variantes Turner mosaicos y 46X-anormal X) c) Disgenesia gonadal pura 46XX, 46XY (síndrome de Swyer), mosaico Alteraciones autoinmunes a) Asociadas a otras endocrinopatías: comúnmente hipotiroidismo, síndrome pluriglandular. b) Aisladas: anticuerpos anti-receptor de gonadotrofinas, ooforitis autoinmune Defectos del receptor gonadotrópico(FSH O LH) y/odefectos a nivel post receptor a) Síndrome de Savage Defectos en secreción o acción de gonadotropinas a) Secreción de formas biológicamente inactivas b) Defectos en la subunidad alfa o beta c) Tumores secretores de gonadotrofinas (adenomas raro) Defectos enzimáticos a) Deficiencia de 17 alfa-hidroxilasa b) Galactosemia Aplasia congénita del timo Causas físicas a) b) c) d) Irradiación Agentes quimioterápicos (especialmente alquilantes) Agentes virales Extirpación quirúrgica a) b) c) d) e) Reducción número células germinales Atresia acelerada de células germinales Asociada con miotonía distrófica Asociada con blefarofimosis-ptosis-epicanthus inverso Idiopática Condrodistrofias Otras (FSH: hormona folículo estimulante; LH: hormona luteinizante) mujeres amenorreicas están hiperprolactinémicas es necesario evaluar las concentraciones de prolactina en toda mujer anovulatoria. Además, si bien la galactorrea puede estar presente en alrededor de 5% a 10% de las mujeres con menstruaciones normales, las concentraciones basales de prolactina son normales en más del 90% de estas mujeres. Para medir correctamente los niveles de prolactina es importante que las muestras de sangre se obtengan en un verdadero estado basal, esto se da en la mañana, en ayuno, sin factores de estrés y sin medicamentos que interfieran con la medición. Idealmente se deben obtener varias muestras seriadas en el mismo momento o en varios días (pool prolactina). Las concentraciones séricas de prolactina elevadas deben alertar al médico acerca de la posibilidad de una neoplasia de hipófisis, con un alto índice de sospecha, en una paciente con galactorrea no puerperal, en la que se han descartado otras causas. El hipotiroidismo es una causa de hiperprolactinemia que debe ser excluido. En la Tabla 5 se señalan causas de hiperprolactinemia. Entre las causas más importantes de hiperprolactinemia encontramos, el adenoma de hipófisis (prolactinoma); un tercio de las pacientes con hiperprolactinemia, tiene una imagen radiológica compatible con microadenoma. Los prolactinomas son la causa endógena más común de hiperprolactinemia. Sin embargo, cualquier tumor del sistema nervioso central que interfiera con el control inhibitorio de la dopamina, podría producir hiperprolactinemia (pseudoprolactinoma). El tamaño del adenoma, en general, se relaciona con los niveles de prolactina; tumores grandes con niveles bajos, son a menudo adenomas no secretores de prolactina y comprimen el tallo hipofisiario. 179 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 Tabla 5. Causas de aumento prolactina30-32 Causas fisiológicas Sueño, alimentación, ejercicio, stress, coito, ciclo menstrual, embarazo, puerperio, lactancia, feto y neonato Causas farmacológicas 1. Estrógeno terapia 2. Anestesia 3. Agentes bloqueantes de los receptores dopaminérgicos: fenotiazinas, haloperidol, metoclopramida, domperidona, pinozida, supirida 4. Bloqueo recaptación de dopamina: nomifensina 5. Agentes que producen depleción de dopamina en el sistema nervioso central: reserpina, metildopa, inhibidor de la monoaminooxidasa 6. Inhibición recambio dopamina opiáceos 7. Estimulación del sistema serotoninérgico: anfetaminas, alucinógenos 8. Antagonista receptor histaminérgico H2: cimetidina Causas patológicas 1. Lesiones hipotalámicas: craneofaringioma, glioma quístico, granuloma, histiocitosis X, neurotuberculosis, sarcoidosis 2. Transección de tallo 3. Posquirúrgica o traumatismo de cráneo 4. Daño por irradiación hipotálamo 5. Seudociesis (funcional). 6. Tumores hipofisiarios: enfermedad de Cushing, acromegalia, prolactinoma, adenomas secretantes mixtos de GH o ACTH y prolactina, adenomas “no funcionantes” 7. Causas reflejas: traumatismos de la pared torácica, neuritis por herpes zoster, cirugía abdominal superior 8. Hipotiroidismo 9. Insuficiencia renal 10. Producción ectópica carcinoma broncogénico, hipernefroma Los adenomas hipofisiarios se dividen en microadenonas (<10 mm) y macroadenomas (>10 mm). Los microadenomas constituyen la mayoría de los prolactinomas; producen elevación moderada de prolactina, aunque puede superar los 100 ng/ml. En autopsias de mujeres se describe la presencia de hasta 27% de microadenomas, la mayoría microscópicos. Los adenomas detectables (>3 mm) se encuentran en el 3% de las mujeres, siendo más frecuentes en mujeres jóvenes. En los macroadenomas, además de síntomas de hiperprolactinemia se podrían agregar síntomas de hipertensión endocraneana, como cefalea y alteraciones del campo visual. El estudio de imágenes a nivel selar y supraselar está indicado sólo en caso de hiperprolactinemia persistente, adecuadamente documentada y habiendo descartado el hipotiroidismo. No obstante, podría obviarse en casos en que sea una clara etiología, inducida por fármacos o fisiológica. En caso de haberse detectado prolactinemia mayor a 100 ng/ml debe descartarse lesión tumoral. La resonancia nuclear magnética (RNM) entrega la mejor y más detallada informa- 180 ción. También es útil tomografía axial computarizada (TAC). No se recomienda la radiografía de silla turca. Siempre debe recordarse que elevaciones modestas de prolactina se pueden acompañar de microadenomas o macroadenomas, tumores hipofisiarios no lactótropos y otras anomalías del sistema nervioso central. III. Síndrome del ovario poliquístico (SOPQ)33-34: En nuestra experiencia, el SOPQ33,34 sería la causa más frecuentemente observada en los cuadros de anovulación crónica, con una frecuencia estimada de 70%, esto pudiera estar sobrestimado debido a que su diagnóstico es por exclusión de otras patologías frecuentes. Este cuadro correspondería a una alteración neuro-endocrino-metabólica, con una prevalencia estimada en 5%-10% de la población33. Actualmente, pese a que no se conoce cabalmente la etiopatogenia de este síndrome, se supone que es un desorden complejo con múltiples genes involucrados33. Existen una serie de factores étnicos, raciales y ambientales que influencian su fenotipo de presenta- EVALUACIÓN ción33. De acuerdo al consenso de Rotterdam34 (Figura 1), su diagnóstico es de exclusión y se establece de acuerdo a la presencia de 2 o más factores de los que se señalan: 1) Oligo o anovulación crónica 2) Signos clínicos y/o bioquímicos de hiperandrogenismo y 3) Criterio ecográfico de ovarios poliquísticos. El SOPQ suele confundirse con el síndrome metabólico. Sin lugar a dudas, el conjunto de pacientes que reúnen características para SOPQ, según el consenso Rotterdam, también son un grupo de riesgo para síndrome metabólico34. Ahora bien, la explicación de este fenómeno estaría dada porque el principal factor presente en el 75% de los síndromes metabólicos, es la resistencia a la insulina y ésta actuaría en el fenómeno de arresto folicular, evitando la selección y dominancia folicular, evidenciado en el SOPQ. Por tanto, existe una correlación entre síndrome metabólico y SOPQ. Dicha correlación también se ha observado en grupos de pacientes con SOPQ ovulante (SOPQ con ovulación en que se cumplen los criterios de signos de hiperandrogenismo y criterio ecográfico de ovarios poliquísticos, con exclusión de otras patologías), que presentan características propias del síndrome metabólico con elementos de resistencia a la insulina, lo cual determina que sean un grupo de riesgo para diabetes mellitus y enfermedades cardiovasculares35. CLÍNICA DE LA PACIENTE CON ANOVULACIÓN CRÓNICA Características del diagnóstico de SOPQ34 1. Descartar otras etiologías El SOPQ como hemos señalado, sería una mezcla de distintas alteraciones neuro-endocrino-metabólicas que involucran alteraciones genéticas variadas, cuya alteración central sería la presencia de falta de ovulación repetida, es decir, es un saco donde caen todas aquellas causas de anovulación que no logramos precisar. Por tanto, el diagnóstico de SOPQ se realiza luego de descartar otras etiologías (Tabla 6) que están reconocidas, estudiadas y cuyo manejo es diferente. 2. Oligo o anovulación crónica Se manifiesta como trastorno menstrual y/o infertilidad. Las alteraciones menstruales pueden ir desde la amenorrea y oligoamenorrea hasta la metrorragia. No obstante, en ocasiones la historia menstrual no es clara y se hace necesario utilizar progesterona en el día 23 para valorar la ovulación; en especial en casos de infertilidad inexplicada, con patrón menstrual aparentemente regular. 3. Signos clínicos y/o bioquímicos de hiperandrogenismo El hiperandrogenismo puede manifestarse ya sea en forma clínica (hirsutismo, acné y/o alopecia) o por bioquímica compatible (índice andrógenos libres, testosterona libre calculada de Ver- Hiperandrogenismo ovárico funcional (síndrome del ovario poliquístico) Presencia de 2 a 3 de las siguientes características: 1. Ciclos anovulatorios (oligoamenorrea o metrorragia disfuncional). 2. Hiperandrogenismo o hiperandrogenemia. 3. Imagen de ovario poliquístico en ultrasonografía ginecológica transvaginal. Riesgo aumentado de cáncer endometrial Se descarta: 1. Hiperprolactinemia 2. Hiperplasia suprarrenal congénita 3. Síndrome de Cushing 4. Neoplasias secretoras de andrógenos 5. Acromegalia Búsqueda de síndrome metabólico: Presión arterial, cintura abdominal, colesterol HDL, triglicéridos y glicemia ayunas LH normal o aumentada LH/FSH >2 Dehidroepinadrosterona sulfato, prolactina y testosterona total en rangos normales o discretamente elevadas FSH: hormona folículo estimulante, LH: hormona luteinizante. Figura 1. Diagnóstico de síndrome del ovario poliquístico34. 181 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 Tabla 6. Etiologías a descartar para hacer el diagnóstico de síndrome del ovario poliquístico33,34 Condición Hiperandrogenismo clínico y/o bioquímico Oligoamenorrea Forma no clásica de hiperplasia suprarrenal congénita (déficit de 21 hidroxilasa) Si No a menudo Síndrome de Cushing Si Prolactinoma y/o hiperprolactinemia Clínicas Características distintivas Bioquímicas y/o hormonales Historia familiar de hirsutismo o infertilidad común en jóvenes Ashkenazi 17OHOPG aumentada en su nivel basal o post ACTH Si HTA, facie medialuna, estrías y atrofia muscular de extremidades Cortisol libre urinario de 24 horas aumentado Ninguna o leve Si Galactorrea Hiperprolactinemia Hipotiroidismo primario Ninguna o leve Puede estar presente Bocio puede estar presente TSH elevada T4 libre normal o bajo Prolactina puede elevarse Acromegalia Ninguna o leve A menudo Prognatismo, crecimiento de las falanges terminales (manos), sudoración excesiva, síndrome del túnel carpiano, macroglosia. Aumento plasmático de IGF-1 aumentado. Respuesta inadecuada de GH a hiperglicemia. Ninguna Si Puede estar asociado a otras endocrinopatías autoinmunes. FSH elevado. Estradiol plasmático bajo o normal A menudo No a menudo Diagnostico por exclusión Ninguno Si Si Clitoromegalia, hirsutismo extremo o patrón de alopecia masculino Testosterona >200 ng/dl DHEAS >5-6 µ/ml A menudo Variable Historia provista de uso de andrógenos, ácido valproico, ciclosporinas u otras drogas Ninguno Falla ovárica prematura Obesidad simple Neoplasia ovárica suprarrenal virilizante Condición asociada a drogas (17OHPG: 17 hidroxiprogesterona; ACTH: hormona adenocorticotrófica; TSH: hormona tiroestimulante; HTA: hipertensión arterial crónica; GH: hormona crecimiento; IGF-1: factor de crecimiento insulino símil tipo1; DHEAS: dehidroepiandrosterona sulfato). meulen)36; siendo, según los distintos estudios, equivalentes ambos modos de detección del problema. En la detección del hiperandrogenismo clínico es importante contar con una adecuada escala, para lo cual, nosotros utilizamos la escala de Moncada-Lorenzo modificada (Figura 2)37. En relación al hiperandrogenismo bioquímico nosotros recomendamos utilizar la testosterona total y SHBG (sex hormome binding globulin) para calcular la testosterona libre de vermeulen y/o el índice de andrógenos libres, dado que han demostrado mayor correlación con la testosterona libre sérica real (medida en diálisis de ultrafiltración)36. Recalcamos no utilizar la testosterona por radioinmunoensayo, pues tiene una pobre correlación con el gold standard, que es la testosterona 182 medida en cámaras con diálisis de ultrafiltración y por lo tanto, no es capaz de discriminar una hiperandrogenemia36. 4. Criterio ecográfico ovarios poliquísticos34,38 El SOPQ38 contiene 2 a 3 veces más folículos en todas las etapas de crecimiento en comparación a ovarios normales. El aumento de dichos folículos está dado por el aumento de la foliculogénesis, bajo dependencia de andrógenos intraováricos, que promueven la proliferación de las células de la granulosa e inhiben la apoptosis, especialmente de pequeños folículos que son ricos en receptores androgénicos. El efecto fisiológico del andrógeno es exagerado por las células de la teca, que son hiperactivas, con sobreexpresión de enzimas esteroidogénicas. Efecto relativamente independiente de LH (hor- EVALUACIÓN CLÍNICA DE LA PACIENTE CON ANOVULACIÓN CRÓNICA Figura 2: Escala de Moncada Lorenzo modificada, se evalúa el pelo terminal en área nasal, mentón, tórax anterior, región abdominal baja y extremidades inferiores asignado un puntaje de 1 a 4 dependiendo la extensión del pelo terminal. En nuestra unidad no evaluamos extremidades superiores37. mona luteinizante) e insulina (observado en cultivos celulares). La teoría del arresto folicular supone que la progresión de pequeños folículos antrales a folículos reclutados (6-9 mm) y la dominancia folicular, no proceden normalmente en pacientes con SOPQ (rol preponderante de la obesidad e hiperinsulinemia)38. De lo antes expuesto, en el síndrome del ovario poliquístico existiría un fenómeno de arresto folicular y en alguna medida, la USTV permitiría detectar dicho fenómeno, para lo cual se han propuesto los siguientes criterios ecográficos utilizados en el diagnóstico de síndrome del ovario poliquístico34,38: 1. Presencia de 12 o más folículos que midan entre 2-9 mm de diámetro en cada ovario y/o un volumen ovárico mayor de 10 ml. Si hay evidencia de un folículo dominante (>10 mm) o cuerpo lúteo, el examen debiera ser repetido en un próximo ciclo. 2. La apariencia subjetiva de ovario poliquístico no debiera sustituir la definición anterior. Debe omitirse la distribución de folículos e incremento de ecogenicidad. 3. Basta la presencia de esta alteración en un ovario para usar criterios ya señalados. La presencia de un quiste anormal o asimetría ovárica requiere mayor estudio. 4. Mujeres usuarias de anticonceptivos y edades cercanas a la menopausia la definición anterior no debería ser aplicada. 5. Las mujeres con imagen de ovario poliquístico en USTV, en ausencia de anovulación o hiperandrogenismo debieran ser consideradas SOPQ asintomático. 6. El ultrasonido debe ser cuidadoso en predecir los resultados de fertilidad en pacientes con SOPQ (respuesta a clomifeno, riesgo de síndrome de hiperestimulación ovárica, decisión de maduración in vitro de oocitos). Los ovarios que cumplen este criterio en la fertilización in vitro tienen una mayor frecuencia de síndrome de hiperestimulación. 7. El ultrasonido es una oportunidad para evaluar la hiperplasia endometrial. Junto con lo anterior, se propuso la aplicación de una normativa técnica en el momento de aplicación 183 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 de la USTV34,38 la cual consistía en: 1) Adecuado entrenamiento del personal y equipos de calidad adecuada. 2) Siempre que sea posible debe usarse la vía transvaginal en especial en pacientes obesas. 3) El estudio ecográfico debe ser realizado en fase folicular precoz (3-5 día ciclo). En mujeres oligoamenorreicas el examen debiera ser efectuado cualquier día o entre el día 3 a 5 después del sangrado vaginal post uso de progestinas. 4) El cálculo del volumen ovárico se debería realizar con fórmula elipse (0,5 x largo x ancho x grosor). 5) El número de folículos debería ser estimado en corte longitudinal y antero posterior. El tamaño de folículos menores de 10 mm debiera ser expresado como una media del diámetro medido en 2 cortes. En la actualidad existe poca conciencia en nuestro medio respecto al criterio diagnóstico y recomendaciones técnicas de la USTV en el diagnóstico de SOPQ, por lo cual las ecografías debieran ser hechas por médicos conocedores y técnicamente habilitados para aplicar la norma del consenso de Rotterdam. No obstante, la aplicación de estos criterios ecográficos, no se ha demostrado una adecuada reproducibilidad tanto intraobservador como interobservador39. IV. Amenorrea hipotalámica funcional32 Corresponde a una alteración neuro-endocrino-metabólica en la cual hay una alteración del pulsador GnRH (factor liberador de gonadotropinas), que se hace lento. Generalmente hay ausencia de ciclos menstruales, pero en grados iniciales es frecuente observar disfunciones ovulatorias con polimenorrea, a la cual, en la medida que se acentúa el problema, sobreviene la oligoamenorrea y amenorrea. La alteración menstrual a menudo es precedida de la pérdida de peso, ejercicio físico excesivo (gimnasia competitiva, ballet o maratonistas) y estrés psicológico. En la mayoría de las mujeres que reducen la pérdida de peso o suprimen el ejercicio físico excesivo, se recuperan las menstruaciones. En nuestra experiencia, ésta ocupa aproximadamente el 10% de las causas de anovulación crónica. Su diagnóstico generalmente se hace por la presencia de ejercicio físico excesivo, estrés psicológico o dieta deficiente32,40, además de descartar la presencia de un SOPQ (no cumple criterios) y de alguna patología orgánica a nivel del eje hipotálamo-hipofisiario, por lo que la indicación de imagenología selar y supraselar es mandatoria en estos casos. Los niveles plasmáticos de LH, FSH (hormona folículo estimulante) y Estradiol son normales o bajos. Los niveles de prolactina son bajos y la respuesta de FSH 184 y LH al GnRH está conservada. Su presencia es considerada un factor de riesgo para osteoporosis. ALGORITMO DIAGNÓSTICO EN ANOVULACIÓN CRÓNICA Una anamnesis detallada y un examen físico completo, tienen importancia fundamental en la evaluación de una mujer con anovulación crónica41. Cuando se considera a la paciente como un sujeto de bioensayos, es fundamental evaluarla desde el punto de vista individual en relación con la pubertad y con la influencia de la secreción hormonal alterada sobre el proceso puberal. Por lo tanto, la sencilla clasificación de Marshall y Tanner42, proporciona un marco de trabajo para el examen inicial. El estudio complementario de laboratorio e incluso el empleo de pruebas de valoración (ejemplo uso de estrógenos y/ o progestinas solas) sólo aporta información que permitirá confirmar una sospecha diagnóstica o diferenciar entre varias posibilidades. Una vez que, a partir de nuestra evaluación clínica, hemos logrado plantear nuestras hipótesis diagnósticas, recién ahí podemos determinar cuál va a ser el estudio complementario a realizar. En nuestra unidad utilizamos un algoritmo diagnóstico como el presentado en la Figura 3. Dicho algoritmo se inicia realizando una adecuada anamnesis, examen físico y planteamiento de hipótesis diagnóstica y si existe una amenorrea, debe hacerse especial énfasis al descarte de un posible embarazo. Posteriormente se solicita la medición plasmática de FSH, prolactina, TSH (hormona tiroestimulante) y T4 libre, que parecieran estar indicadas en todas las pacientes con amenorrea41. En los casos en que existan manifestaciones de hiperandrogenismo clínico y/o virilización (score hirsutismo Lorenzo Moncada modificado mayor a 4 puntos, acné, alopecia, clitoromegalia, voz ronca), deberán además solicitarse 17 hidroxiprogesterona (17OHPG), dehidroepiandrosterona sulfato (DHEAS), testosterona total, SHBG y USTV41. Las concentraciones elevadas de TSH (generalmente mayores de 5 µU/ml), con o sin aumento de prolactina, indican un hipotiroidismo primario23. El aumento de la secreción de TRH (hormona liberadora de tirotrofina) presente en este trastorno, estimula un aumento de la secreción de prolactina y de TSH en muchas mujeres afectadas31. Muchas veces la elevación de la TSH se presentará con una T4 libre normal, lo cual plantea el diagnóstico de un hipotiroidismo primario subclínico, el que no necesariamente requerirá tratamiento23. Si las pruebas tiroideas son normales y las concentraciones del pool de prolactina son persis- EVALUACIÓN CLÍNICA DE LA PACIENTE CON ANOVULACIÓN CRÓNICA Anamnesis - Examen físico Genitales femeninos indemnes Medir: prolactina, FSH, TSH y T4 libre Si score hirsutismo >5 medir: Testosterona total, SHBG, 17 OHprogesterona, DHEA-S ¿Cortisol libre urinario 24 horas? Score hirsutismo normal Aumento THS Evaluar hipotiroidismo primario Aumento FSH Evaluar “Insuficiencia gonadal” TSH normal aumento prolactina TSH normal prolactina normal FSH normal o baja 17 OHprogesterona >6 ng/dl Test Synacten alterado Testosterona >200 ng/dl DHEA-S >7 µg/ml Hiperplasia suprarrenal congénita inicio tardío Evaluar posibilidad neoplasia Evaluar hiperprolactinemia Medir: Testosterona - SHBG Sin hiperandrogenemia LH normal o baja - FSH/LH >1 ¿TAC o RNM cerebral? Disfunción hipotálamo - hipofisiaria Hiperandrogenemia Testosterona aumentada leve: SHBG baja LH aumentada o normal - FSH/LH >2 Hiperandrogenismo ovárico funcional (FSH: hormona folículo estimulante; LH: hormona luteinizante; TSH: hormona tiroestimulante; SHBG: globulina ligante de hormonas sexuales; 17OHProgesterona: 17 hidroxiprogesterona; test de Synacten: test de hormona adenocorticotrófica; DHEAS: dehidroepiandrosterona sulfato; TAC: Tomografía Axial Computarizada; RNM: Resonancia Nuclear Magnética). Figura 3: Algoritmo diagnóstico para anovulación crónica. Unidad de Ginecología Endocrinológica CRS Cordillera Oriente - Hospital Dr. Luis Tisné Brousse. Tomado y modificado de Yen-Yaffé41. tentemente elevadas, se justifica hacer las evaluaciones pertinentes para descartar un adenoma de la hipófisis30,31. Cabe recordar, que ésta no es la única causa de hiperprolactinemia (Tabla 5), por lo que deben también descartarse otras causas, incluso un SOPQ, que pudiera asociarse a hiperprolactinemias leves (50-60 ng/dl)30,31. En caso de hiperprolactinemias mayores a 100 ng/dl es mandatario efectuar imagenología selar y supraselar, sobre todo cuando la amenorrea es primaria, pues la posibilidad de una lesión en estos casos es casi 100%30,31. Las concentraciones elevadas de FSH (mayores de 30 mUI/ml) implican una “insuficiencia ovárica”29. Debemos destacar, el rol de la USTV, la que de acuerdo al tamaño ovárico y la presencia de folículos, nos puede dar luces del pronóstico reproductivo del cuadro. En mujeres menores de 35 años con este trastorno, se justifica recurrir a una evalua- ción para descartar una alteración cromosómica29. En mujeres con complemento Y, es necesario realizar gonadectomía, debido al potencial maligno de las gónadas anormales provistas de una porción de cromosoma Y29. Si FSH, prolactina y TSH son normales o bajas, es decir, estamos en presencia de una anovulación normogonadotrópica, normotiroidea y normoprolactinémica39, hay que enfatizar en la evaluación clínica la búsqueda de signos de hirsutismo o virilización, para tratar de diferenciar el SOPQ32 de las disfunciones hipotálamo-hipofisiarias30. Si existen indicios de hipertiroidismo debido a las concentraciones bajas de TSH, es necesario evaluar la concentración de T4 libre para definir el diagnóstico21. Es posible argumentar a favor de la medición de testosterona total, SHBG y USTV en las mujeres no hirsutas41, teniendo en consideración el consenso de 185 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 Rotterdam para síndrome del ovario poliquístico34, según el cual, es posible la existencia de este cuadro sin hiperandrogenismo clínico, pero con la presencia de anovulación e hiperandrogenismo bioquímico o anovulación y USTV que cumple criterios para SOPQ35. La explicación de este fenómeno sería que no todas las mujeres hiperandrogenémicas tienen hirsutismo debido a la relativa insensibilidad femenina de los folículos pilosos a los andrógenos41. Además, es probable que la alteración de las velocidades de depuración metabólica de los andrógenos y de las concentraciones de la SHBG en el SOPQ41, reduzca las posibilidades de hirsutismo en las mujeres con una disminución de la sensibilidad a andrógenos. Como sea el caso, el hiperandrogenismo clínico es considerado un equivalente del hiperandrogenismo bioquímico34. Como ya hemos señalado, en presencia de manifestaciones clínicas de hiperandrogenismo34,41 será de regla la medición de testosterona total, SHBG, 17OHPG y DHEA-S. Si testosterona mayor a 150 ng/dl o DHEA-S mayor de 7 µg/ml, evaluar la posibilidad de una neoplasia23. Con testosterona normal o levemente elevada y una DHEA-S entre 57 µg/ml, evaluar la posibilidad de una hiperplasia suprarrenal congénita de inicio tardío23,41. Con testosterona, DHEA-S o ambas normales o levemente aumentadas y con una LH normal o levemente aumentada pensar en un SOPQ34,41. La 17OHPG nos permite estudiar la posibilidad de una hiperplasia suprarrenal congénita por déficit de 21- hidroxilasa. Si encontramos valores mayores de 6 ng/dl, el diagnóstico está hecho; en cambio, si el valor está entre 2 y 6 ng/dl debemos recurrir al test de ACTH para definir la posible existencia de este cuadro. Por último, valores menores a 2 ng/dl descartan esta patología41. La relación LH/FSH generalmente es mayor a 2 en los cuadros de SOPQ en pacientes delgadas34,41. En cambio en las obesas con SOPQ, este fenómeno es infrecuente34,41. Por esta razón, este índice no es utilizado como criterio diagnóstico, pero cuando existe, pudiera apoyar el diagnóstico de SOPQ. La explicación de este fenómeno aún no está definida. Por el contrario, en la amenorrea hipotalámica funcional los niveles de LH y FSH están normales o ligeramente disminuidos41. En la diferenciación entre SOPQ y la disfunción hipotalámica, como ambos son diagnósticos de exclusión, pudiera existir alguna superposición de exámenes. El planteamiento de una disfunción hipotalámica, en general, requiere descartar una posible patología orgánica32, lo cual hay que hacer mediante imagenología selar y supraselar. Sin embargo, esto requiere la aplicación de un criterio clínico, pues si la anovulación es de larga data probablemente el rendimiento de la imagenología será muy bajo41. De todas formas son indicaciones de imagenología selar y supraselar los siguientes casos32,41: 1) Paciente con amenorrea que presenta concentraciones bajas de LH y FSH (inferiores a 10 mUI/ml), para excluir una lesión de hipófisis o hipotálamo independiente de las concentraciones de prolactina. 2) Sospecha de “panhipopituitarismo”. La causa principal de esta alteración es la tumoral. Además, en estos casos, se justifica el estudio del eje somatotrópico, gonadotrópico, tiroideo, adrenal y prolactina. 3) Estudio de hiperprolactinemia. Finalmente siempre debemos recordar que la determinación de la etiología de la anovulación crónica, debe comenzar con la paciente, no con el laboratorio y debe facilitar un tratamiento racional. REFERENCIAS Leveno K (eds).Williams obstetricia. Cuarta Edición. Barcelona, Madrid, Paris, Milano, Asunción, Bogotá, Buenos Aires, Caracas, Lima, Lisboa, México, Montevideo, Río de Janeiro, San Juan de Puerto Rico, Santiago de Chile: Masson, 1996: 11-54. 4. FRASER I., SUNGURTEKIN U. Defining menstrual disturbances. In Maclean A., O’Brien P. (eds) study group on menstrual disorders. Royal College of Obstetricians and Gynaecologist 2000; 141-52. 5. BALLINGER C, BROWNING N, SMITH A. Hormonal profiles and psychological symptoms in perimenopausal women. Maturitas 1987; 9: 235-51. 6. PRENTICE A. Healthcare implications of dysfunctional uterine bleeding. In Smith, S.K.(ed) Dysfuntional 1. VILLASECA P, ARTEAGA E. Trastornos menstruales. En: Rodríguez J (ed). Endocrinología Clínica. Primera edición. Santiago, Chile: editorial Mediterráneo, 2000; 342-5. 2. YEN S. Ciclo menstrual humano: regulación neuroendocrina. En: Yen S, Jaffe R, Barbieri R (eds). Endocrinología de la reproducción. Cuarta edición. Buenos Aires, Bogotá, Caracas, Ciudad de México, Sáo Paulo: Editorial Panamericana, 2001; 203-31. 3. CUNNINGHAM F, MACDONALD P, GANT F, LEVENO K. embarazo revision y diagnnóstico. Función ovárica y ovulación. En: Cunningham F, Macdonald P, Gant F, 186 EVALUACIÓN 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. Uterine bleeding. Balière Tindall, London, England; 181-8. DUARTE CONTRERAS A. Hemorragia uterino disfuncional. En: Ginecología de la niña y de la adolescente. 1ª Edición. Colombia: Salvat Editores Colombiana SA, 1988; 373-86. DAWOOD Y, RAVNIKAR V, SCHNEIDER G, WARREN M. Managing dysfunctional uterine bleeding. Patient Care 1992; (Suppl): 2-11. SHAWKY ZA, ASHRAF R. Dysfunctional uterine bleeding in adolescent and teenage girls. Adolesc Pediatr Gynecol 1990; 3: 65-9. FRASER IS, MCCARRON G, MARKHAM R. A preliminary study of factors influencing perception of menstrual blood loss volume. Am J Obstet Gynecol 1984; 149: 788-93. RODRÍGUEZ G, FAUNDES LATHAM A, ATKINSON L. An approach to the analysis of menstrual patterns in the critical evaluation of contraceptives. Stud Fam Plann 1976; 7: 42-51. SNOWDEN R. Statistical analysis of menstrual bleeding patterns. J Biosoc Sci 1977; 9: 107-20. CHIMBIRA TH, ANDERSON ABM, TURNBULL AC. Relation between measured menstrual blood loss and patients’ subjective assessment of loss, duration of bleeding, number of sanitary towels used, uterine weight and endometrial surface area. Br J Obstet Gynaecol 1980; 87. 603-9. FRASER I, PEARCE SHEARMAN R ET AL. Efficacy of mefenamic acid in patients with a complaint of menorrhagia. Obstet Gynecol 1981; 58: 543-51. GRIMES DA. Estimating vaginal blood loss. J Reprod Med 1979; 22: 190-2. NEWTON J, BARNARD G, COLLINS W. A rapid method for measuring menstrual blood loss using automatic extraction. Contraception 1977; 16: 269-82. VASILENKO P, KRAICER PF, KAPLAN R, DE MASI A, FREED N. A new and simple method of measuring menstrual blood loss. J Reprod Med 1988; 33: 293-7. VAN EIJKEREN MA, CHRISTIAENS GCML, SIXMA JJ, HASPELS AA. Menorrhagia: a review. Obstet Gynecol Surv 1989; 44: 421-9. TREOLAR A, BOYNTON R, BEHN B ET AL. Variation of the human menstrual cycle throughout reproductive life. Int J Fertil 1967; 12: 77-126. VOLLMAN R. The menstrual Cycle. W.B. Saunders Philadelphia, United States, 1977; 193. RUBIN B, CROSIGNAMI P. Review and guidelines on dysfuntional uterine bleeding. Study group of the european society of human Reproduction and embriology. Hum Reprod 1990; 5: 637-8. FRASER IS, MCCARRON G, MARKHAM R, RESTA T. Blood and total fluid content of menstrual discharge. Obstet Gynecol 1985; 65: 194-8. CLÍNICA DE LA PACIENTE CON ANOVULACIÓN CRÓNICA 23. YEN S. Anovulación crónica causada por trastornos endocrinos periféricos. En: Yen S, Jaffe R, Barbieri R (eds). Endocrinología de la reproducción. Cuarta edición. Buenos Aires, Bogotá, Caracas, Ciudad de México, Sáo Paulo: Editorial Panamericana, 2001; 511-50. 24. HAYNES PJ, ANDERSON ABM, TURNBULL AC. Patterns of menstrual blood loss in menorrhagia. Res Clin Forums 1979; 1: 73-8. 25. AEDO S, ARROYO M, BASCUR G, CANO F, DORIAN J. Menorragia. Rev Obstet Ginecol Hosp Santiago Oriente Dr. Luis Tisné Brousse 2008; en prensa. 26. RUBIN B, CROSIGNANI PG. Review and guidelines on dysfunctional uterine bleeding. Study group of the European Society of Human Reproduction and Embryology. Hum Reprod 1990; 5(5): 637-8. 27. FRASER IS, SUNGURTEKIN U. Defining menstrual disturbances. In Maclean A, O’Brien PMS. Eds. Study Group on Menstrual Disorders. Royal College of Obstetricians and Gynaecologists, editorial, País, 141-152, 2000. 28. COWAN BD. Dysfunctional uterine bleeding: clues to eficacious approaches. In Alexander NJ, d’Arcangues C. Eds. Steroid Hormones and Uterine Bleeding. AAAS Press, Washington, 9-14, 1998. 29. REBAR RW. Hypergonadotropic amenorrhea and premature ovarian failure. A review. J Reprod Med 1982; 27: 179-86. 30. CONNER P, FRIED G. Hyperprolactinemia; etiology, diagnosis and treatment alternatives. Acta Obstet Gynecol Scand 1998; 77: 2489-262. 31. YEN S, JAFFE R. Prolactina en la reproducción humana. En: Yen S, Jaffe R, Barbieri R (eds). Endocrinología de la reproducción. Cuarta edición. Buenos Aires, Bogotá, Caracas, Ciudad de México, Sáo Paulo: Editorial Panamericana, 2001; 273-301. 32. YEN S, LAUGHLIN G. Anovulación debida a disfunción del eje Hipotálamo Hipófisis. En: Yen S, Jaffe R, Barbieri R (eds). Endocrinología de la reproducción. Cuarta edición. Buenos Aires, Bogotá, Caracas, Ciudad de México, Sáo Paulo: Editorial Panamericana, 2001; 511-50. 33. EHRMANN D. Polycystic Ovary Syndrome. N Engl J Med 2005; 352: 1223-36. 34. The rotterdam eshre/asrm-sponsored pcos consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertility and Sterility 2004; 81(4): 19-25. 35. CARMINA E, LOBO RA. Polycystic ovaries in hirsute women with normal menses. Am J Med 2001; 111: 602-6. 36. VERMEULEN A, VERDONCK L, KAUFMAN L. A critical evaluation of simple methods for the estimation of 187 Disponible en www.revistaobgin.cl REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2010; VOL 5 (2): 175-188 37. 38. 39. 40. free testosterone in serum the journal of clinical endocrinology & metabolism, 1999; 84(10): 3666-72. MONCADA LE. Familial study hirsutism. J Clin Endocr 1970; 31: 556-64. JONARD S, ROBERT Y, CORTET-RUDELLI C, PIGNY P, DECANTER C, DEWAILLY D. Ultrasound examination of polycystic ovaries: is it worth counting the follicles? Human Reproduction 2003; 18 (3): 598-603. AMER SAKS, LI TC, BYGRAVE C, SPRIGG A, SARAVELOS H AND COOKE ID. An evaluation of the inter-observer and intra-observervariability of the ultrasound diagnosis of polycystic ovaries. Hum Reprod 2002; 17: 1616-22. AHIMA R. Body Fat, Leptin, and Hypothalamic Amenorrhea. N Engl J Med 2004; 351(10): 959-62. 188 41. REBAR R. Evaluación práctica del estado hormonal. En: Yen S, Jaffe R, Barbieri R (eds). Endocrinología de la reproducción. Cuarta edición. Buenos Aires, Bogotá, Caracas, Ciudad de México, Sáo Paulo: Editorial Panamericana, 2001; 511-50. 42. MARSHALL WA, TANNER JM. Variations in patterns of puberal changes in girls. Arc Dis Chil 1969; 44: 291. 43. TAGATZ GE, KOHER RA, NAGEL TC, OKAGAKI T. The clitoral index: a bioassay of androgenic stimulation. Obstet Gynecol 1979; 54: 562. 44. AEDO S, PORCILE A, KLAASEN C. Hipotiroidismo primario subclínico y sus implicancias en obstetricia y ginecología. Rev Obstet Ginecol Hosp Santiago Oriente Dr. Luis Tisné Brousse 2007; 2(2): 164-71.