La `marca sináptica` y la huella de la memoria
Anuncio

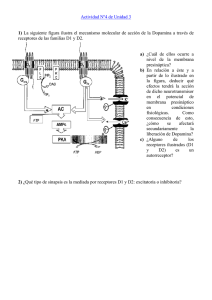
REVISIÓN EN NEUROCIENCIA La ‘marca sináptica’ y la huella de la memoria J. López-Rojas a, W. Almaguer-Melián b, J.A. Bergado-Rosado b LA ‘MARCA SINÁPTICA’Y LA HUELLA DE LA MEMORIA Resumen. Objetivo. Presentar una visión de las principales características y posible identidad de la marca sináptica, así como discutir algunas de sus implicaciones funcionales. Desarrollo. La potenciación sináptica a largo plazo, dadas sus características, se ha impuesto como un modelo sinapticocelular de memoria muy atractivo. De modo similar a la memoria, puede manifestarse como temprana (dependiente fundamentalmente de la modificación de proteínas preexistentes en la sinapsis) o tardía (dependiente de la síntesis de nuevas proteínas). Debido a que la potenciación sináptica a largo plazo es un fenómeno altamente específico, surge un dilema: ¿cómo llegan a las sinapsis apropiadas las proteínas requeridas para la estabilización del cambio plástico en una neurona que normalmente posee miles de contactos sinápticos, todos dependientes del mismo núcleo? En este trabajo se presentan algunos de los modelos que aportan posibles soluciones a este interrogante, haciendo énfasis en la hipótesis del marcaje sináptico. Se exponen los principales hallazgos que han ido conformando esta hipótesis y se analiza la síntesis local y la activación de proteincinasas como posibles candidatos de ser la marca sináptica. Adicionalmente, se discuten algunas implicaciones funcionales del marcaje sináptico. Conclusiones. La hipótesis de la marca sináptica ofrece una explicación muy flexible y razonable acerca de la especificidad del cambio sináptico duradero. Aunque se conocen algunas de sus características, la identidad de la marca no se ha dilucidado aún. Al parecer, existen múltiples marcas que, al ser reclutadas por estímulos específicos, median los efectos plásticos en diferentes dominios temporales. [REV NEUROL 2007; 45: 607-14] Palabras clave. LTP. Marca sináptica. Memoria. Proteincinasa. Sinapsis. Síntesis de proteínas. SINAPSIS Y MEMORIA Por lo esencial que resulta el aprendizaje, en especial por su valor adaptativo, desde tiempos muy remotos nos hemos sentido seducidos por tratar de comprender sus mecanismos fisiológicos y de qué modo podríamos modularlo en nuestro beneficio. Pero no ha sido hasta la segundad mitad del siglo XX cuando los avances tecnológicos y el conocimiento más preciso del funcionamiento del sistema nervioso han permitido comenzar a develar los posibles mecanismos que subyacen a los complejos procesos del aprendizaje y la memoria. Dado que no se producen grandes modificaciones en el número de neuronas a lo largo de la vida que puedan explicar los elevados volúmenes de información que se almacenan en forma de memoria, la sinapsis ha constituido un buen candidato de sustrato mnemónico [1]. La sinapsis es un tipo de unión celular sumamente especializada y constituye el sitio físico que sirve de puente principal para el paso de información de una neurona a otra, permitiendo que las diferentes partes del sistema interactúen funcionalmente [2]. Su importancia en los procesos de almacenamiento de la información se ha postulado desde la época de Ramón y Cajal y más recientemente en los trabajos de Hebb [3] y Matthies [4]. En este sentido, resulta imprescindible señalar además la importante contribución hecha por Bliss et al con la primera descripción detallada del fenómeno que hoy conocemos como potenciación sináptica a largo plazo –long-term potentiation (LTP)–, el cual consiste en un incremento sostenido de la eficacia de la transmisión sináptica tras estimular una vía Aceptado tras revisión externa: 23.02.07. a Departamento de Neurología Experimental, Instituto de Neurología y Neurocirugía (INN). b Departamento de Neurofisiología Experimental. Centro Internacional de Restauración Neurológica (CIREN). La Habana, Cuba. Correspondencia: Dr. Jeffrey López Rojas. Departamento de Neurología Experimental. Instituto de Neurología y Neurocirugía. Calle 29, n.º 139, esq. D. Vedado, Plaza. 10400 La Habana (Cuba). E-mail: erojas@infomed.sld.cu English version available in www.neurologia.com © 2007, REVISTA DE NEUROLOGÍA REV NEUROL 2007; 45 (10): 607-614 aferente con pulsos de corriente eléctrica de alta frecuencia [5, 6]. Como la LTP es un fenómeno dependiente de la actividad, que posee fases y es específico de las sinapsis activadas, y considerando además su carácter asociativo, su rápida inducción y su prolongada duración, este fenómeno se ha impuesto como un modelo sinapticocelular de memoria muy atractivo [7,8]. MARCA SINÁPTICA El conflicto de la especificidad La LTP, de manera similar a la memoria, puede manifestarse como temprana –early-LTP (E-LTP), de una duración inferior a 4 h– y tardía –late-LTP (L-LTP), de una duración superior a 4 h–. La forma temprana resulta fundamentalmente de la modificación de proteínas preexistentes en la sinapsis [9], mientras que la tardía es dependiente, tanto in vitro como in vivo, de la síntesis de nuevas proteínas [10,11], así como de la síntesis de nuevo ARN [12]. Tradicionalmente se ha considerado la región del soma celular como el sitio de mayor importancia en la síntesis macromolecular. De hecho, se ha demostrado in vitro que la estimulación tetánica de las colaterales de Schaffer a dendritas de CA1 separadas de sus somas sólo produce en ellas una LTP transitoria de aproximadamente 3 h, a diferencia de lo ocurrido en neuronas intactas al emplear el mismo patrón de tetanización, en las que se indujo una LTP de al menos 8 h de duración [13]. La LTP es un fenómeno altamente específico en el sentido de que el cambio producido en la eficacia de la transmisión se limita a las sinapsis que reciben la estimulación de alta frecuencia [14]. Esto es consistente con el papel que se supone que desempeñan cambios como la LTP en la formación de la memoria y genera una alta capacidad de almacenamiento de información. Sin embargo, la dependencia del cambio sináptico duradero y específico con el soma neuronal lleva al siguiente dilema: ¿cómo pueden llegar a las sinapsis apropiadas las proteínas que se han sintetizado en el cuerpo celular de una neurona que, normalmente, posee miles de contactos sinápticos, todos de- 607 J. LÓPEZ-ROJAS, ET AL pendientes del mismo núcleo? [7,15]. a b Hipótesis existentes para explicar la especificidad de los cambios plásticos duraderos Teóricamente es posible plantear al menos cuatro hipótesis para dar explicación a este interrogante: la hipótesis de la vía marcada, la hipótesis de la síntesis local, la hipótesis de la sensibilización y la hipótesis de la marca sináptica [7] (Fig. 1). La hipótesis de la vía marcada intenta explicar c d la especificidad sináptica de la L-LTP a partir de un elaborado tráfico intracelular de macromoléculas: a las proteínas recién sintetizadas se les asigna una ‘ruta sináptica’ que las conduce única y exclusivamente a las aferentes responsables de su inducción. Esta hipótesis parece ser poco probable que opere en una célula que, en el caso de una neurona típica de CA1, posee más de 10.000 contactos sinápticos [7,16] (Fig. 1a). Figura 1. Hipótesis que tratan de explicar la especificidad de los cambios sinápticos duraderos. a) Hipótesis de la vía La hipótesis de la sín- marcada: el cambio plástico duradero iniciado en una de las aferentes sinápticas genera una señal que viaja hacia el tesis local propone esen- núcleo, promoviendo la transcripción y traducción, y marca a su vez el camino que deben seguir las proteínas recién b) Hipótesis de la síntesis local: la maquinaria sintética necesaria para la traducción está presente en las cialmente que la especifi- sintetizadas; dendritas y es activada por la estimulación sináptica. Las proteínas sintetizadas localmente son responsables del cidad se logra como resul- cambio sináptico duradero; c) Hipótesis de la sensibilización: los factores plásticos se distribuyen a cada sinapsis intado de que las sinapsis, específicamente, alterando en ellas el umbral al cual la actividad sináptica (dígase el influjo de Ca2+) da lugar a camduraderos. Cuando pocos de los factores plásticos están presentes, permanece un alto umbral y un tétanos déuna vez activadas, adquie- bios bil sólo dará lugar a cambios transitorios, mientras que cuando éstos abundan, el umbral disminuye y se hace más fáren la capacidad de sinte- cil inducir una L-LTP; d) Hipótesis de la marca sináptica: las proteínas sintetizadas en el soma neuronal, y/o localmentizar y usar localmente las te, se distribuyen de forma difusa a través del árbol dendrítico, siendo capturadas y utilizadas sólo por las sinapsis ‘marcadas’. EFAF: estímulo fuerte de alta frecuencia; EDAF: estímulo débil de alta frecuencia. proteínas requeridas para el cambio plástico duradero [16] (Fig. 1b). Según la hipótesis de la sensibilización, la distribución de Utilizando una preparación in vitro de rodajas de hipocampo las macromoléculas necesarias para la estabilización del cambio (CA1) de rata con la posibilidad de estudiar dos aferentes sinápplástico (una vez inducida su síntesis) ocurre difusamente a las ticas independientes (S1 y S2) a una misma población neuronal, terminales sinápticas, alterando en ellas el umbral de estimula- Frey y Morris obtuvieron los siguientes resultados en sus experición que puede dar lugar a cambios duraderos (Fig. 1c). mentos pioneros sobre el tema: se indujo una L-LTP en S1 y 35 La hipótesis de la marca sináptica, establecida en 1997 por minutos más tarde se añadió al medio anisomicina (un inhibidor Frey y Morris a partir de sus experimentos, plantea que la selec- de la síntesis de proteínas). El bloqueo de la síntesis proteica en tividad se alcanza gracias al establecimiento, en las sinapsis es- este tiempo no tuvo influencia apreciable sobre la L-LTP en esta timuladas, de una marca capaz de capturar las proteínas vincu- aferencia. Se aplicó un tétanos idéntico 25 minutos después a S2, ladas al cambio plástico (a las que de un modo general, y referi- estando inhibida la síntesis proteica, y se logró establecer en esdo no sólo a moléculas de naturaleza proteica, denominaremos ta aferente una L-LTP de duración similar a la de S1. Esto consfactores plásticos), las cuales, según este modelo, se distribuyen tituyó un descubrimiento sorprendente porque, como se ha señainespecíficamente una vez sintetizadas a lo largo de las dendri- lado, la inducción de una L-LTP requiere la síntesis de nuevas tas (Fig. 1d). proteínas y la L-LTP en S2 se indujo estando inhibida dicha sín- 608 REV NEUROL 2007; 45 (10): 607-614 MARCA SINÁPTICA curso temporal de la marca sináptica y la dinámica intracelular de la síntesis y distribución de los factores plásticos, sin importar el orden en que ocurran estos eventos. Esta nueva relación descrita a raíz del descubrimiento de la marca sináptica amplió a horas la ventana temporal en la que una aferente sináptica puede ejercer influencias sobre otra, por lo que se denominó asociatividad tardía [7]. Con este trabajo, Frey y Morris se constituyeron en los primeros investigadores en aportar evidencia experimental directa y en hipotetizar, Figura 2. Diagrama que muestra los principales resultados obtenidos por Frey y Morris en sus experimentos pioneros de una manera concreta, acerca del marcaje sináptico, así como su interpretación: a) El bloqueo de la síntesis proteica durante la aplicación del sobre la marca sináptica. tétanos fuerte a S2, con 1 hora intertétanos, no impidió que se desarrollara una L-LTP en esta aferente; b) Al asociar Sin embargo, Matthies, dos tétanos fuertes con 3 horas de intervalo entre uno (S1) y otro (S2) e inhibir la síntesis proteica durante la aplicación del primer tétanos, sólo se produjo una E-LTP en S1; c) Un tétanos débil aplicado a S2 1 hora después de haber aplicaen los años setenta, ya do uno fuerte a S1, permitió el desarrollo de una L-LTP en esa aferencia. La simbología utilizada es similar a la de la figuhabía esbozado la idea ra 1. EFAF: estímulo fuerte de alta frecuencia; EDAF: estímulo débil de alta frecuencia; SP: síntesis proteica. de la marca [1]. También de forma previa a los extesis. Ello resultas incompatible con las hipótesis de la vía mar- perimentos de Frey, Sossin había publicado un trabajo en el que cada y de la síntesis local (aunque sobre esta última discutiremos hacía un detallado análisis teórico de los posibles mecanismos más adelante) y se interpretó por los autores como expresión del que garantizan la especificidad en los cambios sinápticos duramarcaje sináptico: una marca generada en S2 a consecuencia de deros, concluyendo en su razonamiento que requieren de marla actividad sináptica (tétanos fuerte) permitió la captura de las cas sinápticas que identifiquen a las sinapsis activadas. Dentro proteínas que se habían inducido previamente (Fig. 2a). de los mecanismos que trata, incluye lo que él denomina el ‘moEn el experimento siguiente se tetanizó S1 en presencia de delo de activación’: los factores plásticos se envían a todas las anisomicina, se lavó posteriormente el medio y se aplicó, tres sinapsis en la neurona, pero su activación, y por tanto su acción, horas después del tétanos, a S1, un tétanos fuerte a S2. Se obtu- está circunscrita sólo a sinapsis específicas. Siguiendo esta idea, vo una L-LTP en S2, pero sólo una E-LTP en S1. Este resultado Sossin propuso algunos ejemplos: sugiere que la marca se establece de modo transitorio por un – Si los ARNm constituyeran los factores plásticos, entonces tiempo no mayor de cuatro horas, pues las proteínas sintetizasu traducción podría modularse selectivamente en cada sidas producto del tétanos fuerte a S2 no permitieron estabilizar napsis dependiendo de su estado de activación. la LTP de S1 (Fig. 2b). – Si los factores plásticos fuesen proteínas, éstas podrían reFinalmente, se tetanizó S1 y una hora después se aplicó un querir fosforilación o proteólisis para su activación, por lo tétanos débil (capaz por sí solo de inducir una E-LTP) a S2. Se que podrían transportarse inactivas y sólo procesarse en las logró el establecimiento de una L-LTP en ambas aferentes. Este sinapsis que posean activas las cinasas o proteasas necesaexperimento indica, junto al ilustrado en la figura 2a, que tanto rias para su procesamiento. un tétanos fuerte (capaz de producir una L-LTP) como uno débil (capaz de producir una E-LTP) pueden generar una marca en Sossin considera adicionalmente que la marca podría ser alguna las terminales sinápticas que lo reciben [14] (Fig. 2c). molécula, o conjunto de ellas, presente en las sinapsis activas Aunque los resultados hasta aquí descritos pueden interpre- capaz de interactuar específicamente con otra u otras presentes tarse bajo la óptica de la hipótesis del marcaje sináptico, es inte- en determinadas vesículas encargadas del transporte y direccioresante notar que la hipótesis de la sensibilización también po- namiento de los factores plásticos, actuando en este caso la mardría explicar lo ocurrido. No obstante, experimentos posteriores ca como un sumidero de factores plásticos [18]. mostraron que era la marca, y no la sensibilización, la hipótesis correcta [17], pues según la sensibilización, la asociación de un LTD y marca sináptica tétanos débil con uno fuerte, en ese orden, no debe producir la La depresión sináptica a largo plazo –long-term depression (LTD)– consolidación de la E-LTP inducida por el tétanos débil. Sin es análoga a la LTP en muchos sentidos: ambas dependen de la embargo, la hipótesis de la marca predice que la estabilización activación de los receptores NMDA para su inducción [19,20], de una E-LTP en L-LTP estará en función de la intersección del tienen cursos temporales similares, las dos requieren de la síntea REV NEUROL 2007; 45 (10): 607-614 b c 609 J. LÓPEZ-ROJAS, ET AL sis de proteínas para su estabilización a largo plazo [10,21] y se consideran como correlatos celulares de los procesos de aprendizaje y memoria [22]. Adicionalmente en la LTD, y de modo similar a como ocurre en la LTP, se observan los fenómenos de asociatividad tardía y del marcaje sináptico [23]. ‘Diálogo entre marcas’ Recientemente se ha comunicado que existe una relación de asociatividad tardía LTP-LTD (denominada ‘cross-tagging’), que muestra que la inducción de una L-LTP (L-LTD) en una aferencia es capaz de transformar a su opuesto: una E-LTD (E-LTP) inducida en otra aferencia a su forma tardía [23]. Esto trae consigo el siguiente interrogante: ¿se usan las mismas proteínas para la estabilización de una L-LTP y una L-LTD o se usan algunas, dentro de todas las que se inducen, de modo específico por cada proceso en particular? Los resultados obtenidos apuntan a que dentro de las proteínas sintetizadas existen algunas que son utilizadas específicamente por uno de los dos procesos, como es el caso de la proteincinasa C en su forma Mζ necesaria para el mantenimiento de la L-LTP, pero no de la L-LTD [24], aunque probablemente existen otras, como la fosfodiesterasa tipo 4B3, que son utilizadas indistintamente por ambos [25,26]. Duración de la marca sináptica Frey y Morris, en su primera comunicación, habían mostrado que en rodajas de hipocampo a 32 oC la marca sináptica desaparece entre 3 y 4 horas después de aplicar el tétanos que le dio origen [14]. En ensayos posteriores complementaron este resultado mostrando que después de la primera hora la marca comienza a desaparecer, y se extingue entre las 2 y 4 horas de su establecimiento [17]. Por otra parte, estudios en modelos más sencillos han arrojado resultados similares [15], y en cuanto a la LTD, se ha mostrado que la marca sináptica desaparece antes de las 2 horas de su inducción [23]. Pero, ¿el declive de la marca sináptica depende exclusivamente del tiempo o su desaparición se relaciona también con la actividad? Sajikumar et al [27] fueron los primeros en aportar evidencia acerca de la influencia de la actividad sobre la marca sináptica, demostrando que la estimulación de baja frecuencia (EBF), aplicada homosinápticamente 5 minutos después de un tétanos débil, es capaz de borrarla. Posteriormente se ampliaron estos resultados y se mostró que también la EBF aplicada homo o heterosinápticamente 10 minutos previos a un tétanos impide el establecimiento de la marca sináptica [28]. Competencia por los factores plásticos En el año 2004 se publicaron una serie de experimentos muy interesantes, realizados en rodajas de hipocampo (CA1) de rata. En ellos se indujo asociativamente una L-LTP en dos aferentes independientes de una población neuronal y a las 4 horas se aplicó al medio un inhibidor de la síntesis de proteínas. Posteriormente, estando inhibida la síntesis proteica, se tetanizó por segunda vez una de las vías (V1) y se observó que la potenciación adicional de ésta (V1) ocurrió a expensas de un decremento de la LTP en la vía no estimulada (V2), lo cual fue interpretado por los autores como expresión de una competencia entre las sinapsis activadas por los factores plásticos, fenómeno que denominaron ‘mantenimiento competitivo’. Se demostró, además, que un estímulo de reactivación más fuerte provocaba una mayor competencia [29]. 610 En conjunto, estos resultados sugieren que los sitios sinápticos necesitan un continuo recambio de los factores plásticos estabilizadores o que la unión de estos es reversible, que la interacción marca-factores plásticos prolonga el tiempo de existencia de la marca, y que según la fuerza del tétanos se induce mayor o menor cantidad (o afinidad) de la marca en las sinapsis estimuladas, así como que en situaciones de escasa síntesis proteica las sinapsis estimuladas compiten por los factores plásticos [30]. Características generales de la marca sináptica Los resultados expuestos hasta aquí permiten hacer algunas generalizaciones sobre las características de la marca sináptica: – Después de un tétanos capaz de inducir una E-LTP o L-LTP (E-LTD o L-LTD), la marca sináptica se establece con una probabilidad muy alta y supuestamente casi de manera inmediata [17,27]. – De acuerdo con la fuerza del tétanos utilizado, parece inducirse mayor o menor cantidad (o afinidad por los factores plásticos) de la marca sináptica [29]. – Distintas marcas se generan como consecuencia de la inducción de una LTP o LTD [23,31]. – El establecimiento de la marca sináptica es un proceso independiente de la síntesis proteica [14,17]. – La marca sináptica presumiblemente identifica determinadas proteínas entre todas las que son inducidas producto de una L-LTP o L-LTD, pero fuera de esto, la relación marcaproteína es promiscua, pudiendo la marca capturar proteínas sintetizadas en respuesta a la actividad en otra sinapsis [7,14]. – El establecimiento de la marca probablemente involucra procesos transitorios como la fosforilación de proteínas preexistentes, ya que ésta tiene un curso temporal limitado de menos de 4 horas en rodajas de hipocampo de rata a 32 ºC [14,17], aunque existen evidencias de que la interacción marca-proteínas puede prolongar el tiempo de existencia de la marca sináptica [29]. – El proceso de declive de la marca no sólo depende del tiempo, sino que además depende de la actividad [27,28]. A pesar de todo lo que conocemos acerca de la marca sináptica, su identidad aún constituye un enigma no resuelto que ha interesado a muchos. NATURALEZA DE LA MARCA SINÁPTICA Identidad de la marca sináptica Las evidencias acerca de la existencia de la marca sináptica han provocado una oleada de intensos esfuerzos dirigidos a su identificación. Los candidatos propuestos son muchos e incluyen: proteincinasas, cambios en las moléculas de adhesión en las sinapsis, alteraciones en el citoesqueleto, activación o tráfico de canales y síntesis local de proteínas [32]. Síntesis local Generalmente se asume que el soma representa el principal sitio de síntesis macromolecular en la neurona y que las sinapsis dependen de ésta para su funcionamiento. Como ya mencionamos, existen experimentos que apoyan esta dependencia, pero hace algunos años han aparecido nuevas experiencias que muestran el papel no despreciable de los procesos locales en los cambios plásticos [33-35]. REV NEUROL 2007; 45 (10): 607-614 MARCA SINÁPTICA La capacidad de fracciones sinápticas separadas de sus somas de mantener la síntesis proteica de novo se describió hace ya aproximadamente 30 años [36,37]. Recientemente, mediante análisis inmunohistoquímicos detallados, se ha corroborado la presencia de cada uno de los componentes de la maquinaria traductora en las cercanías de los sitios postsinápticos [38,39] y se ha identificado un gran número de ARNm en las dendritas [40]. Más aún, se ha demostrado que la estimulación sináptica provoca el aumento de la síntesis proteica local [41,42]. La evidencia experimental indica que la actividad sináptica puede activar componentes de la maquinaria de síntesis proteica a través de la fosforilación de factores de traducción específicos [43,44]. Asimismo es interesante notar que existe un incremento marcado del porcentaje de espinas dendríticas que contienen polirribosomas después de la inducción de una LTP [45] y que la despolarización puede conllevar la liberación local de ARNm desde los gránulos en los que se encuentra en un estado traduccionalmente silente hacia el conjunto de polisomas activos [46]. Además, existen experiencias que muestran que el ARN sintetizado de novo puede dirigirse específicamente hacia las sinapsis activas, como es el caso del ARNm Arc [47]. De la síntesis local se han derivado numerosas teorías para tratar de dar una explicación a la especificidad de los cambios sinápticos duraderos y al fenómeno de asociatividad tardía. La más tradicional plantea que la síntesis y uso local de las proteínas vinculadas con el cambio plástico ocurre específicamente en las sinapsis estimuladas. Esta hipótesis no logra explicar satisfactoriamente el fenómeno de asociatividad tardía. Por su parte, Biltzer et al [48] tienen una hipótesis interesante; ellos asocian el marcaje sináptico con la liberación de ARNm desde los gránulos en los que se encuentra en un estado traduccionalmente inactivo. Según este modelo, el ARNm liberado incluiría (adicionalmente a los relacionados con el cambio plástico) transcriptos que codifiquen para algún componente limitante o activador de la maquinaria traductora, aunque estos ARNm quedarán sin traducirse y, por tanto, la LTP inducida tendrá un corto curso temporal (E-LTP), a menos que se logre activar la síntesis proteica local dentro de una ventana de tiempo adecuada. De esta manera sería posible explicar la asociatividad tardía sobre la base de que un tétanos fuerte, además de producir el marcaje sináptico, sería capaz de activar la síntesis local en la aferente que lo recibe. Esto provocaría un incremento adicional de la capacidad sintética en la sinapsis por la presencia de las proteínas reguladoras de la traducción recién sintetizadas, las cuales podrían también difundir hacia otras terminales y ser ‘capturadas’ por algunas de las estimuladas débilmente en una adecuada ventana temporal, promoviendo en ellas la traducción de los ARNm previamente liberados en su cercanía. Asimismo, se propone que la dirección del cambio sináptico se relacionaría con la identidad de los ARNm que se liberen en respuesta a la estimulación [48]. A pesar de que el modelo concuerda con la concepción general de que la generación de la marca es independiente de la síntesis de proteínas, de todos modos entra en contradicción con los experimentos de Frey, pues se hace necesario que se traduzcan los ARNm liberados para que las sinapsis estimuladas débilmente puedan expresar potenciación duradera y Frey muestra, en sus experimentos de asociatividad tardía, que las sinapsis débilmente estimuladas se potencian aun en presencia de anisomicina aplicada hasta una hora después del tétanos débil (habiendo probado además que la anisomicina aplicada 35 minutos después de un tétanos fuerte no impide la expresión de una L-LTP REV NEUROL 2007; 45 (10): 607-614 en la aferente que lo recibe). No obstante, es interesante notar que según el modelo de Blitzer, en las sinapsis que son fuertemente estimuladas se activa de forma directa la síntesis local, mientras que en las estimuladas débilmente la activación traduccional se logra de un modo diferente, por lo que no tienen que ser necesariamente iguales los tiempos límite en la dependencia con la síntesis proteica. Sería importante verificar si inhibiendo la síntesis proteica durante todo el tiempo que permanece la marca se logra también la captura de las proteínas por las sinapsis débilmente estimuladas. Por otra parte, experimentos realizados por Casadio et al [49] insinúan que la síntesis local puede funcionar como una marca requerida para la ‘estabilización tardía’ del cambio sináptico, lo cual sugiere que podría ser también necesaria como marca sináptica en neuronas hipocampales si se examinaran los resultados de la LTP en un período más extenso del que habitualmente se evalúa [15]. No obstante toda la evidencia y los modelos propuestos, la relación marca sináptica-síntesis local requerirá de investigaciones futuras para su mayor esclarecimiento. Proteincinasas. PKA. CAMK Las proteincinasas se han vinculado al marcaje sináptico aun desde antes que Frey y Morris mostraran con certeza la autenticidad de la hipótesis de la marca sináptica [1,18]. Su activación puede constituir un mecanismo que permita a las sinapsis ‘recordar’ la actividad sináptica previa de un modo espacial y temporalmente restringido, lo cual constituye un requisito a cumplir por cualquier candidato a marca sináptica [32]. Aunque muchos estudios han demostrado que la proteincinasa A (PKA) es necesaria para la expresión de la L-LTP, el papel de la PKA en la E-LTP está menos dilucidado [50]. Especial importancia se ha dado a la expresión génica, y la consecuente síntesis proteica, mediada por CREB (cyclic AMP responsible element binding protein), producto de la activación de la PKA para la consolidación de una E-LTP a L-LTP [51]. Barco et al [52] han mostrado experimentalmente una nueva arista de la PKA (antes sugerida por Casadio et al [49]): es un elemento crítico en el marcaje sináptico. Estos hallazgos fueron corroborados más tarde por Young et al [28], quienes mostraron que la EBF es capaz de borrar la marca sináptica y en un trabajo recientemente publicado sugieren además que esta acción de la EBF se debe a que interfiere la vía de señalización AMPc/PKA. Asimismo prueban, utilizando herramientas farmacológicas, electrofisiológicas y genéticas, que la PKA está involucrada en el marcaje sináptico [53]. Posteriormente, estos resultados se extendieron y se probó que inhibiendo farmacológicamente el anclaje de la PKA a través de las AKAP (A-kinase anchoring proteins), se logra impedir la expresión de la L-LTP en rodajas de hipocampo, así como reprimir el fenómeno de asociatividad tardía. Sin embargo, el inhibidor farmacológico usado bloquea la interacción de la PKA con la mayoría de las AKAP, por lo se necesitarán ensayos con mayor especificidad que permitan dilucidar la identidad de las AKAP involucradas en este fenómeno [54]. Numerosas AKAP se han implicado en el anclaje de la PKA, junto a otras cinasas y fosfatasas, a proteínas sinápticas tales como receptores NMDA y AMPA, cuya función en los procesos plásticos es crucial [55,56]. Así, el reclutamiento de la PKA a microdominios específicos a través de las AKAP constituye un proceso cuyo posterior estudio podría arrojar nueva luz acerca 611 J. LÓPEZ-ROJAS, ET AL de la especificidad de los cambios plásticos y de la naturaleza del marcaje sináptico. La CAMKII representa el 1-2% de las proteínas totales presentes en el cerebro y es la proteína principal en la densidad postsináptica (PSD) [57]. Recientemente se ha demostrado el papel protagonista de la CAMKII en el marcaje sináptico de la LTP, pero no de la LTD, así como que la MAPK es necesaria para el establecimiento de la marca en la LTD, pero no en la LTP [31]. La importancia de la CAMKII en la inducción de la LTP se ha documentado bien y se ha propuesto, además, como candidata a mediar efectos a más largo plazo [57]. No obstante, su posible influencia sobre el mantenimiento de la LTP no está clara [58]. Tras la entrada de Ca2+ a la célula producto de la activación de los receptores NMDA, la concentración de la CAMKII aumenta de forma considerable en las sinapsis estimuladas, específicamente en la PSD, sitio en el que se acopla a los receptores NMDA [59]. Esta unión de la CAMKII al receptor NMDA hace que permanezca activa aun después de la disociación de la calcio/calmodulina [60]. La CAMKII activada, una vez en la PSD, promueve procesos enzimáticos y estructurales que incrementan la conductancia y el número de los canales AMPA [57], cambios asociados al incremento en la transmisión sináptica que subyace en la inducción de la LTP. Recientemente, Hudmon et al [61] propusieron un nuevo mecanismo para el envío de la CAMKII hacia la PSD tras la activación neuronal: la autoasociación. Argumentaron, además, que la CAMKII podría formar un andamio que, en combinación con otras proteínas sinápticas, reclute nuevas proteínas hacia la PSD. MARCA SINÁPTICA IN VIVO Todos los estudios concernientes a la marca sináptica que hasta aquí hemos referido se han realizado en preparaciones in vitro. Aunque estos experimentos ofrecen grandes ventajas desde el punto de vista técnico, no se debe obviar que se realizan en condiciones artificiales, por lo que se hace necesario contar con modelos in vivo. Recientemente, Hassan et al [62] presentaron una técnica que permite activar dos aferentes sinápticas independientes de la misma población neuronal en animales con libre movimiento, lo cual es un prerrequisito para el estudio de la marca sináptica in vivo de un modo similar al que se ha estudiado in vitro. No obstante, evidencias de que el marcaje sináptico ocurre en organismos intactos existen desde que se realizaron experimentos para investigar la influencia de estímulos emocionales/motivacionales sobre la LTP. Así, una E-LTP puede extenderse o reforzarse si, en una ventana temporal de aproximadamente 30 minutos después de inducido el cambio plástico, se permite beber a animales privados de agua por 24 horas [63,64]. Estudios posteriores de nuestro laboratorio han mostrado que el reforzamiento conductual es dependiente de la síntesis de proteínas [65], que está mediado por la amígdala basolateral [66] (la estimulación de la cual mimetiza el reforzamiento motivacional [67]), que es impedido por la desaferentación subcortical del hipocampo [68] y que la aplicación intraventricular de norepinefrina logra reforzar la LTP de modo similar a lo observado con él [69]. Todos estos resultados, si bien no son pruebas directas de la existencia de la marca sináptica, constituyen evidencias positivas en su favor ya que todos pueden interpretarse lógicamente en el marco de esta hipótesis. Así, el tétanos débil inductor de la E-LTP sería el responsable del establecimiento de la marca en 612 las sinapsis activadas. Luego, la síntesis de proteínas inducida por los estímulos reforzadores (dar de beber a animales privados de agua, estimular la amígdala, administrar norepinefrina intraventricularmente) permitiría a las sinapsis marcadas capturar las proteínas necesarias para que la LTP se prolongue más allá de las 4 horas. Resulta interesante notar que estos estudios in vivo en los que una E-LTP se transforma en L-LTP por estimulación de aferencias moduladoras o manipulaciones conductuales, sugieren que la marca decae en menos de 1 hora [63,67], resultado que concuerda con los obtenidos in vitro teniendo en cuenta que las rodajas se incuban a 32 ºC, mientras que la temperatura en los animales intactos es de aproximadamente 38 ºC, por lo que es lógico esperar que la duración sea menor. Resulta necesario destacar también el resultado de investigaciones recientes realizadas in vivo que apoyan la idea, sostenida desde hace años, de que como resultado del aprendizaje y la memoria se inducen en el hipocampo procesos muy semejantes a la LTP [70-72]. En estos procesos inducidos ‘naturalmente’ podría operar el marcaje sináptico de modo similar a como lo hace en la LTP inducida ‘artificialmente’. Por otra parte, aunque se discute la participación de la LTP en otras estructuras pertenecientes al engrama asociado a la memoria [73], el mecanismo general que involucra activación de receptores, activación de proteincinasas y síntesis de nuevas proteínas responsables de la estabilización de los cambios plásticos parece ser universal [74]. Luego, el destino de estas proteínas recién sintetizadas podría ser determinado también en estas estructuras por alguna de las variantes del marcaje sináptico. ALGUNAS IMPLICACIONES FUNCIONALES DE LA MARCA SINÁPTICA La hipótesis de la marca sináptica podría aportar una explicación de por qué eventos inconsecuentes, o que ordinariamente sólo recordamos de forma transitoria, se recuerdan mejor cuando ocurren temporalmente cercanos a algún otro de un fuerte contenido motivacional/emocional [17]. Sin embargo, a la vez, genera algunas contradicciones porque estímulos débiles podrían estabilizarse indiscriminadamente a costa de estímulos fuertes. Este problema se acentúa si tenemos en cuenta que la propagación de la estabilización puede ocurrir de manera temporal: los estímulos débiles no tienen que estar tan cerca temporalmente del fuerte, y espacialmente, los estímulos débiles pueden aplicarse a sinapsis distantes de aquellas a las que se les aplicó el estímulo fuerte. Parece contraproducente que esta promiscuidad opere como mecanismo de almacenamiento de memoria [30]. No obstante, además de las relaciones de asociatividad y cooperación descritas, existe una competencia por los factores estabilizadores entre las sinapsis activadas en condiciones de escasa síntesis de proteínas [29]. Esta competencia y la modulación homo y heterosináptica que puede ejercer la actividad sobre otras sinapsis conformarían algunos de los mecanismos de control utilizados por la neurona para integrar eficazmente sus aferencias. CONCLUSIONES La hipótesis de la marca sináptica ofrece una explicación muy flexible y razonable acerca de la especificidad del cambio sináptico duradero, constituyendo hasta hoy la más aceptada y difundida. REV NEUROL 2007; 45 (10): 607-614 MARCA SINÁPTICA Como hemos discutido, existen numerosos candidatos moleculares de marca sináptica. Sin embargo, hoy se cree que no existe una única clase de marca, sino múltiples, que al ser reclutadas por estímulos específicos, median los efectos plásticos en diferentes dominios temporales [32]. El conocimiento que logremos acerca del fenómeno del marcaje sináptico y su regulación podría resultar de gran importancia teórica y de utilidad práctica no sólo en lo concer- niente a la memoria, sino también a la recuperación funcional después de lesiones [75]. Conociendo a fondo los mecanismos de marcaje sináptico y su curso temporal se podrían prolongar cambios plásticos de interés asociándolos eficazmente a estímulos motivacionales, con el objetivo de hacerlos perdurables, o bien, a través de manipulaciones específicas, borrar la marca de aquellos eventos cuya preservación sea perjudicial para el individuo. BIBLIOGRAFÍA 1. Matthies H. Neurobiological aspects of learning and memory. Annu Rev Psychol 1989; 40: 381-404. 2. Kandel ER, Siegelbaum SA. Overview of synaptic transmission. In Kandel ER, Schwartz JH, Jessell TM, eds. Principles of neural science. New York: McGraw-Hill, Health Professions Division; 2000. p. 175-86. 3. Hebb DO. The organization of behaviour. New York: Wiley & Sons; 1949. 4. Matthies H. Cellular mechanisms of learning processes and the shaping of memory. Z Psychol 1976; 184: 308-28. 5. Bliss TV, Lomo T. Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. J Physiol (Lond) 1973; 232: 331-56. 6. Bliss TV, Gardner-Medwin AR. Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path. J Physiol (Lond) 1973; 232: 357-74. 7. Frey U, Morris RGM. Synaptic tagging: implications for late maintenance of hippocampal long-term potentiation. Trends Neurosci 1998; 21: 181-8. 8. Almaguer-Melián W, Bergado-Rosado JA. Interacciones entre el hipocampo y la amígdala en procesos de plasticidad sináptica. Una clave para entender las relaciones entre motivación y memoria. Rev Neurol 2002; 35: 586-93. 9. Goelet P, Castellucci VF, Schacher S, Kandel ER. The long and the short of long-term memory –a molecular framework. Nature 1986; 322: 419-22. 10. Krug M, Lössner B, Ott T. Anisomycin blocks the late phase of longterm potentiation in the dentate gyrus of freely moving rats. Brain Res Bull 1984; 13: 39-42. 11. Frey U, Krug M, Reymann KG, Matthies H. Anisomycin, an inhibitor of protein synthesis, blocks late phases of LTP phenomena in the hippocampal CA1 region in vitro. Brain Res 1988; 452: 57-65. 12. Frey U, Frey S, Schollmeier F, Krug M. Influence of actinomycin D, a RNA synthesis inhibitor, on long-term potentiation in rat hippocampal neurons in vivo and in vitro. J Physiol 1996; 490: 703-11. 13. Frey U, Krug M, Brödemann R, Reymann K, Matthies H. Long-term potentiation induced in dendrites separated from rat’s CA1 pyramidal somata does not establish a late phase. Neurosci Lett 1989; 97: 135-9. 14. Frey U, Morris RGM. Synaptic tagging and long-term potentiation. Nature 1997; 385: 533-6. 15. Martin KC. Synaptic tagging during synapse-specific long-term facilitation of aplysia sensory-motor neurons. Neurobiol Learn Mem 2002; 78: 489-97. 16. Schuman EM. Synapse specificity and long-term information storage. Neuron 1997; 18: 339-42. 17. Frey U, Morris RGM. Weak before strong: dissociating synaptic tagging and plasticity-factor accounts of late-LTP. Neuropharmacology 1998; 37: 545-52. 18. Sossin WS. Mechanisms for the generation of synapse specificity in long-term memory: the implications of a recruitment for transcription. TINS 1996; 19: 215-8. 19. Bear MF, Malenka RC. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol 1994; 4: 389-99. 20. Hrabetova S, Sacktor TC. Long-term potentiation and long-term depression are induced through pharmacologically distinct NMDA receptors. Neurosci Lett 1997; 226: 107-10. 21. Sajikumar S, Frey JU. Anisomycin inhibits the late maintenance of long-term depression in rat hippocampal slices in vitro. Neurosci Lett 2003; 338: 147-50. 22. Malenka RC, Bear MF. LTP and LTD: an embarrassment of riches. Neuron 2004; 44: 5-21. 23. Sajikumar S, Frey JU. Late-associativity, synaptic tagging, and the role of dopamine during LTP and LTD. Neurobiol Learn Mem 2004; 82: 12-25. 24. Sajikumar S, Navakkode S, Sacktor TC, Frey JU. Synaptic tagging and cross-tagging: the role of protein kinase Mzeta in maintaining long-term potentiation but not long-term depression. J Neurosci 2005; 25: 5750-6. 25. Ahmed T, Frey JU. Expression of the specific type IV phosphodiesterase REV NEUROL 2007; 45 (10): 607-614 gene PDE4B3 during different phases of long-term potentiation in single hippocampal slices of rats in vitro. Neuroscience 2003; 117: 627-38. 26. Navakkode S, Sajikumar S, Frey JU. The type IV-specific phosphodiesterase inhibitor rolipram and its effect on hippocampal long-term potentiation and synaptic tagging. J Neurosci 2004; 24: 7740-4. 27. Sajikumar S, Frey JU. Resetting of ‘synaptic tags’ is time- and activitydependent in rat hippocampal CA1 in vitro. Neuroscience 2004; 129: 503-7. 28. Young JZ, Nguyen PV. Homosynaptic and heterosynaptic inhibition of synaptic tagging and capture of long-term potentiation by previous synaptic activity. J Neurosci 2005; 25: 7221-31. 29. Fonseca R, Nägerl UV, Morris RG, Bonhoeffer T. Competing for memory: hippocampal LTP under regimes of reduced protein synthesis. Neuron 2004; 44: 1011-20. 30. Turrigiano G. A competitive game of synaptic tag. Neuron 2004; 44: 903-4. 31. Reymann KG, Frey JU. The late maintenance of hippocampal LTP: requeriments, phases, ‘synaptic tagging’, ‘late-associativity’ and implications. Neuropharmacology 2007; 42: 24-40. 32. Martin KC, Kosik KS. Synaptic tagging –who’s it? Nat Rev Neurosci 2002; 3: 813-20. 33. Vickers CA, Dickson KS, Wyllie DJ. Induction and maintenance of late-phase long-term potentiation in isolated dendrites of rat hippocampal CA1 pyramidal neurones. J Physiol 2005; 568: 803-13. 34. Cracco JB, Serrano P, Moskowitz SI, Bergold PJ, Sacktor TC. Protein synthesis-dependent LTP in isolated dendrites of CA1 pyramidal cells. Hippocampus 2005; 15: 551-6. 35. Bradshaw KD, Emptage NJ, Bliss TV. A role for dendritic protein synthesis in hippocampal late LTP. Eur J Neurosci 2003; 18: 3150-2. 36. Autilio LA, Appel SH, Pettis P, Gambetti PL. Biochemical studies of synapses in vitro. I. Protein synthesis. Biochemistry 1968; 7: 2615-22. 37. Morgan IG, Austin L. Synaptosomal protein synthesis in a cell-free system. J Neurochem 1968; 15: 41-51. 38. Tiedge H, Brosius J. Translational machinery in dendrites of hippocampal neurons in culture. J Neurosci 1996; 16: 7171-81. 39. Pierce JP, Van Leyen K, McCarthy JB. Translocation machinery for synthesis of integral membrane and secretory proteins in dendritic spines. Nat Neurosci 2000; 3: 311-3. 40. Zhong J, Zhang T, Bloch LM. Dendritic mRNAs encode diversified functionalities in hippocampal pyramidal neurons. BMC Neurosci 2006; 7: 17. 41. Ouyang Y, Rosenstein A, Kreiman G, Schuman EM, Kennedy MB. Tetanic stimulation leads to increased accumulation of Ca(2+)/calmodulin-dependent protein kinase II via dendritic protein synthesis in hippocampal neurons. J Neurosci 1999; 19: 7823-33. 42. Tsokas P, Grace EA, Chan P, Ma T, Sealfon SC, Iyengar R, et al. Local protein synthesis mediates a rapid increase in dendritic elongation factor 1A after induction of late long-term potentiation. J Neurosci 2005; 25: 5833-43. 43. Khan A, Pepio AM, Sossin WS. Serotonin activates S6 kinase in a rapamycin-sensitive manner in Aplysia synaptosomes. J Neurosci 2001; 21: 382-91. 44. Huang YS, Jung MY, Sarkissian M, Richter JD. N-methyl-D-aspartate receptor signaling results in Aurora kinase-catalyzed CPEB phosphorylation and alpha CaMKII mRNA polyadenylation at synapses. EMBO J 2002; 21: 2139-48. 45. Ostroff L, Fiala J, Allwardt B, Harris K. Polyribosomes Redistribute from dendritic shafts into spines with enlarged synapses during LTP in developing rat hippocampal slices. Neuron 2002; 35: 535-45. 46. Krichevsky AM, Kosik KS. Neuronal RNA granules: a link between RNA localization and stimulation-dependent translation. Neuron 2001; 32: 683-96. 47. Steward O, Worley P. Local synthesis of proteins at synaptic sites on dendrites: role in synaptic plasticity and memory consolidation? Neurobiol Learn Mem 2002; 78: 508-27. 48. Blitzer RD, Iyengar R, Landau EM. Postsynaptic signaling networks: 613 J. LÓPEZ-ROJAS, ET AL cellular cogwheels underlying long-term plasticity. Biol Psychiatry 2005; 57: 113-9. 49. Casadio A, Martin KC, Giustetto M, Zhu H, Chen M, Bartsch D, et al. A transient, neuron-wide form of CREB-mediated long-term facilitation can be stabilized at specific synapses by local protein synthesis. Cell 1999; 99: 221-37. 50. Nguyen PV, Woo NH. Regulation of hippocampal synaptic plasticity by cyclic AMP-dependent protein kinases. Prog Neurobiol 2003; 71: 401-37. 51. Impey S, Mark M, Villacres EC, Poser S, Chavkin C, Storm DR. Induction of CRE-mediated gene expression by stimuli that generate longlasting LTP in area CA1 of the hippocampus. Neuron 1996; 16: 973-82. 52. Barco A, Alarcón JM, Kandel ER. Expression of constitutively active CREB protein facilitates the late phase of long-term potentiation by enhancing synaptic capture. Cell 2002; 108: 689-703. 53. Young JZ, Isiegas C, Abel T, Nguyen PV. Metaplasticity of the latephase of long-term potentiation: a critical role for protein kinase A in synaptic tagging. Eur J Neurosci 2006; 23: 1784-94. 54. Huang T, McDonough CB, Abel T. Compartmentalized PKA signaling events are required for synaptic tagging and capture during hippocampal late-phase long-term potentiation. Eur J Cell Biol 2006; 85: 635-42. 55. Westphal RS, Tavalin SJ, Lin JW, Alto NM, Fraser ID, Langeberg LK, et al. Regulation of NMDA receptors by an associated phosphatase-kinase signaling complex. Science 1999; 285: 93-6. 56. Colledge M, Dean RA, Scott GK, Langeberg LK, Huganir RL, Scott JD. Targeting of PKA to glutamate receptors through a MAGUK-AKAP complex. Neuron 2000; 27: 107-19. 57. Lisman J, Schulman H, Cline H. The molecular basis of CaMKII function in synaptic and behavioural memory. Nat Rev Neurosci 2002; 3: 175-90. 58. Otmakhov N, Griffith LC, Lisman JE. Postsynaptic inhibitors of calcium/ calmodulin-dependent protein kinase type II block induction but not maintenance of pairing-induced long-term potentiation. J Neurosci 1997; 17: 5357-65. 59. Leonard AS, Lim IA, Hemsworth DE, Horne MC, Hell JW. Calcium/ calmodulin-dependent protein kinase II is associated with the N- methylD-aspartate receptor. Proc Natl Acad Sci U S A 1999; 96: 3239-44. 60. Bayer KU, De Koninck P, Leonard AS, Hell JW, Schulman H. Interaction with the NMDA receptor locksCaMKII in an active conformation. Nature 2001; 411: 801-5. 61. Hudmon A, Lebel E, Roy H, Sik A, Schulman H, Waxham MN, et al. A mechanism for Ca2+/calmodulin-dependent protein kinase II clustering at synaptic and nonsynaptic sites based on self-association. J Neurosci 2005; 25: 6971-83. 62. Hassan H, Frey S, Frey JU. Search for a two-input model for future investigations of ‘synaptic tagging’ in freely moving animals in vivo. J Neurosci Methods 2006; 152: 220-8. 63. Seidenbecher T, Reymann KG, Balschun D. A post-tetanic time window for the reinforcement of long-term potentiation by appetitive and aversive stimuli. Proc Natl Acad Sci U S A 1997; 94: 1494-9. 64. Seidenbecher T, Balschun D, Reymann KG. Drinking after water deprivation prolongs ‘unsaturated’ LTP in the dentate gyrus of rats. Physiol Behav 1995; 57: 1001-4. 65. Bergado JA, Almaguer-Melián W, Kostenko S, Frey S, Frey JU. Behavioral reinforcement of long-term potentiation in rat dentate gyrus in vivo is protein synthesis-dependent. Neurosci Lett 2003; 351: 56-8. 66. Almaguer-Melián W, Martínez-Martí L, Frey JU, Bergado JA. The amygdala is part of the behavioral reinforcement system modulating longterm potentiation in rat hippocampus. Neuroscience 2003; 119: 319-22. 67. Frey S, Bergado JA, Seidenbecher T, Pape HC, Frey JU. Reinforcement of early-LTP in dentate gyrus by stimulation of the basolateral amygdala: heterosynaptic induction of late-LTP. J Neurosci 2001; 21: 3697-703. 68. Almaguer-Melián W, Rosillo JC, Frey JU, Bergado JA. Subcortical deafferentation impairs behavioral reinforcement of long-term potentiation in the dentate gyrus of freely moving rats. Neuroscience 2006; 138: 1083-8. 69. Almaguer-Melián W, Rojas-Reyes Y, Alvaré A, Rosillo JC, Frey JU, Bergado JA. Long-term potentiation in the dentate gyrus in freely moving rats is reinforced by intraventricular application of norepinephrine, but not oxotremorine. Neurobiol Learn Mem 2005; 83: 72-8. 70. Gruart A, Muñoz MD, Delgado-García JM. Involvement of the CA3CA1 synapse in the acquisition of associative learning in behaving mice. J Neurosci 2006; 26: 1077-87. 71. Whitlock JR, Heynen AJ, Shuler MG, Bear MF. Learning induces longterm potentiation in the hippocampus. Science 2006; 313: 1093-7. 72. Pastalkova E, Serrano PPB, Wallace E, Fenton AA, Sacktor TC. Storage of spatial information by the maintenance mechanism of LTP. Science 2006; 313: 1141-4. 73. Izquierdo I, Bevilaquua LR, Rossato JI, Bonini JS, Medina JH, Cammarota M. Different molecular cascades in different sites of the brain control memory consolidation. Trends Neurosci 2007; 29: 496-505. 74. Bergado-Rosado JA, Almaguer-Melián W. Mecanismos celulares de la neuroplasticidad. Rev Neurol 2000; 31: 1074-95. 75. Hernández-Muela S, Mulas F, Mattos L. Plasticidad neuronal funcional. Rev Neurol 2004; 38 (Supl 1): S58-68. SYNAPTIC TAGGING AND MEMORY TRACE Summary. Aim. To present a panorama of the main features and possible identity of the synaptic tag, such as to discuss some of its functional implications. Development. Long-term potentiation (LTP) constitutes a very attractive synaptic/cellular memory model. LTP, like memory, can manifest itself early (essentially depending on the modification of pre-existing proteins at synapse) and late (depending on new protein synthesis). As LTP is a highly specific phenomenon, a dilemma arises: how can the proteins, required to plastic change stabilization, that are synthesized at the soma of a neuron containing thousands of synaptic contacts –all depending of the same nucleus– go to the appropriate synapses? In this review, we present some of the models that intend to explain this question, making emphasis on synaptic tagging hypothesis. Some of the main findings that have contributed to tagging hypothesis are exposed. The local protein synthesis and the activation of protein kinases are analyzed as candidates to be the synaptic tag. Additionally, some of the functional implications of synaptic tagging are discussed. Conclusions. The synaptic tagging hypothesis offers a very flexible and reasonable solution to the specificity of long-lasting synaptic changes. Although some of the tagging features are known, the synaptic tag identity has not yet been elucidated. It seems that there is not a unique synaptic tag, but there are rather multiple molecular synaptic tags involved. Each of them might function as a synaptic tag under particular circumstances. Each might be differentially recruited by specific stimuli and mediate plasticity over different time domains. [REV NEUROL 2007; 45: 607-14] Key words. LTP. Memory. Protein kinases. Protein synthesis. Synapse. Synaptic tagging. 614 REV NEUROL 2007; 45 (10): 607-614