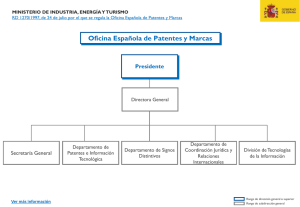
4. Patentes de Medicamentos Antivirales y Antirretrovirales
Anuncio

Ministerio de Fomento, Industria y Comercio (MIFIC) Dirección General Registro de la Propiedad Intelectual (RPI) Dirección de Patentes y Nuevas Tecnologías Patentes de Medicamentos Antivirales y Antirretrovirales Dirección: Costado este hotel Intercontinental Metrocentro Teléfono: 2248-9300 ext. 2214 Elaborado por: Licenciada Paula Martínez e Ingeniero Erick Ariel Zúniga Castellón, examinadores de patentes Patentes de Medicamentos Antivirales y Antirretrovirales Indice Método de Trabajo: Los antivirales: Los fármacos antirretrovirales: Las combinaciones de antirretrovirales: Los Inhibidores de transcriptasa inversa: Los Inhibidores análogos nucleósidos •Zidovudina: • Didanosina: •Estavudina: •Lamivudina: •Abacavir: •Emtricitabina: •Festinavir: 5 6 6 6 6 6 6 6 7 7 7 4 5 Inhibidores de transcriptasa no nucleósidos.7 •Nevirapina: 7 •Delavirdina: 8 •Efavirenz: 8 •Etravirina: 8 •Rilpivirina 8 Inhibidores de transcriptasa análogos de nucleótido 8 •Tenofovir disoproxil fumarato: o tenofovir o TDF 8 Inhibidores de proteasa •Saquinavir •Ritonavir: •Indinavir: •Nelfinavir: •Lopinavir: •Atazanavir: •Fosamprenavir: •Tipranavir • Enfuvirtida : • Maraviroc: Anticuerpos monoclonales anti-CCR5 11 Combinaciones fijas 11 •Combivir® = AZT + 3TC : 11 •Trizivir® = ABC + AZT + 3TC: 12 •Kaletra® = Lopinavir + Ritonavir. 12 •Kivexa® (nombre en Europa) o Epzicom®(nombre en EEUU) = ABC + 3TC :12 •Truvada® = tenofovir + emtricitabina: 12 •Atripla® = tenofovir + emtricitabina+ efavirenz: 12 Combinaciones fijas en desarrollo: 12 tenofovir + emtricitabina+ rilpivirina: 12 tenofovir + emtricitabina+ elvitegravir + cobicistat: 12 sinergísticos 12 •Hidroxiurea, (HU): •Resveratrol (RV): •Ácido micofenólico: •Zumo de toronja o pomelo •Leflunomida: 12 13 13 13 13 8 9 9 9 9 9 9 9 10 10 10 Inhibidores de la integrasa 10 •Raltegravir •Elvitegravir: • Dolutegravir : 10 11 11 Inhibidores de la adhesión 11 •BMS 663068: 11 DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS 2 Patentes de Medicamentos Antivirales y Antirretrovirales Introducción El objetivo del presente trabajo es exponer los diferentes medicamentos antivirales y antirretrovirales de mayor uso en el tratamientos del VIH/SIDA, motivado por los altos precios que tienen en el mercado internacional por parte las compañías transnacionales farmacéuticas, aspecto que repercute considerablemente en el incremento de los costos del tratamiento, y es uno de los principales obstáculos para su disposición en los países como nicaragua. Una iniciativa a nivel internacional es la de producir nacionalmente estos fármacos, con el objetivo de garantizar sostenidamente el acceso global de los pacientes a esta terapia. Todos estos esfuerzos están encaminadas a un mismo propósito, disponer de la mayor cantidad de antirretrovirales como herramientas terapéutico para el tratamiento del VIH/SIDA, así como buscar distintas vías para la adquisición de estos fármacos en condiciones económicas más favorables El desarrollo de esta enfermedad según el IV Informe UNGASS 2010, que fue encomendado al Centro de Investigaciones y Estudios de la Salud (CIES- UNAN) por la Comisión Nicaragüense del SIDA con el apoyo de ONUSIDA, establece que hoy en día en Nicaragua la tasa de incidencia de la epidemia del sida es del 15.1x 100,000 habitantes y la tasa de prevalencia es de 67.7 x 100,000 habitantes. El Registro de la Propiedad Intelectual del Ministerio de Fomento, Industria y Comercio , a través de La Dirección de Patentes y Nuevas Tecnologías, ha elaborado el presente informe de vigilancia Tecnológica sobre los principales medicamentos antivirales y antiretrovirales que son utilizados en el tratamiento contra el VIH/SIDA cuyos componentes se encuentran protegidos por patentes. Una de las táreas más complicadas ha sido la de poder determinar que patente específica le corresponde a un compuesto o procedimiento para elaborar un producto farmacéuticos , ya que no todos los compuestos patentados al final son utilizados o llegan a utilizarse o aponerse a dispoción para un determinado medicamento, dentro del proceso de poder obtener el permiso de comercialización ante la autoridad sanitaria (MINSA). Para informarse por completo, el número de publicación de patente vínculado al medicamento posee un enlace directo a la página web de públicación de la Oficina Europea de Patente, donde se accede a la publicación completa del documento de patente. El cual puede ser del número de la publicación referida o de una traducción de la Oficina Española de Patentes y Marcas de la Publicación Europea ( familia de patente). Así mismos, damos a conocer si cada patente correspondiente al medicamento referido, ha sido solicitado su protección en nicaragua, su estatus y determinar su libre uso para fabricarlo o importarlo. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS 3 Patentes de Medicamentos Antivirales y Antirretrovirales Método de Trabajo: Unas de las principales herramientas utilizadas para el presente estudio, partiendo de la necesidad de identificar las patente correspondientes para cada uno de los producto farmacéutico o las patentes de procedimiento para la fabricación de los mismos, fueron: 1 - Página Web Medicines Patent Pool. 2 - Página Web FDA de los Estados Unidos. 3 - Página Web Registro Sanitario del Canadá. 4 - Página de la Oficina Europea de Patentes: Web worldwide.espacenet.com. 5 - Página Web de Oficina de Patentes y Marcas de los Estados Unidos. 6 - Base de Datos del Patentes del Registro de la Propiedad Intelectual de Nicaragua (Interna). 7 - Página Web del Ministerio de Salud de Nicaragua. Se utilizaron las palabras claves dependiendo de la tecnología desarrollada para cada medicamento, partiendo de la información general sobre la utilización de cada medicamento en el tratamiento respecttivo. Por lo anterior, primero se investigo cada uno de estos medicamentos, sus marcas de comercialización, el titular o fabricante del medicamento. Se han citado las patentes con la cual se protege el medicamento, después hemos definido si estas patentes fueron o están presentadas en nuestro país y dar a conocer su estatus, consultando la base de datos nacional y el expediente en físico. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS 4 Patentes de Medicamentos Antivirales y Antirretrovirales Los antivirales: Son un tipo de medicamento usado para el tratamiento de infecciones producidas por virus. Tal como los antibióticos (específicos para bacteria), existen antivirales específicos para distintos tipos de virus. No sin excepciones, son relativamente inocuos para el huésped, por lo que su aplicación es relativamente segura. Deben distinguirse de los viricidas, que son compuestos químicos que destruyen las partículas virales presentes en el medio ambiente Muchos de los antivirales disponibles actualmente están diseñados para ayudar el tratamiento del VIH (virus del sida), herpesvirus, productores de la varicela, el herpes labial, el herpes genital, etc. y los virus de la hepatitis B y C, que pueden causar cáncer de hígado. Los investigadores están trabajando actualmente para extender el rango de antivirales a otras familias de patógenos. Una etapa muy temprana de las infecciones virales es la entrada viral, cuando los virus se sujetan y entran en la célula huésped. Varias sustancias “entrada-inhibidores” o “entradabloqueantes” se están desarrollando para luchas contra el VIH. El HIV principalmente ataca el sistema inmune de los glóbulos blancos conocidos como “linfocitos T” e identifica a estas células objetivo a través de células-T receptoras superficiales designadas como “CD4” y “CCR5”. Los intentos de interferir el enlace del VIH con el receptor CD4 han fallado para parar la infección de los linfocitos-T, pero las investigaciones continúan intentando interferir con el enlace del HIV al receptor CD5 con la esperanza de que sea más efectivo El primer antiviral exitoso, el aciclovir, es un análogo a los nucleósidos y es efectivo contra el herpesvirus. La primera sustancia antiviral en ser aprobada para tratar el VIH, la zidovudina (AZT), es también un nucleósido análogo. Un mejor conocimiento de la acción de la transcriptasa inversa ha conducido a mejores análogos a nucleósidos para tratar las infecciones del VIH. Uno de estos medicamentos, la lamivudina, ha sido aprobado para tratar la hepatitis B, que utiliza la transcriptasa inversa como parte de su proceso de replicación. Los investigadores han ido más lejos y desarrollaron inhibidores que no parecen nucleósidos, pero pueden seguir bloqueando la transcriptasa inversa Algunos virus incluyen una enzima conocida como proteasa que destruye las cadenas de proteínas virales para que ellas se puedan ensamblar en su configuración final. El VIH incluye una proteasa y por ello investigaciones considerables se han realizado para encontrar “inhibidores de proteasa” para atacar el VIH en dicha fase de su ciclo de vida. Los inhibidores de proteasa estuvieron disponibles en los años 1990 y han probado su efectividad, aunque DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS pueden tener extraños efectos secundarios, por ejemplo causando la aparición de grasa en sitios inusuales. Los inhibidores de proteasa mejorados están ahora en desarrollo. La etapa final, el ciclo de vida de un virus es la aparición de virus completos de la célula huésped y este paso ha sido tomado como objetivo por los desarrolladores de antivirales. Dos medicamentos llamados zanamivir (Relenza) y oseltamivir (Tamiflu) que han sido introducidos recientemente para tratar la gripe previenen el lanzamiento de partículas virales bloqueando una molécula llamada neuraminidasa que se encuentra en la superficie de los virus de la gripe y también parece ser constante a través de un amplio rango de variedades de gripe. Los fármacos antirretrovirales: Son medicamentos para el tratamiento de la infección por el retrovirus VIH, causante del sida. Diferentes antirretrovirales actúan en varias etapas del ciclo vital del VIH. Varias combinaciones de 3 o 4 fármacos se conocen como Terapia Antirretroviral de Gran Actividad o TARGA. Las guías de tratamiento están en cambio constante, desde un inicio más agresivo a un enfoque más conservador, con un punto de inicio alrededor de 150 a 350 linfocitos CD4 /mm³. Las últimas guías europeas1 e internacionales2 usan el límite de 150 CD4+/mm³ como el parámetro para iniciar la terapia antirretroviral, aunque estas mismas guías plantean situaciones en las que debe iniciarse el tratamiento independientemente del número de CD4+ (personas infectadas a la vez por VIH y por el virus de la hepatitis B o Virus de la hepatitis C; personas con parejas que son VIH negativas, personas con más de 50 años, etc). En sí, no existe una pauta exacta para saber cuando iniciar el tratamiento, salvo el uso de la clínica y el estado inmunitario del paciente. Muchas veces el paciente puede presentar un conteo de 500 CD4+/ mm³, pero padecer graves enfermedades oportunistas. Tenemos que hacer referencia también a la carga viral: si ésta es demasiado elevada (superior a un millón de copias del virus/ mm³), es recomendable iniciar el tratamiento. Pero ésta es la carga viral virtual, diferente a la carga viral real, que consiste en saber la cifra exacta de virus en el individuo, que es muy superior. Los regímenes antirretrovirales son complejos, con posibles efectos colaterales serios, dificultades con la adherencia, y potencial desarrollo de resistencia viral (a causa de la falta de adherencia, niveles subóptimos de los fármacos antirretrovirales o una replicación aumentada del virus). 5 Patentes de Medicamentos Antivirales y Antirretrovirales El tratamiento se ofrece a todos los pacientes antes de que estén en riesgo de padecer condiciones definitorias de sida. La recomendación de tratamiento antirretroviral a pacientes asintomáticos requiere evaluar los posibles riesgos y beneficios Las combinaciones de antirretrovirales actúan incrementando el número de obstáculos para la mutación viral, manteniendo bajo el número de copias virales. Los agentes antirretrovirales individualmente no suprimen la infección por VIH a largo plazo, por lo cual deben usarse en combinaciones Las combinaciones de antirretrovirales: Pueden ser de sinergismo positivo o negativo. Esto limita el número de combinaciones disponibles. Por ejemplo, la combinación de ddI y AZT es de sinergismo negativo, ya que tomados juntos, cada fármaco inhibe la acción del otro. Otros factores que limitan las combinaciones disponibles son la aparición de efectos colaterales severos. La necesidad de un horario de administración complicado dificulta la adherencia apropiada al tratamiento. E - Inhibidores de transcriptasa inversa: La transcriptasa inversa es una enzima viral que el VIH requiere para su reproducción. La inhibición de esta enzima impide el desarrollo de ADN viral basado en su ARN. Existen tres clases: Inhibidores análogos nucleósidos Fueron la primera clase de antirretrovirales desarrollados. •Zidovudina: Llamada anteriormente azidotimidina, sus siglas son AZT o ZDV y está comercilaizado como Retrovir® por GlaxoSmithKline (GSK); es un análogo de la timidina Primer antirretroviral aprobado por la FDA, desarrollado originalmente en 1964 y usado en pruebas contra el cáncer durante la década de 1970 pero abandonado por inefectivo y tóxico. Fue aprobado por la FDA el 19 de marzo de 1987 como tratamiento para el sida. La inexistencia de alternativas para tratar el sida condujo a su rápida aprobación. Está asociado con los mismos efectos tóxicos que d4T, aunque tarda un poco más en producirlos. Hoy día se tiende a usarlo cada vez menos por estos efectos. La patente relacionada es: US 4,724,232, con las siguientes prioridades GB 1985 0006869 y GB 1985 0011774. En los países donde se concedió la patente su vencimiento es para DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS el año 2006. En Nicaragua esta no se presentó su solicitud por lo que es de libre uso para su fabricación e importación. • Didanosina: También conocida por su sigla ddI, nombre comercial: Videx®, Videx EC®, análogo de la adenosina. Comercializado por Bristol-Myers Squibb. Segundo antirretroviral aprobado por la FDA el 9 de octubre de 1991. La didanosina se desarrolló con fondos estatales, pero dado que el gobierno estadounidense no estaba autorizado para comercializar el producto, otorgó a BristolMyers Squibb (BMS) una patente por 10 años para mercadeo exclusivo como Videx® tabletas. Al concluir el periodo BMS reformuló Videx®, como Videx EC® y lo patentó. Dado que la didanosina se deteriora fácilmente con la acidez estomacal, la fórmula original utilizó tabletas masticables con un compuesto neutralizante. Estas tabletas eran muy grandes y frágiles, de mal sabor, y además el compuesto neutralizante causaba diarrea. La nueva formulación es una cápsula más pequeña, que contiene microesferas cubiertas. La FDA la aprobó para dosificación de una vez al día. Hoy día se tiende a usarlo cada vez menos ya que los fármacos más nuevos son más eficaces y seguros. Las patentes relacionadas son: WO8701284, con la siguiente prioridad: US 1985 769,016 ; US5880106, con las siguientes prioridades: US 1992 0882204 y US 1991 0733547; WO9961002 con la siguiente prioridad : US 1998 09/083,597. Ninguna de las Patentes mencionadas anteriormente solicitaron protección en Nicaragua. Hace libre su uso para su fabricación e importación. •Estavudina: También llamada d4T, Nombre comercial: Zerit®, Zerit XR®, análogo de timidina. Cuarto antirretroviral aprobado por la FDA el 24 de junio de 1994 y en 1996 para uso pediátrico. En el 2001 se aprobó la versión para dosificación de 1 vez al día. Hoy día casi no se utiliza a no ser que sea absolutamente necesario por sus efectos secundarios tóxicos. Comercializado por Bristol-Myers Squibb. La patente relacionada es: EP0273277, con la siguiente prioridad US 1986 0942666. La Patente mencionada anteriormente no solicitó protección en Nicaragua, lo cual hace libre su fabricación e importación. •Lamivudina: También llamada 3TC, nombre comercial : Epivir®, análogo de citidina. Aprobado por la FDA el 17 de noviembre de 1995 para combinación con AZT y en el 2002 en formulación para usar una vez al día. Comercializado por GlaxoSmithKline. Desde 2010, al caducar la patente en la UE, existe en España 6 Patentes de Medicamentos Antivirales y Antirretrovirales una versión genérica del 3TC comercializada por Laboratorios Normon. Las patentes relacionadas son: EP0382526, con la siguiente prioridad: US 1989 0308101 ; WO9221676, con la siguiente prioridad: GB 1991 9111902.4 (Forma Cristalina); WO9842321 con las siguientes prioridades : US 1997 60/042,353 y GB 1997 9706295.4 ( Nuevas Formulaciones). Las dos primeras no se presentaron protección en nuestro país y están de uso libre para su producción e importación (Epivir). En el caso de la última que protege nuevas formulaciones presentó solicitud de protección el 23 de Marzo de 1998, se otorgo bajo el número de Registro 1298 RPI y su vigencia es hasta el 22 de Marzo de 2018. •Abacavir: También llamado ABC, nombre comercial : Ziagen®, análogo de guanosina. Aprobado por la FDA el 18 de diciembre de 1998, y por el Ministerio de Sanidad de España en 2000. Comercializado por GlaxoSmithKline. Conocido por su implicación en reacciones de hipersensibilidad asociada con muerte súbita en algunos casos; sin embargo se desarrolló una prueba genética que permite predecir a cierto grado la susceptibilidad al desarrollo de esta hipersensibilidad, aunque esta prueba no está estandarizada ni autorizada por las autoridades sanitarias. Se estima que el abacavir puede ser seguro para alrededor del 90 % de los pacientes, pero hay un 10% de riesgo de reacciones de hipersensibilidad potencialmente mortales, especialmente si se administra toda la dosis una vez al día. También produce un aumento de lípidos en sangre. Los últimos datos presentados (CROI2008 y Conferencia Mundial de sida 2008) demuestran que el tomar abacavir aumenta el riesgo de padecer algún evento cardiovascular (infarto de miocardio). Aún no se conoce el mecanismo por el cual produce esto, pero parece que puede ser por un mecanismo inflamatorio, ya que se ha visto que con el uso de abacavir aumentan los niveles de ciertos marcadores indirectos de inflamación como son la proteína C reactiva y la interleucina 6. Las patentes relacionadas son: WO9100282 , con la siguiente prioridad: US 1989 371789 ; EP0434450, con la siguiente prioridad: US1989 0455201; WO9521161 con la siguiente prioridad : GB 1994 9402161.5 ( Intermediarios Nuevos); WO9852949 con la siguiente prioridad : GB 1997 9709945.1 ( Sal de hemisulfato); y WO9939691 con la siguiente prioridad : GB 1998 9802472.2 ( Composiciones para uso pediátrico). De todas las anteriores patentes citadas la única que se presentó para protección fue la sal de hemisulfato, titulada para nicaragua “UNA NUEVA SAL”, el 14 de Mayo de 1998, se otorgo bajo el número de Registro 1197 RPI y su vigencia es hasta el 13 de Marzo de 2018. Siendo esta la única que tiene restricciones para su producción e importación. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS •Emtricitabina: También llamada FTC, nombre comercial : Emtriva®, (anteriormente Coviracil), análogo de citidina, aprobado por la FDA el 2 de julio de 2003. Comercializado por Gilead Sciences. Es similar a 3TC y existe resistencia cruzada entre ambos. Tiene una potencia superior a 3TC y una permanencia en el organismo grande (semivida aproximada de 39 horas), lo que hace que se pueda administrar una vez al día con seguridad, y que ocasiones menos resistencias que 3TC. Aprobado por la Agencia Europea de Medicamentos (EMEA) en octubre de 2003. Las patentes relacionadas son: EP 0382526, con la siguiente prioridad: US 1989 0308101 ; y WO9111186, con la siguiente prioridad: US 1990 473,318. No se presentó solicitud de patente en nicaragua por lo que es libre su producción e importación. •Festinavir: También llamado OBP-601. Se trata de un análogo de timidina “de segunda generación” similar a d4T pero sin sus problemas de toxicidad. Inicialmente desarrollado por la universidad de Yale (EEUU) y licenciado a la biotecnológica japonesa Oncolys BioPharma, en diciembre de 2010 Bristol-Myers Squibb adquirió los derechos de desarrollo y comercialización de este fármaco. Inhibidores de transcriptasa no nucleósidos. •Nevirapina: Nombre comercial : Viramune® primero de esta clase aprobado por la FDA el 21 de junio de 1996 en adultos y en 1998 para uso pediátrico. Aprobado en España en 1999. Comercializado por Boehringer-Ingelheim. Las patentes relacionadas son: EP0429987, con las siguientes prioridades: US 1989 0438923, US1990 0579001 y US1990 0600390 ;WO9909990, con la siguiente prioridad: US 1997 60/056,803P ( Formulación de Hemihidrato); y WO2008154234, con la siguiente prioridad: US 2007 0942765 (Formulación de liberación prologada). No se presentó solicitud de patente en nicaragua por lo que es libre su producción e importación. 7 Patentes de Medicamentos Antivirales y Antirretrovirales •Delavirdina: Nombre comercial : Rescriptor® aprobado por la FDA el 4 de abril de 1997. Actualmente no es de uso coriente debido a sus efectos secundarios adversos. No aprobado para su uso en Europa. La patente relacionada es la WO 9963970 con número de prioridad US19980088960P. Esta no se presentó en nicaragua por lo que es libre su fabricación e importación. •Efavirenz: Nombres comerciales: Sustiva®, y Stocrin®; aprobado por la FDA el 21 de septiembre de 1998. Bristol-Myers Squibb comercializa efavirenz con el nombre Sustiva® en EE.UU., Reino Unido, Francia, España, Alemania, Italia e Irlanda. Merck & Co comercializa efavirenz con el nombre Stocrin® en el resto del mundo. Sustiva fue aprobado en España en el año 2000. Es uno de los componentes de Atripla® (tenofov ir+emtricitabina+efavirenz), de Gilead Sciences y BristolMyers Squibb. Patente relacionada WO9403440, con número de prioridad US 1992 0926607, en nuestro país no se presentó solicitud de patente por lo que es libre su fabricación y su importación. •Etravirina: Nombre comercial: Intelence® comercializado en España por Janssen-Cilag. Patentes Relacionadas WO0027825 con números de prioridades US 1998 60/107,792 y US 1999 60/143,962; WO2006094930 con número de Prioridad EP 2005 05101707.7( Nuevas Series) ; y WO2006079656 con número de prioridad EP 2005 05100521.3 ( Nuevas Formas). En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación. •Rilpivirina Nombre comercial Edurant®. Es propiedad de Tibotec (J&J) y lo comercializará Janssen-Cilag. Aprobado por la FDA de EEUU en mayo de 2011. En Europa está aún (a fecha mayo de 2011) pendiente de aprobación por la EMA. Rilpivirina se ha comparado con Efavirenz y he demostrado tener menos efectos secundarios a nivel del sistema nervioso central, pero por otro lado, hubo más fracasos virológicos al tratamiento entre los pacientes que tomaron Rilpivirina frente a los que tomaron Efavirenz, especialmente en los pacientes con cargas virales iniciales de más de 100.000 copias/mL. Está también en desarrollo un comprimido combinado con tenofov ir+emtricitabina+rilpivirina en colaboración con Gilead. Éste último comprimido de combinación lo comercializará Gilead DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS Sciences. Patente relacionada WO03016306, con números de prioridad EP 2001 01203090.4 y EP 2002 02077748.8. No ha sido presentada solicitud de patente en nicaragua por lo que es libre su fabricación e importación. Inhibidores de transcriptasa análogos de nucleótido Normalmente, los análogos nucleósidos se convierten en el cuerpo a nucleótidos, por lo cual el saltarse este paso deriva en menor toxicidad y disminuye el tiempo de latencia del fármaco. •Tenofovir disoproxil tenofovir o TDF fumarato: o Nombre comercial : Viread®, Aprobado el 26 de octubre de 2001 en EEUU. La EMEA aprobó su uso en febrero de 2002 para la Unión Europea. En España está disponible desde el 4 de julio de 2002, tenofovir es comercializado por Gilead Sciences. Tenofovir es uno de los componentes de Truvada® (tenofovir+emtricitabina) comercializado por Gilead Sciences, de Atripla® (tenofovir+emtricitabina+efa virenz) comercializado por Gilead Sciences y Bristol-Myers Squibb. La Agencia Europea del Medicamento (EMEA) ha autorizado el uso de Viread® para el tratamiento de la hepatitis B crónica, ya que tiene actividad frente a dicho virus. El principal problema de tenofovir es la potencial toxicidad renal y ósea a largo plazo. Patente relacionada WO9905150, con números de prioridad US 1997 08/900,752 y US 1997 60/053,777; WO9804569, con números de prioridad US 1996 08/686,838 y US 1996 60/022,708 ( prodroga de esteres ); WO2004064845, con números de prioridad US 2003 60/440,308 y US 2003 60/440,246 (comb. w/ LPV, FTC, EFV) ; WO2006135933, con números de prioridad US 2005 60/690,010 y US 2006 60/771,279 ( comb w/ EFV + FTC) . No ha sido presentada solicitud de patente en nicaragua por lo que es libre su fabricación e importación. Inhibidores de proteasa La proteasa es una enzima requerida por el VIH para el ensamblaje final de los viriones, por lo cual su inhibición resulta en inhibición de la replicación viral. 8 Patentes de Medicamentos Antivirales y Antirretrovirales •Lopinavir: •Saquinavir Comercializado como Invirase® y Fortovase® por Roche. Patente relacionada EP0432695, con número de prioridad GB 1989 0027913; WO9639142, con números de prioridades US 1995 468,493 y US 1996 616,233 (composición mejorada) ; WO2005004836, con números de prioridades US 2003 60/486,600 y US 2004 60/568,204 (formas de dosificación) . No ha sido presentada solicitud de patente en Nicaragua por lo que es libre su fabricación e importación. •Ritonavir: Comercializado como Norvir®, por Abbott. Actualmente se utiliza combinado con todos los inhibidores de proteasa a dosis pequeñas (100 o 200 mg) como potenciador (no como antiviral), ya que es un potente inhibidor del citocromo P450, lo que hace que los niveles en sangre de los inhibidores de proteasa se mantenga más tiempo en cifras óptimas. Patente relacionada WO9414436, con números de prioridades US 1992 07/998,114 y US 1993 08/158,587; WO0004016, con números de prioridades US 1998 09/119,345 y US 1999 9/326,093 (polimorfos cristalinos). No ha sido presentada solicitud de patente en Nicaragua por lo que es libre su fabricación e importación. •Indinavir: Comercializado como Crixivan® por Merck. Patente relacionada WO9309096, con números de prioridades US 1991 789,508 y US 1992 883,825. No ha sido presentada solicitud de patente en Nicaragua por lo que es libre su fabricación e importación. •Nelfinavir: Comercializado como Viracept® por Roche. Patente relacionada WO9509843, con números de prioridades US19930133543, US19930133696 y US19940190764 . No ha sido presentada solicitud de patente en Nicaragua por lo que es libre su fabricación e importación. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS Que está comercializado como Kaletra®, si bien incluye también bajas dosis de ritonavir. Kaletra es fabricado por Abbott Laboratories. La FDA lo aprobó para el tratamiento de la infección con el VIH en adultos y niños, en el 2000. En España está disponible desde 2001. Un inconveniente del Kaletra es que debía conservarse a temperaturas no superiores a 25 ºC, lo que es una dificultad en muchos países en vías de desarrollo. Recientemente, Abbott ha preparado una nueva formulación del medicamento (comprimidos), con el mismo nombre en Europa y en EEUU, y con el nombre comercial de Aluvia® en los países con menor poder adquisitivo, los comprimidos no tienen estos problemas de conservación. Patente relacionada WO9721685, con números de prioridades US 1995 08/572,226 , US 1996 08/753,201; WO9822106, con número de prioridad US 1996 08/754,390; WO2005039551, con número de prioridad US 2003 10/650,178; WO2006091529, con número de prioridad US 2005 11/064467. Para los dos primeros No ha sido presentada solicitud de patente en Nicaragua por lo que es libre su fabricación e importación. En el caso de las dos últimas su estatus es en examen de fondo. •Atazanavir: Nombre comercial : Reyataz® aprobado el 20 de junio de 2003. Comercializado por Bristol-Myers Squibb. Primer inhibidor de la proteasa aprobado para 1 toma al día. Parece estar menos asociado con la lipodistrofia y la dislipidemia. Parece no tener resistencia cruzada con otros inhibidores de proteasa. En Europa solo está aprobado su uso potenciado con ritonavir. Patente relacionada WO9740029, con números de prioridades CH 1996 1018/96 , CH 1997 29/97, CH 1997 223/97; WO9936404, con número de prioridad US 1998 60/071,968 ; WO03020206, con número de prioridad US 2001 60/316,745; WO2005108349, con números de prioridades US 2004 60/568,043 , US 2004 60/607,533 y US 2005 11/119,558. No ha sido presentada solicitud de patente en Nicaragua por lo que es libre su fabricación e importación. •Fosamprenavir: Nombre comercial: Lexiva® (EEUU) o Telzir® (Europa) pro-fármaco de amprenavir . Aprobado el 20 de octubre de 2003. En España está disponible desde 2005. Comercializado por GlaxoSmithKline. En el organismo es metabolizado para formar amprenavir, el cual es el ingrediente activo. Es en realidad una versión de amprenavir de liberación lenta, lo cual reduce la cantidad de comprimidos necesarios. Patente relacionada WO9933815, con número de prioridad US 1997 08/998,050; WO0004033, con número de prioridad GB 1998 9815567.4. Sólo la última presentó solicitud de patente en Nicaragua y se encuentra en Dominio Público, por lo que son 9 Patentes de Medicamentos Antivirales y Antirretrovirales libre su fabricación e importación. •Tipranavir Aptivus®: su nombre comercial. Comercializado por Boehringer-Ingelheim. Nuevo inhibidor de la proteasa, que es efectivo contra virus que son resistentes a otros :inhibidores de la proteasa. Actualmente se utiliza poco. Patentes Relacionadas WO95/30670 con números de prioridades US 1994 238817 y US 1994 349361; WO0025784 con número de Prioridad US 1994 60/106,963 ; ES2192201(T3) con números de prioridades US 1994 238817 y US 1994 349361; y WO9906043 con número de prioridad US 1997 54078P . En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación. •Darunavir : Prezista® su nombre comercial. Efectivo contra virus resistentes a otros inhibidores de proteasa. Se utiliza principalmente como componente de tratamiento de rescate, ya que su elevado precio hace que no sea coste-efectivo utiizarlo para iniciar tratamiento. Comercializado por Janssen-Cilag en España. En EEUU lo comercializa Tibotec. Inhibidores de la entrada Impiden la entrada del virus a la célula previniendo la infección de células sanas. Patentes Relacionadas WO9404492 con número de prioridad US 1992 07/934,984; WO9628464/ WO9628465 con números de Prioridades US199508/402,450, US 1995 08/479,071, US 1995 08/402,419 y US 1995 08/474,117 (específica) ; WO9967417 con número de prioridad US 1998 0090393P (Método de Uso); WO03049746 con número de prioridad EP 2001 01204841.9 Combinación W/RTV; WO03106461 con número de prioridad EP 2002 02076929.5 (Pseudo Polimorfo); WO2005095410 con número de prioridad EP 2004 04101336.8 (Intermediarios) ; y WO2006005720 con número de prioridad EP 2004 04103256.6 ( Combinaciones W/RTV y TDF. En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación. • Enfuvirtida : Fuzeon® su nombre comercial. Administración por inyecciones subcutaneas. Comercializado por Roche. Es un inhibidor de la fusión del virus con la célula. Patentes Relacionadas Patentes Relacionadas WO 9428920 (A1) con número de prioridad US 1993 73028; y WO 9640191 (A1) con números de Prioridades US1995 481,957. En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS • Maraviroc: Selzentry® su nombre comercial en EE.UU. o Celsentry® su nombre comercial en Europa. Comercializado antes por Pfizer y actualmente por ViiV Healthcare (la joint venture hecha por la unidades de VIH de Pfizer y GSK). Es un inhibidor del correceptor CCR5 únicamente activo contra el VIH que tiene tropismo por este receptor. No es activo contra el VIH que tiene tropismo CXR4 o el que tiene tropismo mixto (CCR5/ CXR4). Para ello, es necesario realizar un test previo al tratamiento, que se llama test de tropismo. Antes dicho test se realizaba sólo en EEUU en un laboratorio llamado Monogram Bioscience, con lo que había que enviar las muestras para análisis allí. Hoy se utilizan las técnicas del análisis genético del virus similares a los estudios de resistencia, que permiten saber si el tropismo es R5 y por lo tanto puede ser tratado con el maraviroc. Existe una tercera posibilidad que se denomina análisis del DNA-proviral enlinfocitos que pudieran usarse en pacientes con carga viral indetectable, pero su uso clínico todavía no está bien establecido. Patentes Relacionadas WO 0038680 (A1) con números de prioridades GB 1998 9828420.1 y GB 1999 9921375.3; WO 0190106 con números de Prioridades GB 2000 0014046 y GB 2000 0015835 . En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación. Inhibidores de la integrasa Medicamentos que evitan la acción de la integrasa, selectivos únicamente al VIH-1. Son potentes antirretrovirales y se ha demostrado cierta eficacia en regímenes sin análogos de nucleósidos, pero siempre en combinación (por ejemplo Inhibidor de Proteasa + Inhibidor de integrasa). Los regímenes de tratamiento con inhibidores de integrasa producen una recuperación de CD4 más rápida que otros regímenes. Este hecho, si bien es positivo, no está claro si tiene algún beneficio clínico. •Raltegravir Isentress® su nombre comercial. Se administra via oral dos pastillas al día. Disponible en España desde 2008. Comercializado por Merck. A diferencia de los otros inhibidores de la integrasa no requiere ser administrado con ritonavir, por lo que está libre de los efectos adversos de éste. Su vía de metabolización es principalmente por glucuronización, por lo que presenta poco riesgo de interacción con medicamentos que se metabolizan por la vía del citocromo P450 (ejemplo tuberculostáticos, metadona, otros antirretrovirales, etc). Patentes Relacionadas WO03035077 con números de prioridades US 2001 60/339,568 y US 2002 60/362,191; WO2006060712 y WO2006060730 con número de Prioridad US 2004 60/633,132 (Sal de Potasio). En nuestro país la primera publicación referida no presentó solicitud de 10 Patentes de Medicamentos Antivirales y Antirretrovirales patente por lo que es libre su fabricación e importación, en el caso de las segundas publicaciones que protegen (sal de potasio) solicito con N°: 2007-0138; Nº de Cocesión: 1959 RPI; Estatus: Vigente; Fecha de Vencimiento: 01 de Diciembre de 2025 . •Elvitegravir: Gilead Sciences. Actualmente (2008) en fase III de desarrollo. Se administra via oral una sola pastilla al día. Requiere ser administrado con ritonavir como potenciador, por lo que no estaría libre de los efectos adversos de éste. Se metaboliza por el citocromo P450, por lo que puede tener interferencias medicamentosas con fármacos que se metabolizan por esta vía. Gilead está desarrollando otro fármaco que actuaría como potenciador y sustituiría al ritonavir, se llama cobicistat. Gilead ha hecho pública su intención de desarrollar en un solo comprimido de administración una vez al día de tenof ovir+emtricitabina+elvitegravir+cobicistat. No está claro si Gilead lo comercializará únicamente en el comprimido de combinación o si también lo comercializará como fármaco único. Se espera que pueda estar disponible como muy pronto en 2014-2015. Patentes Relacionadas WO2004046115 con números de prioridades JP 2002-336843, JP 2003-065807 y JP 2003-139616 ; WO2005113508 con número de Prioridad JP 2004-150979 ( Formas Cristalinas ) ; y WO2007079260 con números de Prioridades US US 2005 60/755,039, US 2006 60/756,631 y US 2006 60/763,901 ( Farmacocinética Mejorada de W/ RTV ) . En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación. • Dolutegravir : ViiV Healthcare. Actualmente en vías de desarrollo (actualmente en fase II-III). Se administra una vez al día y no requiere ser coadministrado con ritonavir ni con ningún otro potenciador. Se metaboliza por la vía del citorcromo P450, con el consiguiente riesgo de interacciones medicamentosas. Patentes Relacionadas WO2006116764 con números de prioridades JP 2005 0131161 y JP2005 0312076; WO2010068253 con número de Prioridad US 2008 61/193,634 ( Proceso de Síntesis ); y WO2010068262 con número de Prioridad US 2008 61/193,636 ( Intermediarios ). En nuestro país no se presentó solicitud de patente por lo que es libre su fabricación e importación. Inhibidores de la adhesión La fase inicial de la infección por VIH tiene 3 fases: en primer lugar, el VIH se adhiere a la célula a través del receptor CD4; en segundo lugar, se une a los correceptores (CCR5 o CXCR4) y finalmente se fusiona. Los inhibidores de la adhesión actúan en el primer paso de la infección por VIH. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS •BMS 663068: De Bristol-Myers Squibb. Fármaco actualmente en desarrollo clínico. Se trata de un profármaco del principio activo BMS 626529, éste se une a la proteína gp-120 del VIH y bloquea su adhesión a los receptores CD4 impidiendo así la infección del VIH a la célula. Está en investigación para administración oral una vez al día. A final de 2011 iniciará la fase 2b. Si no hay problemas en su desarrollo, podría estar disponible en 2013-2014. Patentes Relacionadas WO 2005117868 con número de prioridad US 2004 60/574,669; y WO03072028 con número de Prioridad US 2008 60/359,452. En nuestro país no se presentó solicitud de patente por lo que es de libre su fabricación e importación Anticuerpos monoclonales antiCCR5 Los anticuerpos monoclonales anti-CCR5, son anticuerpos dirigidos contra estos co-receptores. El principio consiste en colocar el receptor CCR5 frente a céluas blancas de cobayo que crearan anticuerpos dirigidos contra una fracción de este antígeno. Estos anticuerpos no son humanos, para su humanización, la fracción constante del anticuerpo sera humanizada con fracción constante de una IgG de humano. Estos anticuerpos bloquean la unión de la GP120 al receptor de la célula y de esta forma el VIH no logra entrar a la célula, la célula se mantendra intacta y continuara con sus funciones normales. Esto ofrece una gran ventaja, ya que los actuales ARV’s actúan dentro de la célula cuando el VIH ya ha infectado a esta célula. Otra ventaja es la siguiente, pueden ser bien tolerados por el paciente con pocos o ningún efecto secundario, además de que su administración sería mensual. Estos anticuerpos aún no se encuentran en el mercado, pero se esta estudiando su posibilidad con una aplicación clínica, como alternativa al tratamiento del VIH multiresistente, con tropismo al co-receptor CCR5. Combinaciones fijas Unión de varios principios activos en un solo cormprimido o cápsula. •Combivir® = AZT + 3TC : Aprobado el 26 de septiembre de 1997. Comercializado por GlaxoSmithKline. Su problema principal es que produce lipodistrofia en la mayoría de los pacientes, tras el uso 11 Patentes de Medicamentos Antivirales y Antirretrovirales contínuo. Patentes Relacionadas WO9220344 con números de prioridades GB 1991 9110624.5, GB 1991 9121381.9, y GB 1991 9123581.2 ; WO9818477 con número de Prioridad GB 1996 9622681.6 ( Formulación de Tableta). En nuestro país no se presentó solicitud de patente para la primera publicación relacionada, por lo que es de libre su fabricación e importación. En el caso de la segunda publicación que protege ( Formulaciones de Tabletas ) se solicitó patente Nº de Solicitud: 1997-0085; Nº de Cocesión: 1190 RPI; Estatus: Caduca por falta de pago de la Anualidad desde el 30 de Abril de 2007; Fecha de Vencimiento: 29 de Octubre de 2017. •Atripla® = tenofovir + emtricitabina+ efavirenz: aprobado en julio de 2006 en EEUU para dosis única diaria. En Estados Unidos, comercializado por Gilead Sciences y Bristol Myers Squibb.En Europa fue aprobado en diciembre de 2007. En España está disponible desde mayo de 2008. En Estados Unidos, España, Reino Unido, Alemania, Italia, Irlanda y Francia los titulares de la autorización con Gilead Sciences y Bristol Myers Squibb. En el resto del mundo, son Gilead Sciences y Merck Co. •Trizivir® = ABC + AZT + 3TC: Aprobado el 15 de noviembre de 2000. Comercializado por GlaxoSmithKline. Actualmente considerado terapia subótpima. Patentes Relacionadas WO9630025 con números de prioridades GB 1995 9506489 y GB 1995 9506490 ; y WO9955372 con número de Prioridad GB 1998 9809213. En nuestro país no se presentó solicitud de patente por lo que es libre su fabricación e importación. •Kaletra® = Lopinavir + Ritonavir. Aprobado el 15 de septiembre de 2000. Demuestra alta potencia, similar a Invirase (saquinavir) y con frecuencia se utiliza para casos de resistencia viral.Su problema son los efectos secundarios, sobre todo el aumento de los niveles de lípidos en sangre. Comercializado por Abbott. Combinaciones desarrollo: fijas en Las que se encuentran en fases más avanzadas son: tenofovir + emtricitabina+ rilpivirina: Aún no tiene nombre comercial pero a menudo se habla de ella como Btripla, y está siendo desarrollada por Gilead Sciences y Tibotec (J&J). •Kivexa® (nombre en Europa) o tenofovir + emtricitabina+ elvitegravir + Epzicom®(nombre en EEUU) = ABC + cobicistat: 3TC : Aprobado el 2 de agosto de 2004 para dosis única diaria. Sus problemas principales son las reacciones alérgicas potencialmente mortales y que eleva los lípidos en sangre. Comercializado por GlaxoSmithKline. •Truvada® = tenofovir + emtricitabina: Aprobado el 2 de agosto de 2004 para dosis única diaria. Disponible en España desde el 19 de julio de 2006. Comercializado por Gilead Sciences. Se trata de la única combinación de nucleósidos recomendada como preferente por las guías americanas de tratamiento (DHHS HIV treatment guidelines, noviembre de 2008) DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS Al que se llama habitualmente QUAD y está siendo desarrollado por Gilead Sciences. Además de estas, hay otras posibles combinaciones a dosis fija que están siendo valoradas. Estas combinaciones ofrecen la comodidad de la reducción del número de pastillas, pero lamentablemente no todos los pacientes pueden tomarlas debido a características propias de su virus o por intolerancia a las mismas. Igualmente, con la aparición de medicamentos genéricos entre los antirretrovirales, según el precio que tengan estas combinaciones puede que no se justifique su uso por un perfil de coste efectividad desfavorable. 12 Patentes de Medicamentos Antivirales y Antirretrovirales sinergísticos Nombre comercial : Arava® Potencia AZT, similar a HU, RV y ácido micofenólico. No poseen por sí mismos actividad antiviral, pero potencian los efectos de los antivirales. No se utilizan habitualmente. •Hidroxiurea, (HU): Utilizada para anemia falciforme y otros trastornos hematológicos. Potencia al ddI, y en menor grado al AZT y ddC. Posiblemente debido a que prolonga la fase S de crecimiento celular lo que ayuda a los antirretrovirales a permanecer más tiempo en la célula. También inhibe la reductasa de ribonucleótidos lo que genera más absorción de ddI, AZT o ddC. HU puede producir supresión medular y pancreatitis. Existen recomendaciones en contra del uso de HU. •Resveratrol (RV): Producto natural existente en las uvas de la vid (Vitis vinifera) y otros vegetales. potencia ddI, y en menor grado AZT y ddC in vitro. Mecanismo similar a HU. RV es mejor tolerado y tiene menor índice de efectos adversos. •Ácido micofenólico: Es un inhibidor de la deshidrogenasa de inosina. Potencia abacavir pero reduce el efecto de AZT y ad4T. Está aprobado para uso en trasplante de órganos como micofenolato de mofetil, nombre comercial: CellCept®. Existe evidencia de posible actividad contra hepatitis C, haciéndolo de interés particular en el manejo de pacientes coinfectados con VIH y hepatitis C. •Zumo de toronja o pomelo Extracto de producto natural. El zumo de toronja o pomelo puede inhibir la enzima CYP3A4 en el tracto gastrointestinal, no así en la sangre. La administración de zumo antes de la toma de inhibidores de proteasa podría incrementar su biodisponibilidad. •Leflunomida: DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS 13 Patentes de Medicamentos Antivirales y Antirretrovirales Bibliografía 1 - http://wikipedia.orange.es/wiki/Antirretroviral 2 - Página Web Medicines Patent Pool. 3 - Págian Web FDA de los Estados Unidos. 4 - Página Web Registro Sanitario del Canadá. 5 - Página de la Oficina Europea de Patentes: Web worldwide.espacenet.com. 6 - Página Web de Oficina de Patentes y Marcas de los Estados Unidos. 7 - Base de Datos del Patentes del Registro de la Propiedad Intelectual de Nicaragua (Interna). 8 - Página Web del Ministerio de Salud de Nicaragua. DIRECCION DE PATENTES Y NUEVAS TECNOLOGIAS 14