formulación quimica inorgánica (ampliación)
Anuncio

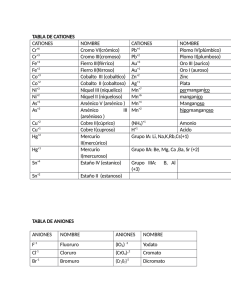
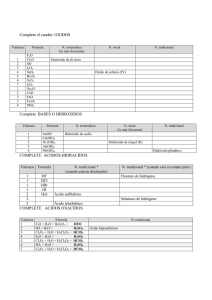
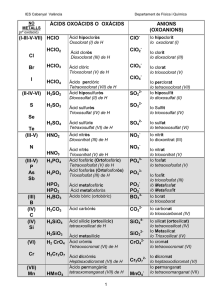
FORMULACIÓN QUIMICA INORGÁNICA (AMPLIACIÓN) PERÓXIDOS Son óxidos que contienen el grupo PEROXO oxígeno tiene número de oxidación de 1-. –O–O– ( O22- ). En estos compuestos cada átomo de - Se nombran anteponiendo la palabra PERÓXIDO al nombre del metal correspondiente. - También se puede usar la notación Stock (indicar el número de oxidación del metal con números romanos encerrados entre paréntesis) Las fórmulas obtenidas no se simplifican Ejemplos K2O2 BaO2 K– O – O – K O–O \ / Peróxido de potasio Peróxido de Bario Ba PEROXOÁCIDOS Son ácidos en donde un átomo de oxígeno se ha sustituido por un grupo PEROXO. Se nombran anteponiendo la palabra PEROXO al nombre del ácido del que provienen. Ejemplos Ác. Sulfúrico H2SO4 Ác. Nítrico HNO3 → Ác. Peroxosulfúrico → Ác.Peroxonítrico H2SO5 (H2SO3O2) HNO4 (HNO2O2) TIOÁCIDOS Ácidos en los que se ha sustituido un átomo de oxígeno por uno de azufre. Se nombran anteponiendo la palabra TIO. Ejemplo Ác. Sulfúrico H2SO4 → Ác. Tiosulfúrico H2S2O3 ÁCIDOS DI (Piro) Resultan de la condensación (unión) de dos moléculas del oxácido más frecuente y la posterior pérdida de una molécula de agua. Ejemplos. 2 H2SO4 - H2O → H2S2O7 Ácido disulfúrico (pirosulfúrico) 2 H3PO4 - H2O → H4P2O7 Ácido difosfórico (pirofosfórico) Ampliación Formulación Q. Inorgánica - 1 ÁCIDOS CON UNIÓN C y N Ácido / Fórmula Anión / Fórmula Ejemplo de sal Ác Cianhídrico H–CN Ác Ciánico H–O–CN Ac. Tiociánico H–S–CN Cianuro NC− Cianato NC–O− Tiocianato NC–S− Cianuro de potasio KCN Cianato de hiero (II) Fe(OCN)2 Tiocianato de sodio NaSCN SALES DOBLES Se obtienen al sustituir los hidrógenos de los ácidos por dos metales (cationes). Éstos se colocan por orden creciente de su carga (Na+ antes de Be2+...) Se nombran intercalando la palabra DOBLE e indicando mediante un prefijo el número de átomos de cada metal presentes. Ejemplos: EJERCICIOS I KAl(SO4)2 Sulfato doble de potasio- aluminio Ca3Al(PO4)3 (Orto)fosfato doble de tricalcio-aluminio (¶) Peróxido de berilio CuO2 Ácido peroxocarbónico NH4SCN Cianuro de amonio H4P2O5 Nitrato doble de cobre(I)-litio Al2(S2O3)3 Cloruro doble de sodio-estroncio FeCr2O7 Tiocianato de hierro(III) PbS2O5 Disulfato de oro(III) KMgAsO4 Ácido peroxosulfúrico Ni(SCN)2 Ácido peroxodisulfúrico P2O54- Peróxido de cinc NaFeS2 Carbonato doble de amonio-cromo(III) H2O2 Ampliación Formulación Q. Inorgánica - 2 EJERCICIOS II 1. Hidróxido de cadmio a. AsH3 2. Sulfuro cuproso b. Co(CN)3 3. Monóxido de manganeso c. CrO3 4. Anhídrido perclórico d. Pb2+ 5. Hidróxido de platino(IV) e. Cu2HAsO4 6. Ácido metafosforoso f. 7. Siliciuro de magnesio g. H2CO4 8. Ácido bromoso h. B2S3 9. Ácido difosforoso i. H4P2O8 10. Ion carbonato - j. Ra(OH)2 k. IO3- 11. Dicromato de mercurio(I) 12. Ion nitruro ZnI2 - l. OF2 13. Peróxido de rubidio m. HgTeO3 14. Ácido bromhídrico n. CuO2 15. Dióxido de nitrógeno ñ. NO 16. Nitruro de fósforo(III) o. CaSrS2 17. Tiosulfato de sodio p. HF 18. Sulfuro doble de amonio y litio q. Sb2O5 19. Hidrogenotelururo de niquel(II) r. CN- 20. Cianato de oro(I) s. Sn(MnO4)4 21. Ion dihidrogenofosfato t. HIO4 22. Peroxosulfato de manganeso(II) u. H2CrO4 Ampliación Formulación Q. Inorgánica - 3 23. Hidruro de cobre(II) a. PbP2O5 24. Anhídrido clórico b. BaO2 26. Sulfuro de estroncio c. AuF3 27. Hidruro de rubidio d. CsOH 28. Óxido ferroso e. HIO3 29. Dióxido de silicio f. H3BO3 30. Anhídrido sulfuroso g. CCl4 31. Monóxido de carbono h. Be(BrO4)2 32. Tetraóxido de dinitrógeno i. Sn3(AsO4)4 33. Peróxido de hidrógeno j. CoS2O2 34. Antimoniuro de cromo(III) k. Hg(CN)2 35. Bromuro de cobalto(III) l. Mg(PO3)2 36. Óxido de manganeso(II) m. AgOH 37. Seleniuro de cromo(VI) n. SbF5 38. Ácido ortoarsenioso o. Cd(NCO)2 39. Ácido tiosulfuroso p. Ra3P2 40. Metasilicato de aluminio q. H2Te 41. Carbonato de plomo(IV) r. Na2O2 42. Dicromato de niquel (III) s. H3SbO4 43. Ácido dioxobórico(III) t. Al(CN)3 44. Clorato de plata u. Au2Cr2O7 45. Fostato de estaño(IV) v. LiHSiO3 46. Selenito(IV) de cadmio w. SiI4 47. Manganato de rubidio x. ZnH2 Ampliación Formulación Q. Inorgánica - 4