Enolatos y Enaminas
Anuncio
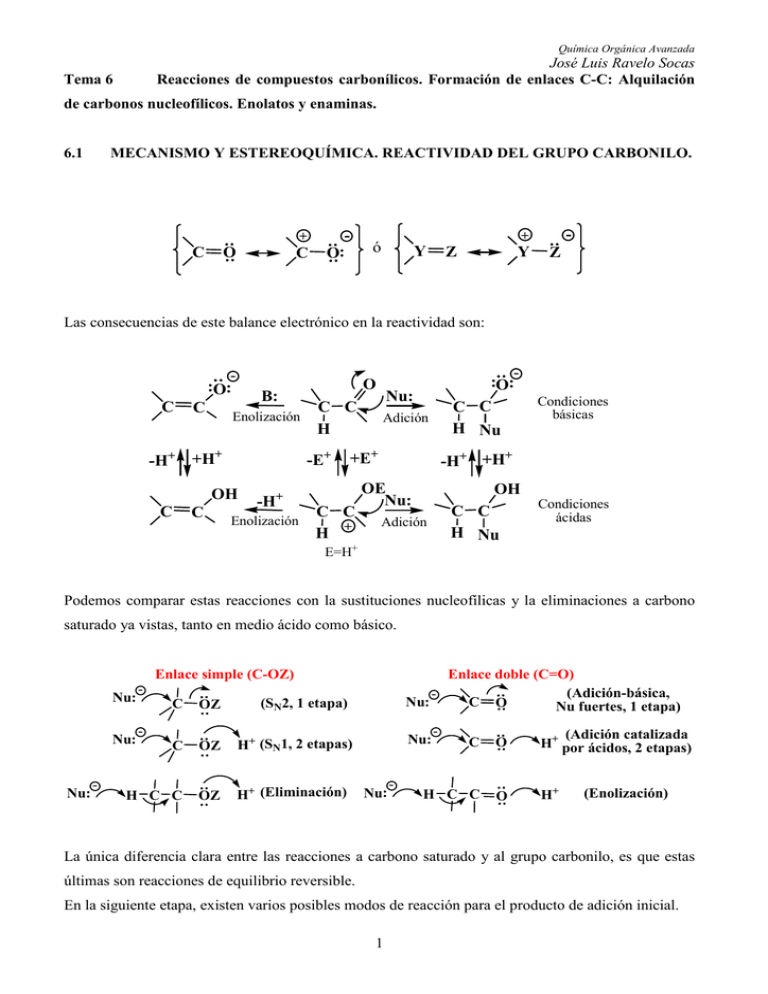
Química Orgánica Avanzada José Luis Ravelo Socas Reacciones de compuestos carbonílicos. Formación de enlaces C-C: Alquilación Tema 6 de carbonos nucleofílicos. Enolatos y enaminas. 6.1 MECANISMO Y ESTEREOQUÍMICA. REACTIVIDAD DEL GRUPO CARBONILO. O C + ó Y Z Y : C O: : : : : + - Z Las consecuencias de este balance electrónico en la reactividad son: C B: -H+ +H+ -E+ OH C O C C Enolización H C C :O: : : :O: Nu: C C H Nu Adición +E+ -H+ C C Enolización H + Condiciones básicas -H+ +H+ OE Nu: OH C C H Nu Adición Condiciones ácidas E=H+ Podemos comparar estas reacciones con la sustituciones nucleofílicas y la eliminaciones a carbono saturado ya vistas, tanto en medio ácido como básico. Enlace simple (C-OZ) : : H+ (SN1, 2 etapas) H C C : : Nu: - H+ (Eliminación) OZ C O (Adición catalizada H+ por ácidos, 2 etapas) H C C H+ Nu: Nu: - - : : OZ - (SN2, 1 etapa) : : C Nu: OZ Enlace doble (C=O) (Adición-básica, Nu: C O Nu fuertes, 1 etapa) : : C : : Nu: - O (Enolización) La única diferencia clara entre las reacciones a carbono saturado y al grupo carbonilo, es que estas últimas son reacciones de equilibrio reversible. En la siguiente etapa, existen varios posibles modos de reacción para el producto de adición inicial. 1 Química Orgánica Avanzada José Luis Ravelo Socas : - O Nu R R´ Producto estable o reversible al carbonilo inicial a) Adición simple : HO Nu R R´ b) Adición-eliminación c) Sustitución O Nu Nu C C+ R R´ R R´ O : - : + Nu C R R L + :L Nu Caso (A): El producto de adición es estable. O C C6H5 OH + LiAlH4 CH3 C6H5 C CH3 H OH CN O + HCN Caso (B): El producto de adición-eliminación. + O R C + HO-R O C HO-R RO C Cetal Ión oxonio C + NH2-R OR N-R Imina (estable) R + R-CH2-CO-R´ C C CO-R´ Caso (C): El producto de sustitución. La enolización produce nucleófilos o grupos electrón-donantes, mientras que el carbonilo es un aceptor de electrones y los aniones enolatos o enoles pueden reaccionar con otros carbonilos. 2 Química Orgánica Avanzada José Luis Ravelo Socas : :O: C + R-L C O-R C C O O - :C C O-alquilación + R-L R C C C-alquilación Finalmente, la enolización sugiere que otros α-enlaces junto a estos hidrógenos también pueden romperse por el mismo camino, para donar electrones a estas especies deficientes: si el enlace es doble tiene lugar la enolización viníloga, o adición viníloga o conjugada. : O O Z + C C : Fragmentación H O : : O H + Condiciones ácidas Hay que tener en cuenta: β 3 - : O C C C : : + : : C C C O - OH Nu C C C Nu C C C : : O C C C C O : : Condiciones básicas : : Nu: + C C C Nu: + C C C Condiciones ácidas : : : : + C C C C : : O Enolización viníloga H C C C C + C C Condiciones básicas : : H C C C C Z - : H+ OH + : O Condiciones ácidas : : : Z C C Adición conjugada - : : : : Z C C Condiciones básicas O OH Química Orgánica Avanzada José Luis Ravelo Socas O O ∆ H3C C H2C C O H O H3C C CH3 + CO2 Fragmentación O H H2C C C C6H5 HCN O H2 H2 NC C C C C6H5 Adición conjugada Estereoquímica. : Nu B:- π C O π H C O C : Nu Enolización Adición Las reacciones de adición al carbonilo ocurren perpendicularmente al plano de la molécula, al enlace π, y así se facilita el solapamiento entre el par de electrones de su orbital con el orbital π deficiente del carbonilo. En la enolización, el enlace del hidrógeno del carbono alfa puede romperse paralelo al orbital π del carbonilo, al tiempo que se solapan para obtener el anión enolato o enol. La enolización sirve para racemizar un carbono alfa asimétrico al carbonilo, aunque el enol no tiene asimetría. La configuración más estable en el carbono alfa resultará del equilibrio de enolización. O(H) O O H+ H ó B- H CH3 Epímero menos estable CH3 H CH3 Enolato ó Enol 4 H H Epímero más estable Química Orgánica Avanzada José Luis Ravelo Socas 6.2 GENERACIÓN DE CARBONO NUCLEOFÍLICO POR DESPROTONACIÓN. : pKa = 36 O CH3-C-CH-C-OEt + EtOH : + O + O: R-CH-N R-CH=N :O::O:: pKa = 17 O O O CH3-C=CH2-C-OEt CH3-C-CH2-C-OEt + EtO- R-CH2=C-R´ + NH3 : : :O:- O R-CH-C-R´ : R-CH2-C-R´ + NH2O : O:- O O :O:- CH3-C-CH2=C-OEt : : R-CH2-NO2 + OH- : : pKa = 15.7 + H2 O El orden de los sustituyentes con respecto a su habilidad para estabilizar carbaniones es el siguiente: NO2 > COR > CN = CO2R > SO2R > SOR > Ph = SR >> H > R (sacado de la obsevación de los valores de las tablas de pKa). O O R-C-CH2 + R-CH2OH ó H2 O EtOH, pKa = 17 : R-C-CH3 + R-CH2Oó OH- t-BuOH, pKa = 19 H2O, pKa = 15.7 Solo convierten una parte pequeña de la cetona en su anión. Con alcóxidos terciarios (más básicos), el equilibrio ácido-base se ve más favorecido y se podrán estabilizar mejor estas bases (enolatos). O O R-C-CH3 + R3CO- : R-C-CH2 + R3COH O : R3C:-, CH3-S-CH2, R2N:Una de las bases más usadas para este propósito es: LDA = [(CH3)2CH]2NLi [(CH3)2CH]2NH + n-BuLi [(CH3)2CH]2NLi + n-BuH Es una base fuerte, y lo suficientemente grande para no actuar como nucleófilo (evita reacciones secundarias). 5 Química Orgánica Avanzada José Luis Ravelo Socas O O R-C-CH2 + [(CH3)2CH]2NH : R-C-CH3 + [(CH3)2CH]2NLi [(CH3)3Si]2N-Li+ ó [(CH3)3Si]2N-Na+ [(CH3)3Si]2NH + n-BuLi 6.3 [(CH3)3Si]2NLi + n-BuH REGIOSELECTIVIDAD Y ESTEREOSELECTIVIDAD EN LA FORMACIÓN DE ENOLATOS. : :O:- : O - B: R2CH-C-CH2-R´ :O:R2C=C-CH2-R´ ó R2CH-C=CH-R´ La composición de una mezcla de enolatos puede ser gobernada por factores cinéticos o termodinámicos. : :O:O Ka : R2CH-C-CH2-R´ + B:- R2C=C-CH2-R´ = A Kb :O: [A] Ka = Kb [B] - control cinético R2CH-C=CH-R´ = B : :O:O Ka R2C=C-CH2-R´ = A K-a K : R2CH-C-CH2-R´ + B:- Kb K-b :O: - R2CH-C=CH-R´ = B [A] Ka / K-a =K= K /K [B] b -b control termodinámico Las condiciones ideales para lograr un control cinético en la formación de un enolato a partir de una cetona, son: 1. La desprotonación es rápida, cuantitativa e irreversible. Esto se logra experimentalmente, por el uso de bases muy fuertes como: LDA ó Ph3CLi. 6 Química Orgánica Avanzada José Luis Ravelo Socas 2. En disolventes apróticos. 3. En ausencia de exceso de cetona. 4. El litio es mejor contraión que el sodio o el potasio para generar regioselectivamente el enolato cinético. Composición de la mezcla de enolatos: : : :O:- :O:- O-COCH3 Ac2O R2C=C-CH2-R´ + R2CH-C=CH-R´ O-COCH3 R2C=C-CH2-R´ + R2CH-C=CH-R´ : : :O:- :O:- R2C=C-CH2-R´ + R2CH-C=CH-R´ O-Si(CH3)3 (CH3)3SiCl O-Si(CH3)3 R2C=C-CH2-R´ + R2CH-C=CH-R´ Ejemplos: termo. a) Regioselectividad. cine. : : : O:- O H3C cine. : O:- H 3C H3C + 28 78 : : 72 22 : : :O:- O C 6H 5 C6 H 5 LDA/THF/-70º KH/THF : LDA/DME Et3N/DMF :O:- O :O:- C3H7-C-CH3 C3H7-C=CH2 LDA/THF/-70º 100% C6 H 5 + 0 100 : : 100 0 b) Estereoselectividad. CH3-CH2-C-C(CH3)3 : O :O:- H3 C Z Control cinético: LDA/THF C(CH3)3 > 98 7 : H3C C(CH3)3 H E <2 :O:: H + Química Orgánica Avanzada José Luis Ravelo Socas En presencia de exceso de cetona puede darse un control termodinámico y aumentar la proporción del isómero E. O-Li+ O - : C6H11-N-CH(CH3)2 Li+ THF, 0ºC H 3C H3 C H3C H3 C En condiciones termodinámicas, el enolato correspondiente a la desprotonación en el carbono γ es el que se presenta en mayor cantidad. CH3 O H3 C C=CH-C-CH3 H3C β α α´ γ 6.4 NH2Na NH3 O- O- CH2=C-CH=C-CH3 >> γ α´ β α H3 C C=CH-C=CH2 H3 C β α α´ γ mayoritario (más estable) minoritario (menos estable) ALQUILACIÓN DE ENOLATOS. La alquilación ocurrirá por un proceso SN2. O O O CH3-C-CH2-C-OEt + CH3(CH2)3Br EtONa EtOH (C6H5)2C-CN - CH3-C-CH-C-OEt (69 - 72%) (CH2)3CH3 C6H5CH2Cl : (C6H5)2CH-CN + KNH2 O (C6H5)2C-CN (98 - 99%) CH2-C6H5 CO2Et EtONa CH2-(CO2Et)2 + Br-(CH2)3-Cl EtOH CO2Et (55%) O O CO2Me + Br-(CH2)6-CO2Et CO2Me (CH2)6-CO2Et HNa DMF (85%) El uso de dihaluros permite la formación de anillos. 8 Química Orgánica Avanzada José Luis Ravelo Socas Por este método es posible obtener anillos de 3, 5, y 6 miembros por alquilación intramolecular. Cl-(CH2)3-CN + NH2Na CN (52 - 53%) Hay que tener en cuenta que los β-cetoácidos y derivados sustituidos del malónico sufren descarboxilación. X O C R H C O C O OH CO2 O C X R´ R´ C C X R´ CH R R X = Ar ó R β-cetoácido X = OH derivado del malónico forma ceto forma enol En el esquema podemos ver un ejemplo. O O CH3-C-CH2 - CH3-C-CH-C-OEt - CH3(CH2)3Br (equivalente sintético de la acetona) O O CH3-C-CH2-(CH2)3CH3 (52 - 61%) O O : EtOH : CH3-C-CH2-C-OEt EtONa O O O H+ CH3-C-CH-C-OEt (CH2)3CH3 O CH3-C-CH-C-O(CH2)3CH3 ∆ H2O/OH- La razón de usar etil-acetoacetato como fuente de carbono nucleofílico en vez de acetona, se basa en: a) El pka del acetoacetato = 10.7, y el pka de la acetona = 20. b) La acetona puede autocondensarse por reacción con su propio enolato. c) A menudo es difícil obtener el producto de mono-alquilación limpio en el caso de la cetona. Otros ejemplos de alquilaciones regioselectivas: H 3C O- O- O LDA THF, -78ºC H3C 25ºC H3C 9 Br Br O H 3C Br (79%) Química Orgánica Avanzada José Luis Ravelo Socas O O Li O CH2-CH=CH2 CH2=CH-CH2-Br Li/NH3 (45%) (trans/cis = 20/1) CH3 CH3 CH3 O OSiMe3 CH3 1) R4N+F-/THF C6H5H2C CH3 2) C6H5CH2Br (89%) La estereoquímica de la alquilación de enolato ha sido estudiada, para establecer la estereoquímca de los productos de alquilación sobre todo en cetonas cíclicas. O- O O Et EtI + Et CH3 Li-O CH3I H + H O H (43%) (1 : 1) (único producto) 6.5 GENERACIÓN Y ALQUILACIÓN DE DIANIONES. O O C-CH2-C-CH3 LDA/THF O-Li+ O C=CH-C-CH3 O-Li+ O-Li+ LDA/THF C=CH-C=CH2 pKa = 9,6 pKa = 20 O O C-CH2-C-CH2-Et 1) Et-I 2) H2O/H+ Podemos controlar la mono-alquilación sin más que elegir la cantidad y naturaleza de la base. Para alquilar ácidos carboxílicos directamente en el carbono alfa, basta usar dos equivalentes de LDA/THF, a través del dianión. 10 Química Orgánica Avanzada José Luis Ravelo Socas (CH2)2C6H5 O-Li+ 1) C6H5(CH2)2Br R R-CH-CO2H LDA R-CH-CO2Li LDA THF THF R´ R´ R´ + O-Li+ 2) H2O/H O-Li+ O-Li+ O CH3-C-CH2-CHO KNH2 2 eq. CH2=C-CH=CH R R´ CO2H (80 - 90%) O 1) C6H5CH2Cl 2) H2O/H+ C6H5CH2-CH2-C-CH2-CHO (80%) O-Li+ O-Li+ O KNH2 CH3-C-CH2-CO2Me 2 eq. CH2=C-CH=C-OMe O (CH3)2C=CHCH2-CH2-C-CH2-CO2Me (85%) 1) (CH3)2C=CHCH2Br 2) H2O/H+ Efecto del disolvente en la alquilación. Los disolventes polares-apróticos (DMF, DMSO, HMPA,…) que presentan altas constantes dieléctricas, y grupos funcionales que favorecen enlaces por puente de hidrógeno implican alta reactividad del ión enolato. O-M+ + disolvente par iónico Opar iónico libre + [M(disolvente)n]+ catión solvatado OO CH3-S-CH3 , H-C-NR2 , O=P[N(CH3)2]3 + DMSO, ε = 47 DMF, ε = 37 HMPA, ε = 30 En el caso de los disolventes polares-próticos. O- O-M+ + disolvente OH par iónico HO disolvente + [M(disolvente-OH)n]+ enolato solvatado catión solvatado En el caso de: THF, DME, Et2O,…, son disolventes poco polares que se coordinan al catión metálico, pero al tener constantes dieléctricas bajas son menos efectivos para separar pares iónicos que los polares apróticos. 11 Química Orgánica Avanzada José Luis Ravelo Socas A veces pueden adicionarse al medio de reacción, reactivos quelantes catiónicos, los cuales elevan la reactividad del enolato, ejemplo los éteres corona. O O H 3C N + N O CH3 M H 3C CH3 O O O O O 18-crown-6 TMEDA 6.6 + Na O + Li O 12-crown-4 O-ALQUILACIÓN FRENTE A C-ALQUILACIÓN. : :O:- O-R´ R´X O R-C-CH2 - R-C=CH2 R´X : R-C=CH2 O O-alquilación R-C-CH-R´ C-alquilación La O-alquilación se ve favorecida cuando el enolato, está más libre, es decir en disolventes polaresapróticos; mientras que en disolventes próticos, o débilmente polares se ve favorecida la Calquilación. O-K+ O O OEt CH3-C=CH-C-OEt + (EtO)2SO2 HMPA t-BuOH THF O O CH3-C=CH-C-OEt + CH3-C-CH-C-OEt Et 83% : 15% polar aprótico 0% : 94% polar prótico 0% : 94% poco polar aprótico El grupo saliente del agente alquilante afecta el tanto por ciento de O-alquilación. O-K + O OEt CH3-C=CH-C-OEt + EtX HMPA O O O CH3-C=CH-C-OEt + CH3-C-CH-C-OEt X = OTs 88% : 11% Et X = Cl 60% : 32% X = Br 39% : 38% X=I 13% : 71% 12 Química Orgánica Avanzada José Luis Ravelo Socas Br Br O O LDA Et2O CH3 H2C CH3 Br Vía O-alquilación O H2C O- Vía C-alquilación LDA Et2O - O O CH2 Br Br C H Br C : O H H C-alquilación O-alquilación - O H En enolatos provenientes de cetonas α,β-insaturados por abstracción del protón del Cγ, tenemos tres potenciales sitios de ataque: “Cα”, “Cγ” y el “O”. La protonación y alquilación en condiciones cinéticas ocurren en el Cα. O CH3-CH=CH-C-OEt 1) LiNR2 2) H2O O O CH2=CH-CH2-C-OEt + CH3-CH=CH-C-OEt (87%) (13%) O O α H 3C NH2Na C=CH-C-CH3 + CH2=CH-C=CH-CH2Br CH2=CH-C=CH-CH2-CH-C-CH3 NH3 H3 C β α CH3 CH3 Cβ (88%) γ CH H3 C 2 γ En el caso del ión fenóxido, se debe tener en cuenta que la C-alquilación destruye la aromaticidad. 13 Química Orgánica Avanzada José Luis Ravelo Socas OCH2C6H5 DMF ó DMSO O+ C6H5CH2-Br O-alquilación 97% CH2C6H5 OH + CF3CH2OH H CH2C6H5 C-alquilación 85% CH2C6H5 O OCH2C6H5 O-alquilación 7% : OH C-alquilación y rearomatización Con disolventes polares (H2O, ROH,…), la fuerte solvatación implica una disminución de la reactividad del oxígeno y favorece la C-alquilación. 6.7 ALQUILACIÓN DE ALDEHIDOS, ÉSTERES Y NITRILOS. La alquilación de aldehidos se realiza indirectamente vía enaminas ó vía sales de magnesio de iminas. (CH3)2-CH-CHO 1) KH/THF 2) BrCH2-CH=C(CH3)2 (CH3)2-C-CH2-CH=C(CH3)2 (88%) CHO Ésteres: también requieren bases fuertes para formar sus enolatos y proceder a su alquilación, se utiliza: R2NLi, LDA a baja temperatura. H 3C H O CH3 1) LDA/DME 2) Br(CH2)3-CH=CH2 O 3) LDA/DME 4) CH3I 14 H3 C H O O (86%) (CH2)3-CH=CH2 H3C CH 3 Química Orgánica Avanzada José Luis Ravelo Socas Nitrilos: pueden desprotonarse con bases no nucleofílicas, relativamente fuertes: LDA, producen C- alquilación. CH3-C N 1) O LiCH2-C N 2) TMSCl LDA/THF (CH3)3SiOCH2CH2CH2-C N (78%) CH2-C N + CH3N(CH2CH2Cl)2 NaNH2 N CH3 N CH3 NC EtO2C meperidina (analgésico) 6.8 ENAMINAS Y METALOENAMINAS. Por condensación de aminas con aldehidos o cetonas, obtenemos iminas. N R´ R-C-R + H2O O R-C-R + R´NH2 Imina Si la amina es secundaria: OH O R-C-CHR2 + R´2NH R´2N-C-CHR2 R +H+ -H2O -H+ + R´2N-C=CR2 R´2N=C-CHR2 R Enamina R El átomo de carbono β en una enamina es un centro nucleofílico. R´2N-C=CR2 : R R´2N-C=CR2 + CH2-X R + + + R´2N=C-CR2 +H R´ N=C-CHR 2 2 Ión Imonio R R : : Esto se utiliza en las alquilaciones: R´´ R + R´2N=C-C-CH2R´´ H2O RR 15 O=C-CR2-CH2R´´ R Química Orgánica Avanzada José Luis Ravelo Socas De particular interés en síntesis han sido la enaminas derivadas de ciclohexanonas. O H CH3 N N + H CH3 CH3 + 9 : 1 N H O Et = repulsión estérica O 1) Et N H CH3 COCH3 2) CH3CO-CHBr-CH3 3) H2O/H+ N R´ CR2 + : R´´-X R´´ N R´ CR2 H2O/H+ O R´-C-CHR2 También con dobles enlaces electrofílicos podría dar adición conjugada. Las metaloenaminas se preparan por desprotonación de iminas (análogo al ión enolato). : NR´ Imina B:- NR´ R-C-CR´´2 : R-C-CHR´´2 :NR´ 16 R-C=CR´´2 Química Orgánica Avanzada José Luis Ravelo Socas Las metaloenaminas son más nucleofílicas que los aniones enolato y reaccionan con halogenuros de alquilo bien. Una aplicación es la alfa-alquilación de aldehidos. O (CH3)2-CH-C-H + (CH3)3CNH2 (CH3)2-CH-CH=NC(CH3)3 EtMgBr MgBr : O H2O/H+ (CH3)2-C-C-H (CH3)2-C-CH=NC(CH3)3 (80%) CH2C6H5 CH2C6H5 (CH3)2-C=CH-N C(CH3)3 C6H5CH2-Cl Con cetonas no simétricas da lugar a la alquilación sobre el carbono alfa menos sustituido. O CH3-C-CH-(CH3)2 6.9 1) N H 2) EtMgBr/THF 3) BuI 4) H2O/H+ O CH3-(CH2)4-C-CH-(CH3)2 ALQUILACIÓN DE CARBONO POR ADICIÓN CONJUGADA. La reacción de enolatos con halogenuros de alquilo requieren un equivalente de base, las adiciones conjugadas ocurren con cantidad catalítica de base. O:- O R-C-CHR2 + B:O:R-C=CR2 + R-C=CR2 + BH O X X BH R-C-CR2-C-C:- O X R-C-CR2-C-CH + B:- Todas las etapas son de equilibrio, el cual se ve favorecido si el producto de partida es un ácido fuerte, y la reacción se lleva a cabo en un medio prótico (ROH), el cual protona el aducto aniónico. 17 Química Orgánica Avanzada José Luis Ravelo Socas La adición directa al carbonilo ( en compuestos carbonilicos α,β-insaturadas), suele ser más rápida que la adición conjugada, sin embargo esta última produce el producto más estable, ya que la reacción se lleva a cabo en condiciones de equilibrio. HO (CH3)2CH-CO2CH3 O O OLi LDA THF C(CH3)2-CO2CH3 + (CH3)2C=C-OCH3 C(CH3)2-CO2CH3 -78ºC 25ºC 88% 7% : : 5% 83% Otros nucleófilos usados en las adiciones conjugadas, además de los enolatos serían: enaminas, cianuros. CH3 CH3 N O 1) O + CH2=CH-C-CH3 O, 16 hr 2) AcONa/AcOH H2O/ ∆ CH(CH3)2 O O CH2CH2-C-CH3 CH(CH3)2 (66%) C6H5 C6H5 CH2(CO2Et)2 + CH2=C-CO2Et EtONa/EtOH (EtCO2)2CH-CH2-CH-CO2Et (60%) CN KOH C6H5-CH-CO2Et + CH2=CH-CN t-BuOH CN C6H5-C-CH2-CH2-CN CO2Et (69 - 83%) La adición de cianuro a compuestos carbonílicos α,β-insaturados, generalmente funcionan en presencia de CNK/ROH o incluso se han dado casos con las especies: Et3Al-HCN o Et2Al-CN, para lograr un alto grado de control estereoquímico. 18 Química Orgánica Avanzada José Luis Ravelo Socas CH3 O CH3 O CNNa THF/H2O H3CO CN (100%) H3CO CH3 C8H17 CH3 C8H17 H 3C H3CO2C Et3Al HCN O H3CO2C 19 H3C (92 - 93%) CN O




