SEMINARIO de los GASES NOBLES
Anuncio

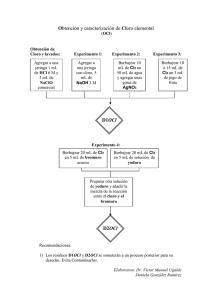
SEMINARIO del Grupo 17 1. Los puntos de fusión en los halógenos aumentan conforme descendemos en el grupo, sin embargo, las energías de disociación lo hacen en sentido inverso. Razona este comportamiento. 2. ¿Por qué la energía de enlace de la molécula H2 es mucho mayor que la de los halógenos?. H2 E (Kcal/mol) 103 F2 Cl2 Br2 I2 37 58 46 36 Justifica este orden. 3. Completa las siguientes reacciones: (a) KClO3 + calor (b) Cl2 + NaOH [5ºC] (c) Br2 + NaOH [30 ºC] (d) Cl2 + I2 (e) F2 + O2 [h] (f) CaF2 + .... HF + .... (g) KClO3 + ..... ClO2 + ... 4. Teniendo en cuenta los siguientes potenciales de reducción en medio ácido, predecir los resultados de las siguientes combinaciones: Eº Cl2/2Cl- = 1.36 v; BrO3-/HBrO = 1.45 v; ClO3-/HClO2 = 1.18 v; HClO2/HClO = 1.67 v. (a) Cl- + BrO3(b) HClO2 + Cl2 5. Justificar el carácter covalente o iónico en los siguientes cloruros: KCl, CaCl2, ScCl3, TiCl4. 6. El iodo se obtiene por reducción del iodato con ioduro en medio ácido. En cambio el cloro y el bromo se obtienen por medio de reacciones de oxidación, por ejemplo del ácido clorhídrico con permanganato potásico y del bromuro de magnesio con cloro, respectivamente. Escribir las ecuaciones completas de las reacciones que se han indicado. 7. Escribe las ecuaciones de síntesis de NaClO a partir del agua de mar. 8. ¿Qué productos de reacción se deben esperar en la reacción de Cl2 con IO3-?. 9. Determina la Hf del ClO2 con los siguientes datos: O=O = 494 KJ/mol Cl-Cl = 240 KJ/mol Cl-O = 218 KJ/mol 10. Sabiendo que Hf del OCl2 es 102.41 KJ/mol. Determina la E (Cl-O) en este compuesto y compara este valor, razonando, con el dato recogido en el ejercicio anterior. 11. Un método para la obtención de OCl2 consiste en reducir KClO3 con H2C2O4. Escribe la ecuación ajustada. 12. Describir la geometría de las siguientes especies utilizando las reglas de Guillespie (VSEPR): ClF; BrF3; ICl2-; IF2+; IF4+; IF6+. Indica los ángulos de enlace y la hibridación del átomo central. 13. A partir de los datos recogidos en los diagramas de Latimer que se adjuntan, (a) ¿qué oxo-derivado de bromo dismuta en medio ácido?; (b) Determina el potencial normal del par BrO3- / Br2 en medio básico; (c) indicar el resultado de mezclar: Cloruro con bromato en medio ácido y cloro con iodato en medio básico. 14. En medio básico el dióxido de cloro descompone. Teniendo en cuenta los siguientes diagramas de Latimer en disolución básica: a) Razona cuales serán los productos formados, ajusta las reacciones que tendrán lugar mencionando explícitamente los valores numéricos de los potenciales. b) ¿Qué reacción tendría lugar si a la disolución anterior le añadimos formiato sódico (NaCO2H)?