Ley de Hess - VaxaSoftware
Anuncio

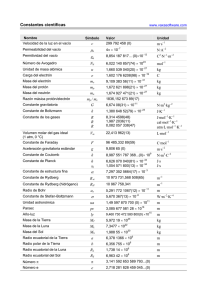
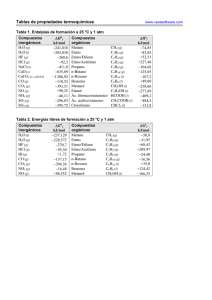
GENERADORES DE EJERCICIOS www.vaxasoftware.com/gp Problemas de Termoquímica: Ley de Hess 1) Dadas las siguientes reacciones a 25 °C: a) C (s) + 1/2 O2 (g) → CO (g) ∆H ° = –110,53 kJ b) C (s) + O2 (g) → CO2 (g) ∆H ° = –393,51 kJ Aplicando la Ley de Hess, calcular la variación de entalpía para la siguiente reacción: CO (g) + 1/2 O2 (g) → CO2 (g) 2) Se conocen las entalpías a 25 °C de las reacciones siguientes: a) 3 C2H2 (g) → C6H6 (l) ∆H ° = –630,81 kJ b) C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ∆H ° = –1299,48 kJ Haciendo uso de la Ley de Hess, determinar la variación de entalpía para la siguiente reacción: C6H6 (l) + 15/2 O2 (g) → 6 CO2 (g) + 3 H2O (l) 3) Dadas las siguientes reacciones a 25 °C: a) H2SO4 (ac) + ZnO (s) → ZnSO4 (ac) + H2O (l) ∆H ° = –211,4 kJ b) H2SO4 (ac) + Zn (s) → ZnSO4 (ac) + H2 (g) ∆H ° = –335,1 kJ c) Zn (s) + 1/2 O2 (g) → ZnO (s) ∆H ° = –409,53 kJ Aplicando la Ley de Hess, calcular la variación de entalpía para la siguiente reacción: 2 H2 (g) + O2 (g) → 2 H2O (l) 4) Dadas las siguientes reacciones a 25 °C: a) N2O5 (g) + H2O (l) → 2 HNO3 (ac) ∆H ° = –142,27 kJ b) N2 (g) + 3 O2 (g) + H2 (g) → 2 HNO3 (ac) ∆H ° = –414,8 kJ c) 2 N2 (g) + 5 O2 (g) → 2 N2O5 (g) ∆H ° = 26,6 kJ Haciendo uso de la Ley de Hess, determinar la variación de entalpía para la siguiente reacción: 2 H2 (g) + O2 (g) → 2 H2O (l) 5) Se conocen las entalpías a 25 °C de las reacciones siguientes: a) H2 (g) + O2 (g) → H2O2 (l) ∆H ° = –187,78 kJ b) 2 H2 (g) + O2 (g) → 2 H2O (l) ∆H ° = –571,66 kJ Aplicando la Ley de Hess, calcular la variación de entalpía para la siguiente reacción: H2O2 (l) → H2O (l) + 1/2 O2 (g) 6) Se conocen las entalpías a 25 °C de las reacciones siguientes: a) 2 C6H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6 H2O (l) ∆H ° = –6535,26 kJ b) H2 (g) + 1/2 O2 (g) → H2O (l) ∆H ° = –285,83 kJ c) 6 C (s) + 3 H2 (g) → C6H6 (l) ∆H ° = 49,08 kJ Aplicando la Ley de Hess, calcular la variación de entalpía para la siguiente reacción: C (s) + O2 (g) → CO2 (g) 1 GENERADORES DE EJERCICIOS www.vaxasoftware.com/gp Problemas de Termoquímica: Ley de Hess 7) Dadas las siguientes reacciones a 25 °C: a) CO (g) + 1/2 O2 (g) → CO2 (g) ∆H ° = –282,98 kJ b) CO (g) + 2 H2 (g) → CH3OH (l) ∆H ° = –132,5 kJ c) CH3OH (l) + 3/2 O2 (g) → CO2 (g) + 2 H2O (l) ∆H ° = –722,14 kJ Haciendo uso de la Ley de Hess, determinar la variación de entalpía para la siguiente reacción: H2 (g) + 1/2 O2 (g) → H2O (l) 8) Dadas las siguientes reacciones a 25 °C: a) H2 (g) + 1/2 O2 (g) → H2O (l) ∆H ° = –285,83 kJ b) H2O (l) → H2O (g) ∆H ° = 44,01 kJ Haciendo uso de la Ley de Hess, determinar la variación de entalpía para la siguiente reacción: H2 (g) + 1/2 O2 (g) → H2O (g) 9) Se conocen las entalpías a 25 °C de las reacciones siguientes: a) C (s) + O2 (g) → CO2 (g) ∆H ° = –393,51 kJ b) SO2 (g) → S (s) + O2 (g) ∆H ° = 296,83 kJ c) CS2 (l) + 3 O2 (g) → CO2 (g) + 2 SO2 (g) ∆H ° = –1076,8 kJ Aplicando la Ley de Hess, calcular la variación de entalpía para la siguiente reacción: C (s) + 2 S (s) → CS2 (l) 10) Se conocen las entalpías a 25 °C de las reacciones siguientes: a) 2 C (s) + 2 H2 (g) + 1/2 O2 (g) → CH3CHO (l) ∆H ° = –164,68 kJ b) H2 (g) + 1/2 O2 (g) → H2O (l) ∆H ° = –285,83 kJ c) C (s) + O2 (g) → CO2 (g) ∆H ° = –393,51 kJ Aplicando la Ley de Hess, calcular la variación de entalpía para la siguiente reacción: CH3CHO (l) + 5/2 O2 (g) → 2 CO2 (g) + 2 H2O (l) Soluciones: –282,98 kJ. 1) –3267,63 kJ. 2) –571,66 kJ. 3) –571,66 kJ. 4) –98,05 kJ. 5) –393,51 kJ. 6) –285,83 kJ. 7) –241,82 kJ. 8) 89,63 kJ. 9) –1194 kJ. 10) 2