Difusión Enfoque atomístico
Anuncio

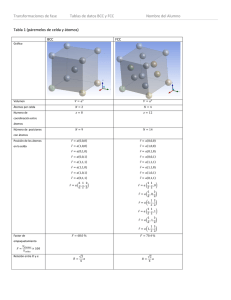
Difusión Enfoque atomístico Estructura cristalina Ma. Eugenia Noguez Amaya Objetivos • Repaso estructura de solidos cristalinos (Redes de Bravais) • Tipos de estructuras • Representaciones gráficas • Parámetro de red y radio atómico • Sitios intersticiales • Repaso Vectores • Difusión en solidos como mecanismo de las transformaciones de fase • Saltos dentro de una red cristalina durante la difusión Redes de Bravais • La estructura de los solidos cristalinos (no amorfos) puede clasificarse de acuerdo al acomodo de sus átomos. • Existen 14 posibles acomodos para los átomos de un solido cristalino, las representaciones geométricas mas pequeñas de la estructura cristalina es lo que se conoce como las redes de Bravais, estudiadas por francés Aguste Bravais en 1850. • Las estructuras mas comunes en las aleaciones metálicas son • HCP (Hexagonal Closed Packed) hexagonal compacta • BCC (Body Centered Cubic) cubica centrada en el cuerpo • FCC (Face Centered Cubic) cubica centrada en las caras • Una celda unitaria es el arreglo mas pequeño que representa la geometría de un solido y al transponerlo muchas veces se obtiene la estructura cristalina Primitivo (Simple) Triclínico Monoclínico Ortorrómbico Tetragonal Centrado en un par de caras Centrado en las caras Centrado en el cuerpo Primitivo (Simple) Romboédrico (Trigonal) Hexagonal Cubico Centrado en un par de caras Centrado en las caras Centrado en el cuerpo Representaciones Gráficas • Existen diversas formas de representar gráficamente un sistema cristalino a fin de visualizar mejor la estructura real o analizar la geometría Parámetros importantes de una celda • 𝑎, 𝑏, 𝑐 representan el tamaño de la celda se conoce como parámetros de red y están el orden de Å o 0.1 nm. (Para sistemas cúbicos solo se necesita especificar 𝑎 , para hexagonal 𝑎 y 𝑐, etc.) • 𝑅 representa el radio atómico está el orden de Å o 0.1 nm. (Generalmente existen ecuaciones para relacionar los parámetros de red 𝑎, 𝑏, 𝑐 con el radio.) a R Ejemplos de relación entre a y R para sistemas cúbicos • FCC • 𝑅= • BCC 2 𝑎 4 • 𝑅= 3 𝑎 4 Tipos de sitios intersticiales • Existen dos tipos de sitios intersticiales en cualquiera de las 14 redes de Bravais • Octaédricos • Tetraédricos • Los datos relevantes para los sitios intersticiales son • Posición dentro de la celda unitaria • Numero de sitios por celda unitaria • Distancia de un sitio intersticial al otro • Numero de coordinación (sitios intersticiales vecinos) • Tamaño del átomo que puede estar en el sitio intersticial Sitios intersticiales en la celda BCC • Sitios octaédricos • Sitios tetraédricos Sitios intersticiales en la celda FCC • Sitios octaédricos • Sitios tetraédricos Relación r/R • Para saber si un átomo cabe en un intersticio se utiliza la relacion 𝑟/𝑅 donde 𝑟 es el tamaño máximo que cabría en un sitio intersticial de una celda con átomos de radio 𝑅 • Para cada tipo de celda hay dos relaciones 𝑟/𝑅 una para los sitios tetraédricos y otra para los octaédricos Puntos dentro de una celda • Algunos puntos de una son de particular interés, por ejemplo los puntos donde se encuentran los átomos • Los puntos dentro de una celda se representan con vectores 𝑟 = 𝑎 0,0,0 1 1 1 𝑟=𝑎 , , 2 2 2 𝑟 = 𝑎 1,1,1 Repaso Vectores • 𝑎 = 𝑎1 , 𝑎2 , 𝑎3 , 𝑏 = 𝑏1 , 𝑏2 , 𝑏3 , 𝑟1 = 1,2,3 y 𝑟2 = 4,5,6 vectores • 𝑐 y 𝑑 escalares • Multiplicación por escalar • (𝑐)𝑎 = 𝑐 𝑎1 , 𝑎2 , 𝑎3 = 𝑐𝑎1 , 𝑐𝑎2 , 𝑐𝑎3 • (𝑑)𝑟1 = 3 1,2,3 = 3,6,9 • Resta vectores • 𝑎 − 𝑏 = 𝑎1 − 𝑏1 , 𝑎2 − 𝑏2 , 𝑎3 − 𝑏3 • 𝑟1 − 𝑟2 = 1 − 4,2 − 5,3 − 6 = −3, −3, −3 • Producto punto • 𝑎 ∙ 𝑏 = 𝑎1 𝑏1 , 𝑎2 𝑏2 , 𝑎3 𝑏3 • 𝑟1 ∙ 𝑟2 = 1 4 , (2)(5), (3)(6) = 4,10,18 • Magnitud de un vector • 𝑎 = 𝑎∙𝑎 = • 𝑟1 = 1 2 + 2 𝑎1 2 2 + 𝑎2 + 3 2 2 + 𝑎3 = 14 2 Difusión • La difusión es el fenómeno donde átomos o moléculas son transportados desde una zona con concentración alta a otra con menor concentración. • Existen dos formas de estudiar la difusión • Modelos atomísticos: se basan en analizar los arreglos atómicos en los solidos y saltos aleatorios dentro de una estructura cristalina • Modelos fenomenológicos: se basan en analizar la composición en un sistema suponiendo que es un medio continuo a través de las leyes de Fick Tipos de difusión • Existen básicamente dos tipos de difusión en el estado solido • Difusión sustitucional: en este caso se considera que un átomo se desplaza dentro de la estructura cristalina desde algún punto en la red hacia una vacancia • Difusión intersticial: los átomos que difunden se desplazan entre los sitios intersticiales dentro de la estructura cristalina Determinacion de la distancia de salto α • Suponiendo una solución intersticial en una celda FCC donde el soluto solo puede estar en los sitios octaédricos 1 1 1 • ¿Un átomo que se encuentra en el sitio 𝑟1 = 𝑎 2 , 2 , 2 y brinca hasta el otro sitio 1 𝑟2 = 𝑎 2 , 1,1 cual es la distancia de salto 𝛼? • Por supuesto esto es para un salto especifico generalmente se debería tomar o el promedio o la moda entre todos los posibles saltos 𝛼 en la red • Para obtener 𝛼 se utiliza la fórmula de distancia entre dos puntos 𝛼 = 𝑑 = ∆𝑟 = ∆𝑟 ∙ ∆𝑟 • Desarrollando los términos se tendría como 𝛼 = ∆𝑟 = 𝑎 𝑟2 − 𝑟1 ∙ 𝑟2 − 𝑟1 1 1 • Para nuestro caso ∆𝑟 = 𝑟2 − 𝑟1 = 𝑎 0, 2 , 2 • ∆𝑟 ∙ ∆𝑟 = • 𝛼=𝑎 1 2 02 = + 𝑎 2 1 2 2 + 1 2 2 2 1 =4=2 Resumen • Estructuras de solidos (redes de Bravais); estructuras comunes HCP, BCC y FCC; representaciones gráficas • Parámetros de red (𝑎, 𝑏, 𝑐 ) y su relación con el radio atómico (𝑅 ) • Sitios intersticiales tetraédricos y octaédricos; análisis en las celdas BCC y FCC • Tamaño del sitio intersticial; relación (𝑟/𝑅) • Puntos en una celda 𝑟 • Repaso vectores; multiplicación por escalar, resta de vectores, producto punto y magnitud. • Difusión; descripción del fenómeno y tipos de difusión en solidos (intersticial y sustitucional) • Determinación de la distancia de salto 𝛼 a partir de la formula de distancia entre dos puntos. Actividad 2 • En una hoja de Calculo Excel • Buscar el valor del radio atómico de átomo de Fe, Cr y C (Incluir unidades en nm) • A partir del valor de radio atómico de Fe obtener el parámetro de red 𝑎 para las fases Austenita (FCC) y Ferrita (BCC). (Incluir unidades en nm) • Determinar el radio máximo para los intersticios de Austenita 𝑟 y Ferrita a partir de la relación ; comparar los resultados con 𝑅 el radio del átomo de C. (Incluir unidades en nm) ¿Dónde se encontraran los átomos de C en intersticios tetraédricos o octaédricos? Actividad 2 • ¿El cromo en las aleaciones que tipo de difusión tendría sustitucional o intersticial?, ¿Porqué? • Se tiene una aleación intersticial de C en Austenita (FCC), obtener la distancia de salto (𝛼) promedio, moda, máxima y mínima. (ayudarse de la hoja de cálculo proporcionada con todas las combinaciones posibles de salto) Objetivos Actividad 2 • • • • • • • Formato fracciones Producto punto Promedio Moda Valor Máximo Valor mínimo Raíz cuadrada