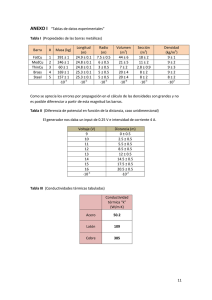
Ejercicios de la unidad 1 1. Preparamos a 55ºC una disolución
Anuncio
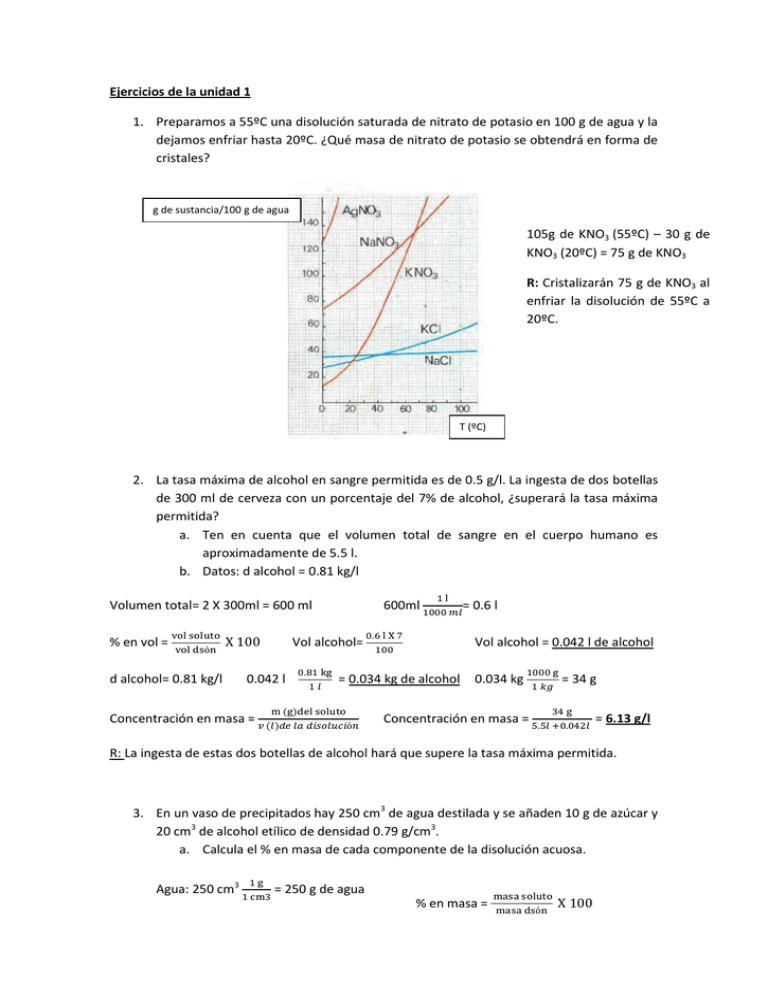
Ejercicios de la unidad 1 1. Preparamos a 55ºC una disolución saturada de nitrato de potasio en 100 g de agua y la dejamos enfriar hasta 20ºC. ¿Qué masa de nitrato de potasio se obtendrá en forma de cristales? g de sustancia/100 g de agua 105g de KNO3 (55ºC) – 30 g de KNO3 (20ºC) = 75 g de KNO3 R: Cristalizarán 75 g de KNO3 al enfriar la disolución de 55ºC a 20ºC. T (ºC) 2. La tasa máxima de alcohol en sangre permitida es de 0.5 g/l. La ingesta de dos botellas de 300 ml de cerveza con un porcentaje del 7% de alcohol, ¿superará la tasa máxima permitida? a. Ten en cuenta que el volumen total de sangre en el cuerpo humano es aproximadamente de 5.5 l. b. Datos: d alcohol = 0.81 kg/l Volumen total= 2 X 300ml = 600 ml % en vol = d alcohol= 0.81 kg/l 600ml Vol alcohol= 0.042 l Vol alcohol = 0.042 l de alcohol = 0.034 kg de alcohol Concentración en masa = = 0.6 l 0.034 kg Concentración en masa = = 34 g = 6.13 g/l R: La ingesta de estas dos botellas de alcohol hará que supere la tasa máxima permitida. 3. En un vaso de precipitados hay 250 cm3 de agua destilada y se añaden 10 g de azúcar y 20 cm3 de alcohol etílico de densidad 0.79 g/cm3. a. Calcula el % en masa de cada componente de la disolución acuosa. Agua: 250 cm3 = 250 g de agua % en masa = Alcohol: 20 cm3 = 15.8 g de alcohol Masa de la disolución = 250+10+15.8 = 275.8 g de disolución % en masa de azúcar = % en masa de azúcar = 3.62 % % en masa de alcohol = % en masa de alcohol = 5.72 % 4. Explica el mecanismo por el que un pez de agua dulce se muere si pasa al mar. Al pasar de agua dulce, con un bajo contenido en sal, al agua salada, las células del pez pierden el agua interior, ya que la concentración de sal en el exterior de las células es mayor que en su interior. 5. ¿Puede una disolución ser saturada y contener una cantidad muy pequeña de soluto? Sí, cuando se trata de un soluto muy poco soluble. 6. Un acero tiene una riqueza del 6% en carbono. ¿Es una disolución o una mezcla heterogénea? ¿Cuál es el soluto y cuál es el disolvente? Calcula la cantidad de carbono contenido en 0.5kg de acero. Es una disolución ya que no se distinguen sus componentes. El soluto es el carbono y el disolvente es el hierro. % en masa = masa del carbono= = 30 g de carbono 7. El análisis químico de un agua mineral indica que, por litro de disolución, contiene 27.2 mg de calcio, 8.8 mg de magnesio y 4.8 mg de sodio. ¿Qué cantidad de esas tres sustancias estaremos ingiriendo si bebemos un vaso de agua de 250ml? Ca: 27.2 mg/l = 0.027 g/l Mg: 8.8 mg/l = 8.8 X 10-3 g/l Na: 4.8 mg/l = 4.8 X 10-3 g/l 250 ml Concentración en masa = = 0.25 l Ca: 0.027 g/l = m Ca = 0.25 l X 0.027g/l = 6.75 X 10-3 g de Ca Mg: 8.8 X 10-3 g/l = m Mg = 0.25 l X 8.8 X 10-3 g/l = 2.2 X 10-3 g de Mg Na: 4.8 X 10-3 g/l = m Na = 0.25 l X 4.8 X 10-3 g/l = 1.2 X 10-3 g de Na Ejercicios de libro Ej 16 pág.191 El agua de cocer lombarda es un indicador ácido-base. Ej 25 pág. 203 El desprendimiento de las burbujas (CO2) es más rápido cuando la piedra caliza está triturada, ya que la velocidad de reacción aumenta con la superficie de contacto. Ej 26 pág. 203 Porque las reacciones de descomposición se producen más lentamente, ya que la velocidad de las reacciones aumenta con la temperatura. Ej 27 pág. 203 Un antioxidante es un catalizador negativo (o inhibidor) de las reacciones de oxidación, no deseadas, de los alimentos. Su misión es disminuir la velocidad de dichas reacciones. Ej.28 pág. 203 Propiedades de los ácidos Propiedades de las bases Sabor agrio Cambian el color de muchos colorantes vegetales Disuelven los metales desprendiendo hidrógeno Pierden sus propiedades al reaccionar con una base Sabor amargo Cambian el color de muchos colorantes vegetales Tacto jabonoso Pierden sus propiedades al reaccionar con un ácido