objetivo.
Anuncio

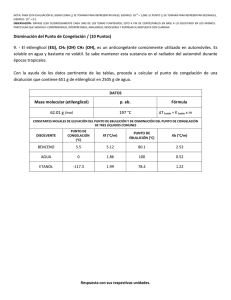
Propiedades Coligativas Punto de ebullición ∆ Tb = Kb m Punto de congelación ∆ Tf = Kf m OBJETIVO. Analizar el efecto que tiene la adición de cantidades diferentes de un soluto no electrolito y un electrolito fuerte sobre el abatimiento de la temperatura de fusión de un disolvente. OBJETIVOS PARTICULARES. a. Determinar la temperatura de congelación de disoluciones acuosas de un electrolito fuerte, a diferentes concentraciones, a partir de curvas de enfriamiento. b. Comparar la temperatura de congelación de soluciones de electrolito fuerte (NaCl y CaCl2) a la misma concentración. PROBLEMA Determinar la relación de la temperatura de congelación de soluciones de no electrolito y de un electrolito fuerte, a la misma concentración El factor de van't Hoff Se define como: moles de particulas i= Valor experimental (medido) = moles de soluto Valor esperado para no electrólito Electrólito y no electrólito Solutos que no se disocian en agua. Para solutos que se disocian completamente Disociación completa Par ionico 1<i<2 Resultados m / ( mol kg-1) t f ( C) T (K) DT e (K) DT no e (K) Algoritmo de cálculos DTno e. = Kf m Disminución de la temperatura de congelación de soluciones de no electrolito Kf = constante crioscópica m = concentración molal i = DT e / DTno e Factor de van t Hoff DT e = Disminución de la temperatura de congelación de soluciones de electrolitos Curva de Enfriamiento