Cinética Química
Anuncio

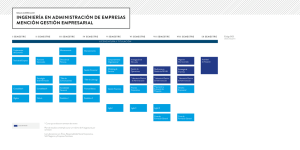
Preuniversitario Solidario Santa María Guía N°16, Electivo. Cinética Química La cinética química es el campo de la química en el que se estudia la rapidez o velocidad de las reacciones, así como los factores que pueden afectar las mismas. En la cinética observamos los procesos químicos en función de la concentración de los reactantes, de los productos de reacción, de los catalizadores, de los diferentes medios disolventes, de la temperatura, y de todas las demás variables que pueden afectar a la velocidad de una reacción en un intervalo de tiempo determinado. Se define la velocidad (V) de una reacción, como la cantidad de reactivo que se consume, o la de producto que se forma, por unidad de volumen en la unidad de tiempo que pueden ser segundos, minutos, horas, etc. (mol/L tiempo). Tanto la concentración de los reactivos como la temperatura influyen en las velocidades de reacciones químicas. El modelo de las colisiones, basado en la teoría cinético-molecular, explica ambos efectos en el nivel molecular. La idea central es que las moléculas deben chocar para que reaccionen. Cuanto mayor es el número de colisiones efectivas que ocurren por segundo, mayor será la velocidad de reacción. www.preusm.cl – Coordinación de Química. Página 1 Preuniversitario Solidario Santa María Guía N°16, Electivo. DEPENDENCIA DE LA VELOCIDAD CON LA CONCENTRACIÓN. La velocidad de una reacción química es proporcional a la concentración (mol/L), de las sustancias reaccionantes. Si dos sustancias homogéneas A y B (gases o soluciones) reaccionan de la forma: La velocidad de la reacción es: V = k [A][B], en la que los corchetes señalan concentraciones en moles por litro, y k es una constante de reacción. DEPENDENCIA DE LA VELOCIDAD CON LA TEMPERATURA. Al aumentar la temperatura las velocidades moleculares aumentan debido a que la energía cinética promedio de las moléculas es proporcional a la temperatura. Luego, al moverse con más rapidez, las moléculas chocan con más fuerza (más energía) y frecuencia (mayor número de colisiones por segundo), con lo cual la velocidad de reacción aumenta. Por lo tanto, se produce un aumento de la velocidad con la elevación de la temperatura. La dependencia con la temperatura de la velocidad de reacción, se debe a la constante de velocidad k, la cual es afectada por la temperatura en forma exponencial, según el modelo de Arrhenius. LEY DE VELOCIDAD Y ORDEN DE LA REACCIÓN. La ley de la velocidad o ecuación de velocidad de una reacción es proporcional a una constante y a la concentración de reactantes, elevados a alguna potencia. Dicha potencia corresponde al orden de los reactivos. La suma de las potencias de los reactivos corresponde al orden de la reacción. Así, la expresión de velocidad para la siguiente reacción: Viene dada por: Donde V es la velocidad de la reacción, k es la constante de velocidad, [A] y [B] son las concentraciones molares de los reactivos, y finalmente α y β son los órdenes de reacción con respecto a A y B, respectivamente. www.preusm.cl – Coordinación de Química. Página 2 Preuniversitario Solidario Santa María Guía N°16, Electivo. Cabe destacar que los órdenes individuales respecto de cada reactante se determinan experimentalmente, y sólo para reacciones elementales (de un solo paso) coinciden con los coeficientes estequiométricos. El orden global de la reacción es la suma de los exponentes y puede ser un número entero o fraccionario. DETERMINACIÓN DE PARÁMETROS DE LA ECUACIÓN DE VELOCIDAD. A continuación se muestra una tabla con los valores experimentales de las concentraciones de dos reactivos con su velocidad en un momento determinado, así podremos calcular el orden de los reactivos, la constante y el orden global de reacción. Experiencia [A] mol/L [B] mol/L Velocidad mol/Ls 1 0,02 0,01 4,4x10-4 2 0,02 0,02 17,6x10-4 3 0,04 0,02 35,3x10-4 4 0,04 0,04 140,8x10-4 www.preusm.cl – Coordinación de Química. Página 3 Preuniversitario Solidario Santa María Guía N°16, Electivo. ENERGÍA DE ACTIVACIÓN. La figura siguiente se conoce generalmente como perfil de energía, y muestra el cambio de energía (potencial) que se produce a medida que los reactantes se convierten en productos. Reacción endotérmica El eje vertical corresponde entonces a la energía potencial, y el eje horizontal corresponde al grado de avance de la reacción (coordenada de la reacción). Si la reacción es endotérmica (se absorbe energía), la energía que poseen los productos va a ser mayor a la energía que poseen los reactivos. Para el caso exotérmico es lo contrario, como muestra la siguiente figura. Reacción Exotérmica www.preusm.cl – Coordinación de Química. Página 4 Preuniversitario Solidario Santa María Guía N°16, Electivo. La energía absorbida o liberada, según sea la reacción endotérmica o exotérmica, se indica como Ereacción en la figura. Eact es la energía de activación, y corresponde al punto donde tiene lugar el complejo activado (especie o tipo de molécula altamente inestable con una elevada energía potencial). Para sistemas reversibles las concentraciones de los reactantes y del producto tienen un valor constante que no cambia en el tiempo, a menos que se modifique la temperatura. CATALIZADORES Los catalizadores son sustancias que intervienen en las reacciones, acelerándolas o retardándolas y que siguen presentes al finalizar la reacción (no se consumen en ésta). Es decir, cambian la velocidad de reacción. Son características de los catalizadores: Gran desproporción entre la masa de las sustancias que reaccionan y la pequeña masa del catalizador. El catalizador se halla igual al final del proceso, que al comienzo de él. Un catalizador no produce una reacción diferente, solo modifica la velocidad de la misma. Los catalizadores son específicos de cada reacción o de un cierto grupo de reacciones. Un catalizador no altera Ereacción, pero si afecta Eact. En el caso que el catalizador aumenta la velocidad de reacción, la energía de activación se ve disminuida debido a la acción del catalizador. www.preusm.cl – Coordinación de Química. Página 5 Preuniversitario Solidario Santa María Guía N°16, Electivo. www.preusm.cl – Coordinación de Química. Página 6 Preuniversitario Solidario Santa María Guía N°16, Electivo. EJERCICIOS CINÉTICA El gráfico representa el proceso cinético de la siguiente reacción, que puede ocurrir en ambos sentidos: 1. 2HI ( g ) H 2( g ) I 2( g ) La línea curva punteada representa la misma reacción, pero catalizada. En el gráfico, I) E1 es la energía de activación del proceso inverso catalizado (<-). II) E2 es la energía de activación del proceso inverso no catalizado (<-). III) E3 es la energía de activación del proceso directo no catalizado (->). Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y II. E) I, II y III. 2. En una reacción química, simbolizada por la ecuación C A B Un catalizador apropiado puede disminuir www.preusm.cl – Coordinación de Química. Página 7 Preuniversitario Solidario Santa María Guía N°16, Electivo. I) La entalpía de la reacción. II) La energía de activación de la reacción. III) El valor de la constante de equilibrio. Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y II. E) I, II y III. Sabiendo que la velocidad de una reacción química depende de la temperatura, ¿cuál de los siguientes gráficos representa la variación de la velocidad (v) en función de la temperatura (t)? 3. 4. Para la reacción: 2 NO( g ) 2H 2( g ) N2( g ) 2H 2O( g ) La ecuación de velocidad es de orden 2 para NO y de orden 1 para H2. Según estos datos, la mejor manera de expresar la ecuación de velocidad para esta reacción es www.preusm.cl – Coordinación de Química. Página 8 Preuniversitario Solidario Santa María Guía N°16, Electivo. A) v k [ NO]2 [ H 2 ] B) v k[ NO]2 [ H 2 ] C) v k[ NO]2 [ H 2 ]2 D) v k[ N2 ]2 [ H 2 ] E) v k[ N2 ][ H 2O] El transcurso de una reacción química se puede representar por el siguiente esquema (Energía en unidades arbitrarias): 5. Respecto a la reacción, se puede decir que I) Se trata de una reacción exotérmica. II) La energía de reacción de los reactantes es mayor que la energía que se libera. III) El punto más alto de la curva representa la energía del complejo activado. Es (son) correcta(s) A) Sólo I. B) Sólo II. C) Sólo III. D) Sólo I y III. E) I, II y III. www.preusm.cl – Coordinación de Química. Página 9 Preuniversitario Solidario Santa María Guía N°16, Electivo. 6. Para la reacción 2 NO( g ) 2O2( g ) 2 NO2( g ) Se tienen los siguientes datos cinéticos: Concentración inicial [mol/L] [NO] 1,0E-03 1,0E-03 1,0E-03 2,0E-03 [O2] 1,0E-03 2,0E-03 3,0E-03 3,0E-03 Velocidad de Formación del NO2 [mol/L s] 7,0E-06 1,4E-05 2,1E-05 8,4E-05 ¿Cuál es el orden de la reacción con respecto al NO? A) 0 B) 1 C) 2 D) 3 E) 4 www.preusm.cl – Coordinación de Química. Página 10