EL BORO
Anuncio

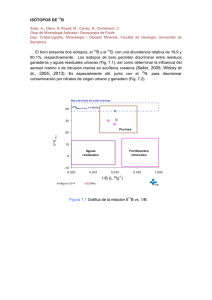
EL BORO Daniel Toro Domínguez Biotecnología LDO. E-mail: Dani_hking@hotmail.com El Boro [B] es un elemento químico de número atómico 5 y de peso molecular 10,81g/mol. Es un metaloide y se comporta como semiconductor (mal conductor a temperatura ambiente). Es trivalente, puede formar 3 enlaces, debido a que tiene vacantes de electrones en el orbital externo, lo que le proporciona una “apetencia de electrones”. El boro posee un elevado punto de fusión (2348 K), Se comporta como un ácido de Lewis. Na Na B Na • • Ejemplo de estructura de Lewis de un compuesto de Boro. Es muy duro (la forma metálica alcanza el 9,3 en la escala de Mohs). Es el metaloide que tiene la más alta resistencia a la tracción*(fundido tiene una resistencia mecánica de entre 1600 y 2400 NPa*) Características ópticas: transmisión de la radiación infrarroja. Debido a que es trivalente, comparte con el Carbono (tetravalente) la capacidad de formar redes moleculares mediante enlaces covalentes. No se encuentra libre en la naturaleza. En la naturaleza se encuentran dos isótopos de boro, 11B (80,1%) y 10B (19,9%). *Ejemplo de red molecular de Boro. Tiene varias formas Alotrópicas: por ejemplo el boro amorfo( polvo marrón) o el boro metálico (de color negro) Tienen como elemento estructural común un Icosaedro* regular, que puede ordenarse de varias formas distintas. • Unión de dos icosaedros por dos vértices, mediante enlaces covalentes normales B - B (figura 1). • Unión de tres icosaedros por tres vértices, mediante un enlace de tres centros con dos electrones (figura 2). # Arriba figura 1, a la derecha figura 2 • Otras estructuras de Boro… Boro tetragonal: 50 átomos de B por celdilla unidad. 4 unidades icosaédricas unidas entre si B-B*¹ ,que actúa como unión tetraédrica. Densidad= 2,31g\cm³. Boro romboédrico α: 12 át. por celdilla unidad. Láminas de icosaedros unidas paralelamente. Uniones intralaminares de 3 centros.*² Uniones interlaminares de 2 centros.*³ Densidad=2,46g\cm³. Boro romboédrico β: 105 át. Por celdilla unidad. Formado por 12 icosaedros B12, ordenados de forma icosaédrica en torno a un icosaedro B12 central. [B12(B12)12] Densidad=2,35g\cm³. *¹ enlaces covalentes entre Boro elemental. *² uniones entre 3 átomos (de boro en este caso). *³ uniones entre 2 átomos (de boro en este caso). Un poco de Historia… Los compuestos de Boro se conocen hace miles de años en varias culturas (en árabe buraq, en persa burah), por ejemplo en Egipto, para la momificación, se utilizaba natrón, que contiene compuestos de boro. En la antigua Roma se utilizaban cristales de Bórax y también en hacia el 300 a.C. A partir del siglo VIII los boratos fueron usados en refinerías de oro y plata. En 1808 Humphry Davy, Gay- Lussac y L. J. Thenard obtuvieron boro con una pureza del 50% aproximadamente, aunque ninguno de ellos reconoció la sustancia como un nuevo elemento, cosa que haría Jöns Jacob Berzelius en 1824. El boro puro fue producido por primera vez por el químico estadounidense W. Weintraub en 1909. APLICACIONES • El compuesto de Boro de mayor importancia es el bórax, que se emplea mayoritariamente en la obtención de fibra de vidrio aislante y perborato de sodio. •Las fibras de boro tienen aplicaciones mecánicas, por ejemplo en la industria aeroespacial (Alcanzan resistencias mecánicas de hasta 3600 MPa) •El boro amorfo se usa en fuegos artificiales (color verde-marrón) •El boro se usa como semiconductor. •Aplicaciones de síntesis orgánica* y fabricación de cristales boro-silicatos. •El ácido bórico se emplea en productos textiles. •Conservantes de madera (por su baja toxicidad). •Los hidruros de boro oxidan fácilmente, liberando grandes cantidades de energía, por lo que se está estudiando como posible fuente de combustible. El B-10 se usa en el control de los reactores nucleares, como escudo frente a las radiaciones y en la detección* de los neutrones. Distribución La abundancia del boro en el universo a sido estimada en 0,001 ppm (muy baja), por ejemplo en los meteoritos hay concentraciones de entre 0,4 y 1,4. •En la corteza terrestre la concentración es de 10 ppm y su masa de 2,4 × 1017 kg. Es más abundante en rocas sedimentarias . El boro llega a la corteza terrestre a través de la precipitación atmosférica, el volcanismo y la sedimentación (en los océanos). En las rocas ígneas, las concentraciones más altas están en las rocas más cristalizadas, como el granito(85ppm). • En la hidrosfera (4,6 ppm y en una masa de 5,4 × 1015 kg ) se encuentra como componente de dos moléculas hidratadas; el B(OH)3 trigonal y el B(OH)4- tetraédrico. • Para las plantas el boro es un nutriente esencial. Parece tener un papel fundamental en el mantenimiento de la estructura de la pared celular (mediante formación de grupos cis-diol ) y de las membranas. Su exceso/ déficit es perjudicial, debilitando a las plantas.