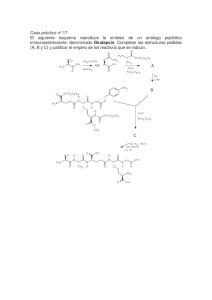
1 TEMA-1. Leyes ponderales. Concepto de mol. Clasificación de la
Anuncio

1 TEMA-1. Leyes ponderales. Concepto de mol. Clasificación de la materia La materia puede presentarse de forma homogénea,(mismas propiedades en todos sus puntos), o heterogénea,(distintas propiedades en sus distintos puntos). Normalmente tanto si se presenta de forma homogénea o heterogénea se trata de mezclas de sustancias que pueden separarse entre sí por métodos físicos: destilación; decantación; filtración, cristalización…etc. Por otra parte la materia que se presenta de forma homogénea puede ser una mezcla de sustancias,(disolución), o una sustancia pura. Las mezclas heterogéneas, y según sea el tamaño de las partículas pueden ser dispersiones coloidales; suspensiones o mezclas groseras… La diferencia básica entre una disolución y una sustancia es que la primera tiene unas propiedades variables que dependen de la proporción en que mezclemos los componentes, mientras las segundas tienen unas propiedades características: color, densidad,…etc Las sustancias puras pueden ser de dos tipos: compuestos, que pueden ser separadas en otras más simples mediante procedimientos químicos y sustancias elementales que no pueden descomponerse en otras más simples. Más adelante estudiaremos la diferencia entre elemento y sustancia elemental. En el siguiente esquema viene resumido todo lo explicado anteriormente. 2 Leyes ponderales La Química, como actividad científica, comenzó al poder expresar de forma cuantitativa las relaciones entre las sustancias que intervenían en la reacción,(reactivos), y las sustancias formadas,(productos). En un orden lógico de exposición y de menos a más complicadas, son tres las leyes ponderales,( referidas a las masas de las sustancias que intervienen): Ley de Lavoisier o de conservación de la materia: “ la masa consumida de los reactivos es igual a la masa obtenida de los productos”. Ley de Proust o de las proporciones definidas: “cuando se combinan dos o más elementos para dar un determinado compuesto siempre lo hacen en una relación de masas constante”. Ley de Dalton o de las proporciones múltiples: “cuando dos elementos se combinan para dar dos o más compuestos, si tomamos una cantidad fija de uno de ellos las cantidades del otro están en una proporción numérica sencilla” Las dos primeras son leyes experimentales y la tercera una ley deducida de la Teoría Atómica. Con ayuda de la ley de Proust podemos establecer un concepto mucho más preciso de sustancia pura: • Materia homogénea de composición constante,( y por lo tanto de propiedades características).Esto la diferencia de una disolución. • Materia homogénea de composición variable, ( y por lo tanto de propiedades variables).(Disoluciones) Teoría atómica de Dalton La podemos resumir en los siguientes postulados: • Los elementos químicos están formados por átomos, indivisibles e indestructibles. 3 • • • Todos los átomos de un mismo elemento son iguales en masa y en las demás propiedades. Los de los distintos elementos se diferencian en la masa y en las demás propiedades. Los elementos se combinan para formar un determinado compuesto en una relación atómica constante para éste (fórmula empírica). En una reacción química los átomos se redistribuyen de distinta manera pero conservándose el número de cada clase. Ley Gay-Lussac. Ley de Avogadro Gay-Lussac midió el volumen de los gases, reactivos o productos; que intervienen en una reacción química encontrando como hecho experimental la siguiente: Ley de Gay-Lussac o de los volúmenes de combinación: “los volúmenes de los gases que intervienen en una reacción química, medidos en las mismas condiciones de presión y temperatura, están en una relación numérica muy sencilla”. (Recuerda que el volumen de un gas depende mucho de la presión y temperatura a que está sometido, por lo que para poder comparar volúmenes de distintas sustancias gaseosas nos tenemos que asegurar que las medimos en las mismas condiciones de presión y temperatura). Para poder explicar esta ley Avogadro supone que en los gases existen moléculas, (agrupaciones o agregados de átomos), incluso en el caso de que se trate de un elemento. Hoy día podríamos definir como molécula a la última partícula físicamente distinguible de una sustancia. Ley de Avogadro: “Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura contienen el mismo número de moléculas”. En realidad no es rigurosamente cierto que todos los gases sean moleculares: los gases nobles,(He; Ne; Ar…etc) son atómicos. Con un ejemplo podemos comprender ahora por qué se cumple la ley de Gay-Lussac. Sea la reacción de combustión del agua. Experimentalmente sabemos que dos litros de gas hidrógeno necesitan 1 litro de oxígeno para su combustión. Pero la ecuación ajustada será: 2 H2 (g) + O2 (g) → H2O (l) 4 Es decir necesitamos doble número de moléculas de H2 que de O2, lo que significa según la ley de Avogadro que el volumen de H2 tiene que ser doble que el de O2 Masa atómica. Peso atómico Para medir la masa de los átomos definimos una escala de masas atómicas referida al C12. Se toma el C por ser el elemento que forma más compuestos. Como sabes de cursos anteriores el C se presenta en la naturaleza en distintos isótopos: C12, C13 y C14. Este exponente expresa el número de partículas del núcleo de estos átomos. Tomaremos como unidad de masa atómica, (u), la doceava parte de la masa de un átomo de C12. Esto nos permite definir la masa atómica y el peso atómico o masa atómica relativa de cualquier elemento químico. Para ver la diferencia entre ambos conceptos observemos el caso del C: Masa atómica: M(C)= 12,01 (u) ; peso atómico: Pa(C)= 12,01. En cualquier tabla periódica encontramos los datos de los pesos atómicos de los distintos elementos. El peso atómico que aparece en la Tabla Periódica es el peso atómico promedio. Así por ejemplo en la naturaleza existen dos isótopos del Cl: Cl35(75%) y Cl37(25%). El Peso atómico promedio será: Pa(Cl) = 75.35+37.25 = 35,5 100 También podríamos definir, para las sustancias compuestas, la masa molecular y el peso molecular o masa molecular relativa. A partir de la fórmula de la sustancia obtendríamos el Pm de la misma como suma de los Pa de los distintos átomos. La masa de una molécula será: Pm (u) Concepto de mol. Número de Avogadro En todos los cálculos químicos ocupa un lugar central el concepto de mol : “ Cantidad de sustancia de un sistema, que contiene tantas entidades elementales, del tipo considerado, como átomos de C12 hay en 0,012 kg de C12”. Hay que recordar que la cantidad de sustancia, en el S.I., es una de las siete magnitudes fundamentales y su unidad es el mol antes definido. 5 Para representar esta magnitud utilizaremos la letra n y entre paréntesis el símbolo o nombre de la entidad elemental considerada. Así n(H2O)= 2,3 mol. Este número de átomos de C12 que hay en 0,012 kg de C12 es el número de Avogadro y tiene un valor de : No= 6,02.1023. También podemos definir a partir de él y del concepto de mol una constante fundamental, denominada constante de Avogadro: NA= 6,02.1023 mol-1 Para el número de entidades elementales utilizaremos la letra N y entre paréntesis el símbolo o nombre de dicha entidad. Por ejemplo N(H2O) = 3,01.1024. Como podemos ver este número de moléculas de agua corresponde a n(H2O) = 0,5 (mol) Masa molar Si consideramos la definición de número de Avogadro y de unidad de masa atómica se llega a una relación entre la unidad de masa atómica y el gramo que es la unidad de masa empleada en los cálculos químicos: La masa, en g, de un átomo de C12 será 12/No (g) ya que en 12 g de C12 hay No átomos de C12; pero de la definición de unidad de masa atómica sabemos que es 12(u) la masa de 1 átomo de C12. Por lo tanto igualando ambas cantidades se llega finalmente a: 1(u)= 1/No(g) (1) Supongamos que tenemos la sustancia X de la que conocemos su Pm(X). Estamos interesados en conocer la masa de un mol de dichas partículas. Para calcularla tendremos: masa de 1 mol de X = No.masa de X = No.Pm(X)(u)= No.Pm(X).1/No(g) =Pm(g). Es decir “la masa de un mol de partículas de una sustancia es igual a su peso molecular expresado en g”. La masa molar de una sustancia será : Pm(g/mol) (2) Esto último es la base de los cálculos referidos a una sustancia, ya que nos permite relacionar la masa, m(g), la cantidad de sustancia, n(mol) y el número de partículas N: 6 n(X)= m(X)/Pm y N(X)=NA.n(X) (3) Ecuación de estado de los gases Las leyes referentes al comportamiento físico de los gases vienen reflejadas en su ecuación de estado: p.V = n . R. T (4) En esta ecuación tenemos: • p: presión del gas medida en atm; mm de Hg; bar o Pa. 1bar=105Pa; 1 Pa= 1N/m2 ; 1 atm = 760 mm de Hg ; 1 atm = 1,01325 bar. • V: volumen del gas medido en m3; cm3 o litros. 1 m3=1000 litros. • T: temperatura termodinámica en K: T(K) = t(ºC) + 273. • n: cantidad de sustancia en mol. • R: constante de los gases. Se utilizan en la práctica los siguientes valores: 0,082 atm.L.K-1.mol-1; 0,083 bar.L. K-1.mol-1 ;8,3 Pa.m3. K-1.mol-1 La ecuación anterior puede ser aplicada para calcular el volumen molar de un gas, haciendo n = 1 mol. Quedará: RT Vm = (5) P Es fácil recordar el valor del volumen molar de un gas en condiciones normales, ( 0ºC y 1 atm): 22,4 L/mol Ley de Dalton de las presiones parciales Para que se cumpla la ecuación de estado el gas tiene que tener un comportamiento ideal. Entonces el volumen ocupado por las moléculas es nulo y no se ejercen ninguna fuerza entre ellas. En estas condiciones cada gas ejerce una presión,(parcial), como si fuese el único que ocupa el recipiente. Por tanto podemos usar la ecuación de estado para calcular dicha presión, teniendo en cuenta que ahora n es solo la cantidad de sustancia del gas considerado y no el total. 7 Es decir que si tenemos n(A) del gas A y n(B) del gas B la presión parcial de cada uno de ellos vendría medida por: PA . V = n(A) R T y PB . V = n(B) R T (6) Cálculos químicos referidos a una sustancia En el esquema tenemos un resumen de los cálculos a realizar si tenemos una sustancia Estamos indicando en el esquema que es la cantidad de sustancia n, la magnitud clave en estos cálculos químicos ya que para pasar de un vértice a otro tenemos que conocer el valor de esta magnitud. Se ha representado la magnitud que hemos de usar para llegar desde un vértice a n. Hay que tener en cuenta que estos cálculos pueden ser hechos con ayuda de una ecuación, una proporción ( regla de tres) o por factores de conversión. Como ejemplo calculemos el número de moléculas de agua que hay en 25 g de esta sustancia. Lo primero que tenemos que calcular es su Pm: 2.1+ 16 = 18. Por lo tanto su masa molar sería: 18 g/mol. a) Utilizando ecuaciones: 18(g/mol) = m(g) 20(g) y n(H2O) = 20/18 (mol) y de aquí : 18g/mol = n n(mol) N(H2O) = NA.n = 6,02.1023(1/mol). 20/18 (mol) = 6,69.1023 b) Por proporciones: Como: 1mol de H2O…………..18 g de H2O resolviendo: x = 20/18(mol) x………………...20 g de H2O 8 Y 1mol de H2O………….6,02.1023moléculas de H2O resolviendo x = 6,69.1023 20/18 (mol) de H2O……………………x c) Por factores de conversión: Se trata de ir multiplicando el dato inicial por factores que, conceptualmente, sean la unidad: 20g de H 2 O. 6,02.1023moléculas de H 2 O 1mol . = 6,69.1023 moléculas de H 2 O 18gdeH 2 O 1mol Cada una de las dos fracciones es ,conceptualmente, la unidad. Al multiplicar con el factor de conversión conseguimos cambiar de unidad. Otro de los cálculos básicos es la obtención de la fórmula de una sustancia a partir de su composición centesimal. Veamos como se hace con un ejemplo. Supongamos que sabemos que un compuesto tiene la siguiente composición centesimal: O : 42,93% N: 28,19% P: 20,78% H: 8,11% Para encontrar la fórmula empírica suponemos que tenemos 100 (u) de sustancia y vamos a calcular el número de átomos de cada elemento que hay en esas 100 (u): O: 42,93/16 = 2, 68 N: 28,19/14 = 2,01 P: 20,78/31 = 0,67 H: 8,11/1 = 8,11 De acuerdo con esto la fórmula empírica será: O2,68N2,01P0,67H8,11 Evidentemente esta proporción debemos convertirla en relación entre números enteros. Para ello dividimos todos por el menor: O: 2,68/0,67 = 4 N: 2,01/0,67 = 3 P: 0,67/0,67 = 1 H: 8,11:0,67 = 12 La fórmula empírica será: O4N3PH12 ( La ordenación correcta es en este caso: (NH4)3PO4) 9 Otra cuestión es si nos preguntan la fórmula molecular. Veamos un ejemplo: Un hidrocarburo tiene la siguiente composición: 88,83% de C y 11,17% de H. Si sabemos que su peso molecular es 54, calcular su fórmula molecular. Comenzamos de la misma forma que en el problema anterior: C: 88,83/12 = 7,4 H: 11,17/1 = 11,17 Luego la fórmula empírica será: C7,4 H11,17 . Dividiendo ambos por el menor queda: C: 7,4/7,4 = 1 H: 11,7/7,4 = 1,5 Esto nos da una fórmula empírica de C1H1,5 que podemos transformar multiplicando ambos números por 2: C2H3 Para calcular su fórmula molecular consideramos que debe ser un múltiplo de la empírica: C2xH3x Pero los pesos moleculares respectivos deben estar en la misma proporción que las fórmulas: Pm(C2xH3x) = x Pm(C2H3) Sustituyendo queda: 54 = x 27 ; x = 2 La fórmula molecular de la sustancia es: C4H6 ( Realmente es: CH≡C-CH2-CH3, y otros isómeros). 10 Ejercicios 1. En la tabla encontramos datos referentes a la obtención de un compuesto entre S y Fe. Los datos de la masa se refieren a las masas consumidas en varias experiencias. ¿Podrías completarla?: Masa de S Masa de Fe Masa de consumido(g) consumido(g) compuesto(g) 3,3 5,8 2,0 9,1 5,5 3,0 3,0 3,0 2. ¿Qué masa tendrá una molécula de CO2?. Sol: 7,3.10-23(g) 3. ¿Cuántas moléculas de SO3 existirán en 50 g de esta sustancia?. Sol: 3,8.1023 4. Calcular la masa de C4H10 existente en 250 litros de gas medidos a 150ºC y 2,3 bar. Sol: 950 (g) 5. Calcular el volumen molar de un gas 100ºC y 780 mm de Hg. Sol: 29,9 (l/mol) 6. ¿Cuál es la densidad del CO2 a 2 bar y 50ºC?. Sol: 3,3 (g/l) 7. Calcular el % de N en la sustancia: (NH4)2S2O7. ¿ Qué masa de la misma tenemos que tomar para tener 1 kg de N. Sol: 13,2% y 7,6 kg. 8. Una sustancia tiene la siguiente composición: C(26,68%); O(71,08) y H(2,24%). Su peso molecular es 90,03. Encontrar su fórmula empírica y molecular. Sol : CHO2 y C2H2O4 9. Un hidrocarburo tiene la siguiente composición: 92,26% de C y 7,74% de H. Si su peso molecular es 78, encontrar su fórmula molecular: Sol: C6H6 10. Un hidrocarburo tiene la siguiente composición: C:85,64% y H: 14,36%. Encontrar su fórmula molecular sabiendo que su peso molecular está comprendido entre 80 y 90. Sol: C6H12 11. Un óxido de nitrógeno tiene un 69,55% de O. Encontrar su fórmula empírica. ¿Cuál será su fórmula molecular si sabemos que su peso molecular es 92. Sol: NO2 y N2O4 12. Un compuesto binario de S y P tiene un 27,87% de P. Calcular su fórmula molecular sabiendo que su peso molecular es de 444. Sol: P4S10 11 TEMA-2 Disoluciones En la tabla vienen recogidas los tipos de mezcla según el tamaño de las partículas que la componen: Tipo Tamaño de las partículas Sedimentación (diámetro) Disoluciones (mezcla Menor de 1nm No sedimentan homogénea) Coloides (mezcla heterogénea) Mayores que 1nm y menores que 200nm No sedimentan Suspensiones (mezcla heterogénea) Mayores que 200nm Si sedimentan Filtración Visibilidad Pasan todos los filtros Las partículas no se ven Pasan los filtros Las partículas se ordinarios peso son “detectan” con retenidas por los el ultrafiltros ultramicroscópio Son retenidas por los filtros ordinarios Las partículas se ven con el microscopio En una disolución se denomina: • • • Soluto: el componente que pierde el estado físico o se encuentra en menor proporción. Disolvente: el componente que mantiene el estado físico o se encuentra en mayor proporción. Si suponemos que el soluto es la sustancia A y el disolvente el agua, la disolución la representaremos por A(aq) Formas de expresar la composición de una disolución En las definiciones que siguen supondremos que los componentes son las sustancias A y B. Igual que para A podríamos definirlas para B. % deA(masa) = En ocasiones se denomina riqueza m(A) .100 (1) m(A)+m(B) 12 %deA(volumen) = V(A) .100 (2) V(A)+V(B) En el caso de un mezcla de gases es igual al % de partículas del gas en la mezcla. Para demostrar esto recordemos la ley de Avogadro. Si consideramos que N es el número de moléculas de gas por unidad de volumen multiplicamos numerador y denominador de la ecuación (2) por N ,tendremos: % de A(en volúmen) = N (A) N.VA .100 = .100=% de A(sobre el total de partículas) N.VA + N.VB N (A) + N (B) g de A/l = m(A)(g) (3) V(mezcla)(l) Concentración de A (molaridad en A) = n(A) (4) V(mezcla)(l) La molaridad de una disolución se suele expresar con el símbolo M. Así una disolución 0,5M,(se lee 0,5 molar), es la que tiene 0,5 mol de soluto por litro de disolución. La representaremos con el símbolo c(A(B)) o [A(B)]. Por ejemplo NaOH(aq) 0,3M Molalidad = n(A) (5) m(B)(kg) Necesariamente en esta ecuación A es el soluto y B el disolvente. La molalidad se indica con el símbolo m. Si una disolución es 0,5m ( se lee 0,5 molal), tenemos 0,5 mol de soluto por cada kg de disolvente. 13 Fracción molar( en A) = n(A) (6) n(A) + n(B) Se suele utilizar el símbolo χ(A) para referirnos a la fracción molar en el componente A. En el caso de una mezcla de gases es fácil demostrar que: % de A(volumen) = χ(A).100. Para ello basta recordar que el volumen molar es igual para todos los gases en unas determinadas condiciones de presión y temperatura. Si llamamos Vm el volumen molar en esas condiciones de presión y temperatura, la ecuación (2) queda como: % de A(en volúmen) = V(A) V(A) V(A) + V(B) .100 = V(A) Vm + Vm V(B) .100 = Vm nA .100 = χ(A).100 nA + nB En la siguiente tabla tenemos disoluciones de ácido clorhídrico: A B 1,098 (g/mL) 1,179 (g/mL) C D 20% 11,64 M. 3% 0,833 M. 1,008 (g/mL) E 0,56 m. 5,37M 0,098 Para completarla haremos los siguientes cálculos: A) Suponemos que tenemos 1(L) de HCl(aq) del 20% y hacemos los siguientes cálculos para obtener los moles de HCl: 20 g de HCl 1 mol de HCl 1098 g de HCl(aq). . 100 g de HCl(aq) 36,5 g de HCl Esto nos da la molaridad: 6,0M Para obtener la molalidad calculamos además de los moles de HCl que hay en un litro de HCl(aq) los kg de disolvente: 14 80 g de H 2O 1 kg de H 2 O . y ahora 100 g de HCl(aq) 1000 g de H 2 O 6 mol de HCl es decir 6,83m. obtenemos: m = 0,8784 kg de H 2 O Para obtener la fracción molar partimos de 1(L) de HCl(aq) y calculamos los mol de H2O(disolvente) que hay a partir de los g de H2O: 1098 g de HCl(aq). 1098 g de HCl(aq). 80 g de H 2 O 1 mol de H 2 O . = 48,8 (mol) y por lo tanto: 100 g deHCl(aq) 18g de H 2 O 6, 0 = 0,109 . Muchas veces este resultado se expresa en %: 10,9 6, 0 + 48,8 moléculas de HCl por cada 100 moléculas totales en la disolución(HCl(aq)) χ ( HCl ) = B) Volvemos a partir de 1(L) de HCl(aq) lo que corresponde a 1179 g de HCl(aq) y 11,64 (mol) de HCl equivalentes a 11,64.36,5 = 424,86 (g) de HCl. Con estos datos procederemos así: 424,86 g de HCl .100 = 36,0 1179 g de HCl(aq) Para calcular la molalidad veamos cuántos g de disolvente tenemos: 1179-424,86 = 754,14. Por lo tanto: 11,64 (mol) de HCl molalidad = = 15,4 0,754 kg de H 2 O % de HCl = Para obtener la fracción molar obtenemos los moles de H2O = 754,14/18 = 41,89(mol) 11,64 χ(HCl) = = 0,217 11,64 + 41,89 C) Como en los anteriores ejemplos partimos de 1(L) de HCl(aq). Considerando el dato de la molaridad podemos obtener la masa de HCl = 0,833.36,5 = 30,40 (g) .A partir de este dato podemos obtener la masa de HCl(aq): 100 g de HCl(aq) = 1013,3 g de HCl(aq) . 3 g de HCl Por tanto la densidad es 1,013 g/mL 30,40 g de HCl. El resto de los cálculos son similares a los realizados en el apartado(B) D) Es quizás más conveniente ahora partir de 1kg de disolvente. La masa de HCl correspondiente será: 0,56.36,5 = 20,44 (g). Luego la masa de HCl(aq) = 20,44 + 1000 = 1020,44(g) de HCl(aq). Podemos ahora obtener el volumen de disolución correspondiente: 15 1 mL de HCl(aq) 1(L)de HCl(aq) . = 1,012(L) 1,008 g de HCl(aq) 1000 mL de HCl(aq) 0,56(mol) de HCl = 0,55M Y la molaridad será: molaridad = 1,012(L) de HCl(aq) 1020,44 g de HCl(aq). Para calcular la fracción molar vemos los moles de H2O existentes en 1kg de H2O = 1000/18 = 55,5 (mol): χ(HCl) = 0,56 = 0,00998 0,56 + 55,5 E) Partimos de 1(L) de HCl(aq) donde hay 5,37 (mol) deHCl. Calculamos los mol de agua que corresponde: Para ello tenemos en cuenta que la fracción molar del H2O = 1- 0,098 = 0,902: 5,37 mol de HCl. 1 mol de HCl(aq) 0,902 mol de H 2 O . = 49,42 mol de H 2 O 0,098 mol de HCl 1 mol de HCl(aq) Obtenemos la masa de H2O = 49,42 . 18 = 889,56 (g). La masa de HCl será = 5,37 . 36,5 = 196, 01(g). Por lo tanto la masa de HCl(aq) será: 889,56 + 196,01 = 1085,57 (g) Y la densidad será: 1085,57(g)/1000 (mL)= 1,086 g/mL La molalidad vendrá dada por: molalidad = 5,37 mol de HCl = 6,04 0,88956 kg de H 2 O La riqueza la obtenemos fácilmente a partir de: % de HCl = 196,01 g de HCl .100 = 18,06 1085,57 Solubilidad La mezcla de gases siempre es homogénea. No ocurre así cuando mezclamos dos sólidos, dos líquidos o un gas y un líquido. Estudiemos el caso de la mezcla formada por un sólido y un líquido. Si añadimos unos cristales de sal en un vaso de agua se produce un doble proceso: Disolución ↔ cristalización 16 En el primer proceso, las partículas del sólido, (iones Na+ y Cl- en nuestro caso particular), se sienten atraídas por las moléculas de agua por lo que se irán incorporando a la disolución. Por otra parte algunos de los iones ya disueltos se incorporarán a la red cristalina, proceso que se denomina cristalización. En nuestro caso predominará el primer proceso y el cristal se disolverá completamente. Pero supongamos que vamos añadiendo cristales de sal. Cada vez el proceso de cristalización será más importante. Llegará un momento en que la velocidad de disolución y de cristalización serán iguales. Entonces por cada mol de cristal que se disuelva se habrá incorporado a la red cristalina otro mol, y por lo tanto aparentemente no podemos disolver mas sal en ese vaso de agua. Diremos entonces que tenemos una disolución saturada Se denomina solubilidad, a la concentración de la disolución saturada Evidentemente es una propiedad que depende del soluto y del disolvente. En el lenguaje vulgar decimos que un sólido es soluble o insoluble en agua cuando la solubilidad es grande o muy pequeña respectivamente. La solubilidad del un sólido en un líquido aumenta generalmente con la temperatura. Por el contrario la solubilidad de un gas en un líquido disminuye con la temperatura. En la figura tenemos representada la variación de la solubilidad, de distintas sustancias sólidas, con la temperatura: Si tenemos una disolución saturada y evaporamos parte del disolvente o disminuimos la temperatura podemos tener una disolución de mayor concentración que la solubilidad en estas condiciones. Se dice que tenemos una disolución sobresaturada. Es un estado no estable, ( estado metaestable), y el exceso de sólido precipitará. 17 La solubilidad de un gas en un líquido está muy influida por la presión. La ley de Henry establece la dependencia matemática entre ambas magnitudes: C(gas) = k p(gas) (7) Es decir la solubilidad de un gas en un líquido es directamente proporcional a la presión parcial que el gas ejerce sobre el líquido. Propiedades coligativas de las disoluciones Se denominan coligativas aquellas propiedades que no dependen de la clase de soluto sino de la cantidad de partículas del mismo. En todo lo que sigue el subíndice(s) representa al soluto y el (d) al disolvente. Con el símbolo (D) indicaremos la disolución. Tenemos cuatro propiedades coligativas: Descenso de la presión de vapor. La disolución tiene menor presión de vapor que el disolvente puro. En la figura viene representado este descenso, para una disolución acuosa La disminución de presión de vapor es proporcional a la molalidad de la disolución: -∆p=k.m (8) En esta ecuación -∆p es p(d)- p(D) y proporcionalidad). m la molalidad; ( k es una constante de 18 Descenso del punto de fusión. La disolución tiene un punto de fusión menor que el disolvente. El descenso es proporcional a la molalidad de la disolución. Es decir: -∆tf = Kc.m (9) En la ecuación -∆tf = tf(d)-tf(D) y Kc es una constante, (denominada constante crioscópica), para cada disolvente. Para el agua es Kc= 1,86 ºC.kg/mol Aumento del punto de ebullición. La disolución tiene mayor punto de ebullición que el disolvente puro. El aumento es proporcional a la molalidad. Matemáticamente: ∆te= Ke.m (10) En donde ∆te= te(D)-te(d) y Ke característica de cada disolvente se denomina constante ebulloscópica. Para el agua es Ke= 0,52 ºC.kg/mol Presión osmótica. Si ponemos en contacto dos disoluciones de diferentes concentraciones estas se igualarán al difundirse las moléculas del soluto hacia la de menor concentración hasta que se igualen. A este fenómeno se le denomina ósmosis, y es simplemente un caso de difusión. Pero supongamos que separamos una disolución del disolvente puro mediante una membrana semipermeable: deja pasar las moléculas del disolvente,(pequeñas) y no las del soluto(más grandes). Habrá un paso de moléculas de disolvente hacia la disolución para diluirla. Se denomina presión osmótica a la presión que hay que ejercer sobre la disolución para impedir el proceso de ósmosis. Podemos calcularla mediante la ecuación: π=c.R.T (11) En esta ecuación π es la presión osmótica, R la constante de los gases, T la temperatura termodinámica y c la concentración(molaridad) de la disolución. 19 Estado coloidal En la tabla inicial del tema establecimos el concepto de coloide como aquella mezcla heterogénea, donde las partículas del soluto eran tan pequeñas que ya no sedimentaban, pero lo suficientemente grandes como para no poder considerarse una disolución Las partículas dispersas reciben el nombre de micelas. La mezcla recibe el nombre de sol. Si la fase dispersante es el agua se trata de un hidrosol. Si es el aire se denomina aerosol. Cuando un sol pierde agua se convierte en una masa gelatinosa denominada gel. Como características más destacadas de las dispersiones coloidales tenemos: - Efecto Tyndall: difusión de la luz por las micelas, lo que las hace visibles cuando la dispersión coloidal es iluminada y se observa en dirección perpendicular. Movimiento browniano: debido al choque de las moléculas de agua sobre las micelas lo que hace que estas adquieran un movimiento caótico. Electroforesis: es el movimiento de las micelas cuando se establece una diferencia de potencial en la dispersión coloidal. Se debe a que tienen carga eléctrica. La materia en estado coloidal presenta un gran poder de absorción debido a la gran superficie de las micelas. Este es el motivo por el que si obtenemos una sustancia a partir de una dispersión coloidal frecuentemente estará muy impurificada. 20 Ejercicios 1. El agua del mar contiene un 2,8% de NaCl y tiene una densidad de 1,02 g/cm3 a una cierta temperatura. Calcula el volumen de agua de mar necesario para obtener 1 kg de NaCl. Solución: 35,01 litros 2. Se disuelven 5 g de NaOH en 25 cm3 de agua. El volumen final es 27,1 cm3. Dato: densidad del H2O(l) = 1 g/ cm3 Calcular: a) % en masa; b) molaridad; c) molalidad. Solución: a) 16,67% ; b) 4,6M.; c) 5m. 3. Un bote de HCl(aq) del laboratorio tiene la siguiente etiqueta: riqueza 36% densidad 1,18 g/mL. Calcular la molaridad. Solución: 11,6 M 4. Disponemos ácido sulfúrico comercial del 98% y 1,84 g/mL. Calcular el volumen del mismo que hemos de tomar para preparar 250 mL de H2SO4(aq) 0,3M. Solución: 4,076mL del sulfúrico comercial de 98%. 5. Mezclamos 100 cm3 de HCl(aq)0,2M con 300 cm3 de HCl(aq) 0,3M. Si suponemos los volúmenes aditivos calcular la molaridad final. Solución: 0,275M. 6. Calcula la cantidad, en g de KNO3 y agua destilada necesarios para preparar 250 cm3 de disolución al 20%.La densidad de la disolución es de 1,2 g/cm3. Calcular la fracción molar en KNO3. Solución: 60 g de KNO3 y 240 mL de H2O ; 0,0426 7. En la siguiente tabla tenemos disoluciones de ácido sulfúrico: A B 1,24 (g/mL) 1,05 (g/mL) C D E 32% 0,86 M. 72% 12 M. 1,07 (g/mL) 1,13 m. 2,9M 0,054 Completar la tabla,( las columnas miden: densidad; riqueza molaridad, molalidad y fracción molar en ese orden) 8. 4,22 g de urea se disuelven en 200 g de agua. La disolución resultante hierve a 100, 180ºC. ¿Cuál es el peso molecular de la urea?. Sol: 60 9. ¿Cuál es el punto de ebullición de una mezcla de CCl4 y Benceno que solidifica a 4,5 ºC?.Datos: P. de f y eb del benceno 5,5ºC y 80,1ºC; Kc= 5,12 ºC.kg/mol; Ke= 2,53 ºC.kg/mol. Sol: 80,6ºC 21 10. Calcula el punto de congelación de una disolución en la que se disuelven 15 g de urea, CO(NH2)2 en 500 g de agua. Dato: Kc= 1,86 ºC mol-1kg. Sol: -093ºC 11. Calcula la temperatura de ebullición de la disolución del problema anterior. Ke(H2O)=0,52ºCkg/mol. Sol: 100,25ºC 12. Una muestra formada por 2 g de un compuesto orgánico disuelto en 100 cm3 de disolución se encuentra a una presión de 1,31 atm en el equilibrio osmótico. Sabiendo que la disolución está a 0ºC, calcula la masa molar del compuesto orgánico. Sol: 342(g/mol) 13. ¿Cuál será la presión osmótica a 25º de una disolución que contiene un soluto de 1200, si 0,30 g del mismo se disuelven en agua hasta un volumen final de 250 mL?. Sol: 0,024 atm 14. Una disolución de 1,436 g de hidrocarburo en 29,3 g de benceno tiene un punto de congelación de 2,94ºC. El hidrocarburo contiene un 14,37% de hidrógeno; hallar su fórmula molecular. El punto de congelación del benceno es 5,5 ºC, y su constante crioscópica es 5,12 ºC.mol-1.kg. Sol: C7H14 22 TEMA-3. Reacciones químicas Una reacción química es un proceso en el que unas sustancias, denominadas reactivos, se transforman en otras, que se denominan productos. El proceso lo podríamos indicar simbólicamente por: R→P En el caso de reacciones irreversibles, estas tienen lugar en un solo sentido, pero en las reversibles si partimos de los productos podríamos obtener los reactivos, por lo que en este caso es más apropiado representar el proceso por: RRP El estudio de las características de los procesos químicos lo vamos a dividir en tres apartados: Energía, velocidad y balance de materia. Energía de las reacciones químicas Desde el punto de vista de la teoría atómica una reacción química consiste en la ruptura de los enlaces entre los átomos de los reactivos y la formación de los nuevos enlaces, entre estos mismos átomos, en los productos. Cuando se forma un enlace químico entre dos átomos se libera una energía, energía de enlace, que es la que se necesita para romperlo. Lo aclararemos con el ejemplo de formación de un enlace entre los átomos A y B. En la formación: A + B → AB + E( energía del enlace (AB)) Es decir al formarse se libera esta energía E. Del mismo modo para romperlo necesitaremos esta misma energía: AB + E → A + B Esta cantidad E será característica del enlace AB y la representaremos por E(AB) Como los enlaces formados y rotos son distintos es evidente que habrá un balance global según el cual necesitamos aportar energía para que la reacción transcurra,(reacciones endotérmicas), o bien hay un desprendimiento de energía,(reacciones exotérmicas). Como ejemplo consideremos la reacción de combustión del H2: 2 H2 + O2 → 2 H2O 23 Para poder formar las moléculas de H2O necesitamos aportar: 2 E(HH) y E(OO) mientras que se desprenderán la energía correspondiente a 4 E(HO).(Hay que tener en cuenta que en una molécula de H2O hay dos enlaces (HO) De una forma general esto lo podríamos visualizar en un diagrama energético. En este diagrama necesitamos gastar una energía para separar en átomos los elementos que forman los reactivos y luego se desprendería la energía correspondiente a la formación de los enlaces, entre estos mismos átomos, en las sustancias productos. En la primera figura tenemos una reacción endotérmica: Esta segunda figura hace referencia al caso de una reacción exotérmica: La energía global puesta en juego aparece en forma de calor por lo que podemos escribir: 24 R→ P + calor (exotérmica) o R + calor → P (endotérmica) Representaremos por Q el calor de reacción y lo mediremos en kJ o kJ/mol Nuestro ejemplo de combustión del H2, era una reacción exotérmica, con un desprendimiento de calor de 285,8 kJ/mol de H2O en estado líquido formado. Es decir: H2(g) + ½ O2(g) → H2O(l) + 285,8 kJ Lo anterior es un ejemplo práctico de ecuación termoquímica. Por lo tanto una ecuación termoquímica es una ecuación química ajustada donde se pone de manifiesto el estado físico de reactivos y productos y el calor absorbido o desprendido en el proceso En este ejemplo si el agua queda en estado gaseoso la energía desprendida sería solamente 241,8 kJ/mol de agua gaseosa formada. La diferencia se justifica por el consumo de energía necesario para convertir el agua del estado líquido al gaseoso. Una de las conclusiones que podemos sacar del uso de estos diagramas es que el balance global de la reacción, es idéntico si la misma transcurre en un solo paso o en varios (ley de Hess). Pongamos un ejemplo: C(s) + O2(g) → CO2(g) + Q(total) (reacción global) a) b) C(s) + ½ O2(g) → CO(g) + Qa CO(g)+ ½ O2(g) → CO2 + Qb Según lo dicho anteriormente debe cumplirse que: Q(total) = Qa+ Qb Velocidad de reacción La velocidad de una reacción la podemos medir estudiando la rapidez con que desaparece un reactivo o se forma un producto. Hay reacciones rápidas y otras son lentas. Veamos esto con un ejemplo: La oxidación de un metal. 2 Na(s) + ½ O2(g) → Na2O (s) ( muy rápida) 2 Fe (s) + 3/2 O2 (g) → Fe2O3 (s) (lenta) Por lo tanto lo que más influye en que una reacción sea rápida o lenta serán los reactivos concretos que la realicen. Pero hay una serie de factores generales que vamos a resumir a continuación: 25 1. Concentración de los reactivos: a medida que aumenta la concentración de los reactivos la velocidad de la reacción aumenta. Esto lo podemos justificar ya que al aumentar la concentración aumentará la frecuencia de los choques entre las moléculas o iones de los reactivos. (Hay que recordar que hay que romper las uniones que forman los reactivos y para ello tienen que chocar). 2. Superficie de los reactivos: (solo en el caso de reactivos sólidos). La velocidad de reacción aumenta mucho con el grado de división. Por eso se pulverizan los reactivos sólidos antes de mezclarlos. ( La explicación es similar al caso anterior). 3. Temperatura: Al aumentar la temperatura, la velocidad aumenta mucho. Es el factor más importante. La explicación es sencilla: para que el choque sea reactivo las partículas de los reactivos deben tener una velocidad mínima. Pero al aumentar la temperatura también lo hará la velocidad mínima de las partículas y por lo tanto el número de choques reactivos. 4. Catálisis: Los catalizadores permiten otro mecanismo pero no aparecen en la ecuación global, por lo que no se consumen. Consideremos esto con más detalle. Supongamos una reacción que consista simplemente en la formación de una unión entre los átomos A y B: A + B → AB ( reacción sin catalizar, lenta)( Una sola etapa) Supongamos ahora la presencia de otra sustancia, C, que permita otro mecanismo en dos etapas: A + C → AC ( rápida) AC + B → AB + C (rápida) Por lo tanto hemos conseguido que la reacción sea más rápida al tener otro mecanismo. Hay que tener en cuenta que el proceso global catalizado es idéntico al proceso sin catalizador. Es decir el catalizador no se consume durante el proceso Balance de materia Supongamos un proceso químico cualquiera donde tenemos dos sustancias reactivos: A y B y dos productos C y D. La expresión simbólica de la misma sería: A+B→C+D Pero como ya sabemos, los átomos son indestructibles y permanecen en las transformaciones, por lo que debemos tener el mismo número de ellos, (para cada elemento), entre los reactivos y productos. 26 Para conseguirlo introducimos unos números, estequiométricos, que consiguen nuestro propósito: denominados coeficientes aA+bB=cC+dD Diremos que hemos ajustado la reacción. Hemos escrito el signo igual puesto que ahora, desde el punto de vista atómico, se trata de una auténtica igualdad. Si la expresión anterior la multiplicamos por No tendríamos: aNo A + bNo = cNo C + dNo D Es decir que el proceso ocurre como si: A mol de A + b mol de B = c mol de C + d mol de D Por lo tanto si denominamos por n(A) ; n(B) ; n(C) y n(D) las cantidades de sustancias de reactivos consumidos y de productos obtenidos podríamos establecer las siguientes proporciones: n(A) n(B) n(C) n(D) = = = a b c d Estas relaciones son la base de los balances de materia o cálculos estequiométricos. (Al igual que en el Tema 1 y 2 los cálculos los podemos realizar usando proporciones; reglas de tres o factores de conversión) Veamos algunos ejemplos de estos cálculos: a) Relaciones volumen- volumen: Supongamos la reacción: N2(g) + 3H2(g) = 2 NH3(g) Como un mol de cualquier gas ocupa el mismo volumen, (en las mismas condiciones de P y T) tendríamos que los volúmenes de los gases estarán en la misma proporción que los coeficientes estequiométricos, es decir en nuestro caso 1 litro de N2 reaccionará con 3 litros de H2 para obtener 2 litros de NH3 ( Recordemos la Ley de Gay-Lussac de los volúmenes de combinación). Así podríamos calcular el volumen de NH3 obtenidos a partir de 20 l de H2: 20 l de H 2 1 mol de H 2 2 mol de NH 3 V(l) de NH3 . . V(l) de H 2 3 mol de H 2 1 mol de NH 3 27 Resultado: 13,3(l). (Se supone que todos los volúmenes están medidos en las mismas condiciones de presión y temperatura). b) Relaciones masa-masa: Teniendo en cuenta el concepto de masa molar podríamos establecer una proporción entre las masas consumidas y obtenidas. Por ejemplo en el ejemplo anterior las masas molares son 28 g/mol(N2); 2g/mol(H2) y 17g/mol(NH3). Por lo tanto 28 g de N2 reaccionarán con 6 g de H2 para dar 34 g de NH3. Esto nos permitirá realizar el cálculo de la masa de N2 necesaria para obtener 50 g de NH3: 50 g de NH 3 1 mol de NH 3 1 mol de N 2 28 g de N 2 . . 17g de NH 3 2 mol de NH3 1 mol de N 2 El resultado: 42,2 g de N2 c) Relaciones masa-volumen: De todo lo dicho en los casos anteriores es evidente que si medimos el volumen de los gases en CN( 22,4 l/mol) tendríamos que 22,4 litros de N2 medidos en CN producen 34 g de NH3 Vamos a calcular el volumen de N2 medidos a 100 ºC y 2,7 bar necesarios para obtener 45 g de NH3. Calculamos el volumen molar de un gas en esas condiciones: Vm = R T 373 = 0,083 = 11,47 (l/mol) P 2,7 Luego: 45 g de NH 3 . 1 mol de NH 3 1 mol de N 2 11,47(l) de N 2 . . 17 g de NH3 2 mol de NH3 1 mol de N 2 Resultado: 15,18(l) de N2 medidos a 100ºC y 2,7 bar d) Reactivos o productos disueltos: Supongamos la reacción: Zn(s) + 2 HCl(aq) = ZnCl2(aq) + H2(g) Como vemos en la ecuación el reactivo es el HCl y el símbolo (aq) se refiere a su estado físico. La cantidad n(HCl) la podemos poner en función del volumen de disolución mediante la relación : n(HCl) = c(HCl(aq)). V(HCl(aq)). Por lo tanto podemos 28 establecer relaciones entre el volumen de HCl(aq) consumido y la masa de Zn disuelto por ejemplo,( o entre el volumen de HCl(aq) y el de H2). Como ejemplo vamos a calcular el volumen de disolución de HCl(aq) 0,3 M necesarios para disolver completamente 0,2 g de Zn(s).Dato: Pa(Zn)65,4. 0,2 g de Zn. 1 mol de Zn 2 mol de HCl 1(l) de HCl(aq) . . 65,4 g de Zn 1 mol de Zn 0,3 mol de HCl Resultado: 0,0204(l)de HCl(aq)0,3M = 20,4 mL de HCl(aq) 0,3M e) Reactivos impuros: Con ayuda de los cálculos estequiométricos podemos realizar el análisis de una mezcla en donde solo uno de los componentes reaccione. Por ejemplo supongamos que nos dicen que una determinada masa de cinc impuro han consumido un determinado volumen de HCl(aq) para disolverse. A partir de este dato calculamos la cantidad de cinc presente en la muestra y por lo tanto su riqueza. Veamos el siguiente ejemplo: Calcular la pureza de una mezcla de Zn y SiO2 sabiendo que 1,2 g de mezcla consumen 15,2 mL de HCl(aq)0,4M. El SiO2 no reacciona con el HCl(aq): 15,2 (mL) de HCl(aq) 0,4M 0,4 mol de HCl 1 mol de Zn 65,4 g de Zn . . 1000 (mL) de HCl(aq) 0,4M 2 mol de HCl 1 mol de Zn Es decir tenemos una masa de 0,199(g) de Zn. Por lo tanto la riqueza será: % de Zn = 0,199 g de Zn .100 = 19,9% 1 g de mezcla f) Reactivo limitante: Supongamos que mezclamos H2 y N2 en una proporción 4 a 1. Es evidente que sobrará N2, que quedará sin reaccionar. Es, por lo tanto el H2 el que nos limita la cantidad total de NH3 que podremos obtener. De ahí el nombre de reactivo limitante. Si en este caso quisiéramos calcular la cantidad de NH3 obtenido tendríamos que partir de la cantidad de H2,(ya que es el que se consume completamente). Por lo tanto cuando tenemos una mezcla de reactivos en proporción no estequiométrica, tenemos que averiguar cual de ellos es el reactivo limitante y usar éste en los cálculos. Vemos esto en el siguiente ejemplo: Se añade 1,2 g de Zn a un vaso que contiene 150 mL de HCl(aq)0,2M. Calcular el volumen de H2(g) desprendido, medido en 29 c.n.;(supondremos que el volumen molar en esas condiciones es 22,4 L/mol9.Datos: Pa Zn = 65,4. Calculamos en primer lugar las cantidades de sustancia de HCl y ZN: 1,2 g Zn. 1 mol de Zn ; n(Zn) = 0,0183 (mol) 65,4 g de Zn 150 mL HCl (aq) 0,2 M. 0,2 mol de HCl ; n(HCl) = 0,030 (mol) 1000 mL de HCl (aq) 0,2 M Luego tenemos las dos sustancias mezcladas en la proporción: n(HCl) 0,030 1,64 = = n(Zn) 0,0183 1 La Proporción estequiométrica es sin embargo: n(HCl) 2 = n(Zn) 1 Es por tanto evidente que falta HCl para que todo el Zn se pueda consumir. El HCl será el reactivo limitante y a partir de el haremos los cálculos: 0,30 mol de HCl. 1 mol de H 2 22,4(L) de H 2 . 2 mol de HCl 1 mol de H 2 resultando: V(H2)cn= 3,36(L) g) Análisis de mezclas: Cuando tenemos una mezcla de dos componentes en donde ambos reacciones para calcular su composición tendríamos que plantear un sistema de ecuaciones a partir de los datos de los productos obtenidos y de los reactivos utilizados. Supongamos que tenemos 10(g) de una mezcla de Zn y Mg. La disolvemos completamente con HCL(aq) 2,5 M, habiéndose gastado 175 mL de este ácido. Para calcular la composición de la mezcla hacemos las siguientes consideraciones: Supongamos que tenemos x(g) de Zn, en ese caso habrá 10-x (g) de Mg. A partir de estas masas vamos a calcular el volumen total de HCL(aq) 2,5 M necesario para disolver. Como datos: Pa(Zn) = 65,4 y Pa(Mg) = 24,3 x g de Zn. 1 mol de Zn 2 mol de HCl 1000 mL HCl(aq) 2,5 M . . y de aquí: 65,4 g de Zn 1 mol de Zn 2,5 mol de HCl 30 V(HCl(aq)) = 12,23 x (mL) (10-x) g de Mg. 1 mol de Mg 2 mol de HCl 1000 mL de HCl 2,5 M . . y por tanto: 24,3 g de Mg 1 mol de Mg 2,5 mol de HCl V(HCl(aq)) = 32,92 (10-x) (mL) Pero como la cantidad total gastada es 175 (mL) podemos plantear la siguiente ecuación: 32,92 (10-x) + 12,23 x = 175 Y de aquí: x = 7,45 (g). Es decir la mezcla está compuesta de 7,45 (g) de Zn y 2,55 (g) de Mg. Rendimiento Por muchos motivos, cuando se lleva a cabo una reacción se obtiene menos cantidad de producto de lo que cabría esperar teóricamente. Esto nos permite definir como rendimiento de la misma: Rendimiento = cantidad de producto obtenido .100 cantidad de producto que teóricamente se podría haber obtenido Calculemos la masa de H2SO4(aq) del 70% que podemos obtener a partir de 1kg de pirita,(FeS2), si suponemos que el rendimiento es del 92%: En primer lugar nos damos cuenta que sean cuales sean los procesos que nos lleven desde el FeS2 hasta H2SO4, podríamos obtener teóricamente 2 mol de H2SO4 a partir de 1 mol de FeS2 1000 g de FeS2 1 mol de FeS2 2 mol de H 2SO 4 98 g de H 2SO 4 100 (g)teórico de H 2SO4 (aq) 0,92 (g) reales 120 g de FeS2 1 mol de FeS2 1 mol de H 2SO 4 70 g de H 2SO4 1 (g) teórico Resultado: 2147 (g) de H2SO4(aq) del 70%/1kg de pirita 31 Problemas 1) Calcular el volumen de aire necesario para quemar 34 litros de H2. ( Se supone que el aire contiene un 21% en volumen de O2).Solución: 80,95 litros de aire 2) Calcular el volumen de O2 necesario para quemar una mezcla de 34 litros de etano,(C2H6) y 45 litros de eteno,(C2H4). ¿Qué volumen de CO2 se producirá?. (Suponer que todos los gases están medidos en las mismas condiciones de presión y temperatura) Solución: 254 litros de O2 y 158 litros de CO2 3) ¿Qué masa de O2 se podrá obtener en la descomposición térmica de 150 g de KClO3? Solución: 58,7 (g) 4) ¿Qué masa de CO2 se desprenderá al atacar con un exceso de HCl(aq) una mezcla formada por 2,4 g de CaCO3 y 3,7 g de MgCO3?. Solución: 2,98 (g) 5) Al disolver 2,3 g de Zn en HCl(aq) qué volumen de H2 medidos a 27ºC y 1,2 bar se obtendrán. Solución: 0,73 litros 6) ¿Qué volumen de HCl(aq)0,4M se necesitará para disolver el Zn del problema anterior?. Solución: 176 ml 7) Para disolver una determinada masa de cinc se han gastado 25 mL de HCl(aq) 0,5M. Calcular el volumen de H2 desprendido medidos a 1,7 bar y 45 ºC. Solución: 97 mL 8) Para disolver 3,7 g de cinc impuro se han utilizado 127 mL de HCl(aq) 0,6M. Calcular la riqueza del cinc. (Se supone que las impurezas no reaccionan con el HCl(aq)). Solución: 67,3% 9) A 3,5 g de cinc se le añaden 245 ml de HCl(aq) 0,6M. Calcular el volumen de H2 desprendidos medidos a 3 bar y 200ºC. Solución: 0,7 (l) 10) Se mezclan en un mismo recipiente 45 litros de butano, (C4H10), y 7,4 litros de O2.Calcular el volumen de H2O formado. Se supone que el H2O se encuentra en estado gaseoso y en las mismas condiciones que el butano y el oxígeno. Solución: 5,7 litros 11) Una mezcla de S y C tiene una masa de 5,5 g y cuando se quema, da una mezcla de CO2 y SO2 que tiene una masa de 13,2 g.¿Qué % de S había en la mezcla original?. Solución: 75,7 % de S 12) Una mezcla de etano y propano tiene un volumen de 57 ml. Se quema y después de volver los gases a las condiciones iniciales tenemos un volumen de 131 cm3. Calcular la composición volumétrica de la mezcla. Se suponen que en estas condiciones el H2O está en fase líquida. Solución: 70,2% de etano 13. Calcular el volumen de H2SO4(aq)4M, que se podría obtener a partir de 1 Tm de pirita,(supondremos que la pirita es FeS2. Suponemos un rendimiento del 95%. Solución: 3958 (l) de H2SO4(aq)4M 32 14. Calcular el volumen de NH3(g) que se podría obtener a partir del N2 contenido en 1m3 de aire. Se supone un rendimiento del 85%. El aire contiene un 79% de N2. Solución: 1343 litros de NH3(g) medidos en las mismas condiciones que el m3 de aire. 15. Calcular la masa de CO2 y de H2O que se podrá obtener cuando hacemos reaccionar 7,4 g de carbonato de sodio con un exceso de ácido clorhídrico. Solución: 3,07 g de CO2 y 1,26 g de H2O. 16. La oxidación catalítica del amoniaco produce NO y H2O. Calcula el volumen de oxígeno necesario , medidos en c.n., para producir 40,7 g de H2O. Solución: 42,7 litros de O2 medidos a 0ºC y 1 bar. 17. La reacción del ácido sulfúrico con aluminio produce sulfato de aluminio e hidrógeno. Calcular el volumen de hidrógeno obtenido medidos a 50ºC y 3 bar, cuando se hacen reaccionar 4 g de aluminio con un exceso de ácido. Solución: 1,99 litros de H2. 18. Calcula el volumen de H2, medidos a 25ºC y 750 mm de Hg, que se desprenden al añadir cinc a 200 mL de disolución de HCl(aq) 0,2M. Solución: 0,50 litros de H2. 19. Calcular la riqueza en Cu de una aleación de Cu y Zn si al tratar 5,0 g de la misma con un exceso de ácido sulfúrico diluido se han desprendido 0,34 L de H2 medidos a 20ºC y 0,97 bar. ( En esas condiciones el Cu no reacciona). Solución: 17,7% de Zn. 20. El O3 existente en la alta atmósfera terrestre parece que reacciona con el NO dando O2 y NO2. Calcular cuántos g de NO2 se formarán si reaccionan 0,74 g de O3 y 0,67 g de NO. Solución: 0,71 g de NO2 21. Hacemos reaccionar 55,8 L de CH4, medidos a 3 bar y 20ºC con 250 g de O2. Calcular la masa de H2O producida. Solución: 140,6 g de H2O. 22. Se hacen reaccionar 10,0 g de Al2O3 con exceso de ácido clorhídrico, obteniéndose 25,0 g de cloruro de aluminio. Calcular el rendimiento de la reacción. Solución: 91% 23. Se queman 45(g) de un mezcla de propano y pentano, para lo que se necesita 73,298(L) de O2 medidos a 25ºC y 1,7 bar. Calcular la composición de la mezcla .Solución: 15% de C3H8, ( tomar 4 cifras decimales al hacer los cálculos). 24. ¿Qué volumen de H2SO4(aq) 64% y densidad = 1,54 g/mL serán necesarios para neutralizar 25 mL de Na(OH)(aq) 0,4M. Solución: 0,497 mL de H2SO4(aq) del 64%. 25. 15 g de una mezcla de Mg y Al se trata con H2SO4(aq) 1,5 M gastándose un volumen de 600 mL de ácido para disolverla completamente. Calcular la riqueza en Mg de la mezcla. Solución: 72,1% de Mg 33 TEMA-4 . Teoría atómica. Tabla Periódica. Enlace químico El modelo nuclear del átomo Como consecuencia de los experimentos de Thomson (1897); Millikan (1909), Rutherford (1910) y Aston (1919), quedó establecido que el átomo era un sistema complejo donde existían tres tipos de partículas: Nombre de la partícula (símbolo) Carga ( medida en Masa ( en kg y Número de ellas en (C) y en unidades de en uma ) el átomo carga atómica(e) Electrón ( e- ) -1,6 .10 -19 (C) -1 9,1 .10-31(kg) 5,5.10-4 (u) Z: número atómico + 1,6 .10-19 (C) 1,673 .10-27 (kg) 1,01 uma Z: número atómico 1,675 .10-27 (kg) 1,01 uma N: número de neutrones + Protón ( p ) +1 Neutrón (n ) 0C 0 Estas partículas se encuentran en dos zonas muy determinadas: El núcleo: Es la región central. Su tamaño es muy inferior al del átomo. Aproximadamente el radio del núcleo es del orden de 10-14 a 10-15 (m), mientras que el del átomo es del orden de 10-10(m). En su interior se encuentran dos tipos de partículas: Z p+ y N n. Estas partículas se denominan nucleones y su número total se representa por A. Se cumplirá por lo tanto que: A = Z + N (1) A se denomina número másico. Si nos fijamos en que aproximadamente, (en umas), la masa del núcleo viene dada por Z + N, comprenderemos fácilmente el motivo. Todos los átomos de un mismo elemento tienen el mismo Z pero pueden tener distinto A ( isótopos). 238 235 y U 92 Los núcleos se representan como Símbolo AZ . Así: tenemos los isótopos U 92 La corteza: Región que rodea al núcleo donde se mueven los electrones. Habrá, en un átomo neutro Z e-. Su tamaño es el del átomo. 34 Estructura electrónica del átomo Los Z electrones de un átomo no se encuentran todos en el mismo estado físico. Se denomina orbital a cada uno de los estados físicos de los electrones de un átomo, debidos a la interacción de los mismos con su núcleo En cada estado el electrón tendrá una energía. A esta se le denomina nivel. Para denominar los distintos niveles de energía utilizaremos unos símbolos compuestos por números: 1,2,3… y letras: s,p,d,…. Así por ejemplo existirán los niveles 1s; 2p; 3d ,3p…etc. El número de estados (orbitales) que corresponde a cada nivel viene determinado por la letra que utilizamos para denominar a este, según la siguiente tabla: Letra del nombre nivel s p d f Número de orbitales 1 3 5 7 (2) Además del estado físico debido a su relación con el núcleo,(orbital), el electrón tiene una propiedad intrínseca muy importante: su espin. Esta es una magnitud vectorial, que representa su momento magnético intrínseco, y puede tener dos posibles valores que representaremos como: ↑ o ↓ El principio de exclusión, (Pauli), establece que no pueden existir en el mismo átomo dos electrones en el mismo estado físico. Esto podemos traducirlo afirmando que “caben dos electrones en cada orbital, con espines opuestos”, lo que representaremos como: ↑↓ Según lo dicho en el párrafo anterior el número máximo de electrones que “caben” en un nivel viene dado por: Letra del nivel Nº máximo de e- s 2 p 6 d 10 f 14 (3) Se denomina configuración electrónica fundamental de un elemento, el conjunto de niveles de energía de los electrones del mismo, cuando tienen la mínima energía posible. 35 El número de electrones en cada nivel lo indicamos mediante un exponente. Así por ejemplo la configuración electrónica fundamental del He será 1s2. Para poder obtener las configuraciones de átomos más complicados debemos conocer el orden de los distintos niveles ( de menor a mayor energía): 1s< 2s< 2p< 3s< 3p< 4s< 3d <4p< 5s< 4d< 5p< 6s< 4f< 5d< 6p< 7s<5f< 6d< 7p (4) Según esto el átomo de Na que tiene Z=11 tendrá la configuración: Na: 1s22s22p63s1 Espectros atómicos Einstein, 1905, había introducido el concepto de fotón como partícula de radiación. La radiación tiene una doble naturaleza: • Por una parte es una onda, caracterizada por su velocidad de propagación, c, su frecuencia, f, o su longitud de onda λ. Entre estas magnitudes existe la relación: c = f.λ (5) • Como tal partícula, el fotón esta caracterizado por su energía, que es proporcional a la frecuencia de la radiación: E= h.f.(6) En esta ecuación h es una constante universal denominada constante de Planck y tiene un valor de: 6,63.10-34 (J.s) Se denomina espectro de una radiación el conjunto de frecuencias que la componen. Para analizar la luz, utilizamos un espectroscópio. En este aparato la luz que queremos analizar la hacemos pasar por una ranura. A su salida incide sobre un prisma. La desviación en este depende de la frecuencia. Cuando la luz sale del prisma incide en una película fotográfica y por lo tanto obtenemos tantas fotos de la rendija como frecuencias compongan la radiación a analizar. 36 En la figura se trata de una radiación compuesta por varias frecuencias El ángulo que forma la dirección del rayo incidente con el emergente crece con la frecuencia. Este es el motivo por el que al incidir una radiación formada por dos frecuencias estas sufren desviaciones diferentes que las separan. Como sabes este fenómeno es el que produce el espectro de la luz solar. Este es un espectro continuo Cuando un átomo absorbe o emite radiación lo hace con un conjunto de frecuencias características que constituyen su espectro de absorción o emisión respectivamente. Se trata por tanto de un espectro discontinuo. En esta relación entre la radiación y la materia debe cumplirse: E fotón emitido o absorbido = E inicial -E final =h.f emitida o absorbida (7) Se comprende por lo tanto que las frecuencias absorbidas y emitidas por un átomo sean exactamente las mismas. En la figura podemos comprobar esto para los espectros de emisión y absorción del H: 37 Tabla periódica La tabla Periódica o Sistema periódico, es un resumen de las propiedades químicas de los distintos elementos. La primera tabla se debe a Mendelejev. En ella aparecían los elementos en orden creciente de peso atómico. En la actualidad están ordenados en orden creciente de número atómico, es decir, en orden creciente de número de electrones. La pregunta fundamental es: ¿Por qué todos los elementos de un grupo tienen propiedades químicas parecidas?. O dicho de otra forma, por qué hay una variación periódica de las propiedades. Esta pregunta básica tuvo una respuesta bastante sencilla gracias al modelo cuántico del átomo. Son los electrones los responsables de las propiedades químicas y dentro de estos los de mayor energía. Vamos pues a considerar una división en los electrones: internos y externos o responsables de las propiedades químicas. Por tanto la configuración fundamental podemos separarla en interna y externa o de valencia. El hecho fundamental es que los distintos elementos de un grupo tienen similar configuración electrónica externa, lo que justifica la similitud de propiedades químicas. La tabla está formada por 18 columnas o grupos y 7 filas o periodos. La dividimos en zonas según la configuración electrónica externa: elementos s, elementos p(ambos forman los grupos principales o representativos), elementos d ( o series de transición) y elementos f( o elementos de transición interna). En la figura están representadas estas zonas: La tabla periódica está estructurada de manera que todos los átomos de una columna tienen los mismos electrones de valencia. Así los metales alcalinos de la primera columna tienen todos un electrón de valencia en un orbital s, ó el grupo de los halógenos que tienen 7 electrones de valencia: dos en el orbital s y 5 en los tres orbitales p. Si agrupamos las columnas en función del último tipo de orbital que se ha llenado tendremos: 38 Esto nos permite establecer una regla nemotécnica muy fácil para recordar tanto las configuraciones externas e internas: Comencemos por las externas: Podemos fijarnos que los elementos de un periodo(n) están llenando los niveles ns,(n-2)f,(n-1)d y np en este orden. Esto permite reproducir los electrones de valencia o externos de cada periodo. La configuración interna la representamos por el símbolo químico del elemento que cierra el periodo anterior. Así por ejemplo Mo:[Kr]4d45s2. el elemento Mo(Z=42) tendrá una configuración fundamental En consecuencia tenemos que memorizar el símbolo y número atómico de los elementos que cierran cada periodo: He(2);Ne(10);Ar(18);Kr(36);Xe(54) y Rn(86) Los electrones d, que se suponen más internos se escriben antes que los s y p. Los electrones f normalmente se consideran internos. Esto último permite explicar el motivo de que los elementos que van llenando los niveles 4f ocupen realmente el mismo 39 lugar que el elemento La, y de ahí que los elementos de la 1ª serie de transición interna se denominen lantánidos. Del mismo modo ocurre con la serie 5f , que ocupan el lugar del Ac (actinidos). En la tabla resumimos las configuraciones externas de las distintas familias de elementos,correspondientes a los grupos principales Una propiedad muy importante para los distintos átomos es su tamaño. En la siguiente tabla viene representado este para algunos elementos: 40 Enlace químico Supongamos dos átomos A y B. Diremos que forman un enlace químico cuando : - Forman una unión permanente, es decir podemos estudiar las propiedades de la unión. Es necesario comunicar una energía a la unión bastante grande para separar los dos átomos. Esta cantidad de energía, denominada energía de enlace, debe ser superior, aproximadamente, a 40 kJ/mol.( Hay que tener en cuenta que esta será la energía desprendida cuando se formó el enlace): A----B + Energía de enlace → A + B - En la figura-1 está representada la energía del sistema formado por los átomos A y B en función de la distancia, r, entre sus núcleos. El mínimo de la curva corresponde a la situación de equilibrio. Está representada la energía de enlace y la longitud de enlace,(distancia entre los núcleos en la situación de equilibrio): Teniendo en cuenta las dos condiciones anteriores se han definido tres modelos de enlace: iónico, covalente y metálico. Por otra parte hay otras interacciones más débiles , pero muy importantes para explicar las propiedades de las sustancias: puentes de hidrógeno y fuerzas de Van der Waals. En la tabla están reseñados los valores típicos de la energía de enlace en estos tres casos: Tipo de enlace Energía de enlace (kJ/mol) Iónico, covalente,metálico ≈100 Hidrógeno ≈10 Van der Waals ≈0,1 La consideración fundamental que debemos hacer para justificar el enlace químico es la gran estabilidad o inercia química que presentan los elementos del grupo 18. Podemos suponer que los demás elementos intentarán conseguir esta configuración y puesto que 41 dichos elementos tienen 8 electrones en la capa más externa supondremos que los demás intentarán alcanzarla, (regla del octeto). Enlace iónico Una de las formas en que esto puede ser alcanzado es mediante el intercambio de electrones entre los átomos. Si nos fijamos en la estructura electrónica de un elemento como el Na: (Ne)3s1 y el Cl: (Ne)3s23p5. Podemos esperar entonces que el Na pierda su electrón 3s y se convierta en Na+ con la estructura del Ne y el Cl lo acepte y forme el anión Cl- con la estructura del Ar. Se habrán formado iones que quedarán unidos por atracción electrostática. Según lo dicho en el párrafo anterior debemos esperar que las valencias iónicas de los elementos de los grupos 1,2,16 y 17 sean: 1, +2 ,-2 y -1 respectivamente. Este enlace se debe formar entre elementos muy separados en la tabla periódica: entre metales y no metales. En el sólido iónico tendremos por tanto una red cristalina donde en los nudos existirán cationes o aniones. Enlace covalente Otra forma de conseguir la configuración de gas noble es compartiendo electrones de valencia. Este enlace covalente entre dos átomos lo representaremos mediante un guión: ─ Cada átomo cuenta como suyos los electrones compartidos. Por tanto un elemento formará tantos enlaces covalentes como le falten para llegar a la estructura de gas noble. La valencia covalente de los elementos de los grupos 14,15,16 y 17 será: 4,3,2 y 1 respectivamente. Si representamos los enlaces mediante guiones y los electrones no compartidos mediante puntos tendremos la estructura de Lewis de la sustancia. De todo lo dicho resultan las siguientes estructuras de Lewis para las moléculas H2, O2 N2 y H2O ; :N ≡ N: ; H-O-H H-H ; :O=O: En estas estructuras el símbolo del elemento representa el núcleo y los electrones internos. Este enlace se formará cuando se unan dos no metales entre sí. 42 Con estos enlaces tenemos dos tipos de redes cristalinas: a) Sustancias covalentes moleculares. Como por ejemplo el H2O. En los nudos de la red cristalinas tenemos moléculas. b) Sustancias covalentes no moleculares. Es el caso del C(diamante). En los nudos de la red cristalina tenemos átomos unidos a sus vecinos por enlaces covalentes. En realidad muchos enlaces covalentes serán parcialmente iónicos, pudiéndose entonces considerar como intermedios. En la figura viene representado uno de estos casos: Enlace metálico Podemos suponer que en un sólido metálico tenemos una red de cationes y los electrones de valencia de los átomos compartidos entre todos los núcleos. Estos electrones, puesto que no pertenecen a ningún átomo en concreto, tendrán libertad de movimiento, constituyendo el gas electrónico. Esto explica la alta conductividad eléctrica de estas sustancias. Fuerzas intermoleculares. Enlace de hidrógeno Cuando se forma un enlace covalente entre dos elementos distintos este será parcialmente iónico. O lo que es lo mismo será un enlace covalente polar. Esto hace que algunas moléculas sean polares convirtiéndose en un dipolo. ( Un dipolo es un conjunto de dos cargas eléctricas de la misma magnitud pero de signo distinto, separadas por una distancia). Entre estos dipolos existirán fuerzas atractivas. En el caso de que la molécula sea no polar aún existirán fuerzas atractivas, denominadas de Van der Waals, que aumentan con el peso molecular de la molécula. Esta interacción es muy inferior a la existente entre moléculas polares. Un tercer tipo de interacción mucho más intenso es el enlace de hidrógeno. Este solo existe entre aquellas moléculas que dispongan de enlaces H-F , H-O o H-N. Es la interacción más fuerte entre moléculas. En la figura tenemos representados los enlaces de hidrógeno entre moléculas de agua. 43 Esto explica por qué el agua es líquida a temperatura ambiente, mientras una sustancia como el CO, de parecido peso molecular, es gaseosa. Propiedades de las sustancias según el tipo de red cristalina En la tabla tenemos resumidas las propiedades que podemos esperar de cada sustancia según los cuatro modelos de red cristalina estudiados. Tipo de red Iónica Covalente molecular Covalente molecular no Metálica Puntos de Fusión o ebullición Altos ( sólidos Bajos a temperatura ambiente) Muy altos Normalmente sólidos Dureza Alta Baja Muy alta Muy variable Conductividad eléctrica Sólido: no Líquido: si Disueltos: si No en ningún No en ningún Conductores en estado estado estado sólido Solubilidad Los que tengan Na+, K+ o NH4+ Solubles en H2O Son solubles si Insolubles pueden formar puentes de H con el H2O Solubles si reaccionan con el H2O 44 Ejercicios 210 235 1. Para los isótopos: Pb82 U92 P1532 encontrar la composición de su núcleo y corteza. Solución: Pb( 82 e- en corteza y 128 n y 82 p+ en núcleo); U( 92 e- en corteza y 143 n y 92 p+ en núcleo); P( 15 e- en corteza y 17 n y 15 p+ en núcleo). 2. Encontrar la energía de un fotón de radiación de 3,4 nm de longitud de onda. Solución: 5,85.10-17 J 3. Una de las longitudes de onda absorbidas o emitidas por el átomo de H es 486,1 nm. Calcular la energía de los fotones correspondientes en eV/átomo y en kJ/mol. Solución: 2,56 eV/átomo; 246,3 kJ/mol 4. Encontrar el lugar que ocupa en la Tabla Periódica un elemento con Z = 76. Solución: Grupo:8; Periodo: 6 5. Qué número atómico tendrá un elemento que se encuentra en el grupo 16 , periodo 5º. Solución: Z = 52 6. Encontrar la configuración electrónica de los elementos de grupo 15. Solución: N (He)2s22p3; P: (Ne) 3s23p3; As: (Ar) 4s24p3; Sb: (Kr) 5s25p3; Bi: (Xe) 6s26p3 7. Para un elemento con Z = 82, encontrar su configuración electrónica fundamental interna y externa. Solución: interna (Xe)4f145d10; externa: 6s26p2 8. Para un elemento con Z = 23, encontrar lugar que ocupa en la Tabla Periódica y su configuración electrónica fundamental. Solución: Grupo 5; Periodo:4; Interna: (Ar); Externa: 3d34s2 9. Completar la tabla indicando qué modelo de enlace es el más adecuado para describir las propiedades de las sustancias: Au(75%) CaCO C(d) BF 3 3 Iónica Covalente Metálica 9. Ordenar según sus p.de f. las siguientes sustancias: CaF2; HF; HCl; H2; N2. Solución: CaF2 > HF > HCl > N2 > H2 10. Para las siguientes sustancias: Cu; NaCl; K2CO3; HClO; SiO2 encontrar: a)las que sean solubles en H2O; b)alguna que sea aislante en estado sólido pero conductora en el estado líquido; c)la más dura; d)alguna que sea conductora en el estado sólido. Solución: a) NaCl y K2CO3; b)NaCl y K2CO3; c) SiO2; d) Cu. 45 TEMA-5. Cinemática Es la parte de la Física que estudia los movimientos, pero no la causa de estos. Un sistema de referencia está constituido por: - Un punto del espacio .( Normalmente lo designaremos por O, inicial de observador). Un sistema de ejes cartesianos que se crucen en dicho punto. Un cronómetro, para medir intervalos de tiempo. En principio consideraremos cualquier objeto como un punto,(punto móvil). (Lo representaremos por P). No podemos, en este curso, estudiar los movimientos internos de los cuerpos La posición del objeto respecto al sistema de referencia, vendrá dada por tres coordenadas: x,y,z que pueden considerarse las componentes de un vector el de G G G GG G G posición: r = x i + y j + z k , ( i,j y k son los vectores unitarios en los ejes OX, OY y OZ respectivamente). En este curso consideraremos que siempre estamos en el plano XY y por lo tanto G G G simplemente escribiremos: r = x i + y j El cuerpo se moverá, con respecto al sistema de referencia, O, cuando cambie su posición respecto a el. Por lo tanto las componentes del vector de posición serán variables y debemos escribir: G G G r = x(t) i + y(t) j .(1) Con x(t) e y(t) queremos representar las funciones que relacionan las coordenadas e y con el tiempo t. En la figura tenemos una representación de lo anterior: 46 ( Figura-1 ) (Nota: el intervalo de tiempo lo indicaremos como t ó ∆t, según convenga, esto es debido a que el intervalo de tiempo será el tiempo transcurrido desde que disparamos el cronómetro,(t=0), hasta que lo paramos, t=t , y por lo tanto se cumplirá: ∆t = t – 0 = t ) El conjunto de posiciones ocupadas por el móvil constituye su trayectoria, y por lo tanto la ecuación (1) la representa. Si queremos encontrar su ecuación cartesiana solo tenemos que eliminar el tiempo entre las dos ecuaciones x(t) y y(t). Como ejemplo consideremos un móvil que se mueve según: G G G r = t i + t2 j Es decir el punto móvil tiene de coordenadas: x = t y y = t2 Por lo tanto la ecuación cartesiana de la trayectoria será: y = x2. Esto representa una parábola con un mínimo en el origen: 47 (figura-2) El trozo punteado corresponde a un intervalo de tiempo negativo,(pasado), y puede carecer de sentido físico). G Al cambio de posición lo denominaremos desplazamiento y vendrá dado por: ∆r . Según (1) se tendrá: G G G ∆r = ∆x i + ∆y j (2) En la figura viene representado dicho desplazamiento y su relación con el espacio recorrido, ∆s ,(realmente sería más apropiado denominarla longitud de trayectoria descrita ): (Figura-3) 48 En general, a menos que la trayectoria sea recta y no cambiemos de sentido, se cumplirá: G ∆r ≠ ∆s (3). Es decir el módulo del desplazamiento no coincide con el espacio recorrido. Velocidad Se denomina velocidad media en un intervalo de tiempo, ∆t, al cociente: G G ∆r (4) vm = ∆t El módulo de esta magnitud se mide en m/s. La podríamos interpretar como el desplazamiento por unidad de tiempo, dentro de ese intervalo. Las componentes de este vector serán: vx = ∆x ∆y ; vy = (5) ∆t ∆t La dirección de este vector será la del vector desplazamiento, es decir la de la cuerda de la figura-3 Rapidez media en ese mismo intervalo vendría medida por: vm = ∆s (6). ∆t Corresponde al espacio recorrido por unidad de tiempo. Según (3) se cumplirá que G v m ≠ v m (7) 49 Se podrían definir los valores instantáneos de la velocidad y de la rapidez si en las ecuaciones (4) y (6) tomamos un intervalo de tiempo suficientemente pequeño, dt. Tendríamos: G G dr v = ; dt y v = ds dt (8). G (Nota: Si existiesen las funciones r(t) y s(t), las expresiones (8) se podrían interpretar como sus respectivas derivadas). Cuando el intervalo de tiempo es muy pequeño la diferencia entre la cuerda y la curva G va haciéndose cada vez menor y en el límite podemos poner: dr =ds (9) y por lo tanto el: Módulo de la velocidad instantánea será la rapidez instantánea. Por otra parte, la dirección del vector velocidad media, se irá aproximando a la de la tangente y por tanto podemos afirmar que: La dirección del vector velocidad coincide con la de la tangente a la trayectoria en cada instante. Resumiendo el vector velocidad nos mide el movimiento en cada instante: - En intensidad : la rapidez Dirección Sentido Las componentes de la velocidad vendrán dadas por : 50 dx dt vx = vy = dy (10) dt Aceleración Denominamos aceleración media a : G G ∆v (11) am = ∆t Es decir es una magnitud que nos mide, en promedio, la variación de la velocidad por unidad de tiempo. Sus componentes son: ax = ∆v ∆v x ; a y = y (12). ∆t ∆t Es una magnitud que se mide en m/s2. La aceleración instantánea podrá definirse de forma similar a lo hecho con la velocidad instantánea: tomaremos un intervalo de tiempo infinitamente pequeño, dt: G G dv (13). a= dt Sus componentes vendrán dados por: ax = dv y dv x ; ay = (14). dt dt 51 G (Nota: vale lo dicho respecto a las ecuaciones (8), si existe la función v(t) ,la expresión (13) sería su derivada). Estas componentes se denominan componentes extrínsecas, puesto que están referidas a unos ejes independientes del objeto que se mueve. Por el contrario se denominan intrínsecas, las componentes de la aceleración que se refieren a dos ejes solidarios al punto móvil: las direcciones tangente y normal a la trayectoria en cada punto. En la figura-2 vienen representadas: ( Figura-4 ) G Estas componentes se denominan respectivamente aceleración tangencial, a t , y G aceleración normal, an . Sus valores son: G dv G G v2 G at = τ o ; an = no (15) dt R G G En estas ecuaciones τ o y no son dos vectores unitarios en las direcciones T,( tangente), y N, (normal), respectivamente; R es el radio de curvatura en ese punto y v es la rapidez en ese instante. Para un movimiento determinado: 52 G a t , nos mide el cambio de rapidez por unidad de tiempo en cada instante; G a n nos mide el cambio de dirección por unidad de tiempo en cada instante Modelos de movimiento Vamos a estudiar a continuación algunos modelos de movimiento. En todas estas ecuaciones t es el intervalo de tiempo: ∆t = t -0 = t. El subíndice (o) significa el valor que toma la magnitud considerada en el instante inicial (t=0). a) Movimiento uniforme En este movimiento at = cte = 0 y por lo tanto v=cte. La única ecuación que podemos utilizar es: s = so + v.t (16) b) Movimiento uniformemente acelerado Ahora tenemos que at = cte ≠ 0 La v no será constante. A partir de la ecuación 15(primera) es fácil deducir, (hay que tener en cuenta que en este caso el valor instantáneo de at coincide con el valor medio): v = v o + at .t (17). Por otra parte entre el espacio recorrido y el tiempo existirá la relación: s = so + v o .t + 1 at t 2 (18) 2 c) Movimiento rectilíneo uniforme G Ahora es a=0 y por tanto, si consideramos que la trayectoria es el eje OX: 53 x = xo + v x .t (19). En esta ecuación vx es la velocidad constante en el eje OX. (Podríamos escribir una ecuación similar para el movimiento en el eje OY sustituyendo las x por y). Desde luego at=0 y an=0 d) Movimiento rectilíneo uniformemente acelerado G a = cte ≠ 0 . Podemos usar la ecuación (14), si el movimiento ocurre en el eje OX. Tendremos la ecuación: v x = v xo + a x .t (20) que nos va a permitir calcular la velocidad en cualquier instante. Por otra parte se cumplirá una ecuación similar a la (18): x = xo + v xo .t + 1 a x .t 2 (21) 2 Si el movimiento ocurre en el eje OY tendríamos las ecuaciones: v y = v yo + a y .t (22) y = y 0 + v yo .t + 1 a y t 2 (23) 2 En este movimiento at ≠ 0 y an = 0 e) Movimiento circular Si tomamos el centro de la circunferencia trayectoria como sistema de referencia, la posición del móvil la podemos determinar usando coordenadas polares: R y θ. (El ángulo θ, que determina la posición lo mediremos en radianes): 54 (figura-5) Cuando el móvil cambie de posición, R será la misma,(hay que tener en cuenta que el radio de la trayectoria coincide con el módulo del vector de posición), pero la coordenada angular habrá variado en la cantidad: ∆θ. Esto nos va a permitir definir una nueva magnitud, la velocidad angular (ω), tanto en sus valores medios como instantáneos: ∆θ (24) ∆t dθ ω= (25) dt ωm = En un movimiento circular uniforme, además de la ecuación (16) se cumplirá: θ = θo + ω.t (26) (Deducida a partir de la (25),teniendo en cuenta que por ser uniforme el valor medio coincide con el instantáneo). El movimiento circular uniforme es un movimiento periódico: T: El periodo lo podemos definir como el tiempo que tarda en dar una vuelta.(Se mide en s) f: La frecuencia será el número de vueltas que da el móvil en un segundo. (Lo mediremos en hertzios, Hz). Entre ambas magnitudes se cumplirá: 55 f.T = 1 (27) La aceleración angular tendrá un módulo constante: an = v2 (28) R En un movimiento circular uniformemente acelerado, definiremos una nueva magnitud, la aceleración angular, α, que nos mida la variación de velocidad angular por unidad de tiempo en cada instante.(En este movimiento será una magnitud constante). Por similitud con las ecuaciones (17) y (18) tendremos: ω = ωo + α.t (29) θ = θo + ωo .t + 1 α.t 2 (30) 2 Aplicación de los modelos: Caída de los cuerpos. Tiro de proyectiles En las aplicaciones que siguen supondremos que el aire no ejerce ninguna fuerza de resistencia. Lo anterior equivale a decir que la única fuerza que actúa sobre el móvil en su recorrido es el peso. Por lo tanto cuando un móvil se mueva en esas condiciones tendremos: G G G a = 0 i - g j (31) Supongamos un cuerpo que cae o sube según la vertical. Tomamos como eje OY el de la trayectoria. Teniendo en cuenta la ecuación (31) y las (22) y (23): vy = vyo - g t (32) y = yo + vy t - 1 g t2(33) 2 56 Consideremos ahora el caso más general en el que lanzamos un cuerpo, desde un punto,(xo, yo), con una velocidad inicial (vxo , vyo)(Todos esto medido con respecto al sistema de referencia). En el eje OY todo ocurre igual que antes por lo que seguirán siendo válidas las ecuaciones (32) y (33).(Hay que tener en cuenta que ahora solo estamos determinando con estas ecuaciones las correspondientes componentes Y de los vectores posición y velocidad respectivamente). Pero en el eje OX no hay aceleración con lo que podemos aplicar para estas componentes la ecuación (19) y tener en cuenta que vx = vxo en todo instante. Si suponemos que la dirección del movimiento en el instante inicial es βo podemos tener las componentes iniciales de la velocidad en función de este ángulo y de la rapidez inicial mediante las relaciones: vxo =vo cosβo(34) vyo =vo senβo(35) Teniendo esto en cuenta, las ecuaciones que debemos aplicar al estudio del movimiento de un proyectil serán: x = xo + vo cosβo t (36) vx = vo cosβo (37) y = yo + vo senβo t - 1 g t 2 (38) 2 vy = vo senβo - g t (39) Veamos la aplicación de todo esto a un ejemplo concreto: Supongamos que lanzamos un objeto desde lo alto de una torre de 50 m, con una rapidez de 30 m/s en una dirección que forma un ángulo de 30º con la horizontal. Vamos a calcular: a) Altura máxima. b) Alcance. c) Rapidez y dirección del movimiento cuando llega al suelo. 57 a) Antes que nada tenemos que escoger el punto que nos va servir de sistema de referencia: el del lanzamiento. Por lo tanto en las ecuaciones (36) y (38) xo= 0 y yo= 0. A continuación calculamos vxo= 30 .cos 30 = 26 (m/s) y vyo= 30 . sen 30 = 15 (m/s) Para calcular la altura máxima tenemos en cuenta la ecuación (39): vy = 15 – 9,8 t Mientras esté subiendo vy> 0 , cuando esté bajando vy < 0 . Por tanto cuando no suba ni baje, es decir se encuentre en el punto de altura máxima vy = 0 y por lo tanto quedará: 0 = 15 – 9,8 .t ; lo que permite calcular t = 1,53 (s) como tiempo que tarda en subir al punto de altura máxima. Ahora utilizamos la ecuación (38) : ymax = 15 . 1,53 – ½ 9,8 . 1,532 = 11,5 (m) Por tanto tendremos : hmax = 50 + 11,5 = 61,5 (m) b) Para calcular el alcance, o xmax, utilicemos la ecuación (37) para calcular el tiempo que tarda en llegar al suelo: -50 = 15 t -1/2 9,8 t2 ; t = 5,07 (s); (solo tomamos la solución positiva, ya que la negativa carece se sentido físico). Sustituyendo este valor de t en la ecuación (36): xmax = 26 . 5,07 + 0 = 132 (m) c) Recordemos que la rapidez es el módulo de la velocidad y por tanto se cumplirá: v= v 2x + v 2y Para poder aplicar esta ecuación tenemos que conocer las componentes de la velocidad en el instante en que llega al suelo,( ecuaciones (37) y (39)): vx = 26 (m/s) ( no cambia durante todo el movimiento) vy = 15 – 9,8 . 5,07 = -34,7 (m/s) ( el signo – indica que en el instante de llegar al suelo nuestro movimiento vertical es hacia abajo). v = 262 + 34,7 2 = 43,4 (m/s) Para calcular la dirección del movimiento en ese instante consideremos que el vector velocidad tiene en cada instante la dirección y sentido del movimiento. Si denominamos por β el ángulo que forma dicho vector con el eje horizontal, podríamos calcular dicho ángulo considerando que: 58 tag β = vy vx = -34,7 = -1,3346 y de aquí resulta β= - 53,2 º 26 Movimiento Relativo Supongamos que tenemos un móvil, (P), cuyo movimiento es estudiado desde dos sistemas de referencia, O1 y O2. La posición del punto P vendrá dada, respecto a ambos G G sistemas por los respectivos vectores de posición: rO1 y rO2 G Si suponemos que la posición del sistema O2, respecto a O1 viene dada por rO2O1 , los tres vectores se podrán relacionar por la ecuación: G G G rO1 = rO2 + rO2O1 (40) Esto viene reflejado en la figura: (figura-6) A partir de la relación (40) podemos encontrar las ecuaciones que relacionan las velocidades y aceleraciones medidas en ambos sistemas de referencia: G G G v O1 = v O2 + v O2O1 (41) G G G aO1 = aO2 + aO2O1 (42) 59 De las ecuaciones (40), (41) y (42) se deduce que si ambos observadores se encuentran en movimiento relativo de traslación uniforme, describirán el movimiento de P con distintas trayectorias y velocidades, pero medirán la misma aceleración. En todo nuestro razonamiento del movimiento relativo hemos dado por supuesto que ambos observadores miden el mismo intervalo de tiempo t. (Esta suposición es fundamental en la Mecánica de Newton-Galileo, puesto que se le concede un carácter absoluto al espacio y al tiempo). 60 Ejercicios 1. Un cuerpo describe un cuadrado, de 5 m de lado, tardando 2(s) en recorrer cada lado. Tomando como referencia uno de los vértices escribir los vectores de posición cuando se encuentre en los mismos o en los puntos representados por la mitad de los lados. ¿Cuál habrá sido su velocidad media cuando se encuentre en el segundo vértice?.¿Y su G G G rapidez media?. Solución: v m = 1,25 i + 1,25 j (m/s) ; vm= 2,5 m/s 2. En la figura tenemos la gráfica v-t para el movimiento de un cuerpo. Calcular la at en cada trozo y la longitud total recorrida. ( En ordenadas la rapidez, v, en m/s y en abcisas el intervalo de tiempo en s). Solución: ∆s = 84 (m) G G G 3. Un cuerpo se mueve según la trayectoria : r = 3t i + t 2 j (m). Encontrar el vector desplazamiento entre los instantes 3 (s) y 6 (s). Cuál será el vector velocidad media en G G G ese intervalo. Solución: v m = 3 i + 9 j (m/s) 4. En el problema anterior encontrar la ecuación cartesiana de la trayectoria. Solución: x2 y= (parábola con un mínimo en el sistema de referencia) 9 G G G 5. Un cuerpo se mueve según la ecuación: r = 4.cos2t i + 4.sen2t j Encontrar la ecuación cartesiana de su trayectoria. Solución: x 2 + y 2 = 16 (circunferencia con centro en el sistema de referencia) 6. Lanzamos un cuerpo con una rapidez inicial de 40 m/s, en dirección vertical hacia arriba, desde una altura de 20 m. Encontrar en qué instante alcanza su altura máxima, cuanto vale esta y la rapidez cuando llega al suelo. Solución: 4,08(s); 101,6 (m); 44,6 (m/s) 7. Una bola de billar rueda con una rapidez de 5m/s sobre una mesa horizontal, sin rozamiento. Al llegar al borde cae. Encontrar: a) punto donde golpea al suelo por primera vez; b) rapidez y dirección en que lo hace. Se supone que la mesa tiene una altura de 2 m. Solución: a) a 3,2(m) del borde de la mesa; b) a 8,0 m/s) en una dirección que forma un ángulo de -51,4º 8. Desde una torre de 50 m, se lanza un cuerpo con una rapidez de 20m/s formando un ángulo de 30º con la horizontal. Calcular a) altura máxima; b)alcance; c) rapidez y dirección cuando llegan al suelo; d) velocidad al cabo de 1,25 (s) de iniciar el 61 movimiento, y su posición en ese instante; e) ecuación cartesiana de la trayectoria. Solución: G 55,1G (m) ; 75,8 (m) ; 37,1 (m/s) formando2 un ángulo de -62,2º; G v = 17 i + 3,9 j a 54,8 m de altura; y = 0,59 x – 0,017 x ( tomando el punto de lanzamiento como sistema de referencia) 9. En el problema anterior encontrar las componentes intrínsecas de la aceleración al G G G G G G cabo de 2s. Solución: a t = 4,17 i -2,31 j (m/s 2 ) y a n = -4,17 i -7,29 j (m/s 2 ) 10. Un hombre se mueve sobre una circunferencia de 50 m de radio dando una vuelta cada 5 minutos. Encontrar su posición , velocidad y aceleración al cabo de 1 minuto. Solución:G G G G G G G G G r = 15,5 i + 47,5 j (m) v = -0,99 i + 0,32 j (m/s) a = -0,0068 i - 0,021 j (m/s 2 ) (Situamos el sistema de referencia en el centro de la circunferencia y comenzamos a contar el tiempo cuando se encuentra en el punto (50;0)(m) 11. Un volante, de 50 cm de radio, da vueltas a razón de 300 r.p.m. Frena y se para al cabo de 20 s. Calcular su aceleración angular, tangencial y normal al cabo de 10 s de comenzar a parar. Solución: α = - 1,57 (rad/s2) ; at = - 0,79 (m/s2) ; an = 123,4 (m/s2) 12. Un hombre quiere cruzar un río de 200 m de anchura. Si la corriente del mismo es de 5 m/s. En qué dirección debe remar para tardar el menor tiempo posible; calcular dicho tiempo. Suponemos que la barca desarrolla una velocidad, respecto al agua, de 10 m/s. Calcular el tiempo que tarda en cruzarlo. Solución : Debe remar formando un ángulo de 120 respecto a la dirección y sentido de la corriente; 23,1(s) 62 TEMA-6. Dinámica y Energética Leyes de la Dinámica La Dinámica, en su formulación debida a Newton-Galileo, está basada en tres leyes o principios, que vamos a desarrollar con detalle a continuación: - 1ª Ley: Ley de la inercia: La materia tiene una cualidad denominada inercia: resistencia de los cuerpos a variar su estado de movimiento. Para medirla utilizamos su masa: a mayor masa mayor inercia. Cuando un cuerpo se mueve, la magnitud velocidad nos mide su movimiento. Pero si queremos modificar dicho movimiento es evidente que resultará tanto más difícil hacerlo cuanto mayor sea su masa. Esto nos lleva a establecer una nueva magnitud denominada cantidad de movimiento, G p , igual al producto de la masa del cuerpo por su velocidad: G G p = m.v (1) La cantidad de movimiento se mide en kg.m/s en el S.I. Estamos ahora en condiciones de establecer la ley de la inercia: “Un cuerpo sobre el que no actúan fuerzas,( o que tengan una resultante nula), permanecerá en su estado de reposo o haciéndolo con movimiento rectilíneo uniforme”. De lo estudiado anteriormente sobre la cantidad de movimiento podemos decir que: “La cantidad de movimiento de un cuerpo aislado permanece constante”. - 2ªLey: Ley fundamental de la Dinámica: Los cuerpos se ejercen acciones mutuas denominadas interacciones. Llamaremos G fuerza, F , a la medida de la interacción. La variación de cantidad de movimiento del cuerpo por unidad de tiempo nos da la medida de la fuerza resultante que sobre el actúa: 63 G ∆pG F= (2). ∆t Si consideramos valores instantáneos tendríamos la ley fundamental: G dpG F= (3) dt G En esta ecuación, como ya hemos dicho, F es la resultante de las fuerzas que actúan sobre el cuerpo. La unidad para medir la fuerza es el kg.m.s-2, denominada newton, N. Desarrollando (2) o (3) llegamos fácilmente a: G G dv G dm F = m. + v. (4) dt dt Si consideramos, caso más frecuente, un cuerpo cuya masa no cambie el segundo sumando es nulo y quedará simplemente: G G G dv F = m. = m.a (5) dt Donde hemos tenido en cuenta el concepto de aceleración. Esta ecuación (5) será por tanto la forma habitual de utilizar la ley fundamental. - 3ªLey: Ley de acción y reacción: Cuando dos cuerpos interaccionan lo hacen mutuamente. La tercera ley nos permite cuantificar dichas interacciones: “Cuando dos cuerpos interaccionan, se ejercen mutuamente fuerzas iguales en intensidad y dirección pero sentidos opuestos”. 64 Es decir si suponemos 1 y 2 los cuerpos que interaccionan: G G F1,2 = - F2,1 (6) (En esta ecuación los subíndices indican los cuerpos que interactúan: 1,2 significa la fuerza que actúa sobre 1,debido a 2) Impulso y cantidad de movimiento: teorema de conservación G G La ecuación (3) o (2) puede ser escrita como F.∆t = ∆p (7). G El primer miembro se denomina impulso I y representa el producto de la fuerza que actúa sobre el cuerpo por el tiempo en que lo hace. El segundo miembro es simplemente la variación de cantidad de movimiento producida. Por lo tanto: “ el impulso es igual a la variación de la cantidad de movimiento” A partir de la 3ª Ley (ecuación (6)) y teniendo en cuenta la (2) podemos escribir, para G G ∆p1 ∆p 2 dos cuerpos sometidos solamente a su interacción mutua: y de aquí =∆t ∆t llegamos fácilmente a: G G ∆p1 = -∆p 2 (8) Por tanto cuando dos cuerpos están sometidos solamente a su interacción intercambian cantidad de movimiento. Si consideramos el sistema formado por los dos cuerpos su cantidad de movimiento G G G G total será: p1 + p 2 . A partir de la ecuación (8) ∆p1 + ∆p 2 = 0 y por lo tanto la cantidad de movimiento total permanecerá constante. G G p1 + p 2 = constante (9) Esto constituye el principio de conservación de la cantidad de movimiento: Cuando dos cuerpos chocan, la interacción es muy intensa pero muy breve en el espacio y tiempo. Podemos suponer que en ese intervalo de tiempo estos cuerpos solo van a estar sometidos a su interacción mutua , por lo que será de aplicación en el estudio de los choques todo lo dicho en los párrafos anteriores. 65 “cuando dos cuerpos están sometidos solamente a su interacción mutua la cantidad de movimiento total permanece constante y la interacción consiste simplemente en intercambiar cantidad de movimiento”. En la figura tenemos representada un a interacción,(choque), entre dos partículas: Sistemas inerciales y no inerciales. Fuerzas de inercia. Hasta ahora no hemos dicho nada sobre el sistema de referencia desde el cuál estamos midiendo las fuerzas que actúan sobre los cuerpos. Consideremos un móvil de masa m cuyo movimiento es estudiado por dos observadores: O1 y O2. Como ya sabemos las aceleraciones medidas por ambos están relacionadas por la ecuación: G G G a O1 = a O2 + a O2O1 (10) Denominaremos inercial un sistema de referencia en el que se cumplen las leyes de Newton. Supongamos que O1 es un sistema inercial. Si la ecuación (7) la multiplicamos G G G por la masa, m, del cuerpo quedará: m a O1 = m a O2 + m a O2O1 G El observador O1considera que ma O1 es la fuerza que actúa sobre el cuerpo. De la misma G forma pensará el observador O2 respecto a ma O2 . Por lo tanto la ecuación anterior G G G quedará como: FO1 = FO2 + ma O2O1 (11). Como ya sabemos O1 es un observador inercial, y por lo tanto mide bien las fuerzas, pero ¿ y O2?. Para comprender el error cometido por este observador vamos a despejar la fuerza medida por el en la ecuación anterior: 66 G G G FO2 = FO1 - ma O2O1 (12). Según esta ecuación, además de las fuerzas realmente existentes, medidas por O1, el observador O2 mide la presencia sobre el cuerpo de una fuerza ficticia, ya que no corresponde a ninguna interacción, cuyo valor es: G G Fi = - ma O2O1 (13) denominada fuerza de inercia. Si consideramos el centro del universo, en reposo, como sistema inercial, la ecuación (12) o (13) nos indican que cualquier sistema que se mueva con movimiento rectilíneo uniforme respecto a dicho centro será también inercial. Por lo tanto será un sistema inercial cualquier cuerpo animado de movimiento rectilíneo uniforme. Cuanto mayor sea la aceleración del sistema de referencia mayor será el error introducido, debido a las fuerzas de inercia, cuando apliquemos en el las leyes de la dinámica. Ejemplos de fuerzas: a) Cuerpo apoyado sobre el suelo. En las figuras N es la fuerza que hace el suelo sobre el cuerpo y P el peso del mismo. Como se indica, en la primera figura, un cuerpo apoyado sobre un suelo horizontal, está ejerciendo una fuerza ,P, sobre el mismo, por lo que este responderá con una fuerza igual y de sentido contrario. 67 Si el cuerpo está apoyado sobre un plano inclinado, solo estará ejerciendo una fuerza Pn En esta figura la inclinación del plano es β, por lo que también será β el ángulo marcado. Si descomponemos el peso según dos ejes normal y tangencial al plano obtendremos Pn y Pt respectivamente. Es muy fácil demostrar que ambas componentes valdrán: Pn = m.g. cosβ y Pt = m. g. senβ (14) b) Tensión en una cuerda: Es la fuerza que aplicada a los extremos la mantiene tirante. Si denominamos T1 y T2 estas fuerzas tangenciales y mc la masa de la cuerda quedará: T1-T2= mc.at (15) Según esta ecuación si at es nula ambas tensiones serán iguales. En todos los problemas en donde intervengan cuerdas, supondremos que estas no tienen masa por lo que según (15) : T1 = T2 cualquiera que sea el movimiento de la cuerda. Esta se limita por tanto a transmitir la fuerza aplicada. c) Rozamiento: Vamos a considerar solo el rozamiento por deslizamiento entre sólidos. La fuerza de rozamiento existente se debe a la rugosidad de la superficie de los cuerpos que deslizan. Distinguiremos dos situaciones: -Rozamiento estático: Este no tiene un solo valor. Será igual a la fuerza total tangencial aplicada al cuerpo. Su valor máximo es proporcional a N: FR,e(máximo)= µe.N (16) 68 La constante de proporcionalidad se denomina coeficiente estático de rozamiento. (Realmente la fuerza dada por (16) es el valor mínimo de la fuerza tangencial aplicada para comenzar a deslizar el cuerpo). -Rozamiento dinámico: Tiene un valor constante igual a: FR,d= µd.N (17) La constante de proporcionalidad se denomina coeficiente de rozamiento dinámico. En todos los casos: µe > µd . Esto equivale a decir que hace falta mayor fuerza para comenzar a deslizar que para continuar haciéndolo. En la figura vienen representadas todas las fuerzas que actúan sobre un cuerpo que desliza sobre un plano: d) Elásticas: Según la ley de Hooke la fuerza deformadora es proporcional a la deformación producida. Así por ejemplo si tenemos un muelle y aplicamos una fuerza F en dirección longitudinal se producirá un alargamiento o acortamiento del mismo , x , proporcional a la fuerza aplicada: 69 F = k .x (18) e) Fuerza gravitatoria: La expresión matemática de la interacción gravitatoria entre dos masas es: F=G m.M (19) r2 En esta ecuación F es la fuerza de interacción, m y M son las masas puntuales que interactúan y r la distancia entre ellas. G es la constante universal de gravitación G = 6,67.10-11N.m2/kg2 Esta fuerza es central, es decir su dirección es la de la recta que une la posición de las dos partículas. La ecuación,(19), solo es válida para masas puntuales o esféricas. En este último caso se tratará de esferas con la masa uniformemente distribuida o por lo menos cuyas diferencias de densidad se produzcan en distintas zonas esféricas concéntricas. Este sería el caso de la Tierra o cualquier otro cuerpo celeste,( en primera aproximación). La Tierra se puede considerar por tanto como una masa puntual colocada en su centro. (Esto solo es válido desde el exterior de la Tierra) Podemos aplicar esta ecuación (19) a la interacción entre un cuerpo de masa m y la Tierra de masa MT. La fuerza con que la Tierra atrae al cuerpo se llama peso del mismo: Ph = G M T .m (R T + h) 2 (20) (Hemos tenido en cuenta que la distancia entre el cuerpo y el centro de la Tierra es: RT + h) 70 Si consideramos un cuerpo en las proximidades de la superficie de la Tierra RT>>>h y quedará: ⎛ M ⎞ Po = ⎜ G 2T ⎟ .m (21). ⎝ RT ⎠ La cantidad encerrada entre paréntesis solo depende de la Tierra y la denominaremos go. Podríamos escribir: Po = m.go(22) Si el peso es la única fuerza que actúa esta cantidad será la aceleración del cuerpo (según la 2ª ley de la dinámica) y por lo tanto todos los cuerpos caerán con la misma aceleración,(en ausencia de aire). La ecuación (20) pone de manifiesto que si el cuerpo cae desde una altura muy grande la aceleración de caída ya no será constante. Si denominamos campo gravitatorio terrestre la región del espacio que rodea la Tierra y definimos como intensidad del mismo en un punto la relación entre el peso de un cuerpo colocado en él y su masa, según la ecuación (20) o (21) resulta que la aceleración de la gravedad es justamente dicha intensidad. 71 Trabajo y energía G En la figura una fuerza F está aplicada en un punto de un cuerpo. El punto Gde aplicación de dicha fuerza, (no necesariamente el cuerpo), sufre un desplazamiento ∆r . Se define como trabajo de esa fuerza constante sobre el cuerpo a: G G G G W = F.∆r = F.∆ r.cosα (23) La unidad de trabajo en el S.I. es el julio,(J), definida como: 1J = 1N.1m Desde un punto de vista técnico tiene mucha importancia el concepto de potencia definido como el trabajo realizado por unidad de tiempo: P= W (24). t La unidad de potencia en el S.I. es 1W= 1J/1s. A partir de la ecuación 24 podemos calcular el trabajo desarrollado W = P . t. Se define una nueva unidad de trabajo ,(no de potencia), 1kW-h que sería el trabajo realizado por una máquina cuya potencia es 1kW trabajando durante 1 h. Su equivalencia es: 1kW-h= 3,6.106 J. Definimos como energía, E, la capacidad de realizar transformaciones. Teniendo en cuenta la definición de trabajo supondremos que el trabajo realizado sobre el cuerpo se invierte en aumentar la energía del mismo. Es decir establecemos la relación: W = ∆E (25). 72 Energía cinética. Teorema de las fuerzas vivas Supongamos un cuerpo de masa m sobre el que aplicamos una fuerza Ft,( estamos suponiendo que la fuerza tiene la dirección y sentido del desplazamiento). Si se ha producido un desplazamiento ∆s el trabajo realizado será: W = Ft.∆s . Si tenemos en cuenta la ley fundamental quedará: W = m.at.∆s . Suponiendo que la fuerza fuera constante el movimiento será uniformemente acelerado por lo que: at.∆s = ½(v2-vo2) quedando finalmente W = ½ m v2 – ½ m vo2 (26) Según la definición (25) ,supondremos que el cuerpo sobre el que se ha hecho el trabajo, W, ha aumentado su energía. Denominaremos energía cinética a la que tiene un cuerpo por el hecho de moverse. Por lo tanto la ecuación (26) podemos escribirla como: W = ∆Ec (27) En esta ecuación la energía cinética, Ec queda establecida como Ec= ½ m v2 + cte. Las ecuaciones (26) o (27) se conocen como teorema de la energía cinética o de las fuerzas vivas. ( Hay que tener en cuenta que las ecuaciones (26) o (27) solo se pueden aplicar para el trabajo de la fuerza resultante y no para el efectuado por cada una de las fuerzas que existan sobre el cuerpo). Energía potencial Supongamos un cuerpo sobre el que aplicamos una fuerza y el único efecto ha sido aumentar la altura sobre el suelo la cantidad ∆h. El trabajo realizado por la fuerza aplicada será: Wf.aplicada = Faplicada.∆h = m go.∆h ( donde hemos tenido en cuenta que la fuerza aplicada es igual en intensidad al peso, aunque de sentido contrario). El cuerpo ha adquirido energía, ya que si lo soltamos cuando vuelva al suelo es capaz de realizar un trabajo. 73 Llamaremos energía potencial a la energía que tiene un cuerpo debido a la altura que tiene sobre el suelo. La ecuación anterior podemos por lo tanto escribirla como: Wf.aplicada=∆Ep= m.go.∆h (28). Esta ecuación permite definir la energía potencial como: Ep= m.g.h + cte (29) Por otra parte como el peso tiene sentido contrario a la fuerza aplicada tendremos que: Wpeso= - Wf.aplicada = -∆Ep(30) Estas ecuaciones (29) y (30) serán válidas aunque solo exista aplicada la fuerza peso,( que por otra parte siempre existirá). Supongamos ahora que estiramos un muelle de constante elástica k una cantidad x. Para calcular el trabajo realizado por la fuerza aplicada tengamos en cuenta la figura: El área rayada corresponde al trabajo efectuado y esta es: W = ½ k x2 Pero por otra parte este trabajo se traduce en un aumento de energía, en este caso energía potencial elástica, Ep,e, y podemos establecer por lo tanto que: Ep,e= ½ k x2 + cte (31) 74 Si una vez estirado soltamos el muelle este recupera su forma por lo que existirá una fuerza elástica recuperadora. Se cumplirá que el trabajo efectuado por ella vendrá dado por: We= - ∆Ep,e (32) En esta ecuación We es el trabajo efectuado por la fuerza elástica. (Observar que la relación (32) es del mismo tipo que la (30)). Energía mecánica. Principio de conservación Denominamos energía mecánica la suma de la energía cinética y potencial: Em = Ec +Ep(33) Consideremos un cuerpo sobre el que solo actúa la fuerza peso. Se cumplirá la ecuación (27), Wpeso= ∆Ec, ya que el peso es la resultante y la (30): Wpeso= -∆Ep .Igualando los segundos miembros tendremos: ∆Ec = -∆Ep y de aquí , ∆Ec+ ∆Ep = 0 Por lo tanto ∆Em=0 Es decir: “ Cuando la resultante de las fuerzas que actúan sobre un cuerpo es el peso, la energía mecánica permanece constante” Matemáticamente : Ec+ Ep= cte (34) 75 Lo anterior constituye el enunciado del principio de conservación de la energía mecánica. Este es el motivo por el que la fuerza peso se considera una fuerza conservativa. Si suponemos que además de la fuerza peso existe una fuerza elástica, la energía mecánica será la suma de la cinética y de las energías potenciales existentes: Em= Ec+ Ep+ Ep,e (35) Por un razonamiento similar al efectuado para deducir la relación (34) ,llegaríamos a la misma relación, por lo que también se cumplirá el principio de conservación de la energía mecánica, definida ahora por la relación (35): Ec + Ep + Ep,e = cte (36) En resumen también la fuerza elástica es una fuerza conservativa. Consideremos que sobre el cuerpo, además de las fuerzas conservativas se ejercen otras fuerzas no conservativas y supongamos que: G G G Fresultante = Fcons + Fno cons (37) El primer sumando incluye el peso, las fuerzas elásticas, ..etc, es decir la resultante de las fuerzas conservativas; el segundo sumando será la resultante de las fuerzas no conservativas, (como por ejemplo el rozamiento). El trabajo total, W, será la suma de los trabajos efectuados por todas las fuerzas y por lo tanto: W = Wcons+ Wno cons (38) Esta ecuación puede ser transformada del siguiente modo: El primer miembro será: ∆Ec, según la (27); el primer sumando del segundo miembro es –∆Ep, (según (30) o (32), incluyendo Ep, la suma de todas las energías potenciales), por lo quedará: ∆Ec = -∆Ep+ Wno cons (39) De aquí fácilmente: 76 Wno cons= ∆Ec+ ∆Ep = ∆Em (40) donde hemos tenido en cuenta la definición de energía mecánica ( (33) o (35)). Un caso muy importante, es cuando la fuerza no conservativa es la fuerza de rozamiento dinámica. En este caso el primer miembro de (40) vendrá dado por: Wno cons= Wrozamiento= - FR,d ∆s (41) Se trata por tanto de una cantidad siempre negativa. Por eso se dice que la fuerza de rozamiento es una fuerza disipativa, ya que su presencia hace disminuir, es decir disipar, la energía mecánica. 77 Ejercicios 1. Un cuerpo de 25 kg de masa se encuentra apoyado sobre un plano inclinado 30º. Calcular: a) la aceleración con que baja si no hay rozamiento; b) dicha aceleración si el coeficiente cinético de rozamiento entre el cuerpo y el plano es = 0,3. Solución: a) 4,9 (m/s2) ; b) 2,45 (m/s2) 2. Un cuerpo de 15 kg de masa reposa sobre un plano inclinado 30º con el que tiene un rozamiento medido por el coeficiente estático = 0,5, ¿ deslizará ?. Solución: Si (Pt = 73,5(N) y Fr,e,max = 63,7 (N)) 3. Sobre la garganta de una polea fija pasa una cuerda sin masa de la que penden dos pesos de 10 y 15 kg. Calcular la aceleración de las masas y la tensión de la cuerda. Solución: 1,96 (m/s2) ; 117,6 (N) 4. Una bala de 0,2 kg es disparada horizontalmente sobre un bloque de madera de 40 kg que se encuentra inicialmente en reposo. Si la velocidad de la bala es de 200 m/s, cuál será la inicial del bloque cuando choque con el.( Suponemos que después del choque la bala queda incrustada en él). Solución: 0,995(m/s) 5. Un hombre de 80 kg se monta ,dentro de un ascensor, sobre una báscula. Encontrar lo que marcaría dicha báscula: a) si el ascensor sube con aceleración de 0,1 m/s2; b) si sube con aceleración de -0,1 m/s2. Solución: a) 80.8 (kg); b) 79,2 (kg) 6. Un cuerpo de 5 kg se encuentra apoyado en una mesa horizontal con la que tiene un rozamiento medidos por los coeficientes: 0,5 y 0,3 unido mediante una cuerda sin masa que pasa por una polea fija a otro cuerpo de 10 kg suspendido en la vertical. Calcular: a) se mueven los cuerpos; b) caso afirmativo con qué aceleración. Solución: a) Si ; b) 5,53 (m/s2) 7. Un cuerpo pende de 2 kg pende de un hilo sin masa del techo de un vehículo. Cuando este frene con una aceleración de -5 m/s2 qué ángulo formará la cuerda con la vertical. Solución: 27º con la vertical hacia atrás. 8. Una piedra de 3 kg está atada a una cuerda de 0,5 m. Hacemos girar la piedra en un plano vertical con una velocidad angular de 100 r.p.m. Calcular la tensión de la cuerda en los puntos de altura máxima y mínima. Solución: Tmax= 193,8(N) ; Tmin = 135 (N) 9. Dos cuerpos de 3 y 6 kg de masa se encuentran unidos por una cuerda sin masa que pasa a través de una polea fija y apoyados en dos planos que forman ángulos de 15º y 45º con la horizontal respectivamente. Si suponemos que entre los cuerpos y el plano existe un rozamiento medido por los coeficientes 0,2 y 0,1 calcular: a) si se moverán; b) con qué aceleración. Solución: a) se mueven hacia la derecha; b) 3,0 (m/s2) 10. Lanzamos un cuerpo de 3 kg de masa desde lo más alto de una torre de 50m. Si la rapidez inicial del mismo es de 20 m/s, calcular la rapidez cuando llegue al suelo: a) si suponemos que no existe el aire; b) si el aire ejerce un rozamiento que elimina el 25% de la energía mecánica. Solución: a) 37,1 (m/s) ; b) 32,2 (m/s) 78 11. Un cuerpo de 5 kg se encuentra situado al lado de un muelle de constante k= 103N/m . Si comprimimos el muelle una longitud de 10cm y soltamos con qué velocidad saldrá despedido el cuerpo. Solución: 1,4 (m/s) 12. Una bala de 0,05 kg se mueve horizontalmente y después de chocar queda dentro de un bloque de madera de 50 kg que se encontraba inicialmente en reposo. Si suponemos que entre el bloque y el suelo existe un rozamiento dinámico medido por el coeficiente = 0,2 y que el bloque ha recorrido 2 m antes de pararse, ¿cuál era la velocidad de la bala antes de chocar con el bloque?. Solución: 2256,2 (km/h) 13. Supongamos dos cuerpos de 3 y 4 kg unidos por una cuerda sin masa que pasa a través de una polea. Si en el instante inicial ambos se encuentran a la misma altura, ¿cuál será su velocidad cuando el primero haya ascendido 0,5 m?. Solución: 1,18 (m/s) 14. Desde el punto más alto de un plano inclinado 30º se deja caer un cuerpo de 4 kg. Si existe rozamiento dinámico medido por el coeficiente =0,3 calcular la velocidad en el punto más bajo del plano. Se supone que el plano tiene una longitud de 2 m. Solución: 3,1 (m/s) 15. Hasta que altura hay que subir para que el peso de un hombre se reduzca a la mitad. Solución: una altura equivalente a 0,41 veces el radio terrestre. 16. Un satélite artificial que se encuentra a una altura de 2000 km ,qué tiempo tarda en recorrer su órbita. Se supone que no existe el aire y además que dicha órbita es circular. Solución: 3,72 horas 17. Para el sistema del problema nº6 suponer que se mueven y que el rozamiento dinámico está medido por el coeficiente = 0,1. Calcular la velocidad cuando han recorrido una distancia de 0,5 m partiendo del reposo. Solución: 2,49 (m/s) 18. Para el sistema del problema nº9 suponer que se mueven hacia la derecha y calcular su velocidad cuando han recorrido 0,5m. Solución: 1,73 (m/s) 19. Un cuerpo de 3 kg de masa atado a una cuerda de 0,5m gira en un plano vertical. Cuál tiene que ser la mínima velocidad en el punto más alto para que pueda hacerlo. Solución: 2,2 (m/s) 20. Dos cuerpos de 3 y 4 kg se mueven sobre un plano horizontal sin rozamiento. Las direcciones de su movimiento son perpendiculares y su rapidez 4 y 5 m/s respectivamente. Si suponemos que después del choque quedan unidos calcular su velocidad. Solución: 3,3(m/s) en una dirección que forma un ángulo de 59º con la inicial de la masa de 3 kg. 79 TEMA-7: Electricidad El contenido de este tema lo vamos a dividir en tres grandes aparatados: a)Electrostática ; b)corriente eléctrica y c) introducción al magnetismo a) Electrostática En los cursos anteriores has estudiado los fenómenos de electrificación por frotamiento. Como consecuencia de los mismos podemos establecer: - La interacción entre los cuerpos electrizados por frotamiento puede ser atractiva o repulsiva. Como consecuencia de lo anterior podemos afirmar que los cuerpos electrizados tienen una carga eléctrica neta, que puede ser de dos tipos. Denominados hoy en día positiva y negativa. La carga eléctrica está cuantizada. ( Es un múltiplo de la cantidad fundamental e, carga del electrón en valor absoluto). La carga eléctrica se conserva en cualquier proceso tanto físico como químico. Se denominan conductores aquellos materiales como los metales que permiten el traslado de la carga eléctrica en su interior o superficie. Por esto estos cuerpos no pueden ser electrificados por frotamiento. Se denominan aislantes o dieléctricos los cuerpos, como los plásticos, que no permiten la circulación de la carga en su interior o superficie y por lo tanto si pueden ser cargados por frotamiento. Ley de Coulomb Denominemos por q la carga que tiene un cuerpo puntual. Esta carga se medirá en culombios, (C), en el sistema internacional. Supongamos dos partículas cargadas q1 y q2 , en reposo, colocadas a una distancia r12. La fuerza de interacción viene dada por la ley de Coulomb: F12 = K q1.q 2 r122 (1) Es decir el módulo de la fuerza de interacción es directamente proporcional al producto de las cargas e inversamente proporcional al cuadrado de la distancia. Tres son las características básicas de la interacción: - Es una interacción central. La dirección de la fuerza es la de la recta que une las dos partículas. 80 - La interacción puede ser atractiva o repulsiva. O lo que es lo mismo existen dos tipos de cargas: positivas y negativas. Cargas del mismo tipo se repelen y de distinto tipo se traen. La interacción depende del medio físico que separe las cargas. Esto equivale a decir que la constante K tiene un valor para cada medio. Si el medio es el vacío y utilizamos el sistema internacional tenemos: Ko= 9.109(N.m2.C-2).(2) Hay que hacer notar la semejanza entre la ley de Newton de interacción gravitatoria entre dos partículas y la ley de Coulomb de la interacción electrostática. El valor de (2) establece que en presencia de la interacción eléctrica la gravitatoria carece de importancia. Así el átomo de hidrógeno existe debido a la atracción eléctrica entre el protón y el electrón y no por su atracción gravitatoria enormemente menor. La ecuación (1) es válida exclusivamente entre partículas o entre cuerpos esféricos. Campo eléctrico Se denomina campo eléctrico al espacio que rodea a los cuerpos cargados. Lo vamos a caracterizar en cada punto del espacio por dos magnitudes: - G Intensidad del campo, E . Se trata de una magnitud vectorial Potencial del campo, V. Es pues una magnitud escalar. Estudiaremos en este apartado la intensidad del campo. Denominamos intensidad del campo eléctrico en un punto al cociente entre la fuerza de origen eléctrico que existe sobre una carga de prueba ,q, colocada en el punto y dicha carga. Es decir: G G Fe (3) E= q Como ya hemos dicho se trata de una magnitud vectorial cuyo módulo en el S.I. se mide en N/m. Vamos ahora a calcular el campo creado por una carga puntual. Para ello supongamos que tenemos en un determinado punto una carga puntual, Q. Este punto lo vamos a tomar como referencia para todos los demás. La fuerza eléctrica vendrá dada por la ley de Coulomb, por lo que el campo creado por dicha carga puntual en un punto tal como el de la figura será: 81 G Q G E = K 2 ro (4) r G En esta ecuación, r es la distancia del punto considerado a la carga Q y ro un vector unitario en la recta que une dicha carga y el punto considerado, sentido desde la carga al punto.( En lo sucesivo las cargas que crean el campo serán denominadas Q, y las que colocamos en un punto para medir el campo creado, q; esto no indica nada sobre su valor relativo). Para representar el campo eléctrico se utiliza el concepto de línea de fuerza: línea imaginaria que en cada punto tiene la dirección de la intensidad del campo. En la figura tenemos representados los campos creados por una carga puntual positiva y otra carga puntual negativa: 82 Si en lugar de una carga puntual tenemos dos, para calcular el campo en un punto podemos utilizar el principio de superposición: “ El campo creado por dos cargas en un punto es la suma de los que crearían en dicho punto cada una de las cargas si estuviese sola” En las figuras tenemos el campo creado en este caso: Evidentemente este principio lo podemos extender a un conjunto de cargas cualquiera. Un campo eléctrico uniforme, es decir constante en todos los puntos, vendrá representado por un conjunto de líneas de fuerza paralelas a igual distancia. Una forma 83 sencilla de conseguir un campo de este tipo es tener dos superficies metálicas, planas, cargadas con cargas iguales y de signo contrario. En la figura tenemos representado el campo en la región central, (alejada de los bordes): En todos los casos vemos que las líneas del campo eléctrico van desde las cargas + a las – Podemos ahora estudiar el efecto del campo eléctrico sobre los distintos tipos de materiales. Si introducimos un trozo de metal en el campo eléctrico, sobre cada electrón de valencia existirá una fuerza eléctrica: G G F e = - e E int (4) Esta ecuación pone de manifiesto que los electrones de valencia se moverán produciéndose una corriente eléctrica. Cuando acabe dicha corriente y se haya producido el equilibrio eléctrico el campo en el interior tiene que ser nulo Esto se pone de manifiesto en la siguiente figura: 84 Como el campo en el interior es nulo, si existe alguna carga neta esta se situará en la superficie, pues ya sabemos que cualquier carga crea un campo a su alrededor. En el caso de un dieléctrico el campo en el interior del material no se anula, solo disminuye. Esto es debido a la polarización del material. Energía potencial eléctrica. Potencial eléctrico Consideremos un campo eléctrico uniforme dirigido en el sentido positivo del eje OX: G G E = Ex i Vamos a trasladar una carga q(+) desde un punto (1) al (2) situados en el eje OX, tal como indica la figura. Para ello aplicamos una fuerza Fapl. De la misma dirección pero de sentido contrario a la fuerza existente sobre la carga debido al campo eléctrico: G G Fe = q E (5) 85 El trabajo realizado por la fuerza aplicada para producir el desplazamiento de (1) a (2) será: G G WF.apl. = Faplicada .∆r = q E x ∆x (6) Si una vez trasladada la carga dejamos de aplicar la fuerza es evidente que se moverá adquiriendo energía cinética. Por lo tanto llegamos a la conclusión que en el punto (2) la carga tiene mayor capacidad de realizar trabajo que en el punto (1). De otra forma el trabajo hecho por la fuerza aplicada será igual al aumento de energía potencial eléctrica adquirido por la carga: WF.apl. = ∆E p,e .(7) Como ya dijimos en cada punto la fuerza aplicada y la fuerza eléctrica son iguales pero de sentido contrario por lo que: W e= WF.apl. y de aquí: We = - ∆E p,e (8) Esta ecuación es válida para cualquier campo eléctrico. Si consideramos que la partícula se mueve en un campo eléctrico y la única fuerza que actúa sobre ella es la eléctrica tendríamos: We = ∆E c (9) según el teorema de las fuerzas vivas. Además según acabamos de demostrar se cumplirá la ecuación (8). Igualando los segundos miembros tenemos: ∆E c = - ∆E p,e (10) Si llamamos EM a la energía mecánica de la partícula, definida como suma de su energía cinética y de la potencial eléctrica, la relación (10) queda como: 86 ∆E M = 0 (11) Es decir la energía mecánica se conserva. Por lo tanto la fuerza eléctrica es una fuerza conservativa. Definiremos como potencial eléctrico en un punto, V, a la energía potencial eléctrica E por unidad de carga colocada en el punto: V = p,e (12) q Su unidad en el S.I. es el voltio: 1(V) = 1(J)/1(m) Utilizando el concepto de potencial, la ecuación (8) queda como: We = -q ∆V (13) y WF.apl. = ∆E p,e = q ∆V (14). Esta última ecuación proporciona un método teórico para definir la diferencia de potencial, ∆V, entre dos puntos: ∆V = WF.apl. , es decir queda q medido por el trabajo hecho para trasladar una carga de prueba, por unidad de carga. Ahora podemos entender la definición de la unidad atómica de energía,(tema 4): (eV) Energía correspondiente al traslado de un electrón entre dos puntos cuya diferencia de potencial es 1(V). Teniendo en cuenta las ecuaciones (14); (13) y (6) podremos escribir que: Ex = - ∆V (15) ∆x Si tenemos en cuenta el sentido del vector campo, vemos que este va de los mayores a menores potenciales. Según la ecuación (15) el campo se puede medir en (V/m). El campo eléctrico se puede representar también por superficies equipotenciales o superficies de nivel: superficies imaginarias que tienen todos sus puntos al mismo potencial eléctrico. El potencial eléctrico de una carga puntual viene dado por la ecuación: 87 V = Ke Q + cte (16) r En el caso del campo eléctrico creado por una carga puntual, las superficies equipotenciales son esferas con centro en la carga: En general en por cada punto del campo pasa una superficie de nivel y una línea de fuerza mutuamente perpendiculares. Con ayuda del principio de conservación de la energía mecánica vamos ahora a estudiar el sentido del movimiento espontáneo de una carga eléctrica. Los puntos de mayor potencial los representaremos por V(+) y los menores como V(-). Cuando una carga q se mueva espontáneamente entre los dos puntos se tendrá: ∆E c = - ∆E p,e = - q∆V (17) En cualquier caso tendrá que ganar energía cinética. Si q es + esto significa que ∆V<0 y por lo tanto la carga positiva se moverá espontáneamente de los mayores a menores potenciales. Es decir del + al -. Al contrario ocurrirá con las cargas negativas. 88 Una consecuencia importante de la ecuación (15) es que un conductor en equilibrio tiene el mismo potencial en todos sus puntos, se trata por lo tanto de un volumen equipotencial. La ecuación (16) puede ser usada para calcular el potencial de un conductor esférico: V=K e Q (18) R En esta ecuación Q es la carga del conductor y R su radio Capacidad de un conductor. Condensadores. Anteriormente hemos considerado algunas características de un conductor en equilibrio eléctrico: - En su interior el campo es nulo. Si está cargado esta carga se sitúa en la superficie. Todo el conductor se encuentra al mismo potencial. Es lógico suponer que a medida que añadimos carga a un conductor este adquiera mayor potencial. (Esto podemos comprobarlo en un conductor esférico usando la ecuación (18)) Se denomina capacidad del conductor, C al cociente entre su carga y su Q potencial: C = (19) V La capacidad se mide en faradios (F): 1(F) = 1(C)/1(V). Podemos aumentar la capacidad del un conductor si le aproximamos otro descargado. Ello es debido a que el descargado se polariza, y estas cargas inducidas, van a crear un campo que van a disminuir el potencial del conductor cargado sin variar su carga y por lo tanto según (19) su capacidad aumenta. El fenómeno se conoce con el nombre de influencia eléctrica. Si tenemos dos conductores en influencia eléctrica total, cualquier línea de fuerza que parta del primero llegará al segundo. Un sistema así formado se denomina condensador. Los dos conductores se encuentran separados por un dieléctrico para evitar el contacto entre ellos. Los condensadores se utilizan para almacenar carga eléctrica. b) Corriente eléctrica Ley de Ohm Diremos que en un medio existe una corriente eléctrica, si se produce un transporte neto de carga entre dos puntos del mismo. En el estado sólido solo se produce una corriente 89 apreciable en los metales ya que en estos los electrones de valencia tienen bastante libertad de movimiento. Consideremos un trozo de metal de forma cilíndrica,( como por ejemplo un trozo de hilo metálico)´ Denominamos intensidad de corriente, I, a la carga que pasa por q una sección del conductor por unidad de tiempo: I = . (20) t La unidad de intensidad de corriente en el S.I. es el amperio, A.. Cuando en el interior del conductor existe un campo eléctrico, sobre cada electrón existirá una fuerza y esto hace que se produzca la corriente. Pero para que exista campo tendrá que haber una diferencia de potencial entre dos secciones del conductor. En la figura queda aclarado lo que se denomina sentido convencional de la corriente, como si fuesen partículas + y el sentido real, ya que son electrones(-): La caída de potencial entre dos puntos del medio se denomina tensión: V(+)-V(-) , y se mide en (V). Es pues la tensión la causa del campo en el interior del conductor y por lo tanto de la intensidad producida, I. Experimentalmente se encuentra que entre ambas magnitudes existe una relación de proporcionalidad,(ley de Ohm): V(+) - V(-) = R (21) I En la figura tenemos representada la relación entre la tensión y la intensidad para un conductor ohmico y no ohmico: 90 En la expresión matemática de la ley, R es la constante de proporcionalidad, característica de cada conductor. Se denomina resistencia eléctrica del mismo. Se mide en ohmios,Ω: 1(Ω) = 1(V)/1(A). La resistencia de un conductor cilíndrico depende de tres factores según indica la ecuación: R=ρ L (22) S L es la longitud del cable; S su sección y ρ su resistividad. Esta última magnitud solo depende del tipo de sustancia que forme el conductor. Dos resistencias pueden conectarse en serie o paralelo. En el primer caso, por las dos pasa la misma corriente. En el segundo caso ambas soportan la misma tensión. En ambos casos es muy fácil demostrar cual es el valor de la resistencia equivalente a un montaje en serie o paralelo, de dos resistencias R1 y R2: -Serie: R equivalente = R1 + R 2 (23) -Paralelo: 1 R equivalente = 1 1 (24) + R1 R2 91 Potencia eléctrica consumida. Efecto Joule Consideremos una corriente entre dos puntos entre los que existe una tensión: V(+)-V(). Según hemos visto sobre el sentido convencional, debemos esperar que las cargas,(consideradas como +), pierdan energía eléctrica en la cantidad: -∆E p,e = q ( V(+)-V(-) ) = I t ( V(+)-V(-) ) (25), donde hemos tenido en cuenta la definición de intensidad,(20). A partir de aquí podemos calcular la potencia eléctrica consumida entre estos dos puntos, Pe: Pe = -∆E p,e t = I ( V(+)-V(-) ) (26) La potencia eléctrica se mide en W. Esta ecuación es de uso completamente general. Evidentemente este consumo de energía eléctrica se habrá traducido en la obtención de trabajo, en un motor, o de luz , en una bombilla, …etc. Consideremos ahora el caso de que entre los dos puntos tengamos solo una resistencia. La pérdida de energía potencial eléctrica no se traduce en un aumento de la velocidad de las partículas que, en promedio, se mueven a velocidad constante. Esta pérdida de energía eléctrica se traduce en el calentamiento de la resistencia. Este hecho se conoce como efecto Joule y se produce en cualquier conductor por el que pase la corriente. La cantidad de calor producido por unidad de tiempo será: Q/t = I2.R (27) En esta ecuación hemos tenido en cuenta la ley de Ohm. (Q es la cantidad de calor desprendido por la resistencia) Generadores: Fuerza electromotriz Para que podamos mantener la corriente en un circuito necesitamos un aparato, denominado generador, donde se produzca energía eléctrica a costa de la energía no eléctrica. 92 Se denomina fuerza electromotriz del generador,Є a la cantidad de energía eléctrica producida en el mismo por unidad de carga que la atraviesa: ЄG = Pe/I (28) Es una magnitud que se mide en V. El generador también es un conductor y tendrá resistencia denominada resistencia interna,( rG) Otro elemento que podemos tener en un circuito es un motor. En el se produce energía mecánica a costa de consumir energía eléctrica. Se denomina fuerza contraelectromotriz del motor,Є, a la cantidad de energía mecánica producida por unidad de carga que lo atraviesa: ЄM = Pm/I. (29) Es una magnitud que se mide en V. En esta ecuación Pm es la potencia mecánica producida. El motor también tendrá resistencia interna (rM) Circuito eléctrico: Ley de Ohm generalizada Supongamos que conectamos un generador: ЄG y rG a un motor: ЄM y rM mediante cables de conexión de resistencia R. En la figura tenemos un esquema del circuito: Cuando lleguemos al estado estacionario, donde la intensidad del circuito permanece constante, la cantidad total, por unidad de tiempo, de energía eléctrica producida será igual a la consumida. Por lo tanto podemos escribir: ЄG I = ЄM I + I2 rG + I2 rM + I2 R y de aquí: 93 I = (ЄG-ЄM)/(R+rG+rM) (30) Está última ecuación sería la expresión de la ley de Ohm generalizada para este circuito. En general tendremos: I = ΣЄ/ΣR (31) En esta expresión consideraremos (+) las fuerzas electromotrices y (-) las fuerzas contraelectromotrices. Todas las resistencias son positivas. Por aplicación del principio de conservación de la energía podemos conocer la tensión, (V+-V-), existente entre cualquier par de puntos del circuito. Esto lo podemos ver, por ejemplo, para calcular la tensión que suministra un generador. La potencia suministrada, y por lo tanto consumida, por el circuito será: (V+-V-)G.I Esta potencia suministrada será la que produce menos la que el mismo consume por efecto Joule: ЄG.I-I2rG Igualando ambas cantidades y dividiendo por I, quedará finalmente: (V+-V-)G = ЄG – I rG (32) Por lo tanto el generador suministra una tensión menor que su fuerza electromotriz. Veamos ahora la tensión en el motor: Este es un consumidor. La potencia consumida será: (V+-V-)M.I Esta potencia se gastará en producir energía mecánica y calentarse por efecto Joule: ЄM I + I2 rM Igualando, y dividiendo por I: 94 (V+-V-)M = ЄM + I rM (33) Veamos un ejercicio práctico donde apliquemos todos estos conocimientos. En la figura tenemos un generador de 30(V) y 2 (Ω) conectado a un motor de 10(V) y 3(Ω) de resistencia interna y cuatro bombillas como indica la figura. Todas las bombillas tienen una resistencia de 3 (Ω)..Los cables de conexión tienen una resistencia despreciable. Calcular: a) Resistencia equivalente al conjunto de bombillas b) Corriente que circula por cada elemento del circuito c) Potencia eléctrica de cada bombilla d) Tensión en la primera bombilla e)Tensión entre los puntos a y b f) Potencia mecánica y eléctrica del motor) a) Calculamos primero la equivalente a las dos de la rama superior: R = 3 + 3 = 6 (Ω). Ahora tenemos dos resistencias en paralelo de 6 ( rama superior) y 3 ( rama inferior) : 1 1 1 = + y de aquí R = 2 (Ω ) . Tenemos ahora esta resistencia equivalente en serie R 6 3 con la otra bombilla de 3(Ω). Quedará por tanto : Req = 3 + 2 = 5 (Ω) b) Utilizamos la ley de Ohm generalizada para calcular la corriente que circula por todo el circuito: 30-10 I= = 2 (A) 10 Esta será la corriente que circula por el generador, el motor y la primera bombilla. Para calcular la corriente en las bombillas en paralelo podemos seguir dos procedimientos 95 equivalentes: ( Vamos a denominar I1 la corriente por la rama de arriba y I2 la que existe en la de abajo) Primer procedimiento: La corriente que llega al nudo se reparte: 2 = I1 + I2 La otra ecuación la obtenemos al considerar que la tensión total en la rama de arriba es igual que la existente en la de abajo: 6 I1 = 3 I2 . Resolviendo : I1 = 2/3(A) y I2 = 4/3(A) Segundo procedimiento: Calculamos la tensión aplicada a la resistencia equivalente al conjunto de bombillas en paralelo: (V+-V-) = 2 . 2 = 4 (V) Esta será la tensión por la rama de arriba o de abajo y de aquí: 4 = 6 I1 (arriba) y 4 = 3 I2 ( abajo) Se observará desde un punto de vista matemático el segundo procedimiento es más sencillo. c) La potencia eléctrica de una bombilla de resistencia R por la que circula una corriente I será: Pe = I2 . R Aplicando esta ecuación a las bombillas del circuito tenemos: - Rama superior: Pe ( de cada una) = (2/3)2.3 = 4/3 (W) - Rama inferior: Pe = (4/3)2.3 = 16/3 (W) - La otra bombilla: Pe = 22 . 3 = 12 (W) d) Utilizando la ley de Ohm: (V+ - V-) = 3 . 2 = 6 (V) e) La potencia eléctrica consumida entre los dos puntos a y b será: 2.(V+- V-) (W) Por otra parte ponemos obtener esta misma cantidad considerando que se ha consumido para obtener energía mecánica y calentar las resistencias tanto de la bombilla como la interna del motor: 2 . 10 + 22 . 3 + 22 .3 Igualando y simplificando queda: (V+ - V-) = 10 + 2 . 3 + 2 . 3 = 22 (V) f) La potencia mecánica producida será: PM = 10 .2 = 20 (W). Para obtener la potencia eléctrica consumida por el motor le sumamos lo que se gasta en su resistencia interna: 22 . 3 (W). Queda: Pe(motor) = 20 + 22.3 = 32 (W) c) Fenómenos magnéticos Los primeros fenómenos magnéticos estudiados fueron producidos por imanes: un imán atrae a un trozo de hierro. Este magnetismo se manifiesta sobre todo en los polos. Se denominaron polo norte, N, y sur, S, del imán.(Se denominaron así debido a la orientación de un pequeño imán suspendido,(brújula)). En la figura está representado el campo magnético creado por un imán poniendo de manifiesto que el polo norte es el lugar por donde salen las líneas de fuerza y el polo sur por donde entran: 96 Un cable por el que pasa la corriente produce a su alrededor un efecto magnético. Se denomina solenoide a un cable por el que pasa la corriente y tiene forma de muelle. Para aumentar el magnetismo ponemos el cable alrededor de un núcleo de hierro,(hierro dulce). Un material que se comporta como el hierro,(concentra las líneas de fuerza del campo magnético y se siente atraído por los polos con una fuerza apreciable), se denomina ferromagnético. En la figura tenemos representado el campo magnético creado por un solenoide con núcleo de hierro: 97 Como se observa el campo magnético es idéntico al creado por el imán. Podemos por lo tanto afirmar que la causa del magnetismo es la carga eléctrica en movimiento. Si ponemos un núcleo de acero. Este queda convertido en un imán permanente al cesar la corriente. El hierro, el acero son materiales ferromagnéticos. Se van a mover hacia los lugares donde el campo es más intenso. En conclusión: Una carga eléctrica en reposo crea un campo electrostático pero una carga en movimiento crea además un campo magnético 98 Ejercicios 1. Una gota de aceite de 2 mg de masa se encuentra en un campo eléctrico vertical. Si suponemos que su carga eléctrica es de - 3pC, calcular la intensidad del campo si sabemos que la gota se encuentra en reposo. Solución: 6,5.109(N/C) 2. Calcular la velocidad que alcanza un electrón que se mueve entre dos puntos de un campo eléctrico de 500 V/m ,separados 0,04 m. Solución: 2,7.106 (m/s) 3. Calcular el potencial de un conductor esférico de 3 cm de radio, rodeado por aire, si suponemos que tiene una carga de 5µC. Solución: 1,5 (MV) 4. Comparar la fuerza eléctrica existente entre el protón y el electrón del átomo de hidrógeno. Radio del átomo 5,3.10-11m. ;e = 1,6.10-19C ; me = 9,1.10-31kg; mp= 1,67.1027 kg. Solución: 2,3.1039 veces mayor la fuerza eléctrica que la gravitatoria. 5. Tenemos dos cargas de 2 µC , de signos contrarios, situadas a una distancia de 2cm. Calcular la fuerza con que atraen. Cuál será la intensidad del campo en un punto situado a 1m a la derecha de la +. Solución: 90 (N) ; 700 N/C hacia la derecha de la carga positiva y en la dirección de la recta que une ambas cargas. 6. Calcular la resistencia equivalente a un conjunto de 8 resistencia de 2(Ω) cada una si: a) están en serie 4 y 4 y ellas en paralelo entre sí; b) tres conjuntos de dos en paralelo y todas en serie con las dos últimas. Solución: a) 4Ω ; b) 7 Ω 7. Conectamos 5 resistencias de 1, 2, 3 , 5 y 5 (Ω) las dos primeras en paralelo y las dos siguientes también en paralelo pero en serie con las primeras y con la de 5 Ω. Si el conjunto lo conectamos a una fuente de tensión de 10 (V), calcular la corriente que circula por cada resistencia. Solución: I1 = 1,23 (A); I2 = 0,62(A); I3 = 1,16 (A) ; I5 = 0,69 (A); I5 = Itotal = 1,85 (A). (El subíndice indica el valor de la resistencia). 8. Un circuito consta de un generador de 30 (V) y resistencia 1(Ω) conectado a un motor de 10 (V) y de 2(Ω) y a una bombilla de 6(Ω). Los cables de conexión son de 1(Ω) en total. Calcular la corriente que circula por el circuito y la potencia suministrada por el generador: Solución: I = 2 (A) ; Pe( suministrada) = 56 (W) 9. Una bombilla de 220 (V) 100 (W) se conecta a una fuente de tensión de 110 (V). ¿Cuál será su potencia?. Solución: 25 (W) 10. Para el circuito del problema 8, calcular la potencia consumida por el motor y la tensión en el mismo. ¿Cuál será la potencia eléctrica de la bombilla de 3(Ω)?. Solución; 28 (W) ; 14 (V) ; 24 (W) 11. En la figura tenemos un generador de 35(V) y 2(Ω) conectado a un motor de 10(V) y 4(Ω) y tres bombillas cuyas resistencias vienen indicadas en la figura. Los cables de conexión tienen en total una resistencia de 1(Ω). Calcular: a) La resistencia equivalente al conjunto de bombillas; b) la intensidad que circula por cada elemento del circuito; c) la potencia mecánica del motor y la tensión suministrada por el generador. Solución: a) 4 (Ω); b) Itotal = 2,5 (A) , (circula por el motor ,generador y bombilla de 2,8 ), I3 = 1(A) , I2 = 1,5 (A) ; c) 25 (W) , 30(V). 99 FORMULACIÓN Y NOMENCLATURA INORGÁNICA Para sacar el máximo rendimiento a estos apuntes debes seguir el siguiente orden: - Primero léete con atención el apartado donde se establece el concepto de número de oxidación. - A continuación estúdiate los números de oxidación que vienen en la Tabla de números de oxidación , y por supuesto los símbolos y nombres de los distintos elementos. - Luego estudia los distintos apartados de los apuntes haciendo los ejercicios recomendados. Estos últimos están divididos en dos niveles de dificultad: nivel1 y nivel-2. Te recomiendo una primera lectura para hacer los del nivel-1 - En cualquier caso ten en cuenta que se trata de formular y nombrar correctamente, por lo que los ejercicios de nombrar y formular están relacionados: el nº7 de formular corresponde al nº7 de nombrar. Valencia y número de oxidación El término valencia se utiliza en química como sinónimo de capacidad de combinación. Al átomo de H se le asigna una valencia igual a 1. De esta forma como existe una sustancia de fórmula NH3 ,(amoniaco), deducimos que el N es capaz de combinarse con 3 átomos de H y por lo tanto le podemos asignar una valencia =3. Pero inmediatamente surgen complicaciones. En la sustancia N2H4, (hidracina), ¿la valencia es la misma?. Para responder a esta pregunta debemos conocer su estructura, es decir como son las uniones entre los átomos. Estas son: H H H H N H H N N H Cada guión significa una unión química, por lo que vemos que cada átomo de N tiene una capacidad de combinación de 3. Esto nos lleva a comprender que el concepto de valencia no puede ser útil para formular ya que las mismas valencias (3 y 1 para el N e H respectivamente), nos lleva a dos fórmulas distintas. Otra complicación adicional existe al comprobar que en una misma fórmula puede haber un elemento con dos valencias distintas. Por ejemplo el ácido cloroso: HClO2, su estructura es: O Cl O H Se observa que uno de los átomos de O está unido a un solo átomo (valencia=1), mientras el otro está unido a dos (valencia=2). 100 Por eso se considera la palabra valencia sinónima de unión química, distinguiéndose entre valencia iónica y covalente. Por ejemplo en el H2O la valencia,(covalencia), del oxígeno es 2 por que forma dos enlaces covalentes. Por el contrario en el CaO, que es un compuesto iónico formado por los iones Ca2+ y O2- la valencia,(iónica), del oxígeno es -2 ,ya que esta es la carga del ion óxido, Todo lo anterior nos hace comprender la poca utilidad del concepto de valencia para la formulación y nomenclatura química, ( no así para la teoría química). Por ello vamos a introducir el concepto de número de oxidación: “Número arbitrario que se le asigna a cada átomo que interviene en la fórmula de una especie química, de forma tal que la suma de todos ellos sea igual a la carga de dicha fórmula”. Como veremos al estudiar el enlace covalente los números de oxidación asignados a los diferentes átomos tienen una justificación teórica. Utilicemos la definición de número de oxidación para calcular el número de oxidación del oxígeno en la especie O 2−2 . Si llamamos x a este valor plantearíamos la ecuación: 2x= -2 y por lo tanto x= -1. Cuando en una especie haya varios elementos distintos utilizando la definición solo podremos obtener una relación entre ellos. Así para el agua: 2 x(H) + x(O) =0 , donde x(H) y x(O) son los números de oxidación del hidrógeno y oxígeno respectivamente. La definición solo nos sirve para conocer el número de oxidación de un elemento, conocidos todos los demás. La mayoría de los elementos tienen números de oxidación variables. Pero para aprender a formular no necesitamos memorizarlos. En la “Tabla Periódica-números de oxidación”tienes los distintos números de oxidación que tienes que memorizar. Es muy importante insistir que para formular o nombrar, según las normas de la IUPAC estos son los únicos que tienes que memorizar. En esta tabla la línea gruesa separa los “no metales” con número de oxidación negativo, de los “metales”, con número de oxidación positivo. Al H se le asignan dos lugares, (con números de oxidación –1 y +1). En la “Tabla completa”, tienes los distintos números de oxidación de los elementos Resumiendo dicha tabla: 1 2 3 +1 +2 +3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 +3 +4 -3 -3 -4 -2 -1 0 101 Por lo tanto nuestro mayor problema consiste en memorizar los símbolos de los distintos elementos y el grupo del lugar que ocupan en la Tabla Periódica. (Hay que recordar además los números de oxidación de Zn(+2);Ag(+1) ; Cd(+2) y Al(+3)). Substancias simples Son substancias formadas por un solo tipo de átomos. Entre estas podemos distinguir dos tipos: - Los metales. Estos se formulan simplemente con el símbolo del elemento. Son sólidas a temperatura ambiente, excepto el Hg. Así por ejemplo el símbolo Fe puede significar indistintamente el elemento o la substancia simple. - Las substancias simples formadas por elementos no metálicos suelen ser moleculares. Por lo tanto para formularlas tendremos que escribir la fórmula molecular: H2; S8; P4. En estado gaseoso la molécula suele ser diatómica: F2;Cl2;N2;O2;H2...etc. Para nombrarlas utilizamos un prefijo para indicar el número de átomos de la molécula. Estos prefijos, que utilizaremos a lo largo de estos apuntes, son: - 1(mono); 2(di); 3(tri); 4(tetra); 5(penta); 6(hexa); 7(hepta); 8(octo); 9(nona) y 10(deca). Así tendremos: H2:dihidrógeno;S8: octoazufre; P4: tetrafósforo. Los gases inertes son atómicos y así se formulan: He;Ne...etc. Substancias binarias Como su nombre indica están formadas por dos elementos distintos. Podemos distinguir dos grandes grupos: a) formadas por un metal y un no metal; b) formadas por dos no metales. Estudiémoslas por separado. a)Metal-no metal Para obtener la fórmula de la substancia se escribe primero el símbolo del metal y a continuación el del no metal. Como subíndices los números de oxidación intercambiados, es decir el metal con el del no metal y el no metal con el del metal. El número de oxidación del no metal es siempre en estos compuestos el número de oxidación negativo que tenemos que memorizar. El número de oxidación del metal será el de la tabla, si es único, o cualquier otro desconocido. Así por ejemplo la substancia binaria formada entre Al y S se formulará como: Al2S3 ya que sus números de 102 oxidación son: Al(+3) y S(-2). Se trata de sustancias no moleculares y por lo tanto escribimos la fórmula empírica que puede ser simplificada. Para nombrarlos utilizamos el nombre del no metal terminado en uro. Así el ejemplo anterior será un sulfuro. A continuación se indica el nombre del metal. Por tanto se trata del sulfuro de aluminio. Cuando el metal tenga varios números de oxidación, para formular y nombrar, no tenemos obligación de conocerlos por lo que tendremos que indicar el estado de oxidación en el correspondiente compuesto de dos formas distintas: - Nombre estequiométrico: utilizamos prefijos para indicar los átomos presentes en la fórmula. El prefijo mono se puede suprimir. Así MnS2 será el disulfuro de manganeso. Nomenclatura de Stock: consiste en indicar el número de oxidación del metal en número romanos, entre paréntesis: MnS2 será el sulfuro de manganeso-(IV) (está simplificada). En la nomenclatura “tradicional” se indicaba los dos números de oxidación del metal mediante las terminaciones –oso e –ico para el menor y mayor respectivamente. Así FeCl2 y FeCl3 se nombraban como cloruro ferroso y cloruro férrico. b) No metal-no metal: En primer lugar tenemos que establecer el orden en que escribimos los símbolos. La norma establecida por la IUPAC es que se escribe a la izquierda el símbolo del elemento que se encuentre antes en la siguiente lista: 103 B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O y F El número de oxidación del elemento que se escribe a la derecha es el negativo que tenemos que memorizar.( Excepto para el H. Así en NH3 los números de oxidación son N(-3) y H(+1)). Para el elemento que se escribe a la izquierda tenemos que utilizar un número de oxidación positivo que no tenemos obligación de conocer. Para nombrarlos podemos utilizar alguno de los siguientes métodos: - Nomenclatura estequiométrica: se indican el número de átomos mediante prefijos: PCl5 es el pentacloruro de fósforo. El prefijo mono no es necesario indicarlo. - nomenclatura de Stock: Indicamos el número de oxidación del elemento escrito a la izquierda en número romanos entre paréntesis. En nuestro ejemplo: cloruro de fósforo-(V). Los compuestos binarios con el oxígeno a la derecha se nombran como óxidos. Así el SO3 es el trióxido de azufre u óxido de azufre-(VI). Del mismo modo CO es el monóxido de carbono. De la misma forma el CrO3 será el trióxido de cromo u óxido de cromo-(VI). 104 Las substancias binarias del H con los demás elementos reciben el nombre genérico de hidruros. De esta forma serán hidruros: NaH; NH3; HCl y H2O. Realmente desde un punto de vista de la nomenclatura solo son hidruros los dos primeros, por estar el H escrito a la derecha. Desde un punto de vista químico solo se considera hidruro el primero por que en el existe el ion H-. Los hidruros de los grupos 16 y 17 tienen propiedades ácidas. Sus disoluciones acuosas se nombran como ácidos utilizando la terminación –hídrico. En la tabla tenemos estos nombres: H2 O Agua HF(aq) ácido fluorhídrico H2S(aq) ácido sulfhídrico HCl(aq) ácido clorhídrico H2Se(aq) ácido selenhídrico HBr(aq) ácido bromhídrico H2Te(aq) ácido telurhídrico HI(aq) ácido yorhídrico Cationes Son especies químicas con una carga neta positiva. Distinguiremos entre cationes monoatómicos y poliatómicos. a)Cationes monoatómicos: 105 Su fórmula es simplemente el símbolo del elemento y como exponente el número de oxidación de este en el catión considerado. Así K+ ; Sr2+; Al3+; Cu+; Co3+. Para nombrarlos utilizamos el nombre del elemento, normalmente un metal, indicando el número de oxidación por el procedimiento de Stock si es necesario Así los ejemplos anteriores según la IUPAC se nombrarán como: catión potasio; catión estroncio; catión aluminio; catión cobre-(I) y catión cobalto-(III). En la nomenclatura tradicional se nombrarán como: catión potásico; catión estróncico; catión alumínico; catión cuproso; catión cobáltico. b)cationes poliatómicos: Puesto que su nomenclatura es algo complicada solo vamos a estudiar los recogidos en la siguiente tabla: UO2+ catión uranilo(V) UO22+ catión uranilo (VI) NH4+ catión amonio PH4+ catión fosfonio H3 O+ catión oxonio 106 Aniones no derivados de los oxoácidos Los aniones son especies químicas con una carga neta negativa. Estos pueden ser monoatómicos y poliatómicos. Los primeros son simplemente los no metales con una carga negativa igual al número de oxidación negativo correspondiente al grupo. Así tendríamos: F-; O2-;N3-;C4-. Para nombrarlos utilizamos el nombre del no metal terminado en uro. Los ejemplos anteriores se nombrarán como: anión fluoruro; anión óxido( única excepción, que existe como tal en los óxidos iónicos); anión nitruro y anión carburo. Entre los poliatómicos encontramos aquellos iones que contienen más de un átomo del elemento no metálico. Los dos ejemplos más importantes son: - S2-2 anión disulfuro - O 2-2 anión peróxido Un anión formalmente relacionado es el C2-2 denominado anión acetiluro, ya que podemos considerarlo derivado del acetileno C2H2 por eliminación de los dos hidrógenos. 107 Por otra parte estos aniones pueden tener hidrógeno, lo que hay que indicar con el prefijo hidrógeno- . Hay que tener en cuenta que la carga negativa de la especie se rebaja en una unidad por cada H añadido. Asi por ejemplo tendremos los aniones: - HS- anión hidrogenosulfuro OH- será el anión hidróxido. Obsérvese que en esta especie cometemos una incorrección, admitida por la IUPAC, en cuanto al orden de escribir ambos símbolos, (debería ser HO-) Hidróxidos Son sustancias ternarias que responden a la fórmula general M(OH)m . M: es el símbolo de un metal y m su número de oxidación. En principio podemos considerarlas substancias iónicas formadas por un catión y el anión hidróxido. Las nombramos como hidróxido de nombre de metal. Por ejemplo Ca(OH)2 es el hidróxido de calcio. Si el metal tiene número de oxidación variable, este lo podemos indicar mediante los procedimientos ya establecidos para las substancias binarias: - Estequiométrico: Por ejemplo el Fe(OH)3 será el trihidróxido de hierro De Stock: La misma substancia se nombrará como hidróxido de hierro-(III) Tradicional: utilizando las terminaciones oso e ico. En este caso sería el hidróxido férrico. Algunos hidróxidos reciben nombres vulgares. Así NaOH se denomina normalmente sosa. De igual modo KOH es la potasa. 108 Oxácidos Son susbtancias ternarias que contienen O y H. La propiedad más importante es que puede sustituir total o parcialmente estos H por metal formando sales. Es muy frecuente que el ácido no se pueda obtener como una sustancia aislada pero si se conocen sus sales. Son las substancias más difícil de formular y nombrar ya que todavía no se han impuesto las normas de la IUPAC. Estas normas son fáciles de entender con un ejemplo: La substancia H2SO4 se nombra como tetraoxosulfato(VI) de hidrógeno: tetra(4)oxo(oxígenos)sulfato(azufre)(VI)(este es el número de oxidación del azufre)de hidrógeno. Por lo tanto la única duda es el número de H. Esto lo podemos solucionar con ayuda del concepto de número de oxidación: H(+1) y O(-2) en estos compuestos. Si suponemos que hay x átomos de H en la fórmula tendremos: x+ 4.(-2)+6=0 y de aquí x=2. Desgraciadamente está muy arraigado nombrar esta substancia como ácido sulfúrico, por lo que será muy difícil que se imponga la nomenclatura de la IUPAC a pesar de su sencillez. 109 Veamos un ejemplo para convencernos de esto último: formular el ácido heptaoxodicromato(VI) de hidrógeno. Si suponemos que tenemos x átomos de H el nombre nos lleva directamente a la fórmula: HxCr2O7 y utilizando el concepto de número de oxidación tendremos la ecuación: x+ 7.(-2)+2.(+6)=0 y de aquí x=2. por lo tanto la fórmula será: H2Cr2O7. Es decir no tenemos que memorizar nada. La nomenclatura tradicional de estos ácidos es sin embrago bastante complicada. En la siguiente lista tenemos agrupados los distintos ácidos según el grupo del sistema periódico del elemento no metálico. En unos pocos casos hemos formulado ácidos de los elementos de transición. Los ácidos más importantes están resaltados en negrita. H3BO3 ácido bórico (orto) H2SeO3 ácido selenioso H2CO3 ácido carbónico H2SeO4 ácido selénico H4SiO4 ácido ortosilícico H2Se2O7 ácido diselénico HNO2 ácido nitroso H2TeO3 ácido teluroso HNO3 ácido nítrico H6TeO6 ácido ortotelúrico H3PO3 ácido fosfónico HClO ácido hipocloroso H3PO4 ácido fosfórico (orto) HClO2 ácido cloroso HPO3 ácido metafosfórico HClO3 ácido clórico H4P2O7 ácido difosfórico HClO4 ácido perclórico H5P3O10 ácido trifosfórico HBrO ácido hipobromoso H3AsO3 ácido arsenioso HBrO2 ácido bromoso 110 H3AsO4 ácido arsénico HBrO3 ácido brómico H2S2O4 ácido ditionoso HBrO4 ácido perbrómico H2SO3 ácido sulfuroso HIO ácido hipobromoso H2S2O6 ácido ditiónico HIO3 ácido yódico H2SO4 ácido sulfúrico HIO4 ácido metaperyódico H2S2O7 ácido disulfúrico H5IO6 ácido ortoperyódico H2S2O3 ácido tiosulfúrico H2MnO4 ácido mangánico HMnO4 ácido permangánico H2CrO4 ácido crómico H2Cr2O7 ácido dicrómico H2MoO4 ácido molíbdico H2WO4 ácido wolfrámico HVO3 ácido metavanádico H3VO4 ácido vanádico (orto) En estos nombres tradicionales se pueden tener en cuenta algunas reglas: - Las terminaciones oso e ico se usan para los ácidos con menor o mayor número de oxígenos respectivamente. Lo que corresponde a menor o mayor número de oxidación del no metal o metal. 111 - Los prefijos hipo o per se utilizan para distinguir entre dos números de oxidación bajos,(hipo: el más bajo), o altos ,(per: el más alto). - Los prefijos di,tri,...etc se utilizan para indicar el número de átomos del elemento( no H ni O). A veces se puede deducir la fórmula uniendo un número de fórmulas del compuesto sencillo y eliminando agua. Así la fórmula H2S2O7 resulta de unir dos de H2SO4 eliminando agua: 2H2SO4→ H2S2O7 + H2O - Los prefijos orto y meta indica la cantidad de agua añadida. A partir de la fórmula “meta” añadiendo agua obtenemos la fórmula “orto”. Veamos los ejemplos: HIO4 + 2 H2O→ H5IO6 ; HPO3 + H2O→ H3PO4 Los ácidos que se encuentran escritos en “negrita” son los que tenemos que memorizar en primera instancia. Aniones provenientes de los oxácidos Si eliminamos, total o parcialmente, los hidrógenos de un oxácido obtenemos un oxoanión, cuya carga negativa coincide con el número de hidrógenos eliminados. Así a partir del ácido fosfórico podemos obtener los aniones: PO3-4 ;HPO 2-4 ;H 2 PO-4 Para nombrar estas especies podemos utilizar el procedimiento recomendado por la IUPAC o el tradicional. 112 El procedimiento utilizado por la IUPAC se basa el contar el número de átomos presentes e indicar el número de oxidación del elemento que no es H ni O, ya que estos dos tienen sus números de oxidación habituales, (+1 y –2 respectivamente). Así los tres oxoaniones anteriores se nombrarán como: anión tetraoxofosfato(V); anión tetraoxohidrogenofosfato(V) y anión tetraoxodihidrogenofosfato(V). En el método tradicional estos aniones se nombran haciendo terminar el nombre del ácido en: - ito si el ácido termina en oso ato si el ácido termina en ico Además tenemos que indicar la presencia de hidrógeno y el número de átomos de este elemento sin que haya ambigüedad posible. Los tres aniones anteriores se nombrarán por este procedimiento como: anión fosfato; anión monohidrogenofosfato y anión dihidrogenofosfato. Veamos otro ejemplo. El anión HSO3- se nombrará como anión trioxohidrogenosulfato(IV), (según la IUPAC), y como anión hidrogenosulfito en el modo tradicional. Sales 113 Son substancias iónicas en donde el anión proviene de un ácido. Así son sales las substancias NaCl, donde el anión Cl- proviene del ácido HCl(aq) y NH4NO3 donde el anión proviene del ácido HNO3. La fórmula de la substancia nos indica simplemente la proporción en que tenemos que mezclar los iones para conseguir que la substancia sea eléctricamente neutra: condición de electroneutralidad. Así si queremos formular una sal entre el anión PO3-4 y el catión Ca2+ para que la mezcla sea neutra la proporción debe ser: 2PO3-4 /3Ca 2+ lo que suele escribirse como Ca 3 (PO 4 ) 2 Para nombrarlas podemos utilizar dos procedimientos fundamentalmente: - El procedimiento usado recomendado por la IUPAC. El tradicional para los aniones y de Stock para los cationes Para comprender el procedimiento propuesto por la IUPAC veamos los ejemplos: - CaSO3: trioxosulfato(IV) de calcio Cu2HPO4: tetraoxohidrogenofosfato(V) de cobre En el tradicional para los aniones y de Stock para los cationes, el más usado, los nombres serían: 114 - Sulfito de calcio Monohidrogenofosfato de cobre-(I) Las sales con H suelen denominarse sales ácidas. En la nomenclatura más tradicional se solía utilizar el prefijo bi- para indicar que la sal era ácida. La IUPAC recomienda que no vuelva a utilizarse este prefijo. Sin embargo una de estas substancias el NaHCO3, hidrogenocarbonato de sodio, sigue siendo denominado de forma vulgar como “bicarbonato”. Hay sales de fórmula más compleja en donde puede haber varios cationes o aniones. Como ejemplos tenemos: - BaBrCl: bromurocloruro de bario CaNa2(SO4)2: sulfato (doble) de calcio-disodio Cu2(OH)2(SO4):dihidroxisulfato de cobre-(II) Ca5F(PO4)3: fluoruro-tris(fosfato) de calcio AgKCO3: carbonato de plata y potasio Iones complejos En estos iones tenemos un átomo central, muy frecuentemente un metal de transición, unido a grupos neutros o negativos. Estos grupos se denominan ligandos. Los más corrientes son: - F-: fluoro Cl-: cloro 115 - Br-: bromo I-: yodo O2-: oxo OH-: hidroxo S2-: tio HS-: mercapto CN- : ciano NO: nitrosilo CO: carbonilo H2O: aqua NH3: ammina Para escribir la fórmula se escribe en primer lugar el símbolo del átomo central y a continuación primero los ligandos (-) y luego los neutros en orden alfabético del átomo del ligando unido al átomo central. Así F- antes que O2-. Para nombrarlos, se citan primero los ligandos en orden alfabético y a continuación el nombre del átomo central. Si es un complejo aniónico se utiliza la terminación ato indicando el estado de oxidación por el procedimiento de Stock.. Si se trata de un catión o un complejo neutro no se utiliza terminación,(pero sí se indica el estado de oxidación). Veamos algunos ejemplos: [ Ag(NH3 )2 ] + : catión diamminaplata [CrF4O] : anión tetrafluorooxocromato(V) - [ Fe(CN)6 ] 4- : anión hexacianoferrato(II) [Cu(NH3 )4 ] 2+ : catión tetraamminacobre(II) 116 [Co(Cl)2 (NH3 )4 ] : catión tetraamminadiclorocobalto(III) [ Fe(Cl)4 (H 2O)2 ] : anión diaquatetracloroferrato(III) + − Estos iones pueden mezclase entre sí o con otros de carga opuesta para formar sales. Para formularlas se escribe a la izquierda el catión y a la derecha el anión. Se nombra primero el anión y a continuación el catión. K 4 [ Fe(CN)6 ] : hexacianoferrato(II) de potasio Ejercicios-Nivel(1) Nombrar: 1. O3 2. MgF2 3. KHS 4. HI 5. HI(aq) 6. Ni2S3 7. AgCl 8. SO2 9. Cd2+ 10. O211. NH +4 12. Fe3+ 13. Cu2+ 14. Sr2+ 15. HS16. OH17. Ba(OH)2 18. ZnO 19. PbO2 20. SO3 21. TiO2 22. S2Cl2 23. H 3O + 24. N2H4 25. Sn2+ 117 26. Te227. B328. Br29. HNO2 30. HIO 31. HClO3 32. NO333. BrO-2 34. HSO-4 35. HPO 2-4 36. ClO37. CO3238. HSO339. (NH4)2S 40. CaSO4 41. MgCO3 42. (NH4)3PO4 43. Ba(ClO2)2 44. KHCO3 45. PbSO3 46. Fe(NO2)2 47. Ca(H2PO4)2 48. PbHPO4 49. KClO4 50. H2O2 Formular: 1. Trioxígeno. (Ozono) 2. Fluoruro de magnesio 3. Hidrogenosulfuro de potasio 4. Yoduro de hidrógeno 5. Ácido yorhídrico 6. Sulfuro de niquel-(III) o trisulfuro de niquel 7. Cloruro de plata 8. Óxido de azufre-(IV) o dióxido de azufre 9. Catión cadmio 10. Anión óxido 11. Catión amonio 12. Catión hierro-(III) 13. Catión cobre-(II) 14. Catión estroncio 15. Anión hidrogenosulfuro 16. Anión hidróxido 17. Hidróxido de bario 18. Óxido de cinc 19. Óxido de plomo-(IV) o dióxido de plomo 20. Óxido de azufre-(VI) o trióxido de azufre 118 21. Óxido de titanio-(IV) o dióxido de titanio 22. Dicloruro de diazufre 23. Catión oxonio 24. Tetrahidruro de dinitrógeno 25. Catión estaño-(II) 26. Anión telururo 27. Anión boruro 28. Anión bromuro 29. Ácido nitroso 30. Ácido hipoyodoso 31. Ácido clórico 32. Anión nitrato 33. Anión bromito 34. Anión hidrogenosulfato 35. Anión monohidrogenofosfato 36. Anión hipoclorito 37. Anión carbonato 38. Anión hidrogenosulfito 39. Sulfuro de amonio 40. Sulfato de calcio 41. Carbonato de magnesio 42. Fosfato de amonio 43. Clorito de bario 44. Hidrogenocarbonato de potasio 45. Sulfito de plomo-(II) 46. Nitrito de hierro-(II) 47. Dihidrogenofosfato de calcio 48. Monohidrogenofosfato de plomo-II 49. Perclorato de potasio 50. Peróxido de hidrógeno (agua oxígenada) Ejercicios-(Nivel-2) Nombrar: 1. BaO2 2. Hg2Cl2 3. Na2O2 4. S2-2 5. UO 2+ 2 6. VO3 7. H2Cr2O7 8. CaCrO4 9. KMnO4 10. KH2AsO4 11. H6TeO6 12. VO3-4 13. H2MnO4 14. HSe- 119 15. UO3 16. SF6 17. (NH4)3AsO4 18. S2 O7219. KNaCO3 20. H5P3O10 21. P2 O7422. C2-2 23. H3BO3 24. Na5P3O10 25. NaPO3 26. Mg2SiO4 27. H3PO3 28. H5IO6 29. (UO2)SO3 30. (NH4)3VO4 31. UO2F 32. CaNaPO4 33. Pb(OH)Cl 34. Cu2(OH)2SO4 35. SiO 4-4 36. CaC2 37. S2 O3238. Na2S2O4 39. PH +4 40. Ce(SO4)2 41. MnO2 42. CaS2O3 43. K2S2O7 44. (NH4)2CrO4 45. PbMoO4 46. FeWO4 47. K2S2O6 48. PH4F 49. WO 2-4 50. HF2Formular: 1. 2. 3. 4. 5. 6. 7. 8. 9. Peróxido de bario Dicloruro de dimercurio Peróxido de sodio Anión disulfuro Catión uranilo-(VI) Anión metavanadato o anión trioxovanadato(V) Ácido dicrómico o heptaoxodicromato(VI) de hidrógeno Cromato de calcio o tetraoxocromato(VI) de calcio Permanganato de potasio o tetraoxomanganato(VII) de potasio 120 10. Dihidrogenoarseniato de potasio o dihidrogenoarseniato(V) de potasio 11. Ácido ortotelúrico o hexaoxotelurato(VI) de hidrógeno 12. Anión ortovanadato o tetraoxovanadato(V) 13. Ácido mangánico o tetraoxomanganato(VI) de hidrógeno 14. Anión hidrogenoseleniuro 15. Óxido de uranio-(VI) o trióxido de uranio 16. Fluoruro de azufre-(VI) o hexafluoruro de azufre 17. Arseniato de amonio o tetraoxoarseniato(V) de amonio 18. Anión disulfato o anión heptaoxodisulfato(VI) 19. Carbonato doble de potasio y sodio 20. Ácido trifosfórico o decaoxotrifosfato(V) de hidrógeno 21. Anión difosfato o anión heptaoxodifosfato 22. Anión acetiluro 23. Ácido bórico o trioxoborato(III) de hidrógeno 24. Trifosfato de sodio o decaoxotrifosfato(V) de sodio 25. Metafosfato de sodio o trioxofostato(V) de sodio 26. Otosilicato de magnesio o tetraoxosilicato(IV) de magnesio 27. Ácido fosfónico o trioxofosfato(III) de hidrógeno 28. Ácido ortoperyódico o hexaoxoyodato(VII) de hidrógeno 29. Sulfito de uranilo(VI) 30. Vanadato de amonio 31. Fluoruro de uranilo(V) 32. Fosfato doble de calcio y sodio 33. Hidroxidocloruro de plomo-(II) 34. Dihidróxidosulfato de cobre-(II) 35. Anión ortosilicato 36. Acetiluro de calcio ( carburo de calcio) 37. Anión tiosulfato 38. Ditionito de sodio o tetraoxodisulfato(III) de sodio 39. Catión fosfonio 40. Sulfato de cerio-(IV) 41. Óxido de manganeso-(IV) o dióxido de manganeso 42. Tiosulfato de calcio 43. Disulfato de potasio 44. Cromato de amonio 45. Molibdato de plomo-(II) o tetraoxomolibdato(VI) de plomo(II) 46. Wolframato de hierro(II) o tetraoxovolframato(VI) de hierro(II) 47. Ditionato de potasio 48. Fluoruro de fosfonio 49. Anión wolframato 50. Anión hidrogenodifluoruro 121 FORMULACIÓN Y NOMENCLATURA ORGÁNICA Introducción Antes de comenzar a leer estos apuntes debes tener en cuenta las siguientes consideraciones: a) En conjunto sobrepasan el nivel normal exigible en 2º curso de bachillerato. b) De acuerdo con lo anterior debes realizar una primera lectura, para alcanzar un “nivel-1”, limitada a: - Hidrocarburos lineales sencillos con ramas simples, (metilo ó etilo). - Distintos tipos de funciones, pero en sustancias con función única y sin ciclos, (solo benceno). c) En una segunda lectura, con la que puedes llegar al “nivel-2”, conveniente para este curso estudiarás: - Hidrocarburos más complicados, incluidos los ciclos y aromáticos. - Prioridad entre distintas funciones. d)Al final encontrarás ejercicios de los dos niveles. Los ejercicios de igual número se refieren a la misma especie química. HIDROCARBUROS En todas las sustancias tomaremos como base la cadena de carbonos unidos por enlaces simples. Por eso vamos en primer lugar a considerar aquellos compuestos que solo contengan C e H: Hidrocarburos. Estos se pueden clasificar en dos grandes grupos: Alifáticos y aromáticos. Dentro de los alifáticos tenemos las siguientes categorías: cíclicos y no cíclicos; ramificados o no y sobre todo con enlaces sencillos, dobles o triples entre los carbonos. Alcanos Son los hidrocarburos con todos los enlaces C-C sencillos. En primer lugar consideremos los no cíclicos y sin ramas. En la tabla siguiente se muestran la fórmula, (semidesarrollada), y el nombre de algunos: FÓRMULA CH4 CH3-CH3 CH3-CH2-CH3 CH3-CH2-CH2-CH3 CH3-(CH2)3-CH3 CH3-(CH2)4-CH3 CH3-(CH2)5-CH3 NOMBRE metano etano propano butano pentano hexano heptano 122 CH3-(CH2)6-CH3 CH3-(CH2)7-CH3 CH3-(CH2)8-CH3 CH3-(CH2)9-CH3 CH3-(CH2)10-CH3 CH3-(CH2)11-CH3 CH3-(CH2)12-CH3 CH3-(CH2)13-CH3 CH3-(CH2)14-CH3 CH3-(CH2)15-CH3 CH3-(CH2)16-CH3 CH3-(CH2)17-CH3 CH3-(CH2)18-CH3 octano nonano decano undecano dodecano tridecano tetradecano pentadecano hexadecano heptadecano octadecano nonadecano eicosano Como se observa el nombre está compuesto por dos partes: un prefijo y un sufijo o terminación. El sufijo es en este caso –ano y nos indica que en el hidrocarburo solo hay enlaces sencillos C-C. El prefijo es variable e indica el nº de átomos de C de la cadena: met(1C); et( 2C); prop (3C); but (4C); pent (5C);...etc( otros ordinales griegos). Estos prefijos son válidos para todas las demás sustancias alifáticas. Los hidrocarburos de cadena lineal se pueden representar de forma simplificada como: H3C H3C H3C CH3 CH3 CH3 o de forma más explicita: H2 C H3C H2 C CH3 H3C ( propano) C H2 (butano) H2 C H2 C CH3 H3C C H2 CH3 (pentano) Si el hidrocarburo es cíclico sin ramas se representa simplemente la forma, tal como indican las figuras: ciclopropano ciclobutano o de forma explicita: ciclopentano ciclohexano 123 H2C H2C CH2 H2C CH2 H2C H2C CH2 CH2 CH2 H2C H2 C H2 C H2C H2C C H2 CH2 C H2 Como sus nombres indican se añade el prefijo ciclo- al nombre del hidrocarburo de cadena lineal de igual número de C. Para poder nombrar los hidrocarburos ramificados sean cíclicos o acíclicos tenemos que estudiar primero como se nombran los radicales que se derivan de estos hidrocarburos. Se denomina radical a un átomo o grupo de átomos con alguna covalencia libre. En el caso que nos ocupa para nombrarlos se utiliza la terminación –ilo o –il. En la tabla aparecen representados algunos de estos radicales: FÓRMULA NOMBRE CH3- metilo CH3-CH2- etilo CH3-CH2-CH2- n-propilo o propilo CH3-CH(CH3)- isopropilo CH3-CH2-CH2-CH2- n-butilo o butilo CH3-CH(CH3)-CH2- isobutilo CH3-CH3-CH(CH3)- sec-butilo CH3-C(CH3)2- terc-butilo Para nombrar los alcanos ramificados tenemos que utilizar un localizador, esto es un número que nos indique en que carbono de la cadena se encuentra la rama considerada. Tenemos que establecer nuevas reglas: - Se toma como cadena principal la de mayor número de carbonos. 124 - Se numera dicha cadena comenzando por el extremo para el que las cadenas laterales tienen localizadores más pequeños. - En caso de igualdad se le dan los localizadores más bajos a los radicales que se nombran primero. - Las cadenas laterales se nombran en orden alfabético. - Siempre los números separados entre sí por comas (,) y estos de las letras por guiones(-) Así por ejemplo: H2 C H2 C H2 C H2 C H3C CH CH H2 C CH H2C CH CH3 H2C CH3 CH2 CH CH3 CH3 H2C CH3 6-etil-3,4-dimetiloctano CH3 1-etil-3-metilciclohexano Alquenos y alquinos Los hidrocarburos que contengan algún enlace doble C=C se denominan alquenos u olefinas. Los que contengan algún enlace triple C≡C alquinos o hidrocarburos acetilénicos. Para formular los alquenos hay que tener en cuenta los criterios siguientes: - Para estos hidrocarburos se utiliza el sufijo –eno - Si hay varios dobles enlaces se utilizan los sufijos: -dieno; -trieno... etc. - Se toma como cadena principal la que contenga el mayor número posible de dobles enlaces. - Se numera esta cadena de forma que los localizadores de los dobles enlaces sean los menores posibles. - A igualdad del criterio anterior se numera la cadena de forma que los localizadores de las cadenas laterales sean los más pequeños posibles. Estos criterios están utilizados en los ejemplos siguientes: 125 H2 C H2 C H3C CH2 C H CH3 HC CH CH3 H C H3C HC H C C H CH CH2 C HC C CH3 HC C H C H2 1-buteno ; 5-metil-1,3-ciclohexadieno; 1,3-pentadieno y 1,2-dimetil-1,3-ciclopentadieno Estos hidrocarburos pueden dar lugar a algunos radicales. Como siempre se utiliza la terminación -ilo o –il al nombre del hidrocarburo del que provienen: - El CH2=CH- será el radical etenilo (denominado normalmente vinilo). - CH2=CH-CH2- será el 2-propenilo ( ya que la valencia libre debe estar sobre el carbono 1º; normalmente se denomina alilo) - CH3-CH=CH- será el 1-propenilo Con ayuda de estos radicales se pueden nombrar hidrocarburos más complicados: H2C CH2 H2 C CH CH CH CH CH HC H2C H2C CH2 C CH HC C H2 CH CH3 HC CH3 HC HC CH CH2 HC CH3 C H 4-etenil-5-metilciclohexeno ; 4-etenil-1,6-octodieno ; 1-etenil-1,3-ciclopentadieno Para los hidrocarburos con algún triple enlace C≡C se utiliza la terminación –ino. Las otras normas a tener en cuenta para su nomenclatura son: - Si hay varios triples enlaces se utilizan los sufijos diino; triino...etc. - Se toma como cadena base la que contenga el mayor número posible de triples enlaces. - Esta cadena se numera de forma que los localizadores de los triples enlaces sean lo más bajo posible. Así, por ejemplo: 126 H2 C C H3 C C CH3 CH3 CH CH H3C C C C CH CH2 C C H2 C H2C propino 4-metilciclohexino CH3 4-metil-2,5-octodiino Los radicales que provienen de estos hidrocarburos se nombran utilizando el nombre del hidrocarburo terminado en ilo: - CH≡C- es el radical etinilo - CH≡C-CH2- es el radical 2-propinilo - CH3-C≡C- es el radical 1-propinilo Ahora podemos nombrar hidrocarburos más complicados: HC CH C C H2C C C CH H2 C C H2C CH C CH CH C C CH3 CH 6-etinil-1,4,7-nonatriino 4-etinil-3-metilciclohexino Cuando en un mismo hidrocarburo hay dobles y triples enlaces se utilizan los sufijos – en –ino o –dien –ino o –en –diino ... etc Para nombrarlos se tiene en cuenta lo siguiente: - Se toma como cadena base la que contenga el mayor número posible de insaturaciones. - Esta cadena se numera de forma tal que los localizadores sean los menores posibles. ( Sin distinguir entre dobles o triples enlaces) - En el caso de que por ambos extremos salgan los mismos números se empieza por el extremo donde a los dobles enlaces les corresponden los menores. Así tenemos: 127 CH3 H3C H2C C H3C C C CH3 H2C CH CH2 C C CH 3-metil-2-hexen-4-ino 2-propilbutenino ciclohexen-4-ino Hidrocarburos aromáticos Como prototipo de estos hidrocarburo podemos tomar el benceno: C6H6. La mejor representación para este hidrocarburo y su correspondiente radical C6H5- (denominado fenilo) son las de las figuras (a) y (b). b a Cuando tenemos dos sustituyentes iguales en el benceno se pueden utilizar los prefijos: o- orto (para el 1,2); m- meta (para el 1,3) y p- para (para el 1,4). En la figura tenemos ejemplos: CH3 CH3 CH3 CH3 CH3 o-dimetilbenceno m-dimetilbenceno H3C p-dimetilbenceno Esta terminología se puede usar para cualquier derivado del benceno. Otros hidrocarburos aromáticos son: bifenilo naftaleno antraceno fenantreno 128 DERIVADOS HALOGENADOS Y NITRADOS DE LOS HIDROCARBUROS Si sustituimos un H por un halógeno X, (X: F,Cl,Br o I), tenemos un derivado halogenado. Para nombrarlos tenemos en cuenta el carbono donde se encuentra el halógeno mediante un localizador. Si hay varios se utilizan los prefijos di,tri,...etc. Los halógenos se nombran en orden alfabético. Todo esto esta reflejado en los siguientes ejemplos: I Br H2 C H3C F CH2 Cl C Cl Cl I Br 2-clorobuteno ; 1-bromo-2clorociclohexano; m-diyodobenceno 5-fluorciclopenteno. 3-bromo-4-cloro- Los términos más sencillos pueden nombrarse de otra forma: I H2 C Cl H3C H3C cloruro de metilo Br bromuro de etilo yoduro de fenilo Los nitros derivados contienen el grupo –NO2 (nitro-). Se nombran con este prefijo indicando mediante un localizador a que carbono está unido. En los siguientes ejemplos se aclara su nomenclatura: NO2 NO2 CH3 CH NO2 H3C nitrometano H3C CH3 2-nitropropano NO2 2-nitrometilciclohexano NO2 m-dinitrobenceno FUNCIONES Se denomina función a un átomo o grupo de átomos que confieren a la molécula donde se encuentra unas propiedades determinadas. En el apartado anterior hemos visto ya la función halógeno (-X) y nitro (-NO2). Las distintas funciones las vamos a agrupar en dos categorías: a) funciones oxigenadas y b) funciones nitrogenadas. 129 A)FUNCIONES OXIGENADAS Como su nombre indica se trata de funciones que contienen oxígeno. Consideraremos las siguientes: 1-Alcoholes Contienen el grupo –OH unido a un carbono alifático que no este unido a otro oxígeno o nitrógeno: CH3OH ó CH3-CH2OH. Para nombrarlos se utiliza el sufijo –ol o –diol ... etc, si tiene dos... varios grupos -OH Veamos algunos ejemplos: OH 2-ciclopentenol OH OH CH H3C H3C OH CH3 2-propanol metanol 1,3-ciclohexanodiol OH Los términos más simples reciben los nombres de: OH H3C alcohol metílico H2 C H2 C H3C OH OH alcohol etílico alcohol bencílico Cuando no es función principal, es decir cuando no tiene prioridad, para designarlo se utiliza el prefijo –hidroxi 2-Fenoles Son sustancias en las que el grupo –OH está unido a un carbono aromático. Se nombran con el prefijo –hidroxi Por ejemplo: OH hidroxibenceno(fenol) 2-Éteres OH OH o-dihidroxibenecno OH 2-hidroxinaftaleno (2-naftol) 130 El radical -O- se nombra como -oxi-. Del mismo modo un radical como el RO- lo podemos nombrar como alquiloxi- . Para algunos de estos radicales se utiliza una contracción: CH3O- se denomina metoxiCH3-CH2O- como etoxiC6H5O- como fenoxiUn éter es una sustancia donde el radical oxi está unido a dos radicales de tipo alquílico (-R) o arílico (-Ar). Para nombrarlos se sigue la siguiente regla: - Se toma como base el radical más complicado y el grupo alquiloxi- o ariloxi- se nombra como sustituyente. - Para los más sencillos se puede utilizar como procedimiento alternativo nombrar los dos radicales en orden alfabético y a continuación la palabra éter. Veamos algunos ejemplos: H3C O O H2 C H3C CH3 CH3 O CH3 O CH3 O metoxietano,(etilmetiléter) ; 1,2-dimetoxiciclohexano; o-dimetoxibenceno 3-Aldehídos Los aldehídos son sustancias que contienen el grupo –CHO . Para nombrarlos se tienen en cuenta los siguientes criterios: - Como grupo principal se nombran con el sufijo –al. - Tiene que estar sobre un carbono primario, luego si es el grupo principal no necesitamos localizador en la cadena, ya que será el carbono 1º. - Si el grupo está en un ciclo se utiliza el sufijo –carbaldehído. - Si no tiene prioridad se utiliza el prefijo –formil u –oxo. Veamos algunos ejemplos: 131 CHO butanodial CHO CHO H2 C CHO H3C OHC etanal ciclohexanocarbaldehido bencenocarbaldehido (benzaldehido) CHO C H2 p-bencenodicarbaldehido CHO 4-Cetonas Son sustancias que contienen el grupo carbonilo -CO- , pero las dos valencias libres de este carbono tienen que estar ocupadas por C. Para nombrarlas se tiene en cuenta: - Si es el grupo principal se utiliza el sufijo –ona. Si hay varios se utilizarán las terminaciones diona; triona; ...etc. - Hay que localizar el C del grupo cetónico ya que tiene que ser secundario. - Si no es el grupo principal utilizaremos el prefijo oxo-. Veamos algunos ejemplos: CH3-CO-CH3 Propanona CH3-CO-CO-CH3 butanodiona CH3-CH2-CO-CH2-CH-CO-CO-CH3 2,3,6-octanotriona 5-Ácidos carboxílicos El grupo –COOH se denomina grupo carboxilo. El hidrógeno del mismo es ácido, es decir puede ser sustituido por un metal Para nombrarlos se tienen en cuenta las siguientes reglas: - Se utiliza la terminación –oico - Si el grupo está sobre un ciclo,(aromático o alifático), terminaremos el nombre en –carboxílico - Si hay dos o más grupos ácidos se utilizan los subfilos –dioico; -dicarboxílico; trioico; ...etc. - Si en la molécula hay otro grupo con prioridad se nombrará con el prefijo carboxi- - En algunos casos reciben nombres vulgares: HCOOH (fórmico);CH3-COOH (acético) y C6H5-COOH(benzoico) 132 Por ejemplo: COOH COOH COOH H3C COOH HOOC CH2 H2C COOH CH3 (a) (b) (c) (a) ácido etanoico (acético); (b) ácido butanodioico; metilciclohexanocarboxílico; (d) ácido o-bencenodicarboxílico. (d) (c) ácido 3- 6-Sales , aniones y radicales Si quitamos el hidrógeno al grupo ácido nos queda el grupo -COO− denominado grupo carboxilato. Es decir la molécula se ha convertido en un anión. Para nombrarlo utilizamos el sufijo –oato ó -carboxilato. Las sales se nombran utilizando el nombre del anión y a continuación el del metal. Por ejemplo: COOK COO - CH3-COONa CH3-COO (a) (b) (c) (d) (a)anión etanoato o acetato; (b) anión ciclohexanocarboxilato; (c) etanoato de sodio o acetato de sodio; (d) bencenocarboxilato de potasio o benzoato de potasio Los grupos R-CO- procedentes de los ácidos se denominan grupos acilo. Para nombrarlos tenemos en cuenta lo siguiente: - Se sustituye la terminación –oico ó –ico del ácido por –oilo o –ilo - En aquellos ácidos que se nombran utilizando el sufijo carboxílico se reemplaza por –carbonilo Los radicales del tipo R-CO-O- serán nombrados como –oiloxi ,(aciloxi) y el –CO-O-R se nombrará como alquiloxicarbonil, (alcoxicarbonil) Véanse los ejemplos: CH3-CO- (etanoilo o acetilo); C6H5-CO- (bencenocarbonilo ó benzoilo); CH3-COO(acetiloxi- o acetoxi-); -CO-OCH3 (metoxicarbonilo) 7-Esteres 133 Formalmente podemos considerar los esteres el resultado de sustituir el hidrógeno de un grupo carboxilo por un radical alquilo o arilo. De R-COOH→R-COO-R´ Para nombrarlos se tiene en cuenta lo siguiente: - Se nombran como las sales sustituyendo el nombre del metal por el del radical - Si el grupo éster no es el principal utilizaremos los nombres de los radicales aciloxi- o alquiloxicarbonilo- Ejemplos: COO-CH2-CH3 CH3-COO-CH2-CH3 (a) (b) COO-CH3 (c) (a) etanoato de etilo o acetato de etilo; (b) ciclohexanocarboxilato de etilo o benzoato de etilo; (c) bencenocarboxilato de metilo o benzoato de metilo FUNCIONES NITROGENADAS Ya hemos considerado una función nitrogenada, el grupo nitro: -NO2, que siempre se nombraban como derivados. Estudiaremos a continuación las aminas, amidas y los nitrilos. 1-Aminas Estas sustancias pueden considerarse derivadas del NH3 sustituyendo 1,2 ó 3 de los hidrógenos por radicales alquílicos o arílicos.(Así se obtienen las aminas primarias, secundarias y terciarias) Para nombrarlas tenemos que tener en cuenta: - Se nombra el radical seguido de la palabra –amina - Si la amina es secundaria o terciaria se toma el radical como base y los otros radicales se nombran como sustituyentes en el N con la denominación N-, o N,N,... etc ,según los casos. - Si la función amina no tiene prioridad, podemos tener diferentes casos: a) El grupo –NH2 se nombra como aminob) El grupo –NHR se nombra como alquilamino- . El –NHAr será arilaminoc) El grupo -RNH2 será nombrado como aminoalquil- .Igualmente el grupo – ArNH2 se nombrará como aminoaril-. Veamos unos ejemplos: 134 NH2 CH3 H3C H3C CH2 H2C NH2 NH2 CH H2 C NH2 NH CH3 H2 C (a) H2 C (b) CH3 (c) N H (d) (a) propilamina ; (b) N-metilisopropilamina; (c) 1,2-ciclohexanodiamina; d) 1aminometil-2-metilaminobenceno De igual modo podemos sustituir los hidrógenos del catión amonio NH +4 y obtendremos las correspondientes sales de amonio. Para nombrarlas se utiliza la terminación –onio. Así: CH3-NH3+ será el catión metilamonio 2-Nitrilos Son compuestos que contienen el triple enlace -C≡N. Para nombrarlos se tienen en cuenta las siguientes consideraciones: - Se cambia la terminación del nombre del hidrocarburo de igual número de carbonos por –nitrilo. La triple unión con el nitrógeno tiene que estar en un carbono primario. - Si sobre la cadena hay dos grupos nitrilos se utiliza la terminación –dinitrilo - Si la función está sobre un ciclo se utiliza el sufijo –carbonitrilo. - Si no es la función principal se utiliza el prefijo ciano- - El metanonitrilo HCN se nombra como ácido cianhídrico, (puede sustituir el H por un metal como el potasio y formar la sal KCN o cianuro de potasio). Los otros nitrilos sencillos se pueden nombrar como sales: CH3-CN será el etanonitrilo o cianuro de metilo. Algunos ejemplos: 135 CN CN H3C H2C CH2 H2C H3C CN CH CN CN (a) (b) CN (c) (d) (a) butanonitrilo ; (b) ciclopentanocarbonitrilo; (c) m-bencenodicarbonitrilo; (d) metilbutanodinitrilo. 3-Amidas Las amidas se pueden clasificar en primarias o monoacilaminas; secundarias o diacilaminas y terciarias o triacilaminas. Las aminas primarias podemos suponer que derivan de los ácidos por sustitución del – OH por -NH2 o –NHR o –NR2( los dos grupos pueden ser distintos o iguales, o arílicos). Para nombrarlas se tienen en cuenta las siguientes reglas: - Se cuenta el número de carbonos de la cadena y en el nombre del ácido del mismo número de carbonos se le sustituye el sufijo –oico por –amida. Así por ejemplo : CH3-CONH2 será la etanamida o acetamida. - Los sustituyentes sobre el N se nombran indicándolo con el localizador N- - Si el grupo –CONH2 se encuentra sobre un ciclo se nombra como –carboxamida - El grupo –CONH-R se nombra como alquilcarboxamida - Si este grupo no es el principal se nombra como carbamoil- - Los radicales –NHCOR se nombra como –acilamido y el –NHCOAr como arilcarboxamido- Veamos algunos ejemplos: CONH2 CONH-CH2-CH4 CH3-CH2-CH2-CONH-CH3 CONH-CH2-CH4 (a) (b) (c) 136 (a) N-metilbutanamida ; bencenodietilcarboxamida (b) ciclohexanocarboxamida ; (c) o- Las amidas secundarias o terciarias se pueden considerar derivadas del NH3 por sustitución de los hidrógenos por grupos acilo. Por ello para nombrarlas tendremos en cuenta: - Si los grupos acilo son iguales se utiliza el prefijo di- o tri- seguido del nombre de la amina sencilla. - Si los grupos acilo son distintos se toma la más complicada como base y los otros grupos se nombran como sustituyentes en el N, mediante el localizador N-. Así por ejemplo: CO-NH-CO-CH2-CH3 CH3-CO-NH-CO-CH3 CH3-CH2-CO-NH-CO-CH3 (a) (b) (c) (a) diacetamida ; (b) N-acetilpropanamida; (c) N-propanoilciclohexanocarboxamida CRITERIOS DE PRIORIDAD Cuando en una molécula hay varias funciones una se considera principal y da lugar a la terminación del nombre y las demás son funciones secundarias. El orden de prioridad de las distintas funciones es el siguiente: 1º Cationes 2º Ácidos 3º Esteres 4º Amidas 5º Nitrilos 6º Aldehídos 7º Cetonas 8º Alcoholes 137 9º Fenoles 10º Aminas 11º Éteres 12º Halógenos y grupo nitro carecen de prioridad Ejercicios de Formulación. Nivel (1) 1. Pentano 2. 2-metilpentano 3. 2,3,5-trimetilheptano 4. propeno 5. 2-penteno 6. 3-metil-1-buteno 7. 4-metil-1-penteno 8. etino ( o acetileno) 9. 2-butino 10. metilbutino 11. 2,4-hexadiino 12. cloroetano ( o cloruro de etilo) 13. 2-bromobutano 14. 3-fluor-1-buteno 15. metanol ( o alcohol metílico) 16. 2-butanol 17. metoximetano ( o dimetiléter) 18. etoxietano ( o dietiléter o simplemente éter) 19. hidroxibenceno ( o fenol) 20. metilbenceno ( o tolueno) 21. bromobenceno 22. metoxibenceno 23. etanal 24. propanal 25. propanona ( o acetona) 26. 2,3-pentanodiona 27. ácido propanoico 28. ácido 3-metilbutanoico 29. ácido 3-clorobutanoico 30. 2-cloropropanal 31. 2-nitropropano 32. nitrobenceno 33. 3-cloropropeno 138 34. ácido 2-nitropropanoico 35. propanoato de metilo 36. etanoato de etilo ( o acetato de etilo) 37. etanoato de metilo ( o acetato de metilo) 38. propanamida 39. etanamida ( o acetamida) 40. cloroetanamida 41. etanonitrilo ( o cianuro de metilo) 42. metilpropanonitrilo 43. 2-cloropropanonitrilo 44. 1-clorobutanona 45. 3-clorobutanona 46. ácido bencenocarboxílico ( o ácido benzoico) 47. metilamina 48. dimetilamina 49. trimetilamina 50. N-metilpropilamina Ejercicios de nomenclatura . Nivel (1) CH3 H3C CH3 H3C H3C CH2 H2C CH CH H2C CH2 (1) CH (2) CH3 H3C CH2 CH (4) CH H3C (5) CH2 CH2 HC H3C H3C CH2 HC CH3 CH3 CH CH CH2 H3C CH3 CH3 H3C (3) CH2 (7) CH H2C (6) CH CH3 CH2 H3C HC CH H3C C C CH3 (9) (8) CH H3C C CH H3C (10) (12) CH2 Cl H3C CH H2C C C C (11) Br H3C C F (13) CH3 H3C CH HC (14) CH2 H3C OH (15) CH3 139 OH H3C (16) CH H3C H3C O (17) H2C O (19) CH2 CH3 CH3 OH (18) CH2 CH3 CH3 O Br CH3 (20) CH3-CH2-CHO CH3-CH2-CO-CO-CH3 (25) (26) Cl CH3 CH2 (27) H3C COOH H3C (28) CH H2C H3C (31) CH H2C CH3 CH3-CH2-COO-CH3 (34) H3C COOH (35) NO2 CH H2C H3C Cl CH2Cl-CONH2 (40) Cl CH3 H3C (41) CH (42) CN H3C CH (36) COOH (37) (39) CN CH (36) CH3-CONH2 (30) CHO CH3-COO-CH3 (38) H3C CH CH3-COO-CH2-CH3 (35) CH3-CH2-CONH2 (29) CH NO2 NO2 Cl H2C COOH CHO (23) CH3-CO-CH3 (24) H3C H3C (22) (21) (43) CN 140 COOH CH3-CH2-CO-CH2Cl (44) CH2Cl-CH2-CO-CH3 (45) CH3 H3 C NH2 (47) H3C NH (46) CH3 H3C (48) Ejercicios de formulación. Nivel(2) 1. 2,6-dimetil-1,3,5-heptatrieno 2. 1-etil-2-metilciclohexano 3. 4-metilciclohexeno 4. 1,3-ciclopentadieno 5. 2,3-dimetil-1,3-pentadieno 6. 4,6-dimetil-3-hepteno 7. 1-metil-1,4-ciclohexadieno 8. 5-metil-1,3-ciclohexadieno 9. 3-metil-1-butino 10. 3,5-dimetil-4-hexen-1-ino 11. 6-metil-1,3-nonadien-8-ino 12. ciclohexen-4-ino 13. 4-hidroxiciclohexeno 14. o-dihidroxibenceno 15. 3-metil-2-penten-1-ol 16. 2-metoxipropano ( o isopropilmetiléter) 17. 1,3-dimetoxiciclohexano 18. 3-metoxiciclohexeno 19. butanodial H3C N CH3 (49) (50) CH2 H2C NH CH3 141 20. 3-oxobutanal 21. ciclohexanocarbaldehído 22. bencenocarbaldehído ( o benzaldehído) 23. 5-hidroxi-3,4-dioxopentanal 24. propanoilbenceno ( o etilfenilcetona) 25. ácido m-bencenodicarboxílico 26. ácido 3-hidroxi-4-metilpentanoico 27. ácido 3-ciclopentenocarboxílico 28. ácido 3-amino-4-hexenoico 29. ácido 2-cianobenzoico 30. ácido 5-hidroxi-2-ciclohexinocarboxílico 31. ácido 3-oxohexanoico 32. 2-formilbencenocarbonitrilo 33. 5-amino-2-pentanona 34. N-etilisopropilamina 35. 2-aminohidroxiciclohexano 36. 3-metilbutanoato de etenilo 37. benzoato de etinilo 38. ciclohexanocarboxamida 39. ácido 2-carbamoilbenzoico 40. 3-cianopentanamida 41. N-metilaminobenceno 42. catión tetrametilamonio 43. 2-metilpentanodinitrilo 44. N-metilacetamida 45. 2-hidroxi-N-metilbencenocarboxamida 46. 4-aminociclohexino 47. 3-hidroxibutanonitrilo 48. metoxipropanona 49. propanoato de 2,2-cicloroetano 50. ácido 2-cloro-4,5-dioxopentanoico Ejercicios de nomenclatura . Nivel (2) CH3 H2 C C CH3 HC HC CH (4) C (2) CH3 CH3 (1) C H2 CH3 H2 C CH3 C H3 C C H3 C CH (5) CH3 CH3 CH CH3 HC H2 C CH3 (6) (3) CH2 C CH3 CH3 CH3 (7) (8) 142 CH3 HC CH3 H3C (9) CH C H3C CH HC C C (9) CH C H2C H2C CH CH2 CH3 (10) (11) OH OH OH OH HC H3C (12) H2C O CH3 (16) CH3 (19) (17) OHC CH O (15) CH3 O H3C CH2 C (14) (13) H3C H2 C CH (11) CH (10) CH3 CH HC CH3 CH2 (18) CH3 H2C CHO O CHO CH3-CO-CH2-CHO HOC-CH2-CO-CO-CH2OH CHO (20) (21) O (22) HO COOH CH C H3C CH2 CH (25) HC H3 C CH COOH (27) (26) OH COOH NH2 O (30) H3C CH H2 C COOH COOH CN (28) CH2 CH3 CH3 (24) (23) COOH (29) COOH H2C C CH2 H2 C (31) COOH 143 CH3 CN H2C H2N CH2 CH2 C H3C CHO HN (32) O H3C NH2 CH2 CH CH3 OH (35) (34) (33) O CH3 H3C CH H2C CONH2 C O CONH2 O (39) CH2 C (36) O C (37) CH (38) COOH CH O H3C H2C H2C C CH (40) H N CH3 CH3 H3C NH2 N CN HN CN CH3 O (46) C (44) C CH CH3 OH CH2 (43) O H3C NC (42) (41) H2C CH3 (45) CH3 CH3 NH2 N H H3C H2C CN (47) CH OH O O C H3 C C (48) H2 O O CH3 H3C C C H2 O (49) HCl C C H2 C OHC CHCl2 C H2 COOH (50)