Rendimiento cognitivo y calidad de vida de la esclerosis múltiple en
Anuncio

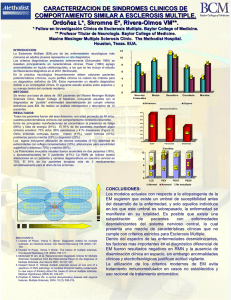
ORIGINAL Rendimiento cognitivo y calidad de vida de la esclerosis múltiple en Gipuzkoa Andone Sistiaga, Tamara Castillo-Triviño, Jone Aliri, Mirari Gaztañaga, Joana Acha, Maialen Arruti, David Otaegui, Javier Olascoaga Introducción. El deterioro cognitivo y la presencia de síntomas depresivos, comunes en los pacientes con esclerosis múltiple, inciden en la calidad de vida de los pacientes. Objetivo. Describir la calidad de vida, la afectación cognitiva y los niveles de depresión, en relación con otras variables clínicas, en los pacientes con esclerosis múltiple de la provincia de Gipuzkoa. Pacientes y métodos. Se evaluó neuropsicológicamente a 114 pacientes. Se incluyeron el MSQoL-54 y el inventario de depresión de Beck para evaluar la calidad de vida y los niveles de depresión. Se emprendieron tres análisis principales: comparación del rendimiento cognitivo entre subtipos, análisis de correlación entre variables clínicas, neuropsicológicas y de calidad de vida, y análisis sobre los efectos del género en el rendimiento cognitivo. Resultados. Se halla en la esclerosis múltiple un patrón neuropsicológico caracterizado por enlentecimiento en el procesamiento de la información y dificultades atencionales. La calidad de vida se relaciona con síntomas depresivos y con el rendimiento cognitivo global pero no con factores clínicos como la tasa de brote o la duración de la enfermedad. Los datos confirman un peor rendimiento cognitivo en los hombres, sobre todo en la memoria auditiva verbal. Conclusiones. El género se presenta como un factor modulador en el impacto de la enfermedad sobre el rendimiento cognitivo, que refuerza el interés de estudios que clarifiquen el origen de dichas diferencias. Además, la calidad de vida muestra una mayor relación con la adaptación a la enfermedad que con sus síntomas. Palabras clave. Calidad de vida. Esclerosis múltiple. Género. Memoria. Recurrente remitente. Síntomas cognitivos. Introducción La esclerosis múltiple (EM) es una enfermedad autoinmune crónica con un sustrato patológico inflamatorio y degenerativo del sistema nervioso central, que se expresa en diferentes formas clínicas y cursa habitualmente con una discapacidad progresiva. Se produce deterioro cognitivo en el 40-70% de todos los pacientes con EM [1] y afecta de modo variable a funciones cognitivas tales como la atención, la velocidad de procesamiento de la información, la memoria, la función ejecutiva y la percepción visuoespacial. Las fases crónicas de la enfermedad se suelen asociar con mayor frecuencia con deterioro cognitivo, pero algunos estudios han demostrado que este deterioro puede ser detectable desde el inicio de la enfermedad o en presencia de una mínima discapacidad física [2,3]. Tanto las múltiples lesiones específicas como la patología axonal difusa, características patológicas de la EM, pueden explicar la alta frecuencia de disfunción cognitiva en la enfermedad [4]. Algunos trabajos han demostrado que los pacientes con formas recurrentes remitentes (RR) se desenvuelven mejor www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 a escala cognitiva que aquellos con las formas progresivas [5], lo que a menudo se asocia con el tiempo de evolución de la enfermedad [6]. Otros estudios añaden que incluso el patrón cognitivo observado en los diferentes subtipos difiere de unos a otros [5], lo que sugiere heterogeneidad y perfiles cognitivos distintos dependiendo del curso de la enfermedad [1]. El déficit neurocognitivo aumenta la morbilidad del paciente y se asocia a una disminución en la participación y funcionamiento de las actividades de la vida diaria [7]. Asimismo, los pacientes con EM muestran resultados inferiores que la población normal en calidad de vida, incluso en aquellos casos en los que la exploración neurológica es normal [8]. Se ha sugerido que la calidad de vida de pacientes con EM está influida por factores tales como la discapacidad funcional, la fatiga, el dolor, el deterioro cognitivo, el tipo de tratamiento o la presencia de síntomas depresivos [9,10]. La investigación en torno a diferentes factores biopsicosociales que afectan al impacto que tiene la enfermedad sobre el rendimiento cognitivo ha tenido un interés creciente. Por ejemplo, parece que la actividad cognitiva premórbida de los pacientes afec- Departamento de Personalidad, Evaluación y Tratamiento Psicológico (A. Sistiaga, J. Aliri); Departamento de Procesos Psicológicos Básicos; Universidad del País Vasco, UPV-EHU (M. Gaztañaga, J. Acha). Centro de Investigación en Red de Enfermedades Neurodegenerativas, CIBERNED (A. Sistiaga). Unidad de Esclerosis Múltiple; Instituto de Investigación Sanitaria Biodonostia (T. Castillo-Triviño, M. Arruti, D. Otaegui, J. Olascoaga). Red Española de Esclerosis Múltiple, REEM (T. Castillo-Triviño, M. Arruti, D. Otaegui, J. Olascoaga). Servicio de Neurología; Hospital Universitario Donostia (M. Arruti, J. Olascoaga). Donostia-San Sebastián, Guipuzkoa, España. Correspondencia: Dra. Andone Sistiaga Berrondo. Departamento de Personalidad, Evaluación y Tratamiento Psicológico. Universidad del País Vasco (UPV-EHU). Avda. Tolosa, 70. E-20018 DonostiaSan Sebastián (Gipuzkoa). Fax: +34 943 015 670. E-mail: andone.sistiaga@ehu.es Agradecimientos: J. Esteve, L. Gamero y E. Palacios, por su trabajo en la fase de recogida de los datos. Aceptado tras revisión externa: 14.03.14. Cómo citar este artículo: Sistiaga A, Castillo-Triviño T, Aliri J, Gaztañaga M, Acha J, Arruti M, et al. Rendimiento cognitivo y calidad de vida de la esclerosis múltiple en Gipuzkoa. Rev Neurol 2014; 58: 337-44. © 2014 Revista de Neurología 337 A. Sistiaga, et al ta al estado de sus capacidades cognitivas y frena incluso el impacto de la atrofia cerebral [11]. A su vez, la presencia de síntomas depresivos, relacionada con la respuesta al diagnóstico, con la presencia de limitaciones funcionales, con la afectación de determinados sistemas neurales y con algunos tratamientos inmunomoduladores parece afectar al deterioro cognitivo o al menos a algunas funciones cognitivas tales como el procesamiento de la información en la EM [12]. El género también ha sido analizado como un factor inherente que afecta al rendimiento cognitivo en la EM. Aunque la EM es más frecuente en mujeres, los hombres suelen desarrollar un curso más grave de la enfermedad [13]; para algunos autores, esa mayor afectación también influye en la esfera cognitiva [14,15]. Sin embargo, el origen de esta afectación cognitiva diferencial entre géneros se discute debido a que un peor rendimiento cognitivo también se asocia a factores de riesgo tales como la duración de la enfermedad, el grado de discapacidad física o la presencia del alelo APO-E4 [1,3]. La detección de déficits cognitivos y los posibles factores envueltos en el rendimiento intelectual son importantes para implementar un tratamiento integral del paciente, adecuar las tareas habituales a sus capacidades y mejorar su calidad de vida. Este tipo de estudio tiene un interés añadido en una región como Gipuzkoa (prevalencia de 75-100 casos por cada 100.000 habitantes), que por sus características fisicohistóricas tiene cierta homogeneidad genética [16]; conocer las dificultades cognitivas y limitaciones en la vida diaria que esta población pueda tener nos permitirá adaptar dicho tratamiento a las necesidades reales de este grupo. Para ello, el objetivo de este estudio es describir por primera vez la calidad de vida, la afectación cognitiva y los niveles de depresión, en relación con otras variables clínicas y sociodemográficas, en una muestra representativa de pacientes con EM de la provincia de Gipuzkoa. Pacientes y métodos Se invitó a participar en el estudio a todos los pacientes que consecutivamente se visitaron de febrero a junio de 2011 en la Unidad de Esclerosis Múltiple del Servicio de Neurología del Hospital Universitario Donostia. Se incluyó a todos los pacientes mayores de 18 años que en el momento de la visita no estaban en brote y que aceptaron participar, todos ellos en condiciones de firmar un consentimiento informado. 338 Exploración neurológica Se recogieron datos sociodemográficos y clínicos básicos. La valoración del grado de discapacidad física se hizo de acuerdo con la Expanded Disability Status Scale (EDSS) y se calculó la tasa de brote (número de brotes/años de enfermedad). En esta consulta, se entregó a los pacientes la escala de calidad de vida Multiple Sclerosis Quality of Life (MSQoL-54) y el inventario de depresión de Beck (BDI). Los pacientes tenían la instrucción de devolver los cuestionarios a las psicólogas que llevarían a cabo las exploraciones neuropsicológicas. Exploración neuropsicológica Con una duración aproximada de una hora, fueron realizadas por tres psicólogos formados conjun­ tamente en la administración de dichos tests (no más tarde de 15 días tras la visita neurológica). En concreto, de la Wechsler Adult Intelligence Scale (WAIS-III), se administraron el subtest de matrices y de vocabulario para estimar el cociente intelectual (CI), el subtest de dígitos para valorar la atención y la memoria a corto plazo y el subtest de claves para valorar la velocidad psicomotora. Se utilizó el test de aprendizaje verbal EspañaComplutense (TAVEC) como lista de palabras para valorar memoria y aprendizaje verbal, el Trail Making Test (TMT) para la velocidad de procesamiento y flexibilidad cognitiva, el FAS para la fluencia verbal tanto fonética como semántica y el Paced Auditory Serial Addition Test (PASAT) con dos series de 2 y 3 segundos de intervalo entre estímulos para evaluar la atención sostenida y dividida (los resultados de esta prueba se analizan utilizando las puntuaciones directas obtenidas por los pacientes y no corregidas de acuerdo con datos normativos; esto se debe a que, como ya han hecho otros autores antes [17], se redujo el número de ítems de la prueba, a la mitad en este caso, debido a la ansiedad y frustración generada en los pacientes por la dificultad de la prueba [18]). Análisis estadístico El análisis estadístico se llevó a cabo mediante el programa informático SPSS v. 20.0. Las pruebas realizadas fueron las siguientes: análisis descriptivos –medias y desviaciones estándares (DE), puntuaciones máximas y mínimas, y porcentajes– para poder describir los diferentes tipos de pacientes (RR y SP); análisis de chi al cuadrado con la finalidad de detectar si hay o no asociación entre dos va- www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 Rendimiento cognitivo y calidad de vida de la esclerosis múltiple en Gipuzkoa riables; análisis de varianza para analizar si hay diferencias entre los diferentes tipos de pacientes en las variables evaluadas, así como para evaluar si hay diferencias de género en los pacientes RR en las variables objeto de estudio; y, por último, análisis de regresión lineal múltiple con el fin de identificar variables predictoras del bajo rendimiento cognitivo. Resultados Participaron en el estudio 114 pacientes (el 83,3%, formas recurrentes remitentes o RR; el 12,3%, secundariamente progresivas o SP; el 2,6%, síndromes clínicamente aislados o CIS; el 0,9%, primarias progresivas o PP, y el 0,9%, progresivas con recaídas o PR). En la tabla, se describen los resultados sociodemográficos y clínicos básicos de los dos grupos de pacientes más prevalentes. De acuerdo con las características propias de cada una de las formas de presentación, los pacientes RR de la muestra estudiada son más jóvenes, tienen menor duración de la enfermedad, están físicamente menos deteriorados y hay un mayor porcentaje de ellos sometido a tratamiento. En ambas formas, la enfermedad es más frecuente en mujeres. La percepción que tienen los pacientes de su calidad de vida en general es significativamente mejor en las RR que en las SP y ninguno de los grupos muestra síntomas depresivos en el BDI. En cuanto a la exploración neuropsicológica, la gráfica de barras de la figura 1 muestra que los pacientes con SP rinden en general cognitivamente peor que las formas RR: tienen resultados significativamente peores en las claves del WAIS-III (p = 0,005) (mientras que un 58% de los pacientes con SP está 1 DE por debajo de la norma en este test, sólo un 16% de las formas RR lo está; p = 0,001), muestran en el TAVEC una menor capacidad de aprendizaje (p = 0,029), una mayor interferencia retroactiva (p = 0,018) y un peor recuerdo a largo plazo con claves (p = 0,006). También tienen menor fluencia verbal semántica (p = 0,015), son más lentos en el TMT A y B (p = 0,006 y 0,008, respectivamente) y muestran peor rendimiento en el PASAT de 2 y 3 segundos (p = 0,004 y 0,016, respectivamente). Los análisis de correlación (Fig. 2) muestran que, tanto en las formas RR como en las SP, la calidad de vida de los pacientes se relaciona inversamente con los niveles de depresión (en las SP sólo el índice de calidad de vida general); además, los pacientes con mejor calidad de vida mental tienen un CI mayor y, en los pacientes con más años de enfermedad, la tasa de brote baja. Además, aunque ya sólo en las www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 Tabla. Variables sociodemográficas en las formas remitente recurrente (RR) y secundariamente progresiva (SP). Se presentan por cada una de las variables la media ± desviación estándar y rango (mínimo y máximo) o la frecuencia de aparición en porcentaje. RR (n = 95) SP (n = 14) p Edad 42,4 ± 9,3 años (rango: 22-75,7) 54,2 ± 16,2 años (rango: 32,4-79,7) 0,000 Duración de la enfermedad 12,9 ± 8,25 años (rango: 0,08-34) 17,4 ± 10,5 años (rango: 5,8-45,3) ns Tasa de brote 0,69 ± 1,3 (rango: 0,12-12) 0,35 ± 0,29 (rango: 0,09-1,21) ns 2,3 ± 1,9 (rango: 0-6,5) 6,6 ± 0,85 (rango: 5-7,5) 0,000 Femenino 64,2% 78,6% Masculino 35,8% 21,4% Sin estudios 2,1% 14,3% Primarios 10,5% 0% Secundarios 47,4% 57,1% Superiores 35,8% 28,6% Desconocido 4,2% 0% Sí 74,7% 50% No 22,1% 42,9% Desconocido 3,2% 7,1% Sin depresión (0-9) 62,5% 25% ns Depresión leve (10-18) 25% 58,3% ns Depresión moderada (19-29) 9,1% 16,7% ns Depresión grave (≥ 30) 3,4% 0% ns RR (n = 90) SP (n = 13) Calidad de vida general 64,4 ± 17,5 48,3 ± 12,7 0,004 Salud física compuesto 67,4 ± 18,5 39,2 ± 13,6 0,000 70 ± 18,8 66,8 ± 14,1 ns RR (n = 88) SP (n = 12) 9,5 ± 8,1 (rango: 0-40) 13,7 ± 5,6 (rango: 7-27) Expanded Disability Status Scale Género Nivel de estudios Tratamiento Índice de depresión de Beck Multiple Sclerosis Quality of Life ns Salud mental compuesto Índice de depresión de Beck ns ns ns ns: no hay diferencias significativas (p > 0,05). 339 A. Sistiaga, et al Figura 1. Rendimiento neuropsicológico en pacientes con formas RR frente a SP. Las barras representan las puntuaciones medias para cada una de las pruebas neuropsicológicas: a) Puntuación escalar (media: 10 ± 3); b) Cociente intelectual (media: 100 ± 15); c) Puntuación T (media: 50 ± 10). * p < 0,05; ** p < 0,01. a b c Dadas las diferencias en cuanto a la distribución de la enfermedad por género y la influencia de dicha variable en la varianza de los tests estudiados, se analizó la influencia del género sobre la exploración neuropsicológica en los pacientes con la forma RR (Fig. 3). Se descartaron las diferencias en EDSS, BDI y calidad de vida entre ambos grupos y los resultados mostraron que los hombres con RR son más lentos en las claves del WAIS-III (p = 0,035) y en la parte A del TMT (p = 0,015), pero sobre todo muestran peor rendimiento en los diferentes valores del TAVEC. El 60% de los hombres está por debajo de 1 DE en capacidad de aprendizaje, mientras que sólo un 31% de las mujeres lo está (p = 0,001). Los hombres sufren mayor interferencia tanto proactiva (p = 0,000) como retroactiva (p = 0,001) en el aprendizaje y recuerdan menos información a largo plazo (p = 0,003). Discusión RR, la calidad de vida de los pacientes muestra una asociación negativa con la discapacidad medida con el EDSS, y además aquellos con mayor discapacidad tienen más síntomas de depresión y más años de enfermedad. Con el análisis de regresión lineal múltiple, el objetivo era evaluar la varianza que variables tales como la discapacidad física (EDSS), los niveles de depresión (BDI), la duración de la enfermedad, el género del paciente o la tasa de brote explican del rendimiento cognitivo. Los resultados de este análisis destacan la influencia que sobre los resultados neuropsicológicos tiene el género, sobre todo en tareas de memoria verbal, donde son las mujeres las que muestran un mejor resultado. Pero además del género, otras de estas variables afectan puntualmente a algunos de los tests administrados: la edad, que explica parte de la variación de la puntuación en dígitos (8,3%), la fluencia verbal (9-17%) y la interferencia retroactiva del TAVEC (6%); la discapacidad física medida con el EDSS, que explica un 5,8% de la variación de la puntuación en claves; la duración de la enfermedad, del test de vocabulario (4%) y de la fluencia verbal (5,3-11,5%), y el BDI, del PASAT (4,5-12%). 340 El deterioro cognitivo, la presencia de síntomas depresivos y la fatiga son comunes en los pacientes con EM, lo que contribuye sustancialmente al impacto de la enfermedad en su calidad de vida diaria. En este estudio, hemos analizado neuropsicológicamente pacientes de la población de Gipuzkoa y podemos confirmar que la distribución de EM que hemos observado se ajusta a la distribución descrita en todo el mundo, donde el subtipo RR es la forma más común, seguida por el subtipo SP [19]. Analizamos las diferencias en el rendimiento cognitivo entre estos dos subtipos más prevalentes y los resultados muestran en una tarea de inteligencia fluida (matrices del WAIS-III) puntuaciones dentro de la normalidad en ambos casos; esto sugiere que la capacidad de razonamiento más inherente del paciente e independiente del conocimiento adquirido resiste el impacto de la enfermedad. Además, el CI total es en ambas formas normal. En ambos subtipos se detecta enlentecimiento en el procesamiento de la información, tanto simple como compleja, y dificultades en atención sostenida y dividida [2], pero como ya han descrito otros autores con anterioridad, los déficits en las formas SP son mayores que en las RR también en nuestra muestra [1]. La memoria verbal también se ha descrito como uno de los puntos débiles neurocognitivos de la EM, que se asocia en algún caso con la duración de la enfermedad más que con el subtipo o fase de la enfermedad [20]. En nuestro trabajo, la memoria auditiva-verbal sólo se ha visto significativamente afec- www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 Rendimiento cognitivo y calidad de vida de la esclerosis múltiple en Gipuzkoa Figura 2. Análisis de correlación en los grupos RR y SP. Sólo se muestran los valores estadísticamente significativos (p < 0,05 bilateral). La intensidad de rojo indica el grado de correlación inversa y la intensidad de azul, el grado de correlación positiva. tada en las SP; en concreto, estos pacientes tienen una mayor interferencia retroactiva, es decir que la consolidación de su aprendizaje previo se ve dificultado por el aprendizaje de nueva información. A pesar de que la fluencia verbal semántica en las formas SP es menor que en las RR, en contra de lo descrito por otros autores, los resultados obtenidos por nuestros pacientes en sus distintos subtipos muestran puntuaciones dentro de la normalidad en esta área [2]. Asimismo, su expresión verbal, evaluada a partir de una tarea de conocimiento y definición de palabras (vocabulario del WAIS-III) es normal en ambos casos, lo que apuntaría a favor de la conservación de las funciones lingüísticas en la EM. Sadovnik [21] describió depresión mayor en el 50% de los pacientes con EM. En nuestra muestra, mientras un 37,5 % de la población con RR tiene síntomas depresivos leves o moderados, sólo un 25% de las SP está libre de síntomas depresivos. Sin embargo, son pocos los trabajos que han tomado en consideración la depresión en el análisis sobre el funcionamiento cognitivo [22]. Algunos investigadores han hallado que los pacientes con EM que padecen síntomas depresivos sobreinforman en torno a dificultades cognitivas [23] y que las quejas cognitivas subjetivas se correlacionan más con la depresión que el funcionamiento neuropsicológico objetivo [24]. A pesar de la existencia de datos contradictorios al respecto [25], la mayoría de los trabajos recientes sugiere que la depresión no es la explicación del deterioro cognitivo observado en la EM [26] y, de hecho, en nuestro trabajo no hemos hallado ninguna relación entre los síntomas depresivos y el deterioro cognitivo y el CI de los pacientes o ambos. Sin embargo, la presencia de síntomas depresivos se muestra como un factor importante en la afectación de las diferentes dimensiones de la calidad de vida de los pacientes con RR. www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 Cada vez más, la progresión de una enfermedad discapacitante como la EM se valora por cómo la enfermedad afecta a la calidad de vida del paciente y no sólo por cambios en las pruebas de imagen o en análisis objetivos. En nuestra población, la calidad de vida de los pacientes con SP es más baja que la de las RR, lo que es compatible con la mayor discapacidad física de las formas SP; sin embargo, no se observa esta diferencia entre subtipos en la calidad de vida mental. Hasta el momento, la relación entre el deterioro cognitivo y la calidad de vida ha sido contradictoria [27,28]. Nuestros resultados, en contra de la hipótesis en torno a la falta de conciencia de déficit sugerida por algunos autores en pacientes con EM [29], hallan que el CI de los pacientes está relacionado con su calidad de vida mental, de modo que un peor rendimiento cognitivo afecta a su bienestar mental (sobre todo en las SP). En cuanto a la relación depresión/calidad de vi­ da, es de suponer que, mientras la falta de concentración, el bajo estado de ánimo y el desinterés por las cosas, entre otros, afectan a la calidad de vida mental de los pacientes, síntomas depresivos tales como la fatiga, la anergia o la falta de apetito estarían afectando a la calidad de vida física. En el caso de las SP, la asociación de estos síntomas con la calidad de vida general es fuerte, pero no se detecta para cada una de las dimensiones más específicas, lo que podría explicarse por el reducido poder estadístico de la muestra de pacientes SP analizada. El grado de afectación física (EDSS) se asocia con la calidad de vida física en las RR (de nuevo un escaso poder estadístico podría explicar la ausencia de esta asociación en las SP); sin embargo, en ninguno de los dos subtipos, la tasa de brote o la duración de la enfermedad parecen afectar a la calidad de vida. Esto último resulta de gran interés y es que la asociación entre el estado de salud y el bienestar no es 341 A. Sistiaga, et al Figura 3. Rendimiento neuropsicológico en RR: mujeres frente a hombres. Las barras representan las puntuaciones medias para cada una de las pruebas neuropsicológicas: a) Puntuación escalar (media: 10 ± 3); b) Cociente intelectual (media: 100 ± 15); c) Puntuación T (media: 50 ± 10). * p < 0,05; ** p < 0,01. a b c sencilla. El bienestar podría ser el reflejo de la adaptación a la enfermedad [30]; de hecho, la bibliografía describe que los pacientes mayores y con mayor duración de la enfermedad son más propensos a referir una relativamente buena calidad de vida [31]. Aunque los hombres tienen un riesgo menor de desarrollar EM que las mujeres, estas últimas suelen manifestar formas benignas con mayor frecuencia [13]. Nuestros resultados confirman este mejor rendimiento en mujeres también en el área cognitiva [14]: los hombres son más lentos en las tareas motoras que dependen de la velocidad (claves y parte A del TMT), pero la diferencia entre sexos es aún más significativa en la memoria verbal auditiva. La bibliografía de la EM en torno a las diferencias de género en neuroimagen es escasa y aún contradictoria. Los primeros estudios sugirieron un menor número de lesiones en T2 en los hombres [32]; otros, sin embargo, concluyen que el efecto del género desaparece si se controlan otras covariables como la discapacidad [33]. Se ha descrito menor conectividad funcional y eficiencia de redes neurales en hombres con EM [34]; asimismo, éstos tienen mayor atrofia cortical, en particular en el tálamo, lo que se correlaciona altamente con el deterioro cognitivo observado en estos pacientes [3,35]. De acuerdo con nuestros resultados, parece razonable incluir 342 en la EM el estudio de estructuras involucradas en los procesos mésicos como el hipocampo. Debido a que la edad de máxima incidencia de la EM es durante la etapa reproductiva de las mujeres, es posible que las hormonas reproductoras desempeñen un papel modulador. Sin embargo, en qué medida y modo las hormonas sexuales afectan a la enfermedad es poco clara. Además, las hormonas sexuales y el género están probablemente implicados en complejas interacciones con el medio ambiente (exposición al sol, la vitamina D) [36], factores genéticos y epigenéticos (transmisión de alelos de riesgo MHC) y culturales (urbanización, educación femenina), todos ellos influyen en el riesgo y la progresión de la EM [3]. Estas diferencias se pueden observar también en la expresión génica en la sangre periférica [37]. En resumen, este estudio llevado a cabo en una población con un background genético homogéneo como Gipuzkoa refuerza resultados y tendencias descritos en estudios anteriores sobre el déficit cognitivo en pacientes con EM (menor velocidad de procesamiento de la información y una deficiente atención sostenida y dividida) y confirma mayor deterioro cognitivo en las formas SP que en las RR. La calidad de vida de los pacientes se relaciona con síntomas depresivos y con su rendimiento cognitivo global pero no con factores clínicos (tasa de brote o años de enfermedad), lo que puede reflejar que la calidad de vida de los pacientes está relacionada con la adaptación a la enfermedad más que con la discapacidad propia de la enfermedad. Además, los datos van a favor de un peor rendimiento cognitivo en los hombres, así estas diferencias afectan principalmente a la memoria auditiva verbal. Sin embargo, no podemos dejar de lado las limitaciones de este trabajo: más allá del escaso poder estadístico proporcionado por la reducida muestra de pacientes SP, la ausencia de algunas pruebas complementarias impide dar continuidad a las hipótesis generadas; en este caso, se considera esencial el estudio del origen y el impacto de las diferencias de género, tanto a través de estudios de neuroimagen como de estudios genéticos y ambientales o ambos. Estas pruebas, a su vez, permitirían comprender mejor las relaciones de los procesos cognitivos implicados en el deterioro. No obstante, los datos de este tipo de estudios descriptivos son esenciales para un conocimiento más profundo de la EM y proporcionan información importante que debe tenerse en cuenta en el manejo clínico de la enfermedad y en futuras investigaciones. www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 Rendimiento cognitivo y calidad de vida de la esclerosis múltiple en Gipuzkoa Bibliografía 1. Potagas C, Giogkaraki E, Koutsis G, Mandellos D, Tsirempolou E, Sfagos C, et al. Cognitive impairment in different MS subtypes and clinically isolated syndromes. J Neurol Sci 2008; 267: 100-6. 2. Achiron A, Polliack M, Rao S, Barak Y, Lavie M, Appelboim N, et al. Cognitive patterns and progression in multiple sclerosis: construction and validation of percentile curves. J Neurol Neurosurg Psychiatry 2005; 76: 744-9. 3. Bove R, Chitnis T. Sexual disparities in the incidence and course of MS. Clin Immunol 2013; 149: 201-10. 4. Deloire M, Salort E, Bonnet M, Arimone Y, Boudineau M, Amieva H, et al. Cognitive impairment as marker of diffuse brain abnormalities in early relapsing remitting multiple sclerosis. J Neurol Neurosurg Psychiatry 2005; 76: 519-26. 5. Huijbregts SC, Kalkers NF, De Sonneville LM, De Groot V, Reuling IE, Polman CH. Differences in cognitive impairment of relapsing remitting, secondary, and primary progressive MS. Neurology 2004; 63: 335-9. 6. Andreu-Català M, Pascual-Lozano AM, Bueno-Cayo A, Boscá-Blasco I, Coret-Ferrer F, Casanova-Estruch B. Afectación de las funciones cognitivas en la esclerosis múltiple secundaria progresiva. Rev Neurol 2008; 46: 664-6. 7. Benedict RH, Wahlig E, Bakshi R, Fishman I, Munschauer F, Zivadinov R, et al. Predicting quality of life in multiple sclerosis: accounting for physical disability, fatigue, cognition, mood disorder, personality, and behavior change. J Neurol Sci 2005; 231: 29-34. 8. Nortvedt MW, Riise T, Myhr KM, Nyland HI. Quality of life in multiple sclerosis: measuring the disease effects more broadly. Neurology 1999; 53: 1098-103. 9. Olascoaga J. Calidad de vida en la esclerosis múltiple. Rev Neurol 2010; 51: 279-88. 10. Opara J, Jaracz K, Brola W. Quality of life in multiple sclerosis. J Med Life 2010; 3: 352-8. 11. Sumowski J, Wylie G, Gonnella A, Chiaravalloti N, DeLuca J. Premorbid cognitive leisure independently contributes to cognitive reserve in multiple sclerosis. Neurology 2010; 75: 1428-31. 12. Sánchez-López MP, Olivares-Pérez T, Nieto-Barco A, HernándezPérez MA, Barroso-Ribal J. Esclerosis múltiple y depresión. Rev Neurol 2004; 38: 524-9. 13. Confavreux C, Vukusic S, Adeleine P. Early clinical predictors and progression of irreversible disability in multiple sclerosis: an amnesic process. Brain 2003; 126 (Pt 4): 770-82. 14. Benedict RH, Zivadinov R. Risk factors for and management of cognitive dysfunction in multiple sclerosis. Nat Rev Neurol 2011; 7: 332-42. 15. Savettieri G, Messina D, Andreoli V, Bonavita S, Caltagirone C, Cittadella R, et al. Gender-related effect of clinical and genetic variables on the cognitive impairment in multiple sclerosis. J Neurol 2004; 251: 1208-14. 16. Otaegui D, Zuriarrain O, Castillo-Triviño T, Aransay A, Ruiz-Martínez J, Olascoaga J, et al. Association between synapsin III gene promoter SNPs and multiple sclerosis in Basque patients. Mult Scler 2009; 15: 124-8. 17. Diehr MC, Cherner M, Wolfson TJ, Miller SW, Grant I, Heaton RK. The 50 and 100-item short forms of the Paced Auditory Serial Addition Task (PASAT): demographically corrected norms and comparisons with the full PASAT in normal and clinical samples. J Clin Exp Neuropsychol 2003; 25: 571-85. 18. Tombaugh TN. A comprehensive review of the Paced Auditory Serial Addition Test (PASAT). Arch Clin Neuropsychol 2006; 21: 53-76. www.neurologia.com Rev Neurol 2014; 58 (8): 337-344 19. Hurwitz BJ. The diagnosis of multiple sclerosis and the clinical subtypes. Ann Indian Acad Neurol 2009; 12: 226-30. 20. Defer GL, Daniel F, Marie RM. Study of episodic memory in multiple sclerosis using the California Verbal Learning Test: the data favour altered encoding. Rev Neurol (Paris) 2006; 162: 852-7. 21. Sadovnick AD, Remick RA, Allen J, Swartz E, Yee IM, Eisen K, et al. Depression and multiple sclerosis. Neurology 1996; 46: 628-32. 22. Landro NI, Celius EG, Sletvold H. Depressive symptoms account for deficient information processing speed but not for impaired working memory in early phase multiple sclerosis (MS). J Neurol Sci 2004; 217: 211-6. 23. Carone DA, Benedict RH, Munschauer FE 3rd, Fishman I, Weinstock-Guttman B. Interpreting patient/informant discrepancies of reported cognitive symptoms in MS. J Int Neuropsychol Soc 2005; 11: 574-83. 24. Julian L, Merluzzi NM, Mohr DC. The relationship among depression, subjective cognitive impairment, and neuropsychological performance in multiple sclerosis. Mult Scler 2007; 13: 81-6. 25. Arnett PA, Higginson CI, Randolph JJ. Depression in multiple sclerosis: relationship to planning ability. J Int Neuropsychol Soc 2001; 7: 665-74. 26. Wishart H, Sharpe D. Neuropsychological aspects of multiple sclerosis: a quantitative review. J Clin Exp Neuropsychol 1997; 19: 810-24. 27. Gold SM, Schulz H, Monch A, Schulz KH, Heesen C. Cognitive impairment in multiple sclerosis does not affect reliability and validity of self-report health measures. Mult Scler 2003; 9: 404-10. 28. Baumstarck-Barrau K, Simeoni MC, Reuter F, Klemina I, Aghababian V, Pelletier J, et al. Cognitive function and quality of life in multiple sclerosis patients: a cross-sectional study. BMC Neurol 2011; 11: 17. 29. Goverover Y, Chiaravalloti N, DeLuca J. The relationship between self-awareness of neurobehavioral symptoms, cognitive functioning, and emotional symptoms in multiple sclerosis. Mult Scler 2005; 11: 203-12. 30. Isaksson A, Ahlstrom G, Gunnarsson L. Quality of life and impairment in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry 2005; 76: 64-9. 31. Ford HL, Gerry E, Johnson MH, Tennant A. Health status and quality of life of people with multiple sclerosis. Disabil Rehabil 2001; 23: 516-21. 32. Pozzilli C, Tomassini V, Marinelli F, Paolillo A, Gasperini C, Bastianello S. ‘Gender gap’ in multiple sclerosis: magnetic resonance imaging evidence. Eur J Neurol 2003; 10: 95-7. 33. Fazekas F, Enzinger C, Wallner-Blazek M, Ropele S, PlutaFuerst A, Fuchs S. Gender differences in MRI studies on multiple sclerosis. J Neurol Sci 2009; 286: 28-30. 34. Schoonheim MM, Hulst HE, Landi D, Ciccarelli O, Roosendaal SD, Sanz-Arigita EJ, et al. Gender-related differences in functional connectivity in multiple sclerosis. Mult Scler 2012; 18: 164-73. 35. Houtchens MK, Benedict RH, Killiany R, Sharma J, Jaisani Z, Singh B, et al. Thalamic atrophy and cognition in multiple sclerosis. Neurology 2007; 69: 1213-23. 36. Pozuelo-Moyano B, Benito-León J. Vitamina D y esclerosis múltiple. Rev Neurol 2013; 56: 243-51. 37. Irizar H, Muñoz-Culla M, Zuriarrain O, Goyenechea E, Castillo-Triviño T, Prada A, et al. HLA-DRB1*15:01 and multiple sclerosis: a female association? Mult Scler 2012; 18: 569-77. 343 A. Sistiaga, et al Cognitive performance and quality of life in multiple sclerosis in Gipuzkoa Introduction. Cognitive impairment and the presence of depressive symptoms, which are commonly found in patients with multiple sclerosis, affect the patients’ quality of life. Aim. To describe the quality of life, cognitive compromise and levels of depression, in relation to other clinical variables, in patients with multiple sclerosis in the province of Gipuzkoa. Patients and methods. A total of 114 patients were submitted to neuropsychological evaluation. The MSQoL-54 and Beck’s Depression Inventory were applied to evaluate the quality of life and levels of depression. Three main analyses were performed: a comparison of cognitive performance among subtypes, an analysis of the correlation among clinical, neuro­ psychological and quality of life variables, and an analysis of the effects of gender on cognitive performance. Results. A neuropsychological pattern is found in multiple sclerosis that is characterised by a slowing of the processing of information and attentional difficulties. Quality of life is related with depressive syndromes and with overall cognitive performance but not with clinical factors such as the rate of attacks or the length of time the disease lasts. The data confirm the existence of poorer cognitive performance in males, above all in terms of verbal auditory memory. Conclusions. Gender is presented as a factor that modulates the impact of the disease on cognitive performance, which reinforces the interest in conducting studies that clarify the origin of such differences. Furthermore, the quality of life displays a greater relationship with the degree of adaptation to the disease than with its symptoms. Key words. Cognitive symptoms. Gender. Memory. Multiple sclerosis. Quality of life. Relapsing-remitting. 344 www.neurologia.com Rev Neurol 2014; 58 (8): 337-344