FORMULACIÓN INORGÁNICA
Anuncio

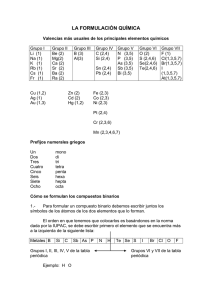
FORMULACIÓN INORGÁNICA 26/07/2015 Podemos clasificar las sustancias en dos grandes grupos: las sustancias inorgánicas, y las orgánicas. Las inorgánicas son aquellas sustancias que existen independientemente de la vida. No son sustancias de estructura compleja. Sin embargo, las sustancias orgánicas pueden llegar a ser extremadamente complejas, y son sustancias que la forman los seres vivos, aunque esto no quiere decir que no se puedan sintetizar en un laboratorio con la suficiente tecnología. La mayoría de las sustancias conocidas, son orgánicas, ya que al formar moléculas complejas hay más posibilidades de formar estructuras distintas. Las sustancias orgánicas están íntimamente relacionadas con el elemento carbono, puesto que realmente se tratan de moléculas cuya estructura principal es una cadena de átomos de carbono enlazados. En estos apuntes, nos vamos a preocupar de cómo formular y nombrar las sustancias inorgánicas, cuya estructura veremos que no son muy complicadas. 1.- Valencias Cada elemento tiene una o varias valencias. Pueden ser positivas o negativas. Conocer las valencias de los distintos elementos es fundamental para poder formular las distintas sustancias que hay en la naturaleza. En una primera aproximación, podemos imaginar que la valencia de un elemento es el nº de “ganchos” que tiene el átomo de ese elemento para enlazarse con otros átomos. El hidrógeno tiene siempre un “gancho”. Por eso, se podemos define la valencia de un elemento, de una manera seria, como el nº de hidrógenos con el que se puede enlazar. Por ejemplo el calcio (Ca) se puede enlazar con 2 hidrógenos, por eso su valencia es 2. Hay algunos elementos de son capaces de enlazarse con distinta cantidad de hidrógenos. Por ejemplo, el hierro puede enlazarse a 2 hidrógenos y también a 3. Por eso, el elemento hierro tiene estas dos valencias, la valencia 2 y la 3; unas veces el hierro actuará con valencia 2 y otras con valencia 3. Puede comprobarse, que las valencia positiva de un elemento metálico, es la carga eléctrica que adquiere un átomo de este elemento cuando se ioniza de la manera más estable. Igual ocurre con la valencia negativa de los elementos no metálicos. Para comprender las valencias positivas de los elementos no metálicos, tendríamos que estudiar el átomo a un nivel que no corresponde a este curso. Las valencias más importantes, que deberemos memorizar, son las siguientes: 2.- Sustancias simples Las sustancias puras pueden ser de dos tipos: sustancias formadas por átomos del mismo elemento, a las que llamaremos sustancias simples (también se les llama sustancias elemento), y sustancias formadas por átomos de distintos elementos, a las que llamamos compuestos. Veamos cómo la IUPAC (Unión Internacional de Química Pura y Aplicada), nos aconseja que se nombren las distintas sustancias. Esto depende del tipo de sustancia que sea. Veamos: a) Sin ionizar Si la sustancia está formada por una red ordenada de átomos del mismo tipo (cuando se encuentra en estado sólido), se formula escribiendo simplemente el símbolo del elemento. Todos los metales son de este tipo. En este grupo incluimos a los gases nobles. Si en caso contrario, la sustancia está formada por moléculas (agrupaciones de átomos), se formula escribiendo el símbolo del elemento, seguido de un subíndice que nos dice cuántos átomos forman la molécula. El oxígeno (O2) está constituido por moléculas, cada una de ellas formada por dos átomos de oxígeno. Sin embargo, el hierro (Fe), está formado por una estructura constituida por una cantidad enorme de átomos de hierro ordenados. Cristales Moleculares Fe: Hierro H2: Hidrógeno, o hidrógeno diatómico o molecular. Dihidrógeno Ag: Plata N2: Nitrógeno, o nitrógeno diatómico o molecular. Dinitrógeno Au: Oro F2: Flúor, o flúor diatómico o molecular. Diflúor C: Carbono O2:Oxígeno, o oxígeno diatómico o molecular. Dioxígeno Si: Silicio Cl2: Cloro, o cloro diatómico o molecular. Dicloro Cu: Cobre Br2: Bromo, o bromo diatómico o molecular. Dibromo Hg: Mercurio I2: Yodo, o Yodo diatómico o molecular. Diyodo K: Potasio S8: Azufre alfa, o azufre octoatómico. Octoazufre He: helio P4: Fósforo, o fósforo tetraatómico. Tetrafósforo Ne: Neón O3: Ozono. Trioxígeno b) Cationes monoatómicos Un catión es un átomo que ha dejado de ser neutro debido a que ha perdido electrones. Por lo tanto ha quedado cargado positivamente. Todas estas sustancias son metales (más el hidrógeno), que son las únicas sustancian que se ionizan positivamente. La carga eléctrica es precisamente la valencia del elemento. Se nombran anteponiendo la palabra catión seguido del nombre del elemento. Seguidamente se escribirá en números romanos la carga del catión sólo en el caso de que el elemento tenga varias valencias. H+: Catión hidrógeno Mn3+: Catión manganeso III Na+: Catión sodio Cu+: Catión cobre I Ca2+: Catión calcio Cu2+: Catión cobre II Al3+: Catión aluminio Ti4+: Catión titanio IV Mn2+: Catión manganeso II V5+: Catión vanadio V c) Aniones monoatómicos Un anión es un átomo que ha ganado electrones, por tanto, está cargado negativamente. Esto le ocurre a los no metales (más el hidrógeno). La carga del ión coincide con la valencia negativa que tiene el elemento. Se nombran añadiendo el sufijo –uro al nombre del elemento. Puede haber alguna variación como con el hidrógeno, el oxígeno, el azufre... H-: Hidruro Se2-: Seleniuro F-: Fluoruro N3-: Nitruro Cl-: Cloruro P3-: Fosfuro Br-: Bromuro As3-: Arseniuro O2-: Óxido C4-: Carburo S2-: Sulfuro Si4-: Siliciuro 3.- Compuestos En un compuesto aparecerán los símbolos de los distintos elementos que forman el compuesto con un numerito como subíndice (si es un uno no se pone) que nos indica cuántos átomos de ese elemento hay en una molécula del compuesto, en el caso de que esté formado por moléculas. En el caso de que el compuesto esté formado por una red cristalina, los subíndices nos dicen la proporción en la que se encuentran los elementos en la red. Vemos que el sulfuro de potasio (K2S), es una red ordenada de átomos, donde por cada átomo de azufre (S) hay dos de potasio (K). Los compuestos binarios son aquellos compuestos formados por dos tipos de elementos. La manera de formularlos es siempre la misma; hay que hacer tres pasos: 1º- Se escriben los símbolos de los dos elementos en el orden en el que se encuentren en la tabla, de izquierda a derecha. 2º- Se cruzan las valencias (no se escriben los signos, y los unos). 3º- Si se pueden simplificar los subíndices dividiendo por un mismo número, se hace. Veamos distintos tipos de compuestos binarios. a) Óxidos Es la unión del oxígeno (con valencia -2) con otro elemento. Si el otro elemento es un metal, hablamos de un óxido metálico, y si es un no metal, decimos que se trata de un óxido no metálico o anhídrido. Los anhídridos son sustancias que al añadirle agua, forman ácidos. Esto no les ocurre a los óxidos metálicos. α) Nomenclatura sistemática Todos ellos se nombran anteponiendo a la palabra óxido, el prefijo que nos diga cuántos átomos de oxígeno hay, y después el nombre del otro elemento anteponiéndole también el prefijo que nos indique cuántos átomos de este otro elemento hay, excepto si es uno, que se omite el prefijo “mono”. Prefijos: 1- mono; 2- di; 3- tri; 4- retra; 5- penta; 6- hexa; 7- hepta; 8- octa; 9- nona; 10- deca. Óxidos metálicos PtO2: Dióxido de platino P2O5: Pentaóxido de difósforo Li2O: Monóxido de dilitio Cu2O: Monóxido de dicobre Sb2O3: Trióxido de diantimonio CaO: Monóxido de calcio CuO: Monóxido de cobreo MgO: Monóxido de magnesio Sb2O5: Pentaóxido de diantimonio Ag2O: Monóxido de diplata SO: Monóxido de azufre Au2O: Monóxido de dioro SO2: Dióxido de azufre Au2O3: Trióxido de dioro SO3: Trióxido de azufre ZnO: Monóxido de cinc Cl2O: Monóxido de dicloro Hg2O: Monóxido de dimercurio Cl2O3: Trióxido de dicloro HgO: Monóxido de mercurio Cl2O5: Pentaóxido de dicloro Al2O3: Trióxido de dialuminio PbO: Monóxido de plomo PbO2: Dióxido de plomo Sc2O3: Trióxido de diescandio TiO2: Dióxido de titanio V2O5: Pentaóxido de divanadio CrO: Monóxido de cromo MnO: Monóxido de manganeso Cr2O3: Trióxido de dicromo Mn2O3: Trióxido de dimanganeso CrO3: Trióxido de cromo MnO2: Dióxido de manganeso MnO3: Trióxido de manganeso Óxidos no metálicos Mn2O7: Heptaóxido de dimanganeso CO2: Dióxido de carbono FeO: Monóxido de hierro N2O3: Trióxido de dinitrógeno Fe2O3: Trióxido de dihierro N2O5: Pentaóxido de dinitrógeno PtO: Monóxido de platino P2O3: Trióxido de difósforo Cl2O7: Heptaóxido de dicloro SiO2: Dióxido de silicio CO: Monóxido de carbono B2O3: Trióxido de diboro N2O: Monóxido de dinitrógeno NO: Monóxido de nitrógeno NO2: Dióxido de nitrógeno N2O4: Tetraóxido de dinitrógeno Hay algunos elementos de la zona de los no metales, que se comportan como metales cuando actúan con una valencia, y como no metales cuando actúan con otra. Por ejemplo, el CO (monóxido de carbono) no forma ácido al añadirle agua; en este caso, el carbono se está comportando como un metal. Sin embargo, el CO2 (dióxido de carbono), sí que forma ácido al añadirle agua, comportándose como un no metal. En este caso se forma el ácido carbónico (H2CO3). Observa otro detalle importantísimo. Cuando veas una fórmula, comprueba que al sumar las valencias (número de oxidación) de los elementos que actúan (teniendo en cuenta los subíndices, que nos dicen cuántos elementos hay, y teniendo en cuenta los signos), siempre nos tiene que salir cero. Salvo que se trate de un ión que deberá salir la carga del ion. Por ejemplo, en la fórmula N2O5 (pentaóxido de dinitrógeno), vemos que el nitrógeno actúa con valencia +5 y el oxígeno con -2 (que es la única que tiene), y que se cumple que (+5)·2+(-2)·5=0. β) Nomenclatura de Stock Se dice “óxido de” seguido del elemento del que se trate, y con números romanos se indica la valencia con la que actúa el elemento en el caso de que tenga más de una valencia. Óxidos metálicos PbO2: Óxido de plomo IV MnO2: Óxido de manganeso IV Li2O: Óxido de litio Sc2O3: Óxido de escandio MnO3: Óxido de manganeso VI CaO: Óxido de calcio TiO2: Óxido de titanio IV Mn2O7: Óxido de manganeso VII V2O5: Óxido de vanadio V FeO: Óxido de hierro II MnO: Óxido de manganeso II Fe2O3: Óxido de hierro III Mn2O3: Óxido de manganeso III PtO: Óxido de platino II MgO: Óxido de magnesio Al2O3: Óxido de aluminio PbO: Óxido de plomo II PtO2: Óxido de platino IV CrO3: Óxido de cromo VI SO3: Óxido de azufre VI Cu2O: Óxido de cobre I Óxidos no metálicos Cl2O: Óxido de cloro I CuO: Óxido de cobreo II CO2: Óxido de carbono IV Cl2O3: Óxido de cloro III Ag2O: Óxido de plata N2O3: Óxido de nitrógeno III Cl2O5: Óxido de cloro V Au2O: Óxido de oro I N2O5: Óxido de nitrógeno V Cl2O7: Óxido de cloro VII Au2O3: Óxido de oro III P2O3: Óxido de fósforo III SiO2: Óxido de silicio ZnO: Óxido de cinc P2O5: Óxido de fósforo V CO: Óxido de carbono II Hg2O: Óxido de mercurio I Sb2O3: Óxido de antimonio III B2O3: Óxido de boro HgO: Óxido de mercurio II Sb2O5: Óxido de antimonio V N2O: Óxido de nitrógeno I SO: Óxido de azufre II NO: Óxido de nitrógeno II SO2: Óxido de azufre IV NO2: Óxido de nitrógeno IV CrO: Óxido de cromo II Cr2O3: Óxido de cromo III b) Peróxidos Se trata de la unión de un elemento metálico con valencia +1 o +2 (más el hidrógeno con valencia +1) con dos átomos de oxígeno unidos (O 2) . Los dos átomos de oxígeno unidos, se comportan como un elemento con valencia -2. Se formula como hemos explicado en el caso anterior, pero no se puede simplificar el 2 que lleva el oxígeno. α) Nomenclatura sistemática H2O2: Dióxido de dihidrógeno (agua oxigenada) Na2O2: Dióxido de disodio BeO2: Dióxido de berilio Cu2O2: Dióxido de dicobre CuO2: Dióxido de cobre β) Nomenclatura de Stock H2O2: Peróxido de hidrógeno Na2O2: Peróxido de sodio BeO2: Peróxido de berilio Cu2O2: Peróxido de cobre I CuO2: Peróxido de cobre II c) Hidruros Es la unión del hidrógeno con otro elemento. Si el otro elemento es un metal, estamos hablando de los hidruros metálicos. En este caso, el hidrógeno se escribe en segundo lugar, y actúa con valencia -1. Por la nomenclatura Sistemática, se nombra diciendo “hidruro” con su prefijo, y el nombre del metal con su prefijo , salvo que sea uno. Por la nomenclatura de Stock, se dice “hidruro de”, y el elemento que se trate, usando números romanos para indicar su valencia en el caso de que tenga varias. c1) Hidruros metálicos α) Nomenclatura sistemática LiH: Monohidruro de litio CaH2: Dihidruro de calcio NaH: Monohidruro de sodio AlH3: Trihidruro de aluminio KH: Monohidruro de potasio CsH: Monohidruro de cesio BeH2: Dihidruro de berilio MgH2: Dihidruro de magnesio GaH3: Trihidruro de galio GeH2: Dihidruro de germanio GeH4: Tetrahidruro de germanio SnH2: Dihidruro de estaño MgH2: Hidruro de magnesio SnH4: Tetrahidruro de estaño CaH2: Hidruro de calcio PbH2: Dihidruro de plomo AlH3: Hidruro de aluminio PbH4: Tetrahidruro de plomo GaH3: Hidruro de galio CuH: Monohidruro de cobre GeH2: Hidruro de germanio II CuH2: Dihidruro de cobre GeH4: Hidruro de germanio IV NiH2: Dihidruro de níquel SnH2: Hidruro de estaño II NiH3: Trihidruro de níquel SnH4: Hidruro de estaño IV MnH3: Trihidruro de manganeso PbH2: Hidruro de plomo II β) Nomenclatura de Stock LiH: Hidruro de litio NaH: Hidruro de sodio PbH4: Hidruro de plomo IV CuH: Hidruro de cobre I CuH2: Hidruro de cobre II KH: Hidruro de potasio NiH2: Hidruro de níquel I CsH: Hidruro de cesio NiH3: Hidruro de níquel III BeH2: Hidruro de berilio MnH3: Hidruro de manganeso III Si el otro elemento es un no metal, tenemos los hidruros no metálicos. Los podemos dividir en haluros e hidruros volátiles. En este caso de los haluros, el hidrógeno actúa con la valencia +1, y lo escribimos en primer lugar. El no metal es del grupo 16 o 17 y actúa con su valencia negativa. Se nombran como si se trataran de un anión (terminando en “uro” el no metal), con el prefijo necesario, seguido de “de hidrógeno”. Los haluros son sustancias normalmente gaseosas en las condiciones de la Tierra y que se disuelven muy bien en agua, formando una disolución ácida. Si esta sustancia la tenemos mezclada en agua formando un ácido, entonces se nombra de otra manera. Se dice la palabra ácido seguido del no metal añadiendo el sufijo “hídrico”. En este caso, detrás de la fórmula se suele poner “aq” para indicar que está mezclado con agua. c2) Haluros En estado puro Disueltos en agua HF: Fluoruro de hidrógeno HFaq: Ácido fluorhídrico (en agua=aq) HCl: Cloruro de hidrógeno HClaq: Ácido clorhídrico (aq) HBr: Bromuro de hidrógeno HI: Yoduro de hidrógeno H2S: Sulfuro de hidrógeno H2Se: Seleniuro de hidrógeno H2Te: Telururo de hidrógeno HBraq: Ácido bromhídrico (aq) HIaq: Ácido yodhídrico (aq) H2Saq: Ácido sulfhídrico (aq) H2Seaq: Ácido selenhídrico (aq) H2Teaq: Ácido telurhídrico (aq) Por último, los hidruros volátiles. Son la unión del hidrógeno (con valencia +1) con un elemento no metálico de los grupos 13, 14 o 15, actuando con su valencia negativa. Ahora el hidrógeno se escribe en segundo lugar (salvo con el O). Estas sustancias no forman ácidos. Tienen nombres propios, pero se pueden nombrar siguiendo la nomenclatura Sistemática con los prefijos. c3) Hidruros volátiles NH3: Trihidruro de nitrógeno / Amoniaco PH3: Trihidruro de fósforo / Fosfina o fosfano AsH3: Trihidruro de arsénico / Arsina o arsano SbH3: Trihidruro de antimonio / Estibina o estibano BH3: Trihidruro de boro / Borano CH4: Tetrahidruro de carbono / Metano SiH4: Tetrahidruro de silicio / Silano H2O: Dihidruro de oxígeno / Agua d) Cationes poliatómicos Son cationes de moléculas, no de átomos simples como hasta ahora hemos visto. Sólo veremos dos, que tienen nombres propios. NH4+: ion amonio H3O+: ion hidrónio o ion oxonio El amonio se puede comportar a veces como si fuera un elemento NH 4 con valencia +1 para enlazarlo con otros elementos. e) Sales binarias Es la unión de un metal (con su valencia positiva) y un no metal (con su valencia negativa). Se pueden nombrar por la nomenclatura Sistemática o la de Stock, como ya sabemos. α) Nomenclatura sistemática NH4Br: Monobromuro de amonio CaF2: Difluoruro de calcio (NH4)2S: Monosulfuro de diamonio ScBr3: Tribromuro de escandio β) Nomenclatura de Stock FeCl2: Dicloruro de hierro CaF2: Fluoruro de calcio FeCl3: Tricloruro de hierro ScBr3: Bromuro de escandio CuBr: Monobromuro de cobre FeCl2: Cloruro de hierro II CuBr2: Dibromuro de cobre FeCl3: Cloruro de hierro III AlI3: Triyoduro de aluminio CuBr: Bromuro de cobre I MnS: Monosulfuro de manganeso CuBr2: Bromuro de cobre II MnS2: Disulfuro de manganeso AlI3: Yoduro de aluminio V2S5: Pentasulfuro de divanadio MnS: Sulfuro de manganeso II Mg3N2: Dinitruro de trimagnesio MnS2: Sulfuro de manganeso IV NiSi2: Disiliciuro de diníquel V2S5: Sulfuro de vanadio V NiSi3: Trisiliciuro de triníquel Mg3N2: Nitruro de magnesio CrB: Monoboruro de cromo Ni2Si: Siliciuro de níquel II NH4Cl: Monocloruro de amonio Ni3Si: Siliciuro de níquel III CrB: Boruro de cromo III NH4Br: Bromuro de amonio NH4Cl: Cloruro de amonio (NH4)2S: Sulfuro de amonio f) Hidróxidos Es la unión de un metal con el anión hidróxido OH-. El ion hidróxido se comporta como un elemento de fórmula OH con valencia -1. Se nombra diciendo la palabra hidróxido de elemento metálico en cuestión, sin olvidar los prefijos. Aunque sea un compuesto ternario, puesto que está formado de tres tipos de elementos, podemos seguir formulándolo como si fuera un compuesto binario si consideramos OH como si fuera un elemento con valencia -1. α) Nomenclatura sistemática β) Nomenclatura de Stock LiOH: Hidróxido de litio LiOH: Hidróxido de litio NaOH: Hidróxido de sodio NaOH: Hidróxido de sodio AgOH: Hidróxido de plata AgOH: Hidróxido de plata Pb(OH)2: Dihidróxido de plomo Pb(OH)2: Hidróxido de plomo II Pb(OH)4: Tetrahidróxido de plomo Pb(OH)4: Hidróxido de plomo IV Ba(OH)2: Dihidróxido de bario Ba(OH)2: Hidróxido de bario Fe(OH)2: Dihidróxido de hierro Fe(OH)2: Hidróxido de hierro II Fe(OH)3: Trihidróxido de hierro Fe(OH)3: Hidróxido de hierro III Cr(OH)2: Dihidróxido de cromo Cr(OH)2: Hidróxido de cromo II NH4OH: Hidróxido de amonio NH4OH: Hidróxido de amonio g) Oxoácidos Es un compuesto ternario. Está formado por el hidrógeno (que se escribe en primer lugar) con valencia +1, seguido de un no metal, con valencia positiva, y por último el oxígeno con su valencia -2. Estos ácidos son los que se obtienen al añadir agua a un anhídrido (óxido no metálico). La molécula de anhídrido captura una molécula de agua, formando un oxoácido (también se dice oxiácido u oxácido). La IUPAC aconseja que utilicemos la nomenclatura tradicional. Se nombra anteponiendo la palabra ácido, seguido del no metal con distintos sufijos y prefijos, (puede ser también un metal como el cromo o el manganeso). - Si el elemento central de la molécula (el no metal), tiene una única valencia, se nombrará terminando en “ico”. - Si tiene dos valencias, se utiliza “ico” para la mayor y “oso” para la menor. - Si tiene tres, se usa “ico” para la mayor, “oso” para la siguiente, y el prefijo “hipo” con el sufijo “oso” para la menor. - Si tiene cuatro, se usan las tres anteriores más el prefijo “per” con el sufijo “ico” para la mayor. El procedimiento es el siguiente: se escribe el átomo central, con el hidrógeno a su izquierda y el oxígeno a su derecha. Hay que ajustar el subíndice del oxígeno. Para ello, multiplicamos 2 (valencia del oxígeno) por el subíndice mínimo para que supere la valencia del átomo central. El subíndice del hidrógeno será la diferencia entre este resultado y la valencia del átomo central. Este método consiste simplemente en hacer el número de oxidación de la molécula cero. Por ejemplo, el carbono cuando actúa con valencia +4, escribimos H a CO b . Para superar la valencia 4 del carbono, el b más pequeño es 3, ya que, 2x3=6. Así, H a CO 3 . La diferencia entre 6 y 4 es 2, luego a es 2. Por tanto, H 2 CO 3 . Ácidos oxoácidos H2CO3: Ácido carbónico H2CrO4: Ácido crómico H2SO4: Ácido sulfúrico H2Cr2O7: Ácido dicrómico H2SO3: Ácido sulfuroso HClO4: Ácido perclórico HNO3: Ácido nítrico HClO3: Ácido clórico HNO2: Ácido nitroso HClO2: Ácido cloroso HMnO4: Ácido permangánico HClO: Ácido hipocloroso H2MnO4: Ácido mangánico HPO3: Ácido metafosfórico HPO2: Ácido metafosforoso Cuando el elemento central es el fósforo, el arsénico el antimonio o el boro, hay dos posibilidades a la hora de formarse el oxoácido. H3PO4: Ácido ortofosfórico (o Ácido fosfórico): Se le suma 1 al subíndice normal del oxígeno. H3PO3: Ácido ortofosforoso (o Ácido fosforoso): Se le suma 1 al subíndice normal del oxígeno. HPO3: Ácido metafosfórico: Se pone el subíndice normal del oxígeno. HPO2: Ácido metafosforoso: Se pone el subíndice normal del oxígeno. h) Aniones poliatómicos La mayoría son aniones proceden de un oxoácido que ha perdido sus átomos de hidrógeno. Pero al marcharse estos átomos dejan su electrón. Por tanto, la carga eléctrica de anión es negativa y su número es igual al número de hidrógenos que se han marchado. Se nombra como el ácido, pero sin decir ácido, y si terminaba en “oso”, ahora decimos “ito”, y si terminaba en “ico”, ahora decimos “ato”. Como caso aparte, tenemos también el ion hidróxido (OH -), que ya hemos comentado anteriormente. CO32-: carbonato Cr2O72-: dicromato SO42-: sulfato PO43-: fosfato u ortofosfato SO32-: sulfito PO33-: fosfito u ortofosfito NO3-: nitrato ClO4-: perclorato NO2-: nitrito ClO3-: clorato MnO4-: permanganato ClO2-: clorito MnO42-: manganato ClO-: hipoclorito CrO42-: cromato PO3-: metafosfato PO2-: metafosfito i) Oxisales Son compuestos ternarios. Proceden de la unión de un metal con un anión poliatómico (excepto con el OH-, que ya sabemos que forma hidróxidos). Los aniones poliatómicos se comportan como una molécula que actúa con una valencia negativa igual a su carga eléctrica. Los nombraremos como lo hacíamos con las sales binarias por la nomenclatura de Stock. Na2CO3: Carbonato de sodio NH4NO3: Nitrato de amonio K2SO4: Sulfato de potasio Ca(NO3)2: Nitrato de calcio CaSO4: Sulfato de calcio KMnO4: Permanganato de potasio PbSO4: Sulfato de plomo (II) Na2CrO4: Cromato de sodio Pb(SO4)2: Sulfato de plomo (IV) K2Cr2O7: Dicromato de potasio FeSO4: Sulfato de hierro (II) Li3PO4: Ortofosfato de litio (o fosfato de litio) Fe2(SO4)3: Sulfato de hierro (III) RbSbO3: Metaantimoniato de rubidio Ag2SO3: Sulfito de plata HgClO: Hipoclorito mercurio I KNO3: Nitrato de potasio Pb(NO2)4: Nitrito de plomo IV