Los datos de la Fase I del ensayo de AlloCSC-01 se han
Anuncio

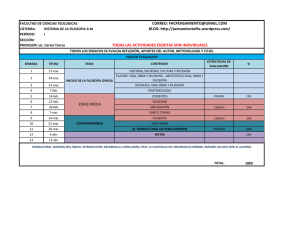
NOTA DE PRENSA Los datos de la Fase I del ensayo de AlloCSC-01 se han presentado en el Congreso de la Sociedad Europea de Cardiología • Los datos de la fase abierta de escalado de dosis del ensayo CAREMI presentados en el Congreso de la Sociedad Europea de Cardiología (ESC) confirman el perfil de seguridad de AlloCSC-01 en pacientes que sufren de infarto agudo miocardio (IAM). • Los pacientes con IAM tratados en la fase abierta de escalado de dosis mostraron una reducción de la zona infartada y una mejoría de la fracción de eyección (FEY) ventricular izquierda, verificada con imagen por resonancia magnética (IRM), después de la administración de AlloCSC-01 y durante un periodo de seguimiento de seis meses. Lovaina (BÉLGICA) – 23 de septiembre de 2015 – TiGenix NV (Euronext Brussels: TIG), compañía biofarmacéutica que desarrolla y comercializa nuevas terapias basadas en sus plataformas de células madre alogénicas expandidas, anuncia hoy que los datos de la fase abierta de escalado de dosis del ensayo CAREMI se han presentado en el Congreso de la Sociedad Europea de Cardiología. CAREMI es un ensayo de dos fases –una fase abierta, de escalado de dosis, y una segunda fase randomizada, de doble ciego y controlada con placebo- cuyo objetivo es evaluar la seguridad y tolerabilidad de una inyección intracoronaria de AlloCSC-01, una suspensión de células madre alogénicas cardiacas (CSC en sus siglas en inglés). En la fase abierta de escalado de dosis, seis pacientes se trataron con AlloCSC-01 de los que cinco fueron monitorizados por un periodo de seis meses. Los pacientes recibieron una única inyección de 11 millones (M), 22M ó 35M de células de AlloCSC-01 (n=2 cada una) mediante una inyección intracoronaria a los 5 ó 7 días después de una Intervención Coronaria Percutánea (ICP). Los datos presentados muestran que AlloCSC-01 tiene un buen perfil de seguridad y no presenta efectos adversos o eventos cardíacos adversos graves (MACE en sus siglas en inglés) tras un periodo de seguimiento de seis meses. Es destacable que los datos preliminares de eficacia observados mostraron una reducción de la zona infartada y una mejora de la fracción de eyección ventricular izquierda verificada con imagen por resonancia magnética durante el periodo de seguimiento de seis meses (n=5, p<0.05 en ambos parámetros). AlloCSC-01 puede representar una nueva forma de prevenir la remodelación cardiaca y el riesgo de insuficiencia cardiaca (IC) tras un episodio de infarto agudo de miocardio (IAM). En Estados Unidos y Europa se tratan aproximadamente 1,5 millones de IAM cada año. Actualmente las opciones de tratamiento terapéutico del IAM pasan por la angioplastia coronaria transluminal percutánea (ACTP) combinada con la implantación de un stent, que se han mostrado eficaces en la mayoría de los casos a la hora de restablecer la perfusión isquémica del miocardio, lo que ha contribuido a reducir la mortalidad inmediata tras el infarto. De todas formas, estos tratamientos no ayudan a recuperar el tejido dañado. De hecho, las terapias aprobadas hasta el momento son paliativas y están diseñadas para preservar la funcionalidad del miocardio no afectado. "Estamos esperanzados de haber finalizado con éxito esta fase de escalado del ensayo CAREMI y con el reclutamiento de más de 70% en la actual fase del ensayo randomizado, de doble ciego y controlado con placebo" afirma Marie Paule Richard, Chief Medical Officer de TiGenix. "Esperamos finalizar el reclutamiento de CAREMI en el cuarto trimestre de 2015 y presentar datos preliminares de eficacia durante el segundo semestre de 2016. Los resultados finales se presentarán durante el primer semestre de 2017. Hay una enorme demanda de tratamientos eficaces para prevenir las serias consecuencias que siguen al infarto de miocardio y AlloCSC-01 pude representar una solución innovadora para el tratamiento de estos pacientes". Para más información, por favor contacte con: Abigail Diaz-Agero (adiazagero@comco.es) Comco - Teléfono: +34 91 4361800 Daniel Herrero (dherrero@comco.es) Comco - Teléfono: +34 91 4361800 Ana Pombo Strategic Planning and IR Manager T: + 34 91 804 92 64 ana.pombo@tigenix.com Sobre AlloCSC-01 Este producto celular consiste en células madre alogénicas adultas cardiacas aisladas, procedentes de los apéndices del ventrículo derecho de donantes y expandidas in vitro. Los datos preclínicos evidencian actividades cardio-protectoras e inmuno-reguladoras de AlloCSC-01. Los estudios “in vivo” sugieren que AlloCSC-01 tiene potencial cardio-reparador, mediante la activación de mecanismos de regeneración endógena, y de provocar la formación de tejido cardiaco. Además, AlloCSC-01 ha mostrado un fuerte tropismo para el corazón posibilitando una mayor retención celular en el miocardio tras la administración intracoronaria. AlloCSC-01 se encuentra ahora mismo en la Fase I/II de su ensayo clínico (CAREMI). El ensayo CAREMI comprende dos fases consecutivas: una fase abierta de escalado de dosis (n=6) y una fase 2:1 randomizada, de doble ciego y controlada con placebo (n=49). El objetivo de este ensayo clínico es evaluar la seguridad y eficacia del producto de células madre cardiacas AlloCSC-01 en el tratamiento de cardiopatías isquémicas agudas. El objetivo primario del ensayo CAREMI en Fase I aborda todas las causas de mortalidad a los 30 días y eventos cardiacos adversos de cualquier tipo desde la inclusión de los pacientes hasta 7 días después de la administración del tratamiento. Los objetivos secundarios incluyen parámetros de eficacia IRM, imagen por resonancia magnética (evolución del tamaño de la zona infartada y de los parámetros biomecánicos), de los parámetros clínicos (test de caminata de 6 minutos y escala IC –insuficiencia cardiaca- elaborada por la New York Heart Association) y de seguridad (todos los eventos adversos dentro de 30 días, después mensualmente hasta los 6 meses y finalmente trimestralmente después de AlloCSC-01, todas las causas de mortalidad y muerte por causas cardiovasculares a los 12 meses y de eventos MACE, medido a los 6 y 12 meses). Participan un total de 8 centros en España y Bélgica y el reclutamiento de pacientes se encuentra en una fase avanzada. Los resultados finales se anunciarán en el primer semestre de 2017, con un análisis preliminar a los seis meses que proporcionará datos en el segundo semestre de 2016. Sobre TiGenix TiGenix NV (Euronext Bruselas: TIG) es una compañía biofarmacéutica que desarrolla y comercializa nuevas terapias basadas en sus plataformas de células madre alogénicas expandidas. Dos productos de la plataforma tecnológica derivada del tejido adiposo, o eASCs, se encuentran actualmente en desarrollo clínico: Cx601 está en Fase III para el tratamiento de fístulas perianales complejas en pacientes con enfermedad de Crohn. Cx611 ha completado la Fase I/II del ensayo para artritis reumatoide, así como la Fase I del ensayo para sepsis. Con efecto desde 31 de Julio 2015, TiGenix ha adquirido Coretherapix, cuyo principal producto celular (AlloCSC-01) está actualmente en la Fase II del ensayo clínico para indicaciones de infarto agudo de miocardio (IAM). Coretherapix tiene previsto también iniciar la evaluación clínica de AlloCSC-01 para indicaciones crónicas, además de participar en el desarrollo clínico de un compuesto farmacológico de factores de crecimiento para tratar el infarto agudo de miocardio. TiGenix también desarrolló el primer Medicamento de Terapia Avanzada (ATMP) aprobado por la Agencia Europea del Medicamento (EMA), ChondroCelect, un producto de terapia celular autólogo para la reparación del cartílago de la rodilla. Desde Junio de 2014, los derechos de comercialización y distribución de ChondroCelect fueron licenciados en exclusividad a Sobi para la Unión Europea (a excepción de Finlandia, donde se distribuye por la Finnish Red Cross Blood Service) Noruega, Rusia, Suiza y Turquía, y los países de Oriente Medio y África del Norte. TiGenix tiene su sede en Lovaina (Bélgica) y cuenta con operaciones en Madrid (España). Para obtener más información, por favor visite http://www.tigenix.com/es Información sobre previsiones futuras Este documento podría contener información sobre perspectivas de futuro y estimaciones en relación con los resultados futuros anticipados de TiGenix y el mercado en el que opera. Algunas de estas afirmaciones, previsiones y estimaciones pueden reconocerse con el uso de palabras tales como, sin limitación, “cree”, “anticipa”, “espera”, “pretende”, “planea”, “intenta”, “estima”, “puede”, “podría” y “continúa”, y expresiones similares. Éstas incluyen todos los asuntos que no son hechos históricos. Tales afirmaciones, previsiones y estimaciones están basadas en varios supuestos y valoraciones de riesgos conocidos y no conocidos, incertidumbres y otros factores, que fueron considerados razonables cuando se hicieron pero que pueden o no ser correctos. Los hechos exactos son difíciles de predecir y pueden depender de factores ajenos al control de la Compañía. Por tanto, los resultados exactos, la situación financiera, los resultados o los logros de TiGenix, o los resultados del sector, podrían ser materialmente diferentes de cualquier resultado o logros futuros expresados o implícitos en esas afirmaciones, previsiones y estimaciones. Dadas estas incertidumbres, no puede hacerse ninguna representación respecto a la exactitud o imparcialidad de esas afirmaciones de futuro, previsiones y estimaciones. Además, las afirmaciones de futuro, previsiones y estimaciones sólo se refieren a la fecha de publicación de este documento. TiGenix renuncia a cualquier obligación de actualizar ninguna afirmación de futuro, previsión o estimación para reflejar cambio alguno en las expectativas de TiGenix en relación a ello, o cualquier cambio en los acontecimientos, condiciones o circunstancias en las que estén basadas dichas afirmaciones, previsiones o estimaciones, excepto en la medida exigida por la ley belga. Page 3 of 3