VV SS dT dP -
Anuncio

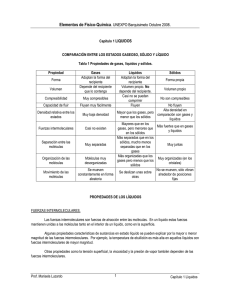
CAMBIOS DE ESTADO CAMBIOS DE ESTADO Presión de vapor y punto o temperatura de ebullición (Teb): Un líquido entra en ebullición cuando la presión de vapor es igual a la presión externa. Variación del punto de ebullición P con la presión externa. 1 atm líquido vapor Punto de ebullición normal: Es la Teb para P externa = 1 atm. Teb Normal T CAMBIOS DE ESTADO Diagramas de fases de un componente: Punto crítico La temperatura crítica es la temperatura por encima de la cual el líquido no se puede licuar a ninguna presión La presión crítica es la necesaria para licuar el gas a la temperatura crítica CAMBIOS DE ESTADO Fluído Supercrítico (P > Pc y T > Tc): Fluído que tiene la densidad de un líquido pero con la viscosidad de un gas Punto Triple: condición de T y P a la que pueden existir las 3 fases en equilibrio. CAMBIOS DE ESTADO CAMBIOS DE ESTADO Ejercicio: Deducir una ecuación similar a la Clausius Clapeyron para el equilibrio S-V a partir de: Curva de enfriamiento: VARIACIÓN DEL PUNTO DE FUSIÓN CON LA PRESIÓN. dP SV −SS = dT VV − VS ln S ' V P2 ∆H SUB ⎡ 1 1 ⎤ = ⎢ − ⎥ P1 R ⎣ T1 T2 ⎦ Qué aproximaciones se hicieron? Podrán hacerse las mismas aproximaciones para el equilibrio S-L? CAMBIOS DE ESTADO CAMBIOS DE ESTADO Diagramas de fases del agua: CO2 H2 O AUMENTO DE P FAVORECE LA FUSIÓN EL SÓLIDO FUNDE A LA PRESIÓN DE 1 ATM CAMBIOS DE ESTADO dP SL −SS = dT VL − VS Signo VL VS Mayoría de las sustancia >0 s (Siempre) H>0 2O <0 REGLA DE LAS FASES DE GIBBS Signo dP/dT FASE (P): Porción homogénea y físicamente distinta de un sistema, separada de las otras partes del sistema por una superficie límite definida. >0 NÚMERO DE COMPONENTES (C): Es el menor número de constituyentes químicos independientes necesarios para Expresar la composición de cualquier fase del sistema. <0 CAMBIOS DE ESTADO NÚMERO DE GRADOS DE LIBERTAD (F): Es el número de variables (T,P, composición) que deben fijarse para que la condición de un sistema en equilibrio quede definida. F=C–P+2 EL SÓLIDO SUBLIMA A LA PRESIÓN DE 1 ATM CAMBIOS DE ESTADO Pendiente de curva S-L: Signo SL SS AUMENTO DE P FAVORECE LA SOLIDIFICACIÓN CAMBIOS DE ESTADO Diagramas de fases del azufre: Aplicar la regla de las fases a los Puntos 1-5. 1 Hacer el ejercicio 10 b de la guía. 2 5 3 4 CAMBIOS DE ESTADO CAMBIOS DE ESTADO Algunas propiedades de los líquidos: Algunas propiedades de los líquidos: Viscosidad Tensión superficial Resistencia que presenta un líquido a fluir. Energía requerida para aumentar el área superficial de un líquido. Un líquido fluye porque sus moléculas se deslizan unas sobre otras. Las moléculas de la superficie perciben una fuerza neta hacia adentro. Cuanto más intensas son las FI, mayor es la viscosidad del líquido. Cuanto más intensas son las FI, mayor es la tensión superficial. A mayor T, menor viscosidad. CAMBIOS DE ESTADO