MUJER JOVEN CON PARAPARESIA Y RETARDO MENTAL LEVE
Anuncio

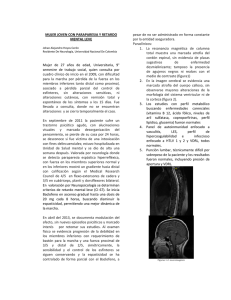
MUJER JOVEN CON PARAPARESIA Y RETARDO MENTAL LEVE Johan Alejandro Hoyos Cerón Residente De Neurología, Universidad Nacional De Colombia Mujer de 27 años de edad, Universitaria, 9° semestre de trabajo social, quien consulta por cuadro clínico de inicio en el 2009, con dificultad para la marcha por pérdida de la fuerza en los miembros inferiores tanto distal como proximal, asociado a pérdida parcial del control de esfínteres, sin alteraciones sensitivas, ni alteraciones cutáneas, con remisión total y espontáneo de los síntomas a los 15 días. Fue llevada a consulta, donde no se encuentran alteraciones y se cierra temporalmente el caso. En septiembre de 2011 la paciente sufre un trastorno psicótico agudo, con alucinaciones visuales y marcada desorganización del pensamiento, se pierde de su casa por 24 horas, se desconoce si fue víctima de una intoxicación con fines delincuenciales; estuvo hospitalizada en Unidad de Salud mental y se dio de alta una semana después. Valorada por neurología donde se detecta paraparesia espástica hiperrefléxica, con fuerza en los miembros superiores normal y en los inferiores mostró un gradiente hacia distal con calificación según el Medical Research Council de 4/5 en flexo-extensores de cadera y 3/5 en cuádriceps, planti y dorsiflexores bilateral. En valoración por Neuropsicología se determinan criterios de retardo mental leve (CI 67). Se inicia Baclofeno en ascenso gradual hasta una dosis de 20 mg cada 8 horas, buscando disminuir la espasticidad, permitiendo una mejor dinámica de la marcha. En abril del 2013, se documenta modulación del afecto, sin nuevos episodios psicóticos y marcado interés por retomar sus estudios. Al examen físico se evidencia progresión de la debilidad en los miembros inferiores con requerimiento de bastón para la marcha y una fuerza proximal de 3/5 y distal de 2/5, simétricamente, la sensibilidad y el control de los esfínteres se siguen conservando y la espasticidad se ha controlado de forma parcial con el Baclofeno, a pesar de no ser administrado en forma constante por la entidad aseguradora. Paraclínicos: 1. La resonancia magnética de columna total muestra una marcada atrofia del cordón espinal, sin evidencia de placas sugestivas de enfermedad desmielinizante; tampoco la presencia de agujeros negros ni realces con el medio de contraste (figura1) 2. En la imagen cerebral se evidencia una marcada atrofia del cuerpo calloso, sin observarse mayores alteraciones de la morfología del sistema ventricular ni de la corteza (figura 2). 3. Los estudios con perfil metabólico buscando enfermedades carenciales (vitamina B 12, ácido fólico, niveles de aril sulfatasa, coproporfirinas, perfil lipídico, glucemia) fueron normales 4. Panel de autoinmunidad enfocado a vasculitis, LES, perfil de hipercoagulabilidad e infeccioso enfocado a HTLV 1 y 2 y VDRL, todos normales. 5. Punción lumbar, técnicamente difícil por sobrepeso de la paciente y los resultados fueron normales, incluyendo presión de apertura y VDRL. Figuras 1-2: neuroimagenes Se hace estudio neurofisiológico completo, el estudio fue unilateral por la gran simetría de los hallazgos y su resultado fue considerado normal (ver tabla 1). NEUROCONDUCCIONES SENSITIVAS ( a 10cm) Latencia Amplitud Velocidad de de pico conducción Mediano 2.3 ms 22 uV 59 m/s Derecho Cubital 2.1 ms 14 uV 56 m/s Derecho Radial 2.3 ms 21 uV 43 m/s Derecho Sural 3.1 ms 37 uV 43 m/s Derecho NEUROCONDUCCIONES MOTORAS Sitio Latencia Mediano derecho Muñeca 3.3 ms Amplitud Velocidad de conducción 4.8 mV 50 m/s Codo 7.3 ms 4.2 mV Cubital derecho Muñeca 2.3 ms 9.1 mV Distal al 5.6 ms codo Proximal 7.3 ms al codo Peronero derecho Tobillo 4.2 ms 7.3 mV Peroné 8.7 ms (cabeza) Tibial Derecho 1.5 mV 55 m/s 6.4 mV 1.2 mV 64 m/s Tobillo 5.4 ms 2.8 mV Fosa poplítea 14.8 ms 1.3 mV Nervio LATENCIA F Mediano der 26.2 Cubital der. 23.6 Tibial der 49.6 36 m/s LATENCIA H 29.2 ms Tabla 1: neuroconducciones ANÁLISIS Se trata de una paciente en la tercera década de la vida con cuadro de pérdida progresiva de la fuerza en las extremidades inferiores de 4 años de evolución, que se asoció a tono espástico en las mismas. Solo tuvo pérdida del control de esfínteres por algunas semanas, pero este se recuperó total y espontáneamente Luego del estudio exhaustivo para descartar causas secundarias y tratables (enfermedades desmielinizantes tipo esclerosis múltiple, vasculitis y lupus, sífilis e infección por HTLV 1 y 2, y déficit de vitamina B12 y acido fólico) se logra determinar la concomitancia con atrofia del cordón espinal y del cuerpo calloso, además de un retardo mental leve y un episodio psicótico aislado. Se considera entonces un cuadro de origen genético de expresión tardía (si bien en la familia no hay hasta la fecha otras personas con un cuadro similar), compatible con paraparesia espástica hereditaria (PEH). La paraparesia espástica hereditaria (nombres alternativos: paraplejia espástica hereditaria o familiar) se define como una condición neurodegenerativa, cuya principal característica es una axonopatía dependiente de la longitud que afecta las terminaciones de los tractos descendentes corticoespinales y las columnas ascendentes dorsales. (1). Una característica llamativa que a la vez dificulta el diagnóstico, es la gran heterogeneidad de su presentación clínica. Se puede dividir en pura (no complicada) y compleja (complicada). Si bien los dos grupos son clínicamente indistinguibles, se puede decir que la forma pura de la PEH se caracteriza por disfunción piramidal de los miembros inferiores, con paresia, espasticidad y respuesta plantar extensora (signo de Babinski). Se puede acompañar de pérdida de la sensibilidad profunda y urgencia urinaria. El curso es lentamente progresivo y hay una considerable variabilidad en edad de inicio y severidad (2). LA PEH complicada se caracteriza por la asociación de síntomas neurológicos como retardo mental, demencia, signos extrapiramidales, pérdida visual y epilepsia, además de signos no neurológicos como cataratas, degeneración retiniana, ictiosis y anormalidades esqueléticas. También se pueden asociar anormalidades estructurales como adelgazamiento del cuerpo calloso, hiperintenisdades en la sustancia blanca, atrofia cortical y cerebelosa. (2). Una familia se clasifica como portadora de PEH complicada, si al menos uno de los miembros afectados presenta alguna de las características no piramidales. Existen formas esporádicas de PEH que se desarrollan después de los 20 años y se convierten en un problema en la práctica neurológica. La ausencia de historia familiar de PEH, hacen de ésta un diagnóstico de exclusión. Se pueden encontrar familiares afectados asintomáticos, que son portadores de una mutación no penetrante (3). En los casos de PEH comprobada, los hallazgos más comunes en los estudios de RNM suelen ser adelgazamiento del cordón espinal cervical y torácico y del cuerpo calloso, así como hiperintenisdades escasas en la sustancia blanca. En la mayoría de los casos de PEH pura, los estudios de neuroconducción y electromiografía suelen ser normales. Los potenciales evocados somatosensoriales de los miembros inferiores suelen estar disminuidos en amplitud. Los estudios de LCR son usualmente normales. Por las características del caso clínico, se considera que el perfil fenotípico de PEH de la paciente es del tipo SPG11/KIAA1840 (4). Esta es, probablemente, la forma más frecuente de PEH, siendo responsable del 20% de los casos donde la herencia es autosómica recesiva. Se manifiesta en las 3 primeras décadas de vida, acompañándose de déficit cognoscitivo (aproximadamente 80%), disartria (80%) e hipotrofia tenar e hipotenar (50%). Los signos cerebelosos pueden aparecer tardíamente. La progresión es alta comparada con las paraparesias espásticas no-SPG11, llegando a la dependencia de silla de ruedas en promedio 16 años después del inicio de los síntomas. El adelgazamiento del cuerpo calloso en las neuroimágenes es la marca distintiva de la mutación SPG11, casi siempre acompañada de cambios en la sustancia blanca y atrofia cortical. La neuropatía sensitiva axonal es altamente frecuente (cerca del 80% de los casos). Si el fenotipo típico está presente, especialmente adelgazamiento del cuerpo calloso y déficit cognoscitivo, la frecuencia de SPG11 es del 59%, en los cuadros autosómicos recesivos. En los casos que se estudia SPG11 y resulta negativo, se debería seguir con el estudio de SPG15, que es el segundo mas frecuente (30% de los casos negativos para SPG11) (2,4), esto teniendo en cuenta que se han descrito al menos 5 mutaciones de SPG11: 2 con cambio del marco de lectura, 2 con mutaciones sin sentido y la mutación R2034X, que es la mas frecuente en la población mediterránea y aparentemente tiene origen en el norte del continente africano (5) y medio oriente (6) Neuropsicológicamente, se describe un déficit cognoscitivo leve a moderado, alteraciones atencionales y de memoria. Las dificultades de aprendizaje se presentan de forma más temprana que los cambios motores (7) El diagnostico diferencial imagenológico incluye esclerosis múltiple, leucodistrofias y anormalidades estructurales que afecten cerebro y cordón espinal y ayuda a clasificar la PEH cuando se ha considerado el origen genético. Las anormalidades observables incluyen adelgazamiento del cuerpo calloso sugestivo de mutaciones SPG11, anormalidades cerebrales o cerebelosas propias de las mutaciones SPG7 e hidrocefalia en SPG1 (8). La EMG y VCN suelen ser normales en las formas no complicadas, aunque se han descrito neuropatías sensitivas subclínicas en estas. Las formas complicadas como SPG10, SPG14, SPG15 y SPG26 se asocian con neuropatía periférica y ocasionalmente con evidencia de lesión de motoneurona inferior. El tratamiento se limita a reducir la espasticidad con Baclofeno (oral o intratecal), Dantrolene o Tizanidina. La reducción de la urgencia urinaria puede ser tratada con Oxibutinina y la fuerza y compromiso postural se manejan mediante un programa integral de rehabilitación (8). En cuanto al pronóstico, los sujetos que muestran síntomas en los primeros años de vida experimentan muy poco deterioro a través de las dos primeras décadas. A partir de entonces, la marcha puede empeorar lentamente debido a la espasticidad y al desacondicionamiento muscular general. (8). También se conoce la asociación de PEH con cuadros psicóticos, similares a esquizofrenia. Estos se presentan en la adolescencia, siendo alta la frecuencia de asociación con retardo mental y esto es particularmente cierto para los pacientes con mutación SPG4(9). Muchos de los pacientes cursan con trastornos del ánimo y labilidad emocional. REFERENCIAS 1. 2. 3. 4. 5. 6. 7. 8. 9. McDERMOTT, C.J. et al. Clinical Features of hereditary spastic paraplegia due to spastin mutation. Nuerology 2006; 67: 45-51. GOIZET, C. et al. SPG15 is the second most common cause of hereditary spastic paraplegia with thin corpus callosum. Neurology 2009; 73:1111-1119. SALINAS, S. et al. Hereditary spastic paraplegia: clinical features and pathogenic mechanisms. Lancet Neurology 2008; 7:1127-38. SCHÜLE, R., SCHÖLS, L. Genetics of hereditary Spastic paraplegias. Seminars in Neurology 2011; 31: 484-493. SAMARANCH, L, et al. Compuesto de mutaciones SPG11 en paraparesia espástica con cuerpo calloso delgado. Neurology 2008; 71: 332-336. LOSSOS, A., et al. Hereditary Spastic Paraplegia with thin coprus callosum: Reduction of the SPG11 interval and evidence for further genetic heterogeneity, Archives of Neurology 2006; 63: 756-760. SIRI, L. et al. Cognitive profile in spastic paraplegia with thin corpus callosum and mutations in SPG11. Neuropediatrics 2010; 41:35-38. FINK, J. Hereditary spastic paraplegia. Current Neurology and Neuroscience Reports, 2006; 6:75-76. McMONAGLE, P., et al. Hereditary spastic paraparesis and psycosis. Eurpean Journal of Neurology 2006; 13: 874-879.