RESUMEN DE INVESTIGACIÓN
Anuncio

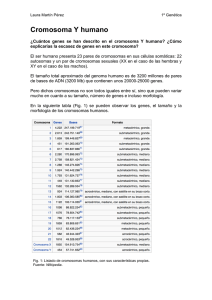
RESUMEN DE INVESTIGACIÓN The Minimalist Y Capel, B. (2014). The Minimalist Y. Science, 343(6166), 32-33. Karima Al-Akioui Sanz Genética Molecular Grado en Biología, 2014/2015 INTRODUCCIÓN DETERMINACIÓN CROMOSÓMICA DEL SEXO La determinación cromosómica del sexo está extendida en el reino animal, aunque no se da en todos los casos. Hay distintos sistemas de determinación cromosómica del sexo, pero el fundamental en mamíferos es el sistema XX/XY, de machos heterogaméticos y hembras homogaméticas. El cromosoma X es más grande y rico en genes, mientras que en cromosoma Y es más pequeño, heterocromático y con muy pocos genes (1, 2). Figura 1. Comparación entre el cromosoma X e Y humanos. (http://www.ensembl.org/Homo_sapiens/Location/Genome) EL CROMOSOMA Y: ORIGEN Y ESTRUCTURA Tanto el origen como el fututo del cromosoma Y de mamíferos ha sido sujeto de mucha especulación. Se cree que el origen y evolución de los cromosomas sexuales en mamíferos pudo tener lugar a partir de la diferenciación de una pareja de cromosomas ancestrales. El proceso se inició cuando uno de los cromosomas homólogos adquirió un locus determinante del sexo, como el locus TDF (testis-determining factor) del cromosoma Y. La acumulación de alelos específicos determinantes del sexo masculino provocó una represión progresiva de la recombinación (representada por cruces en la figura 2), y la creación de una región específica del cromosoma X y de una región específica del cromosoma Y (MSY - male-specific region on the Y-). La limitación de recombinación provocó que el cromosoma Y perdiera material rápidamente, sufriera varias duplicaciones y se quedara con pocos genes, de los cuales un gran porcentaje tienen homólogos en el X. El cromosoma X, en cambio, se conservó mejor gracias a la existencia de recombinación entre las dos copias presentes en hembras. Entre ambos sólo quedó una pequeña región homóloga llamada región pseudoautosómica (PAR). Figura 2. Evolución de los cromosomas a partir de dos cromosomas ancestrales (1). Por otro lado, además de la pérdida de genes en el cromosoma Y, se produjeron una serie de estratificaciones que dieron lugar a 5 capas distinguibles. La estratificación favoreció la perdida de homología entre cromosomas, la disminución del entrecruzamiento y por tanto la pérdida de material en el cromosoma Y. Pero se ha observado que en las capas o estratos más antiguos del cromosoma (capas 1-4) la pérdida de material ha cesado, y sólo prosigue en el quinto estrato. Esto lleva a pensar que la desaparición del cromosoma Y no se va a producir, ya que, aunque al principio el cromosoma estaba expuesto a una gran erosión, posteriormente se ha ido estabilizando, y se han conservado regiones específicas que han proporcionado ventajas evolutivas al los organismos que las portaban. Además este cromosoma Y es fundamental para la determinación del sexo en muchas especies, por lo que su desaparición sin la aparición de un sistema que permitiera dicha determinación no es viable (1). Por otro lado, mediante estudios de secuenciación se ha revelado la compleja estructura del cromosoma Y, con sus multitud de capas palindrómicas. Las secuencias palindrómicas pueden facilitar el apareamiento de bases interno, permitiendo así al cromosoma Y autorrepararse mediante conversión génica (3,4). Este proceso evitaría también una mayor pérdida de información en el cromosoma, lo que apoya la idea de que una pérdida del cromosoma Y no se va a producir en principio. EL CROMOSOMA Y: papel en la gametogénesis y formación de descendientes viables FASES DE LA GAMETOGÉNESIS En un proceso normal, las espermatogonias crecen para generar espermatocitos 1º, que se dividen por meiosis para dar lugar a 4 espermátidas; estas se diferencian dando lugar a los espermatozoides maduros. El cromosoma Y y los genes que contiene son importantes en el proceso, aunque hasta qué punto está todavía por resolver (5). Figura 3. Fases de la espermatogénesis (5). EL CROMOSOMA Y: GAMETOGÉNESIS Y OBTENCIÓN DE DESCENDIENTES VIABLES Genes imprescindibles del cromosoma Y Cada cromosoma, incluyendo el Y, se divide en dos brazos mediante una constricción primaria o centrómero. Ya se había visto que el brazo largo completo del cromosoma Y de ratón (76 Mb aproximadamente) es prescindible si el genoma de espermátidas anormales producidas por los ratones son transferidas al citoplasma del óvulo mediante una técnica llamada ROSI (round espermatid inyection), una inyección espermática intracitoplasmática (6). Además sólo dos genes de las 2 Mb restantes del brazo corto del cromosoma Y se requerían para llevar a cabo reproducción asistida en el ratón (mediante ROSI) y generar una descendencia viable (4). Esos dos genes son: Sry (sex-determining region Y), gen determinante del sexo masculino en mamíferos. Eif2s3y (Y-encoded subunit 3 of the eukaryotic translation initiation factor 2), necesario para dirigir la espermatogénesis en ratón, donde dará lugar a la formación de espermatozoides haploides (4). Ratones de una cepa con sólo un cromosoma X (XO) son completamente infértiles. Si en estos ratones se expresa el gen Sry (que se puede incorporar en forma de transgén), desarrollan un testículo plagado de espermatogonias, células germinales que permanecen en estado de arresto sin entrar a dividirse. Si además se expresa el gen Eif2s3y (también incorporado en forma de transgén), se observa que se recupera la proliferación y desarrollo de esas espermatogonias, que quedan arrestadas en la fase de espermatocitos 2º (no hay formación de espermátidas, ni espermatogénesis o diferenciación para poder dar lugar a espermatozoides maduros). En algunas ocasiones incluso se llega a formar algunas células similares a espermátidas, aunque redondeadas, pero con una eficiencia extremadamente baja. Sin embargo, el que esto ocurra permite afirmar que los dos genes del cromosoma Y mencionados deben ser suficientes para generar todas las modificaciones epigenéticas paternales que acompañan a la espermatogénesis (4,7). Algunas características morfológicas de las gonias y las espermátidas, así como otros aspectos de lo anteriormente mencionado se recogen en la figura 4. Figura 4. Corte histológico de testículo de ratón, espermátidas y descendencia viva. Barras de escala: 16 mm (A, B), 50 mm (C), 10 mm (D, E); mo = meses de vida. (A) Corte histológico de un testículo de un macho con Eif2s3y y Sry exclusivamente (cepa X EOSry, con el primer gen en el cromosoma X y el segundo en un autosoma; tienen testículos más pequeños, aunque cargados de células germinales); presenta arresto meióticos y postmeiótico que sólo ocasionalmente permite la formación de espermatozoides (cabezas de flecha). (B) Se observa la degeneración de los túbulos seminíferos con formación de cuerpos multinucleados (flechas largas), vacuolas (flechas cortas) y células muertas o apoptóticas (cabezas de flecha), lo cual se ve con frecuencia en este tipo de ratones. Por otro lado, en (C) se ve cómo las características mencionadas en la figura (B) acaban generando túbulos seminíferos con el síndrome SCO (Sertoli-cell-only); estos individuos no presentan apenas células germinales, sólo células de Sertoli. (D) Suspensión del contenido del testículo de ratones wildtype; aparecen espermatozoides (flechas) y espermátidas redondeadas (cabezas de flecha). (E) Suspensión de ratones de una cepa XEOSry, donde no hay espermatozoides y las espermátidas presentes son más redondeadas, con la superficie rugosa y los núcleos más pequeños (cabezas de flecha). Estas espermátidas son funcionales en técnicas de reproducción asistida (ROSI). (F) Cría obtenida mediante ROSI, utilizando espermátidas de ratones con sólo dos genes el cromosoma Y. (G) Hembra adulta resultado del crecimiento de la cría mostrada en (F) y su propia descendencia (4). Importancia de la región PAR El bloqueo de la progresión meiótica ocurre cuando el cromosoma X y el Y no aparean durante la meiosis masculina. El apareamiento normal ocurre a lo largo de una región homóloga entre ambos cromosomas llamada región pseudoautosómica (PAR). Esta región se ha perdido en muchas de las variantes cromosómicas del Y usadas en los estudios que aquí se analizan, incluyendo los machos de la cepa XEOSry. Para evitar este problema se introdujo un minicromosoma Y artificial que contenía la región PAR para que apareara con el cromosoma X (cepa XEY*XSry), pero esto no mejoró a producción de espermátidas haploides o la frecuencia de obtención de descendientes mediante la técnica ROSI (4). Figura 5. Comparativa entre el % de espermátidas haploides obtenidas con cada una de las cepas de ratón, mostrándose un máximo (azul) y un mínimo (rojo). Como se puede apreciar, no hay mucha diferencia a pesar de la inclusión del minicromosoma Y (4). El problema de la ploidía Muchas de las espermátidas obtenidas de las cepas de ratones utilizadas eran diploides, lo cual generaría descendientes triploide. Pero sin embargo la descendencia generada con la técnica ROSI era diploide, y además sana y fértil, lo cual sugería que la ploidía se ajustaba en el zigoto a través de un mecanismo aun desconocido. Una investigación más profunda del comportamiento de los cromosomas y su segregación en la primera división cigótica de la descendencia obtenida mediante ROSI a partir de machos XEOSry podría ser informativa, aunque de momento cómo se ajusta la ploidía está por resolver (4). ¿Por qué no deshacerse de todo el cromosoma Y, si con 2 genes se pueden generar descendientes viables? Puede ser interesante analizar el papel que tienen los genes Sry y Eif2s3y, y ver hasta qué punto son imprescindibles en la génesis de espermatozoides o de descendientes viables. Gen Sry El gen Sry se transcribe muy activamente en el testículo de ratones adultos. La función del transcrito de Sry se desconoce, aunque se acumula sobre todo en la cresta genital. Clones 5’RACE y cDNA aislado de testículos o de líneas celulares transfectadas con el gen Sry presentan una estructura inusual, con secuencias que suelen estar en 3’ situadas en 5’. Ensayos de protección de la acción de RNAsas y ensayos con retrotranscriptasas inversas confirman que estas inusuales moléculas de RNA representan el mayor transcrito presente en el testículo. Es más, técnicas de hibridación con oligonucleótidos y digestión con RNAsas H prueban que estos transcritos son circulares. Este RNA circular se ha hallado en el citoplasma, aunque no unido a ribosomas, de manera que no se cree que se traduzcan. Parece que, como consecuencia de un proceso de splicing normal, y debido a la secuencia inusual que presentan los transcritos, se circularizan, lo cual impide su traducción (8). Otros estudios han demostrado que el transcrito de Sry circularizado sirve como esponja de microRNAs-138, los cuales se han propuesto como importantes reguladores postranscripcionales en el testículo. Parece entonces que el gen Sry es importante, pero se podría evitar su requerimiento mediante la sobreexpresión de otros genes autosómicos como Sox9 (Sry-box 9), que pudieran dirigir la determinación del sexo en machos por sí mismos. De hecho la sobreexpresión de Sox9 en un ratón carente de Sry puede restaurar la fertilidad del ratón al completo, lo cual sugiere que el transcrito circular de Sry, aunque es importante, no es esencial (9). Gen Eif2s3y El gen Eif2s3y actúa en el proceso de espermatogénesis, en la primera división meiótica, aunque parece que tampoco es imprescindible en ratones para generar una descendencia viable mediante ROSI. Eif2s3y codifica la subunidad 3 del factor de iniciación de la traducción 2 de eucariotas. El por qué este gen es esencial para la progresión de la meiosis no está claro, sin embargo no hay copia del mismo en el cromosoma Y de primates, incluyendo humanos. Es su lugar, los humanos poseen un miembro diferente de la familia de este gen, EIF1AY, que se encuentra en la región AZFb del cromosoma Y. Mutaciones en esta región suelen provocar azooespermia (ausencia de esperma en la eyaculación), lo cual sugiere que en humanos este gen si es imprescindible para generar gametos viables. Entonces, si los genes no son tan esenciales como parece, ¿el cromosoma Y está destinado a perderse en algunos casos? No es probable. Al utilizar la técnica ROSI no es necesario generar un esperma maduro con una motilidad adecuada, con receptores de membrana que reconozcan al oocito y con un acrosoma cargado de enzimas que le permitan incorporar su material genético a dicho oocito. Pero el brazo corto del cromosoma Y codifica información esencial para la morfogénesis del esperma, incluyendo el desarrollo del acrosoma, la elongación de la cabeza espermática y la morfogénesis de la cola. Es más, la deleción del gen Sly, que está localizado en el brazo largo del cromosoma Y, conduce a una desrepresión de genes tanto del cromosoma X como del Y que normalmente están silenciados durante la espermatogénesis, y pueden ser la causa de las anormalidades en las cabezas espermáticas que ocurren en las deleciones de brazo largo en ratones. A menos que estemos planeando abandonar la reproducción natural y utilizar otras técnicas como la mencionada ROSI para dar lugar a las futuras generaciones, la mayoría de los cromosomas Y de mamíferos son necesarios. CONCLUSIONES En los organismos con determinación cromosómica del sexo, y en concreto aquellos con un sistema XX/XY, tanto el cromosoma X como el Y son importantes. Hay un dimorfismo entre ambos cromosomas, siendo el X más grande y con más genes, y el Y mucho más pequeño y con menor carga génica. Los cromosomas X e Y sólo conservan una región homóloga, la región PAR, que les permite aparearse durante la meiosis (proceso fundamental para la formación de los gametos). Aunque por origen, el cromosoma Y ha tendido a perder información genética, en estos momentos se mantiene estable. Además posee secuencias palindrómicas que le permiten llevar a cabo procesos de autorreparación. De todos los genes que conserva el cromosoma Y, solo dos son importantes para poder generar un descendiente viable mediante técnicas de reproducción asistida (ROSI) en ratones: Sry y Eif2s3y. Sin embargo, se ha demostrado que no son completamente imprescindibles. El resto de genes del cromosoma Y son fundamentales para completar diversas fases de la espermatogénesis, o formación de gametos masculinos, proceso imprescindible para que se pueda generar un cigoto de forma natural, aunque no lo sea para llevar a cabo una reproducción artificial. Así, el cromosoma Y no está destinado a desaparecer, ya que está estabilizado, aparea correctamente con el cromosoma X, y es fundamental para la gametogénesis en los machos. BIBLIOGRAFÍA 1. Graves, J. A. M. (2006). Sex chromosome specialization and degeneration in mammals. Cell, 124(5), 901-914. 2. Ellegren, H. (2011). Sex-chromosome evolution: recent progress and the influence of male and female heterogamety. Nature reviews genetics, 12(3), 157-166. 3. Rozen, S., Skaletsky, H., Marszalek, J. D., Minx, P. J., Cordum, H. S., Waterston, R. H., ... & Page, D. C. (2003). Abundant gene conversion between arms of palindromes in human and ape Y chromosomes. Nature, 423(6942), 873-876. 4. Yamauchi, Y., Riel, J. M., Stoytcheva, Z., & Ward, M. A. (2014). Two Y genes can replace the entire Y chromosome for assisted reproduction in the mouse. Science, 343(6166), 69-72. 5. Climent, S. F., Sarasa, M., Domínguez, L., Muniesa, P., Terrado, J. 1998. Manual de anatomía y embriología de los animales domésticos. Conceptos básicos y datos aplicativos. Acribia, S.A. 6. Vernet, N., Mahadevaiah, S. K., Ellis, P. J., de Rooij, D. G., & Burgoyne, P. S. (2012). Spermatid development in XO male mice with varying Y chromosome short-arm gene content: evidence for a Y gene controlling the initiation of sperm morphogenesis. Reproduction, 144(4), 433-445. 7. Burgoyne, P. S., Mahadevaiah, S. K., Sutcliffe, M. J., & Palmer, S. J. (1992). Fertility in mice requires XY pairing and a Y-chromosomal “spermiogenesis” gene mapping to the long arm. Cell, 71(3), 391-398. 8. Capel, B., Swain, A., Nicolis, S., Hacker, A., Walter, M., Koopman, P., ... & Lovell-Badge, R. (1993). Circular transcripts of the testis-determining gene< i> Sry</i> in adult mouse testis. Cell, 73(5), 1019-1030. 9. Qin, Y., & Bishop, C. E. (2005). Sox9 is sufficient for functional testis development producing fertile male mice in the absence of Sry. Human molecular genetics, 14(9), 1221-1229.