Neurosífilis: formas de presentación y manejo clínico
Anuncio

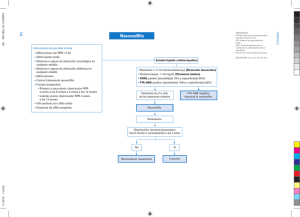
M.A. CONDE-SENDÍN, ET AL REVISIÓN Penman N, et al. An open trial evaluation of mitoxantrone in the treatment of progressive MS. Neurology 1993; 43: 1401-6. 20. Millefiorini E, Gasperini C, Pozzillini C. Randomised placebo controlled trial of mitoxantrone in relapsing remitting multiple sclerosis: a 24 month clinical and MRI outcome. J Neurol 1997; 244: 153-9. 21. Edan G, Miller D, Clanet M, Cofavreux C, Lyon-Caen O, Lubetzki C, et al. Therapeutics effects of mitoxantrone combined with methylprednisolone in multiple sclerosis: a randomised multicentre study of active disease using MRI and clinical criteria. J Neurol Neurosurg Psychiatry 1997; 62: 112-8. 22. Hartung HP, Gonsette R, MIMS Study Group. Mitoxantrone in progressive MS: a placebo-controlled, randomised, observer blind phase III trial: clinical results and 3 year follow up. Neurology 1999; 52: 290. 23. Faulds D, Goa KL, Benfield P. Cyclosporin. A review of its pharmaco- dynamic and pharmacokinetic properties, and therapeutic use in immunoregulatory disorders. Drugs 1993; 45: 953-1040. 24. No authors listed. Efficacy and toxicity of cyclosporine in chronic progressive multiple sclerosis: a randomized, double-blinded, placebo-controlled clinical trial. The Multiple Sclerosis Study Group. Ann Neurol 1990; 27: 591-605. 25. No authors listed. Double-masked trial of azathioprine in multiple sclerosis. British and Dutch Multiple Sclerosis Azathioprine Trial Group. Lancet 1988; 2: 179-83. 26. Kremenchutzky M. La Historia Natural de la Esclerosis Múltiple. Rev Neurol 2000; 30: 967-72 27. Hohlfeld R, Wiendl H. Ups and Down of MS therapeutics Ann Neurol 2001; 49: 281-3. INMUNOSUPRESORES Y ESCLEROSIS MÚLTIPLE Resumen. Objetivo. Los avances tecnológicos y las mejoras en el diseño de los ensayos clínicos y en la RM han conducido a una gran variedad de aproximaciones terapéuticas a la esclerosis múltiple (EM), algunas de ellas con éxito, mientras que otras no lo han sido tanto, a pesar de los prometedores resultados en modelos animales. Desarrollo. En este artículo revisamos el estado de la terapia con inmunosupresores en la EM y prestamos especial atención a los ensayos realizados con cladribina, linomide, sulfasalacina, ciclofosfamida, mitoxantrona, ciclosporina A y azatioprina. Conclusión. Una inmunosupresión grave e inespecífica disminuye la actividad anatomopatológica y clínica de la enfermedad, con modestos beneficios en las tasas de ataques y la RM, pero no se han demostrado efectos sobre la progresión y sí la existencia de serios efectos secundarios a corto y largo plazo que impiden, en algunos casos, su administración, aunque bien es verdad que la demostración de la eficacia de estos productos puede no haberse conseguido por problemas metodológicos; posiblemente son más útiles solos o combinados con inmunomoduladores. [REV NEUROL 2002; 35: 373-80] Palabras clave. Ciclofosfamida. Cladribina. Ensayo clínico. Esclerosis múltiple. Inmunosupresores. Inmunomoduladores. Linomide. Mitoxantrona. Sulfasalacina. IMUNOSSUPRESSORES E ESCLEROSE MÚLTIPLA Resumo. Objectivo. Os avanços tecnológicos, melhorias no desenho dos ensaios clínicos e da RM conduziram a uma grande variedade de aproximações terapêuticas à esclerose múltipla (EM); algumas delas com sucesso, enquanto que outras não o têm sido tanto, apesar de resultados prometedores em modelos animais. Desenvolvimento. Neste artigo revemos o estado da terapia com imunossupressores na EM e prestamos atenção especial ao ensaios realizados com cladribina, linomida, sulfasalazina, ciclofosfamida, mitoxantrona, ciclosporina A e azatiopirina. Conclusão. Uma imunossupressão grave e inespecífica diminui a actividade anatomopatológica e clínica da doença, com modestos benefícios nas taxas de ataques e na RM; contudo não se demonstraram efeitos sobre a progressão, mas sim a existências de efeitos secundários graves a curto e longo prazo que impedem, em alguns casos, a sua administração, embora seja verdade que a demonstração da eficácia destes produtos pode não ter se conseguido por problemas metodológicos; possivelmente são mais úteis sós ou em combinação com imunomoduladores. [REV NEUROL 2002; 35: 373-80] Palavras chave. Ciclofosfamida. Cladribina. Ensaio clínico. Esclerose múltipla. Imunossupressores. Imunomoduladores. Linomida. Mitoxantrona. Sulfasalazina. Neurosífilis: formas de presentación y manejo clínico M.A. Conde-Sendín a, J.L. Hernández-Fleta b, M.A. Cárdenes-Santana c, R. Amela-Peris a NEUROSYPHILIS: FORMS OF PRESENTATION AND CLINICAL MANAGEMENT Summary. Introduction and aims. Neurosyphilis results from the infection of the central nervous system by Treponema pallidum. It causes diverse clinical pictures which are occasionally similar to other, better known neurological diseases. In this paper our aim is to offer a global clinical vision of this entity by reviewing the different forms it can take and its diagnostic and therapeutic management. Development. The forms of presentation of neurosyphilis can be grouped in two categories: early (asymptomatic, meningeal and meningovascular neurosyphilis) and late (progressive general paralysis and tabes dorsalis). Other less important forms, such as gummas, ocular forms, syphilitic amyotrophy or hypoacusis, have also been described. Diagnosis is complex and is based on the study of the cerebrospinal fluid. Given the difficulty involved in performing an accurate diagnosis, different criteria have been developed in which T. pallidum serology plays a key role. The most effective treatment is penicillin, although on occasions it may have no effect and we therefore recommend clinical and fluid analysis follow-ups. Lastly, we describe the changes in incidence and clinical presentation, and the complications that may arise in diagnosis when HIV-carrying patients also suffer from this disease. Conclusions. Neurosyphilis is a disease that still occurs nowadays and, due to its clinical polymorphism, must be borne in mind as a differential diagnosis in a number of neurological and psychiatric illnesses. This, together with the fact the serological tests are difficult to interpret and its irregular response to the usual treatment, makes it difficult to manage and means that the neurologist must have a thorough knowledge of the disorder. [REV NEUROL 2002; 35: 380-6] Key words. Asymptomatic syphilis. Gumma. Meningeal syphilis. Meningovascular syphilis. Neurosyphilis. Progressive general paralysis. Tabes dorsalis. Treponema pallidum. Recibido: 24.10.01. Aceptado tras revisión externa sin modificaciones: 12.01.02. a Servicio de Neurología. b Servicio de Psiquiatría. c Servicio de Medicina Interna. Hospital General de Gran Canaria Dr. Negrín. Las Palmas de Gran Canaria, España. 380 Correspondencia: Dr. Miguel Ángel Conde Sendín. Secretaría de Neurología. Hospital General de Gran Canaria Dr. Negrín. Barranco de la Ballena-El Cardón, s/n. E-35020 Las Palmas de Gran Canaria. E-mail: mcondes@meditex.es 2002, REVISTA DE NEUROLOGÍA REV NEUROL 2002; 35 (4): 380-386 NEUROSÍFILIS INTRODUCCIÓN Se denomina neurosífilis a la afectación del sistema nervioso central (SNC) por Treponema pallidum, e incluye tanto las manifestaciones clínicas que de ella se derivan (neurosífilis sintomática) como aquellos casos en los que no se provoca ningún síntoma (neurosífilis asintomática). Aunque con frecuencia tiende a pensarse que éstas se producen únicamente en la fase terciaria (tabes dorsal y parálisis general progresiva), lo cierto es que aparecen manifestaciones neurológicas en cualquier estadio de la enfermedad, y se observa una relación entre el tiempo transcurrido desde la primoinfección y el síndrome clínico desarrollado. La sífilis ha sido y sigue siendo una enfermedad común. Desde las primeras descripciones de la enfermedad, hacia finales del siglo XV [1], su incidencia ha sufrido variaciones tanto a lo largo del tiempo como en diferentes áreas geográficas. Así, se presenta más frecuentemente en países poco desarrollados que en los industrializados [2,3]. Se estima que las regiones más afectadas en el mundo son el sur-sureste de Asia, África subsahariana y Latinoamérica, y las que menos, Europa occidental y Norteamérica. En cuanto a su evolución temporal, en los países industrializados se observó un descenso significativo del número de casos desde el descubrimiento de la penicilina, pero volvió a incrementarse en los años sesenta, con un nuevo aumento de la incidencia a partir de los años ochenta en relación con la actual pandemia de infección por el virus de inmunodeficiencia humana (VIH). Resulta complicado conocer los datos reales de incidencia y prevalencia, ya que los casos declarados habitualmente están infraestimados en una cuantía que no se conoce. Según los datos del Centro Nacional de Epidemiología, en España se declararon 1,77 casos nuevos de sífilis por cada 100.000 habitantes durante el año 2000 [4]; la incidencia más elevada fue en Melilla (24,46/ 100.000 hab.) y en Canarias (11,20/100.000 hab.) [5]. Más difícil aún es obtener datos fiables acerca de la incidencia real de la neurosífilis, pero se estima que puede presentarse en un 4-10% de los afectados por sífilis [6-8]. Figura 1. Evolución natural de la sífilis no tratada. Las formas que aparecen en los dos primeros años se denominan tempranas, y las posteriores, tardías. Tabla I. Principales síndromes clínicos que pueden aparecer en la neurosífilis. Formas precoces Asíntomática Meningitis Meningovascular Formas tardías Parálisis general Tabes dorsal Otras formas Goma PATOGENIA Y EVOLUCIÓN NATURAL DE LA SÍFILIS NO TRATADA El principal mecanismo de contagio de T. pallidum es el contacto sexual, si bien es posible la transmisión directa o indirecta no sexual por lesiones primarias o secundarias. Otras vías de contagio, más infrecuentes, son la sangre, a través de transfusiones, picaduras o cortes y por vía transplacentaria. Una vez que el treponema ha accedido al huésped, generalmente a través de lesiones cutáneas o mucosas, y tras un período de incubación de 10-90 días, se desarrolla el complejo primario de la sífilis denominado chancro primario, que consiste en una ulceración rojiza de bordes indurados y adenopatías en la zona ganglionar subsidiaria. También desde las primeras horas del contagio puede producirse una bacteriemia, muchas veces subclínica o con sintomatología inespecífica. En este estadio, se estima que en un 20% de los casos se produce invasión del líquido cefalorraquídeo (LCR) [9]. Tras curar el chancro, entre 6-12 semanas, se produce una diseminación sanguínea del treponema con linfadenopatías y exantema generalizados. Es el estadio secundario que se resuelve espontáneamente en cuatro semanas. En esta fase el treponema invade el sistema nervioso hasta en un 70% de los casos no tratados [9]. Posteriormente se entra en un período asintomático denominado lúes latente. Como las recidivas de la enfermedad y el riesgo REV NEUROL 2002; 35 (4): 380-386 Oculares Amiotrófica Lesión del VIII par craneal de sífilis congénita son altos durante los primeros dos años, la Clasificación Internacional de Enfermedades divide el período de latencia en fase latente temprana (menor de dos años de duración) y en fase latente tardía (mayor de dos años de duración). A partir de la fase latente puede volver a producirse un nuevo estadio secundario o bien aparecer una sífilis terciaria, que afectaría principalmente a los sistemas cardiovascular o nervioso. En la figura 1 se esquematiza la evolución natural de la sífilis. FORMAS CLÍNICAS Existen diversas formas de presentación clínica, unas muy características, como la tabes, y otras similares a algunas enfermedades neurológicas (sífilis vascular o meníngea). Como se esquematiza en la tabla I, las formas de presentación suelen dividirse en formas tempranas, entre ellas la afectación meníngea y vascular, y formas tardías, donde se incluyen aquellas con afectación del parénquima cerebral (parálisis general progresi- 381 M.A. CONDE-SENDÍN, ET AL va y tabes dorsal). Cada una de ellas tiene una relación temporal con la primoinfección, de forma que en función del tiempo transcurrido desde ésta, es más frecuente encontrar una u otra (Fig. 2). Con mucha frecuencia se encuentran varios de los síndromes clínicos combinados que constituyen formas de presentación complejas y heterogéneas. En las últimas décadas se ha comenzado a hablar sobre un cambio en las manifestaciones de la neurosífilis [8,10-13], que consiste en un aumento de las formas tempranas. Este hecho se atribuye al uso generalizado e indiscriminado de antibióticos y al elevado número de enfermos infectados por el VIH que, con frecuencia, también padecen esta enfermedad. Sin embargo, actualmente siguen presentándose las mismas formas clínicas de neurosífilis que se han descrito clásicamente: asintomática, meníngea, meningovascular, parálisis general progresiva y tabes dorsal. Tabes dorsal PGP Meningovascular Meningitis años 0 5 10 15 20 25 30 Neurosífilis asintomática Cerca de un 15% de los pacientes con sífilis primaria y hasta un 40% de los infectados por T. pallidum presentan anomalías del LCR [14]. El diagnóstico se realiza tras una punción lumbar en un paciente con sífilis, y se comprueba que existe una pleocitosis leve con proteinorraquia. El cuadro puede curar espontáneamente, sin bien las anomalías del LCR en pacientes asintomáticos con sífilis suponen un alto riesgo de desarrollar clínica neurológica. De ahí surge la importancia de realizar un estudio del LCR en los enfermos sifilíticos. Neurosífilis meníngea Es la más temprana de las formas clínicas. Ocurre generalmente durante el primer año de la infección y puede asociarse a lesiones cutáneas. Se presenta con cefalea, náuseas y vómitos. Según los síntomas que predominen, se distinguen tres variantes: 1. Hidrocefalia aguda sifilítica, en la que existe cefalea, náuseas y vómitos, sin signos focales; 2. Meningitis aguda del vértex, en la que se presentan signos de afectación cortical (crisis convulsivas, déficit focales como hemiplejía o afasia, confusión o delirio), y 3. Meningitis aguda basal, en la que quedan afectados principalmente los pares craneales (VII y VIII más frecuentemente, seguido del II y los oculomotores). Neurosífilis meningovascular Es la forma clínica más frecuente (10-12% en las series antiguas) [15]. Habitualmente se combinan la forma vascular con inflamación meníngea. Ocurre entre los primeros meses y los 12 años tras la infección. En más de un 50% de los casos comienza con un período prodrómico de semanas o meses de duración, que consiste en cefalea, vértigo, cambios de personalidad, insomnio o crisis. Posteriormente aparece el cuadro vascular cuya clínica es superponible a la de otros cuadros cerebrovasculares, salvo por la edad de presentación, que suele ser antes de los 50 años. Con más frecuencia queda afectado el territorio de la arteria cerebral media, aunque también es posible en otros territorios vasculares cerebrales o medulares. De manera anatomopatológica se distinguen dos formas de sífilis meningovascular: aquella que afecta a vasos grandes y medianos –arteritis de Heubner– y la que afecta a las arteriolas –arteritis de Nissl–. En ambos casos existe inicialmente una infiltración de linfocitos y células plasmáticas en la pared de los vasos. Progresivamente, el proceso inflamatorio destruye las fibras elásticas y musculares de la capa media, y al final, si 382 Figura 2. Relación temporal entre los principales síndromes clínicos de la neurosífilis y la infección por T. pallidum. La fecha del contagio se marca como punto 0. PGP: parálisis general progresiva. no se impone tratamiento, se produce una proliferación fibrosa subendotelial que provoca una oclusión irreversible de la luz vascular. Parálisis general progresiva En tiempos pasados constituyó una de las causas más frecuentes de ingreso en las instituciones psiquiátricas. En nuestros días ha pasado a ser una forma de presentación infrecuente. Ocurre a los 15-20 años tras la primoinfección. El síndrome se instaura de forma insidiosa y comienza frecuentemente con trastornos psiquiátricos poco específicos: irritabilidad, dificultad en la concentración, labilidad emocional o ideación delirante. En estas fases el examen neurológico puede ser normal. Más adelante se instaura una demencia franca con temblor y disartria y, en fases finales, se asocian crisis convulsivas, pérdida de fuerza en las extremidades e incontinencia anal y vesical. En el estudio macroscópico se observa una atrofia cerebral global con aumento del tamaño de los ventrículos, mientras que el microscópico se caracteriza por una pérdida de neuronas con gliosis. En algunos casos se pueden poner de manifiesto espiroquetas en la corteza cerebral mediante tinciones de plata. Las meninges suelen estar engrosadas con cambios inflamatorios crónicos. Tabes dorsal Es la forma de aparición más tardía (18-25 años tras la infección). El cuadro consiste en dolores lancinantes episódicos en los miembros inferiores, que se distribuyen en territorios de múltiples raíces lumbares. Un 20% experimentan crisis viscerales caracterizadas por episodios de dolor abdominal. Posteriormente aparecen parestesias con pérdida de la sensibilidad profunda, dolorosa y pérdida de reflejos osteotendinosos. Otros hallazgos tardíos son pérdida de la continencia urinaria y ataxia. En el estudio anatomopatológico macroscópico se observa una importante atrofia de los cordones medulares posteriores y de la raíz dorsal del nervio raquídeo, junto con un engrosamiento de las meninges en la zona afectada (habitualmente la región lumbar). En el análisis microscópico las áreas dañadas muestran una disminución del número de neuronas y cambios inflamatorios con infiltración de linfocitos y células plasmáticas. Muy raramen- REV NEUROL 2002; 35 (4): 380-386 NEUROSÍFILIS te se observan treponemas en el tejido afectado, y es la forma que con más frecuencia tiene ausencia de pleocitosis y negatividad en la serología luética (VDRL, del inglés Veneral Disease Research Laboratory) en el LCR [15]. Goma del SNC El goma es una formación nodular granulomatosa. Puede aparecer en cualquier estadio de la sífilis y localizarse en cualquier parte del organismo: piel, hueso, vísceras abdominales, etc. Aunque no es en sí una forma específica de la sífilis del SNC, se incluye en la neurosífilis la presencia de gomas en el SNC. Formadas a partir de la piamadre, pueden encontrarse en cualquier territorio del SNC, y se observan macroscópicamente como una masa blanda, bien delimitada y de tamaño variable (desde pocos milímetros hasta varios centímetros). Microscópicamente es un infiltrado inflamatorio crónico e inespecífico compuesto por linfocitos y células plasmáticas; pueden observarse treponemas utilizando tinciones de plata o por inmunofluorescencia. La clínica se produce por el efecto masa de la lesión, en el que la localización medular es la más frecuente. El diagnóstico es por tomografía axial computarizada (TAC) o por resonancia magnética (RM), aunque habitualmente, dada la rareza de los casos, se diagnostica mediante biopsia. Otras formas Se han descrito otras formas de presentación de neurosífilis. En muchos casos pueden clasificarse como formas oligosintomáticas de las ya descritas, aunque algunas de ellas por sus características clínicas y patológicas puede constituirse como una entidad diferente. – Formas oculares: aparecen manifestaciones como la uveítis, coriorretinitis o queratitis. Son características las anomalías pupilares, como la pupila de Argyll-Robertson o anisocoria. La neuritis óptica luética suele asociarse a la meningitis y la atrofia óptica sifilítica es secuela de una meningitis. – Amiotrofia sifilítica: se trata de una paquimeningitis hipertrófica que se asienta principalmente en la médula cervical, y provoca compresión extrínseca que se expresa como dolor radicular y atrofia en los miembros superiores, con piramidalismo y síntomas cordonales en las extremidades inferiores. – Lesión del VIII par craneal: se debe a una meningitis basal. Puede combinar daño vestibular y coclear y, antiguamente, fue causa frecuente del síndrome de Menière. En resumen, como se ha descrito, las formas de presentación clínica de la neurosífilis abarcan diversos patrones tanto por su perfil temporal como por su perfil clínico. Así, puede presentarse en forma ictal (cuadros meningovasculares), recurrente (crisis convulsivas o cuadros focales vasculares repetidos) y también de forma progresiva (parálisis general progresiva o mielopatías). En cuanto a su perfil sindrómico, puede presentarse como un deterioro cognitivo progresivo parecido a la enfermedad de Alzheimer, como un cuadro focal agudo similar a un ictus o como un cuadro multifocal recurrente parecido a una esclerosis múltiple; incluso se han descrito formas de presentación como una enfermedad de motoneurona [16,17]. Este enorme polimorfismo hace que esta enfermedad, que le ha valido el nombre de ‘gran simuladora’, haya de tenerse en cuenta en casi todos los diagnósticos diferenciales en neurología. REV NEUROL 2002; 35 (4): 380-386 DIAGNÓSTICO El diagnóstico se basa en las características clínicas junto con las anomalías bioquímicas y serológicas del LCR. Sólo en contados casos, como el goma o las formas meningovasculares, la TAC y la RM pueden tener valor diagnóstico. La principal utilidad de las técnicas de neuroimagen es descartar otras enfermedades neurológicas que podrían cursar con un cuadro clínico similar. – Anomalías del LCR. El recuento de células muestra una pleocitosis linfocitaria leve (5-100 cél/campo) salvo en la meningitis, que puede ser más elevado, y en la tabes, que suele ser normal. La glucorraquia es normal excepto en la meningitis, en la que puede estar ligeramente descendida. Las proteínas experimentan un aumento moderado (45-200 mg/dL) en todas las formas salvo en la tabes dorsal, que suelen ser normales. Es frecuente encontrar bandas oligoclonales y producción intratecal de inmunoglobulinas (Ig) con aumento de los índices Ig/albúmina. – Pruebas serológicas. El patrón de referencia para confirmar la enfermedad sigue siendo la inoculación en un testículo de conejo, capaz de detectar hasta 10 treponemas en inoculado. Es una prueba relativamente cara y que precisa tres meses para evaluar sus resultados, por lo que habitualmente no se practica. Por todo ello, hoy en día las pruebas serológicas de detección de anticuerpos en la sangre y en el LCR siguen siendo el principal apoyo para el diagnóstico en la práctica clínica. Éstas son de dos tipos: pruebas reagínicas (inespecíficas), que ponen en evidencia la presencia de anticuerpos antilipoideos, y pruebas treponémicas (específicas), que detectan anticuerpos contra el treponema. Entre las primeras, las más utilizadas son la prueba de la reagina plasmática (RPR, del inglés Rapid plasma reagin) y el VDRL, y entre las segundas, el índice de ácido tetrahidroptérico (THPA, tetrahydropteric acid) y la prueba para la detección de anticuerpos treponémicos fluorescentes (FTA, fluorescent treponemal antibody test) o la prueba de absorción de anticuerpos treponémicos fluorescentes (FTA-Abs, fluorescent treponemal antibodyabsorption). En general, en la sífilis temprana, la FTA es la primera prueba que se revela positiva; en las formas secundarias todos los tests son fuertemente positivos, pero en los períodos de latencia y formas terciarias, las pruebas reagínicas son positivas en un 70% y las treponémicas en un 80-100% (especialmente la FTA-Abs). Por lo tanto, una FTA negativa excluye el diagnóstico de neurolúes y una FTA positiva hace necesaria la realización de una punción lumbar para descartar la afectación del SNC por T. pallidum. Transitoria o crónicamente para las pruebas reagínicas, puede haber falsos positivos, que generalmente se producen con valores inferiores a 1/8 [18]. Las pruebas treponémicas pueden dar lugar también a falsos positivos en enfermedades que cursan con trastorno de los niveles séricos de inmunoglobulinas (artritis reumatoide, anemia hemolítica o cirrosis hepática) y en el embarazo [18,19]. En el LCR, el VDRL es muy específico para el diagnóstico de neurolúes, con un valor cercano al 100% [20] (puede haber algún falso positivo por una punción muy traumática), pero su sensibilidad es muy baja (40-60%) [21]. Esta especificidad lo convierte en el test de elección para el diagnóstico de neurolúes, aunque por su baja sensibilidad su negatividad no excluye la enfermedad. La FTA-Abs en el LCR es mucho más sensible que el VDRL, si bien 383 M.A. CONDE-SENDÍN, ET AL pueden darse falsos positivos con mucha frecuencia debido al paso de anticuerpos a través de la barrera hematoencefálica o por punciones lumbares traumáticas. Con el fin de evitar estos falsos positivos, se han diseñado unos índices de pruebas treponémicas que estiman la producción intratecal de anticuerpos [22]; el más sencillo es el llamado cociente THPA, que se obtiene a partir del siguiente cálculo [23]: Índice THPA = = Valor TPHA en el LCR / (Cociente de albúmina × 1.000), siendo el cociente de albúmina la división entre la concentración de albúmina en el LCR (mg/dL) y la concentración plasmática de albúmina (mg/dL). Un resultado de entre 70 y 500 indica probable neurosífilis activa y un índice mayor de 500 es prácticamente diagnóstico [22]. La especificidad de este índice es alta, pero su sensibilidad no lo es tanto [22,24]. Recientemente se están desarrollando tests diagnósticos para la sífilis basados en la detección del ADN del treponema por reacción en cadena de la polimerasa (PCR) [25-28]. Estas técnicas, además de ser muy sensibles y específicas, son más rápidas que las de la inoculación en un conejo. Sin embargo, actualmente no es posible disponer de estas pruebas en la práctica clínica diaria, cuyo uso queda prácticamente restringido a la investigación. Ante la enorme variabilidad de las distintas formas clínicas y la dificultad de interpretación de las pruebas serológicas, algunos autores han establecido criterios para el diagnóstico de la enfermedad [29-31]. Basándonos en nuestra experiencia [32], y en la sensibilidad y especificidad de las pruebas serológicas en la sangre y en el LCR, nosotros utilizamos en nuestra práctica clínica diaria los siguientes criterios: A) Neurosífilis definida: – Pruebas treponémicas positivas en sangre. – VDRL positivo en el LCR. B) Neurosífilis probable: – Pruebas treponémicas positivas en la sangre. – Pruebas treponémicas positivas en el LCR. – Presencia en el LCR de >45 mg/dL de proteínas o >5 leucocitos/mm3. – Se han descartado otras causas de hiperproteinorraquia y pleocitosis diferentes de la sífilis. Si se dispone de la titulación de anticuerpos (TPHA) se pueden utilizar los índices señalados previamente. A veces puede ser de ayuda la realización de una punción lumbar en los días posteriores al inicio del tratamiento con penicilina, ya que se ha comprobado que pruebas reagínicas previamente negativas pueden hacerse positivas, e incluso puede aparecer una mayor pleocitosis e hiperproteinorraquia que contribuirían a definir el diagnóstico [29,33,34]. TRATAMIENTO A pesar de las dificultades diagnósticas que se presentan con frecuencia, se recomienda iniciar el tratamiento tanto en aquellos pacientes con neurosífilis definida como en los que presentan criterios de neurosífilis probable. El tratamiento tiene como objetivo principal conseguir niveles antibióticos treponemicidas en el SNC durante el ciclo de 384 Tabla II. Evolución habitual de los hallazgos del LCR cuando el tratamiento antibiótico es eficaz. 3 meses 6 meses 12 meses 24 meses Resuelta Células < N N N N Proteínas < << N N N VDRL < << <<< <1/4 <1/4 VDRL: Veneral Disease Research Laboratory. reproducción del germen, que es largo e irregular en las formas tardías. Por ello, el tratamiento deberá ser prolongado y se utilizarán dosis elevadas de antibióticos administradas en bolos (debe evitarse la perfusión continua al no permitir conseguir elevados picos plasmáticos y, por lo tanto, disminuir el paso del antibiótico a través de la barrera hematoencefálica). Se recomiendan las siguientes pautas: 1. Penicilina G sódica IV, en dosis de 12.000.000-24.000.000 UI diarias, repartidas en seis dosis. 2. Para evitar el elevado coste que supone el ingreso hospitalario de un paciente para recibir tratamiento intravenoso, algunos autores plantean la administración de 2.400.000 UI de penicilina procaína IM diarias más probenecid (500 mg/6 h VO). Esta combinación puede alcanzar niveles elevados de penicilina en el LCR [35], pero en general tiene menos adeptos que la primera pauta. 3. Ceftriaxona IV en dosis de 1 g/día. El tratamiento se mantiene durante 10-14 días. Posteriormente se sigue de 2.400.000 UI semanales (en una dosis semanal) de penicilina benzatina IM durante tres semanas. En los casos de alergia a la penicilina debería intentarse la desensibilización y un posterior tratamiento con ella. De no ser posible, se recomienda la pauta de ceftriaxona, tras el correspondiente estudio de sensibilidad, y, en último caso, cloranfenicol (1 g/6 h IV durante 14 días) o eritromicina (500 mg/6 h IV durante 10 días). En una enfermedad en la que se producen recidivas con frecuencia, tan importante como el tratamiento es el seguimiento posterior, con el fin de detectar aquellos fracasos terapéuticos. Se recomienda el estudio del LCR a los 3, 6, 12 y 24 meses tras el tratamiento. La celularidad puede aumentar en las dos primeras semanas, pero debe descender a los tres meses y haber desaparecido a los seis meses. Las proteínas tienen que descender hasta normalizarse antes del año. Los títulos de VDRL en el LCR deben desaparecer o descender cuatro veces su valor, aunque es posible que queden positivos con títulos bajos (inferiores a 1/4) durante muchos años [36]. Los valores de anticuerpos antitreponémicos descienden, pero raramente llegan a desaparecer; el índice de THPA se hace menor de 70. En la tabla II se resumen los valores que deben esperarse en los parámetros del LCR cuando el tratamiento antibiótico es eficaz. Si durante el seguimiento no se observase esta evolución del LCR o empeorase la clínica, se procederá de nuevo al tratamiento con la misma pauta descrita durante 14 días. NEUROSÍFILIS E INFECCIÓN POR VIH Estudios epidemiológicos han demostrado que una historia de enfermedad de transmisión sexual, incluida la sífilis, se asocia REV NEUROL 2002; 35 (4): 380-386 NEUROSÍFILIS al riesgo de infección por el VIH entre homosexuales y heterosexuales, probablemente debido a que las conductas sexuales que incrementan el riesgo de otras enfermedades venéreas también aumentan la probabilidad de adquirir el VIH. Además, las enfermedades de transmisión sexual causan ulceraciones genitales que facilitan la infección por el VIH. Recientemente se ha sugerido que la infección por el VIH puede alterar la historia natural de la sífilis, así como la dosis o duración del tratamiento requerido para su curación [37]. La incidencia real de la sífilis, y especialmente de la neurosífilis, es desconocida en los pacientes con infección por el VIH, debido a que muchos pacientes con sífilis no son testados serológicamente para el VIH y a que dichas condiciones no se comunican en la mayoría de ocasiones. Algunos autores americanos han estimado, en cohortes de pacientes infectados por el VIH, una prevalencia del 10-30% para la sífilis y del 1% para la neurosífilis [38,39]. Las manifestaciones neurológicas de la sífilis en los pacientes coinfectados por el VIH son similares a las que aparecen en personas sin dicha infección, aunque probablemente son más frecuentes y aparecen en estadios más tempranos [40,41]. La mayoría de los casos de neurosífilis sintomática en pacientes con infección por el VIH han sido formas tempranas, como la meningitis sifilítica aguda y la sífilis meningovascular. No obstante, también se han descrito pacientes con tabes, meningomielitis sifilítica con paraparesia espástica y parálisis general progresiva. Es preciso destacar la importancia de una cuidadosa valoración neurológica en cualquier paciente con sífilis o con infección por el VIH. El diagnóstico de la sífilis puede ser complicado en los pacientes con infección VIH, ya que los individuos positivos para el VIH pueden, en sus pruebas reagínicas, dar falsos positivos sin padecer sífilis [42]. También se ha descrito ausencia de reactividad en los tests realizados, tanto en la sangre [43,44] como en el LCR [33] en pacientes con sífilis demostrada. Todo ello complica el diagnóstico debido a la ausencia de pruebas alternativas disponibles y la dificultad de distinguir entre las manifestaciones neurológicas causadas por el T. pallidum, por el propio VIH o por diferentes patógenos oportunistas. Se deberán realizar estudios serológicos en todos los pacientes en los que se sospeche la presencia de sífilis y en todos los individuos positivos para el VIH. Se recomienda el examen del LCR en todos estos pacientes positivos con sífilis latente, con trastornos neuropsiquiátricos y en los que no se obtenga la respuesta serológica esperada después del tratamiento de una sífilis temprana. Hasta que dispongamos de mejores pruebas diagnósticas, deberemos tratar como neurosífilis los casos con trastornos bioquímicos licuorales sugestivos, aunque el VDRL sea negativo, después de descartar otras posibles etiologías. El tratamiento de elección de los pacientes con infección por VIH y neurosífilis sintomática es la penicilina G cristalina acuosa en dosis de 12-24 millones de unidades diarias durante un mínimo de 14 días. Los pacientes alérgicos a la penicilina se someterán a desensibilización si las pruebas cutáneas confirman la alergia. La mayoría de los expertos recomiendan completar el tratamiento con penicilina G benzatina intramuscular. La eficacia de regímenes terapéuticos que contengan tetraciclinas o cefalosporinas no se ha demostrado en los pacientes con neurosífilis coinfectados por el VIH. Después del tratamiento se deberá realizar un seguimiento mediante punciones lumbares de repetición y repetir éste si la evolución licuoral no es adecuada. CONCLUSIONES La neurosífilis es una antigua enfermedad que todavía se presenta en nuestros días y provoca muy variados síndromes; ello hace que, con frecuencia, deba tenerse en cuenta en el diagnóstico diferencial de numerosas enfermedades neurológicas y psiquiátricas. A esta variabilidad sindrómica hay que añadir otra serie de inconvenientes, como la ausencia de una prueba diagnóstica rápida y eficaz para su detección, la frecuencia con que ocurren los fracasos terapéuticos a pesar de utilizar los antibióticos indicados y, recientemente, las modificaciones que la infección por el VIH produce en su evolución, diagnóstico y pronóstico. Todo ello, y el olvido por parte de muchos médicos de una enfermedad que se cree que ‘pertenece a tiempos pasados’, hacen que con frecuencia existan dificultades en su manejo clínico que, en nuestra opinión, se presentan fundamentalmente a la hora de interpretar las pruebas diagnósticas y del seguimiento después del tratamiento. Asimismo, el uso frecuente de las pruebas serológicas para la sífilis en las consultas de neurología podría ser muy útil como método de cribado para la detección de estos casos sin provocar un elevado coste sanitario. BIBLIOGRAFÍA al infections. In Bradley WG, Daroff RB, Fenichel GM, Marsden CD, 1. Sparling PF. Natural history of syphilis. In Holmes KK, Mardh PA, Saeds. Neurology in clinical practice. Boston: Butterworth Heinemann; 1999. parling PF, et al, eds. Sexually transmitted disease. 2 ed. New York: p. 1317-51. McGraw-Hill; 1990. p. 213-9. 9. Hook EW III, Marra CM. Acquired syphilis in adults. N Engl J Med 1992; 2. DeSchryver A, Mcheus A. Epidemiology of sexually transmitted diseases: the global picture. Bull World Health Organ 1990; 68: 639-54. 326: 1060-9. 10. Joffe R, Black MM, Floyd M. Changing clinical picture of neurosyphilis: 3. Gerbase AC, Rowley JT, Mertens TE. Global epidemiology of sexually report of seven unusual cases. Br Med J 1968; 1: 211-2. transmitted diseases. Lancet 1998; 351 (Suppl 3): S2-4. 11. Burke JM, Schaberg DR. Neurosyphilis in the antibiotic era. Neurology 4. Área de vigilancia epidemiológica, Centro Nacional de Epidemiología. 1985; 35: 1368-71. Comentario epidemiológico de las enfermedades de declaración obliga12. Musher DM, Hamill RJ, Baughn RE. Effect of human immunodeficientoria y Sistema de Información Microbiológica. España. Año 2000. Bocy virus HIV infection on the course of syphilis and on the response to letín Epidemiológico Semanal 2001; 9: 101-5. treatment. Ann Intern Med 1990; 113: 872-81. 5. Área de vigilancia epidemiológica, Centro Nacional de Epidemiología. Incidencia de las enfermedades transmisibles de declaración obligatoria, 13. Hook EW III. Syphilis. In Scheld WM, Whitley RJ, Durack DT, eds. Infections of the central nervous system. Philadelphia: Lippincott-Raven; casos y tasas por 100.000 habitantes a nivel provincial/CCAA. España. 1997. p. 669-84. Año 2000. Boletín Epidemiológico Semanal 2001; 9: 106-7. 14. Goodman LJ, Karakusis PH. Neurosyphilis. In Harris AA, ed. Handbook 6. Gjestland T. The Oslo study of untreated syphilis. Acta Dermatol Veneof clinical neurology. Vol. 8. Microbial disease. Amsterdam: Elsevier orol 1955; 35 (Suppl 34): S11-36. Science Publishers; 1988. p. 273-87. 7. Rowland LP. Spirochete infections: neurosyphilis. In Rowland LP, ed. 15. Merrit HH, Adams JW, Solomon HC. Neurosyphilis. New York: Oxford Merrit’s textbook of neurology. Baltimore: Williams & Wilkins; 1985. p. University Press; 1946. 200-8. 8. Solbrig MV, Healy JF, Jay CA. Infections of the nervous system: bacteri16. El Alaoui-Faris M, Medejel A, Al Zemmouri K, Yahyaoui M, Chkili T. REV NEUROL 2002; 35 (4): 380-386 385 M.A. CONDE-SENDÍN, ET AL Amyotrophic lateral sclerosis syndrome of syphilitic origin. 5 cases. Rev Neurol (Paris) 1990; 146: 41-4. Karlov VA, Sorokina ND, Drozhzhina GR. A case of late onset cerebrospinal meningovascular syphilis with amyotrophic lateral sclerosis syndrome. Zh Nevrol Psikhiatr Im S S Korsakova 2001; 101: 41-3. Sparling PF. Diagnosis and treatment of syphilis. N Engl J Med 1971; 284: 642-53. Jones RR, Pusey C, Schifferli J, Johnston NA. Essential mixed cryoglobulinaemia with false-positive serological tests for syphilis. Br J Vener Dis 1983; 59: 33-6. Izzat NN, Bartruff JK, Glicksman JM, Holder WR, Knox JM. Validity of the VDRL test on cerebrospinal fluid contaminated by blood. Br J Vener Dis 1971; 47: 162-4. Lukehart SA, Hook, EW III, Baker-Zander, SA, Collier AC, Crichlow CW, Handsfiel HH. Invasion of the central nervous system by Treponema pallidum: implications for diagnosis and treatment. Ann Intern Med 1988; 109: 855-62. Luger A, Schmidt BL, Kaulich M. Significance of laboratory findings for the diagnosis o neurosyphilis. Int J STD AIDS 2000; 11: 224-34. Luger A, Schmidt BL, Steyrer K. Neurosyphilis a retrospective evaluation of 22 cases (WHO/INT/VDT/80.316). Geneva: World Health Organization; 1980. Molins A, Malagelada A. Neuroinfecciones por bacterias. In Codina-Puiggrós A, ed. Tratado de Neurología. Madrid: ELA; 1994. p. 189-97. Grimprel E, Sánchez PJ, Wendel GD, Burstain JM, McCraken GH, Radolf JD, et al. Use of polymerase chain reaction and rabbit infectivity testing to detect Treponema pallidum in amniotic fluid, fetal and neonatal sera and cerebrospinal fluid. J Clin Microbiol 1991; 29: 1711-8. Zoechling N, Schluepen EM, Soyer HP, Kerl H, Volkenandt M. Molecular detection of Treponema pallidum in secondary and tertiary syphilis. Br J Dermatol 1997; 136: 683-6. Beyrer C, Jitwatcharanan K, Natpratan C, Kaewvichit R, Nelson KE, Chen CY, et al. Molecular methods for the diagnosis of genital ulcer disease in a sexually transmitted disease clinic population in northern Thailand: predominance of herpes simplex virus infection. J Infect Dis 1998; 178: 243-6. Liu H, Rodes B, Chen CY, Steiner B. New tests for syphilis: rational design of a PCR method for detection of Treponema pallidum in clinical specimens using unique regions of the DNA polymerase I gene. J Clin Microbiol 2001; 39: 1941-6. Hooshmand H, Escobar MR, Kopf SW. Neurosyphilis. A study of 241 patients. JAMA 1972; 219: 726-9. 30. Bracero L, Wormser GP, Bottone EJ. Serologic tests for syphilis: a guide to interpretation in various stages o disease. Mt Sinai J Med (NY) 1979; 46: 289-92. 31. Simon RP. Neurosyphilis. Arch Neurol 1985; 42: 606-13. 32. Conde MA, López JC, Pérez-Vieitez MC, Alemany MJ, Aladro Y, Cubero A. Neurosífilis en pacientes inmunocompetentes: análisis retrospectivo. Rev Neurol 1998; 27: 696. 33. Feraru ER, Aronow HA, Lipton RB. Neurosyphilis in AIDS patients: initial CSF VDRL may be negative. Neurology 1990; 40: 541-3. 34. Conde-Sendín MA, Pérez AL, Fernández-Sanfield ML, Fernández-Martín FM. Sífilis meningovascular: positivización de las pruebas serológicas tras tratamiento con penicilina. Rev Neurol 1993; 8: 81-4. 35. van der Valk PG, Kraai EJ, van Voorst-Vader PC, Haaxma-Reiche H, Snijder JA. Penicillin concentrations in cerebrospinal fluid (CSF) during repository treatment regimen for syphilis. Genitourin Med 1988; 64: 223-5. 36. Larsen SA, Steiner BM, Rudolph AH. Laboratory diagnosis and interpretation of tests for syphilis. Clin Microbiol Rev 1995; 8: 1-21. 37. Johns DR, Tierney M, Felsenstein D. Alteration in the natural history of neurosyphilis by concurrent infection with the human immunodeficiency virus. N Engl J Med 1987; 316: 1569-72. 38. Brandon WR, Boulos LM, Morse A. Determining the prevalence of neurosyphilis in a cohort co-infected with HIV. Int J STD AIDS 1993; 4: 99-101. 39. Inungu J, Morse A, Gordon C. Neurosyphilis during the AIDS epidemic, New Orleans, 1990-1997. J Infect Dis 1998; 178: 1229. 40. Flood JM, Weinstock HS, Guroy ME, Bayne L, Simon RP, Bolan G. Neurosyphilis during the AIDS epidemic, San Francisco, 1985-1992. J Infect Dis 1998; 177: 931-40. 41. Katz DA, Berger JR, Duncan RC. Neurosyphilis. A comparative study of the effects of infection with human immunodeficiency virus. Arch Neurol 1993; 50: 243-9. 42. Rompalo AM, Cannon RO, Quinn TC, Hook EW III. Association of biologic false-positive reactions for syphilis with human immunodeficiency virus infection. J Infect Dis 1992; 165: 1124-6. 43. Hicks CB, Benson PM, Lupton GP, Tramont EC. Seronegative secondary syphilis in a patient infected with the human immunodeficiency virus (HIV) with Kaposi sarcoma. A diagnostic dilemma. Ann Intern Med 1987; 107: 492-5. 44. Tikjob G, Russel M, Petersen CS, Gerstoft J, Kobayasi T. Seronegative secondary syphilis in a patient with AIDS: identification of Treponema pallidum in biopsy specimen. J Am Acad Dermatol 1991; 24: 506-8. NEUROSÍFILIS: FORMAS DE PRESENTACIÓN Y MANEJO CLÍNICO Resumen. Introducción y objetivo. La neurosífilis es la afectación del sistema nervioso central por Treponema pallidum. Provoca diversos cuadros clínicos que, en ocasiones, son similares a otras enfermedades neurológicas más conocidas. En este artículo se pretende dar una visión clínica global de esta entidad revisando sus formas de presentación y su manejo diagnóstico y terapéutico. Desarrollo. Las formas de presentación de la neurosífilis se agrupan en dos: precoces (neurosífilis asintomática, meníngea y meningovascular) y tardías (parálisis general progresiva y tabes dorsal). Además se han descrito otras de menor importancia, como el goma, formas oculares, amiotrofia sifilítica o hipoacusia. El diagnóstico es complejo y se basa en el estudio del líquido cefalorraquídeo. Debido a la dificultad para hacer un diagnóstico con certeza se han establecido diferentes criterios diagnósticos, en los que juega un papel fundamental la serología para T. pallidum. El tratamiento más eficaz es la penicilina, que en ocasiones puede no ser efectivo, por lo que se recomienda un seguimiento posterior clínico y licuoral. Finalmente, se describen los cambios en la incidencia y presentación clínica, así como las dificultades diagnósticas que pueden darse en los enfermos portadores del VIH que además sufran esta enfermedad. Conclusiones. La neurosífilis es una enfermedad aún presente en nuestros días, que ha de tenerse en cuenta como diagnóstico diferencial en múltiples enfermedades neurológicas y psiquiátricas dado su polimorfismo clínico. Este hecho, la difícil interpretación de los tests serológicos y su irregular respuesta al tratamiento habitual suponen una dificultad para su manejo, y para el neurólogo, la necesidad de conocerla con detalle. [REV NEUROL 2002; 35: 380-6] Palabras clave. Goma. Neurosífilis. Parálisis general progresiva. Sífilis asintomática. Sífilis meníngea. Sífilis meningovascular. Tabes dorsal. Treponema pallidum. NEUROSÍFILIS: FORMAS DE APRESENTAÇÃO E ABORDAGEM CLÍNICA Resumo. Introdução e objectivo. A neurosífilis é o envolvimento do sistema nervoso central por Treponema pallidum. Provoca diversos quadros clínicos que, por vezes, são semelhantes a outras doenças neurológicas mais conhecidas. Neste artigo pretende-se dar uma visão clínica global desta entidade, revendo as suas formas de apresentação e a sua abordagem diagnóstica e terapêutica. Desenvolvimento. As formas de apresentação da neurosífilis dividem-se em dois grupos: precoces (neurosífilis assintomática, meníngea e meningovascular) e tardias (paralisia geral progressiva e tabes dorsal). Além disso, foram descritas outras de menor importância como a goma, formas oculares, amiotrofia sifilítica ou hipacusia. O diagnóstico é complexo e baseiase no estudo do líquido cefalorraquidiano. Dada a dificuldade para fazer um diagnóstico correcto, estabeleceram-se diversos critérios de diagnóstico em que a serologia para T. pallidum representa um papel importante. O tratamento mais eficaz é a penicilina, que por vezes pode não ser eficaz, pelo que recomenda-se um seguimento posterior clínico e humoral. Descrevem-se, por fim, as alterações na incidência e na apresentação clínica e as dificuldades de diagnóstico que podem ocorrer nos doentes infectados pelo VIH, que além do resto padecem esta doença. Conclusões. A neurosífilis é uma doença ainda presente aos nossos dias que se deve ter em conta como diagnóstico diferencial em múltiplas doenças neurológicas e psiquiátricas dado o seu polimorfismo clínico; este facto, a difícil interpretação dos testes serológicos e a sua irregular resposta ao tratamento habitual supõem uma dificuldade para o seu trato e, para o neurologista, a necessidade de conhecê-la pormenorizadamente. [REV NEUROL 2002; 35: 380-6] Palavras chave. Goma. Neurosífilis. Paralisia geral progressiva. Sífilis assintomática. Sífilis meníngea. Sífilis meningovascular. Tabes dorsal. Treponema pallidum. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 386 REV NEUROL 2002; 35 (4): 380-386