Ejercicios extra para practicar el primer parcial
Anuncio

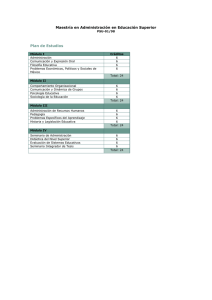
Ejercicios extra para practicar el primer parcial Departamento de Química Física. Facultad de Farmacia. Aspectos previos a tener en cuenta para el parcial a) Se debe utilizar siempre las cifras significativas adecuadas (leer el Seminario 1, pp.1-9). Siendo de obligado cumplimiento las “reglas prácticas para los cálculos” (Seminario 1, p.9). b) Es obligatorio “arrastrar” siempre las unidades de las magnitudes al hacer los cálculos (Seminario 1, pp.10-11), dando el resultado final siempre con sus unidades correspondientes. c) Al hacer una gráfica deben de seguirse los “convenios para elaboración de gráficas” (Seminario 1, pp.12-15). d) Conviene disponer de una calculadora que permita hacer el ajuste de una recta por regresión lineal (Seminario 1, pp.16-17). 1. Resolvamos algún ejercicio extra para el primer parcial: Ejercicio 1 Un estudio cinético de la hidrólisis de homatropina en medio ácido y temperatura de 90.0 ºC proporcionó los siguientes resultados: tiempo / h Homatropina / µM 0.00 100.0 3.00 85.2 6.00 73.0 8.60 63.1 12.00 52.5 a) Encuentre el orden de la reacción mediante el método de integración aplicado numéricamente. b) Determine el valor de la constante de velocidad mediante un método gráfico. c) Asumiendo para esta reacción una energía de activación de 70.0 kJ/mol, ¿cuánto valdrá la constante de velocidad a 25.0 ºC?. Calcule el tiempo de caducidad, a 25.0 ºC, de una disolución de homotropina en medio ácido, si se considera que el mínimo de concentración para descartar la disolución es el 90% de la inicial. Solución: a) orden uno, k=0.0533 h -1 b) k=0.053 h-1 c) k(25.0ºC)=3.41·10 -4 h-1, tc=309 h. Ejercicio 2 En un estudio de cinética enzimática llevado a cabo con la enzima L-Histidina amoniaco liasa y su sustrato natural, se obtuvieron los siguientes resultados a la temperatura de 37.0 ºC: [S] / 10-3 M v / 10-3 µmol L-1 min-1 10.0 58.7 12.5 68.3 16.7 82.0 25.0 101.5 50.0 134.2 a) Calcúlese, graficamente, la velocidad máxima y la constante de Michaelis de la enzima a esa temperatura. b) Calcúlese el número de recambio (constante k2 ) de la enzima a esa temperatura, sabiendo que la concentración de enzima empleada en la experiencia fue de 0.040 mg/L y que su masa molecular es de 9.00 .104 g/mol Solución: a) Vmax=0.20 b) k2=7.5 s -1 mol/L min , Km=0.024 M 2. Responda a estas preguntas: 1) Suponiendo que la reacción A d productos fuese de orden 0, deduzca su ecuación integrada de velocidad y explique como se determinaría su constante de velocidad. 2) Escriba la ecuación de Arrhenius y comente lo que significan sus parámetros. 3) Suponiendo que la reacción A d P experimenta catálisis ácido-base específica y reacción no catalizada, escriba la ecuación de velociad correspondiente y su comportamiento en un gráfico log k − pH. 4) Escriba el mecanismo de reacción de una inhibición enzimática competitiva, su ecuación de velocidad y explique cómo es su representación en el espacio doble inverso de Lineweaver-Burk.