Productos Necesarios para Diabeticos
Anuncio

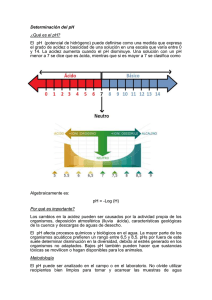
ECIAL PRODUCTOS NECESARIOS PARA DIABÉTICOS Incidentes con Medidores de Glucosa & Tiras Reactivas Las tiras reactivas más bien causan problemas. de Dr. Rüdiger Siekmeier & Dr. Johannes Lütz Resumen Desde el año 1999 hasta el año 2005 el BfArM ha recibido 653 reportes sobre diagnósticos in vitro (IVD). 127 de estos reportes afectan dispositivos y tiras reactivas para la determinación de glucosa en la sangre. Los reportes recibidos vinieron por parte de los usuarios y fabricantes en igual frecuencia (44,8 % y 44,1 % respectivamente). En 31 casos el defecto del producto no pudo ser comprobado y en 34 casos se mostraron defectos no causados por el usuario. Los casos restantes se deben a errores de aplicación (29) o todavía no han podido ser aclarados (33). Los defectos comprobados del producto afectaron en 23 casos las tiras reactivas y solamente en 11 casos los medidores. Medidas correctivas fueron implementadas como medidas preventivas en 33 casos. En 26 de los 33 casos, un defecto del producto pudo ser comprobado antes y en 7 casos los defectos del producto pudieron ser comprobados a causa de conocimientos adicionales obtenidos en el control realizado por el fabricante. Priv.-Doz. Dr. Rüdiger Siekmeier (re.) es jefe de sección para diagnósticos in vitro en el Instituto Federal de Fármacos y Dispositivos Médicos, BfArM, Dr. Johannes Lütz es jefe provisional del departamento de Dispositivos Médicos en el BfArM Según la información de la Sociedad Alemana de Diabetes, aproximadamente 10% de los Alemanes padecen de diabetes por lo cual el número de enfermos aumenta aproximadamente 3% cada año. Los afectados son más o menos una tercera parte de las personas entre 55 y 74 años de edad, aunque siempre más y más jovenes padecen de esta enfermedad. Por esa razón la distribuición de sistemas de medición (medidor y tiras reactivas) llamados productos OTC (OTC: over the counter), con las cuales las personas afectadas pueden realizar la medición y en caso de diabetes tipo I ajustar su propia terapia según los datos recibidos de la medición. Sistemas de Medición de Glucosa en la Sangre como Diagnósticos in vitro (IVD) Desde que se hizo la implementación de la directiva 98/79/CEE en el derecho nacional, dentro del marco de la segunda ley modificada de dispositivos médicos del 01 de enero del año 2002, el registro y la evaluación cientifica de reportes en relación con diagnósticos in vitro incumbe al Instituto Federal de Fármacos y Dispositivos Médicos (BfArM) ó al Instituto PaulEhrlich (PEI) en caso de grupos de productos en particular del apéndice II de la directiva IVD. Antes de esta fecha, el BfArM realizó una evaluación de los reportes recibidos. El siguiente análisis muestra todos los reportes que recibió el BfArM entre el 01 de enero del año 1999 hasta el 31 de diciembre del año 2005 con relación a los sistemas de medición de glucosa y productos OTC. de Glucosa Reportes relacionados con los Sistemas de Medición La evaluación total de los reportes que recibió el BfArM con relación a los diagnósticos in vitro (IVD) demuestra un aumento continuo el cual se intensificó despúes de la implementación de la segunda modificación de la Ley de Dispositivos Médicos (2. MPG-ÄndG). Con 19,4% (127 de 653 reportes) los sistemas de medición de glucosa tienen una importancia considerable. En comparación a estos diagnósticos, otros IVD, puestos en circulación como productos OTC (p. ej. pruebas de embarazo y pruebas para la coagulación sanguínea) presentan solo una parte pequeña de los reportes que recibió el BfArM y no están considerados en la evaluación presente. Fuentes de los Reportes Recibidos Observando la fuente de los reportes recibidos, se puede diferenciar entre reportes recibidos de fabricantes, usuarios (directamente de pacientes o de farmacias, de usuarios profesionales o clínicas o por comisiones de fármacos o por médicos o farmacéuticos), autoridades nacionales e/o internacionales y otras fuentes (p.ej. asociaciones de fabricantes, sociedades profesionales, otros fabricantes, comunicados de prensa). El análisis de las fuentes realizado en el BfArM durante las fechas arriba mencionadas que se refieren a los casos acumulados en relación a los sistemas de medición de glucosa demuestra que los reportes de usuarios y fabricantes presentan partes casi igual de altos (44,8 y 44,1% de todos los reportes respectivamente) mientras que los reportes de autoridades nacionales e internacionales y de otras fuentes fueron menos frecuentes (9,4% y 1,6% respectivamente). De los 57 reportes de usuarios en total, 16 (28,1%) fueron efectuados directamente de pacientes o farmacias consultadas por pacientes en caso de problemas y solamente 3 (5,3%) provinieron de clínicas. Por el contrario 38 casos (66,7%) fueron reportados al BfArM por comisiones de medicamentos, principalmente de los farmacéuticos alemanes. La comisión de medicamentos de los farmacéuticos alemanes transmitió los reportes, los cuales han recibido de las farmacias, y realizó en su propio laboratorio los primeros análisis con el material reclamado disponible (mayormente tiras reactivas) para verificar la reclamación. 3 de los 12 reportes recibidos de autoridades tratan de reportes de autoridades federales alemanas y 9 reportes fueron recibidos de otras autoridades, mayormente europeas (asi llamadas Competent Authorities) en el marco del sistema de vigilancia establecido para el intercambio de información. Los dos casos restantes que aparecieron en el período evaluado de otras fuentes proceden de una queja contra el competidor (1) o fueron retomados por iniciativa propia del BfArM (1); un reporte de asociaciones profesionales (p.ej. sociedades profesionales, asociaciones de pacientes) no fue realizado en el período elaborado. Frecuencia & Tipo de Defectos de los Productos En 31 (24,4 %) de 127 casos en total, ningún defecto de producto pudo ser comprobado. En 34 casos (26,8%) defectos del producto no relacionado con el usuario han sido comprobados. Los casos restantes originaron en errores del usuario (29/22,8%) o no pudieron ser aclarados (33/26%). En cuanto a un defecto del producto el cual ha podido ser comprobado por el fabricante en el análisis, las tiras reactivas eran afectadas en 23 casos (67,6%) y los medidores en solamente 11 casos (32,4%). Las causas de error muestran diferencias notables. En cuanto a las tiras reactivas se trata principalmente de: ■ Defectos de Fabricación (13; perforaciones y cortes defectuosas tanto como estampas defectuosas con la tinta conductora, mapas de líneas defectuosos en la fabricación y rasguños en el material conductor sobre las tiras reactivas o rasgaduras en el fondo del tubo de las trias reactivas ) los cuales causaban el fallo de las tiras reactivas a consecuencia de una entrada insuficiente de sangre, cortocircuitos en las tiras reactivas, la ausencia del inicio de sistema y avisos de error de los aparatos o el daño anticipado de las tiras reactivas. ■ Defectos de Envase (4; tubos de tiras reactivas no cerradas, ausencia de tarjetas de código, tiras de calibración o chips de código) ■ Defectos del Material (3; material hidrófobo de la superficie de las tiras reactivas que impide la entrada de la sangre, rasgaduras en las pista conductora debido al material causaron la avería de las tiras y la conductividad modificada de la tinta usada para estampar las tiras reactivas). En casos singulares se encontraron instrucciones insuficientes en el manual y una posible interferencia de la detección por reacción a causa de otros azúcares (p.ej. maltosa) con el riesgo de resultados falsos positivos de análisis en ciertos grupos de pacientes (2; pacientes en diálisis peritoneal e inyección de inmunoglobulinas) (1). En cambio, los errores de software prevalecieron en los equipos (5; cambio espontaneo de la unidad del valor de medición representado en la pantalla de "mg/dl" a "mmol/l" y viceversa, valores incorrectos o desconexión del equipo), mientras que raras veces se presentaron los defectos de fabricación (2; altos valores de medición falsos a causa de defectos de hardware, fallo de componentes en el pantalla del equipo), errores eléctricos (1; el equipo no se enciende después de introducir la tira reactiva), los defectos del material (1; fallo de los componentes de la pantalla), los defectos de envase/empaque (1; declaración de equipos ajustados a "mmol/l" como equipos preajustados a "mg/dl") y los errores de identificación (1; declaración sobre las advertencias descrepantes de la software en las instrucciones de uso). En los 29 errores del usuario principalmente se trató de alteraciones de las tiras reactivas a causa de errores de almacenamiento en su campo de responsabilidad, los cuales causaron un funcionamiento defectuoso (valores de medición altos falsos de la glucosa sanguinea y en casos singulares la medición no fue posible). Las causas de esto eran un daño de las tiras reactivas a través de la exposición a humedad p.ej. a consecuencia de dejar abierto por mucho tiempo el tubo de las tiras. Asi la humedad de aire entrando sobrepasó la capacidad de resorción del desecante. En otros casos las tiras reactivas se dañaron por causa de la exposición a químicos (lociones, desinfectantes con alcohol) o los diferentes lotes de productos de tiras reactivas se mezclaron. Además hubo casos de errores de manejo en el uso de los equipos, los cuales llevaban a un funcionamiento supuestamente defectuoso. Por consiguiente los errores reportados decían: • el equipo está usando demasiado sangre • las tiras reactivas que están en el tubo de despensa no fueron usados por el equipo • el uso de los equipos por pacientes diferentes (uso compartido/share use) que no corresponde a los instrucciones del fabricante causó la transmisión de infecciones • el uso de tiras reactivas de diferentes lotes de producción sin calibración repetida o el uso de un chip de calibración falso causaron resultados erróneos de medición y los valores repetidos resultaron mucho más altos que los valores de equipos de otros fabricantes usados para la comparación Cuando era seguro que se detectaba un error de usuario, el usuario afectado normalmente fue informado e instruido. Estos datos, sin embargo, no fueron elaborados e integrados como medidas correctivas en la siguiente evaluación. En los 33 casos siguientes, es decir en 26% de los casos reportados en total no se podían realizar instrucciones concluyentes porque o las tiras reactivas tanto como los equipos usados no fueron puestos a disposición del fabricante para el examen (16) o solamente el equipo pero no las tiras reactivas estaban disponibles para el examen (11). Solamente en 6 de los casos todavía no terminados, un defecto de fabricación causante no pudo ser detectado aún despúes de haber realizado un análisis especifico. Esto demuestra que el reenvio consecuente de equipos y remanentes existentes con el usuario de las tiras reactivas usadas en relación con la reclamación podría colaborar fundamentalmente para la mejora de la instrucción sobre posibles errores de fabricación. Medidas Correctivas Medidas correctivas no fueron realizadas en 94 de los 127 casos reportados al BfArM (74%). Aunque solamente en 5 de estos casos las medidas no fueron realizadas, porque los productos correspondientes no estaban disponibles en el mercado alemán. Las medidas correctivas realizadas en total tenían el fin de minimizar el riesgo saliendo del producto y a mejorar la seguridad de los productos futuros (medidas preventivas) y afectaban principalmente los casos que fueron comprobados de defectos en los equipos o tiras reactivas (26 de 34 casos). Además las medidas correctivas fueron realizadas en 7 casos en los cuales no se presentaron o no se identificaron errores de fabricación porque el análisis realizado por el fabricante dió por resultado indicaciones acerca de posibles riesgos los cuales requieren de medidas preventivas correctivas. En los 10 casos en las cuales se presentó un error del equipo, las siguientes medidas correctivas fueron realizadas según el tipo del error causante (con posibilidad de referencia múltiple): Información al cliente (9), actualización del software (5), modificaciones de la gestión de la producción y de la gestión de la calidad (4), retiros (3), modificaciones en las intrucciones de uso (2), congelación de distribución (2), modificación de los materiales usados para la producción (1). Éstas medidas correctivas fueron realizadas en 16 de 23 casos con la existencia de defectos en las tiras reactivas (con posibilidad de referencia múltiple): Modificaciones de la gestión de la calidad y de la producción (11), información al cliente (5), modificaciones en las instrucciones de uso (3), modificación del material usado (2), retiros (1) y actualizaciones del software (1). Particularidades de los Reportes sobre Sistemas para la Medición de Glucosa Besonderheiten der Meldungen zu Blutzucker-Messsystemen El análisis de los casos evaluados hasta fines de 2005 muestra que los productos OTC para la auto - medición de glucosa tienen mucha importancia también a causa de la cantidad de casos. Además estos productos normalmente son usados por personas no expertas (pacientes) y no de usuarios profesionales (personal de laboratorios) como en caso de los demás IVD. En el periodo de observación, esto tenia por consecuencia que habia una gran parte de casos en los cuales el fabricante no pudo detectar un defecto del material o que aparecieron a causa de errores previos de usuario. En diferencia a los reportes en relación con los demás IVD, también hubo una gran parte de reportes directamente enviados por pacientes o farmaceúticos o por la comisión de fármacos de los famaceúticos alemanes (Arzneimittelkommission der Deutschen Apotheker). La alta cantidad de casos definitivamente no aclarados también podría ser una consecuencia del uso de equipos por personas no expertas, porque frecuentemente los productos reclamados (la falta de las tiras reactivas) no fueron puestos completamente a disposición del fabricante para el análisis. Según el BfArM, la instrucción mejorada del usuario puede llevar a una reducción de éstos casos, en los cuales no se presenta un error de fabricación, se puede comprobar un error de usuario o la aclaración completa del caso no puede ser realizada. Otra particularidad, en especial en el mercado alemán, es el uso de equipos de medición de glucosa que pueden presentar los resultados de medición en diferentes unidades. Mientras que en los estados federales del oeste la medición de la concentración de la glucosa sanguinea normalmente fue realizada en la unidad de "mg/dl", la costumbre en los estados federales del este es la medición en la unidad de "mmol/l". Por consiguiente, 4 casos afectados por errores de equipo estaban directamente relacionados con el uso de unidades diferentes. En 3 de estos casos, a causa de problemas de software sucedió un cambio espontaneo de la unidad que presenta los resultados de la medición, con el riesgo de una terapia errónea por el paciente si el no reconoce este cambio. Hay que mencionar también el riesgo de un cambio de la unidad de medición por descuido a través del el paciente mismo. Para la reducción de estos riesgos, los fabricantes afectados realizan medidas correctivas, las cuales incluyen actualizaciones de software hasta el punto que en el futuro solamente los equipos permanentemente preprogramados, que no permiten un cambio entre "mg/dl" y "mmol/l" pueden ser colocados en el mercado. Durante el periodo de observación también 2 casos relacionados con la reimportación de las tiras reactivas para el análisis de glucosa en la sangre a Alemania fueron reportados al BfArM. En el primer caso, las gamas de colores adjuntas al envase fueron alteradas y la fecha de caducidad prolongada en comparación con las fechas originales del fabricante, debido a una falsificación del producto fuera de la responsabilidad del fabricante. No habian incidentes reportados para el primer caso. En el segundo caso sin embargo, las tiras reactivas reimportadas a Alemania no eran aptas para el uso junto con los equipos de medición puestos en el mercado alemán. Según el BfArM se debe partir del punto que estos casos podrían obtener más importancia en el futuro a causa de un incremento de reimportaciones debido a los gastos y en especial pueden poner en peligro la seguridad del producto por falta de identificación como reimportaciones y una colocación indebida en el mercado. http://www.bfarm.de/cln_012/nn_424526/SharedDocs/Publikationen/DE/Medizinprodukte/riskinfo/wissauf/blutzuckermessg er_C3_A4te__TeststreifenMTD82006,templateId=raw,property=publicationFile.pdf/blutzuckermessger%C3%A4te_TeststreifenMTD8-2006.pdf