Nobilis MG 6-85 - MSD Animal Health
Anuncio

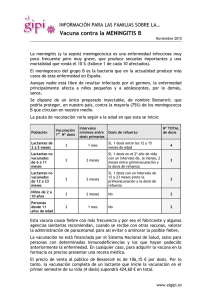
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS MG 6/85 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Por dosis de vacuna reconstituida: 106,9 – 108,5 CFU de Mycoplasma gallisepticum cepa MG 6/85 viva atenuada. Excipientes(s): Para la lista completa de excipientes, véase la sección 6.1. 3. FORMA FARMACÉUTICA Liofilizado para suspensión. 4. 4.1 DATOS CLÍNICOS Especies a las que va destinado el medicamento Pollos (futuras ponedoras, productoras de huevos para consumo humano). 4.2 Indicaciones de uso, especificando las especies a las que va destinado> Inmunización activa de futuras ponedoras para reducir la aerosaculitis y lesiones traqueales causadas por Mycoplasma gallisepticum. La inmunidad se desarrolla durante las 4 semanas siguientes a la vacunación. Se establece una duración de la inmunidad de 24 semanas tras la vacunación con un lote típico que contenga 7,5 log10 CFU. 4.3 Contraindicaciones No utilizar durante las 4 semanas previas al comienzo de la puesta ni durante la misma. No indicada para futuras reproductoras. 4.4 Advertencias especiales, especificando las especies a las que va destinado Tomar precauciones para evitar la transmisión de la cepa de la vacuna a otras aves diferentes de pollos y pavos, como aves de caza, gansos y patos. 4.5 Precauciones especiales que deben adoptarse durante su empleo Precauciones especiales para su uso en animales Nebulización en este caso significa que se sigue el principio de administración como aerosol. CORREO ELECTRÓNICO smuvaem@aemps.es F-DMV-01-03 Página 1 de 4 C/ CAMPEZO, 1 – EDIFICIO 8 28022 MADRID TEL: 91 822 54 01 FAX: 91 822 54 43 Vacunar solamente aves sanas. Una vez abierto el vial, utilizar todo su contenido. No mezclar con ningún otro producto inmunológico. Seguir la normativa en vigor relativa a la profilaxis de micoplasmosis. Tras la vacunación, la cepa de la vacuna de Mycoplasma gallisepticum MG 6/85 puede ser aislada en aves durante al menos 15 semanas. En raros casos puede producirse seroconversión después de la vacunación. La cepa de la vacuna puede diferenciarse del Mycoplasma gallisepticum salvaje en base a un análisis de DNA de rutina. Precauciones especiales que deberá adoptar la persona que administre el medicamento a los animales Evitar el contacto accidental con los ojos o la piel. La persona que administre el producto debe utilizar mascarilla y protección ocular. 4.6 Reacciones adversas (frecuencia y gravedad) Ninguna. 4.7 Uso durante la gestación, la lactancia o la incubación Ver apartado 4.3. 4.8 Interacción con otros medicamentos y otras formas de interacción - No administrar fármacos frente a Mycoplasma durante los 5 días anteriores o las dos semanas siguientes a la vacunación, ya que puede afectar a la cepa de la vacuna. - No se dispone de información sobre los efectos del uso concurrente de esta vacuna con cualquier otra. Por este motivo, se recomienda no administrar otras vacunas durante los 14 días anteriores o siguientes a la vacunación con este producto. 4.9 Posología y forma de administración Reconstituir la vacuna con el volumen correspondiente de agua para conseguir al menos 106,9 CFU (1 dosis) por ave para nebulización (vacunación por aerosol). Programa de vacunación La vacuna puede ser administrada como una sola dosis en pollos a partir de 6 semanas de edad. Preparación de la vacuna La vacuna debe ser utilizada durante las dos horas siguientes a su disolución en agua. 1. Utilizar agua limpia, fresca, no clorada. 2. Abrir el vial bajo el agua. 3. Retirar la cápsula y el tapón del vial. 4. Añadir a la vacuna la cantidad de agua necesaria para el aerosol. El volumen de agua para la reconstitución debe ser suficiente para asegurar una distribución uniforme cuando se pulveriza sobre las aves. Este variará dependiendo de la edad de las aves que van a ser vacunadas y del sistema de manejo, pero se recomienda 250- 400 ml de agua por cada 1000 dosis. Página 2 de 4 NOBILIS MG 6/85 - 1392 ESP – Ficha técnica F-DMV-01-03 MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD Agencia Española de Medicamentos y Productos Sanitarios Administración por nebulización (vacunación por aerosol) 1. La vacunación debe llevarse a cabo con un equipo de pulverización adecuado, capaz de producir gotitas finas. La suspensión de la vacuna debe dispersarse uniformemente sobre el número correcto de aves, a una distancia aproximada de 40 cm. 2. No utilizar desinfectantes ni leche desnatada en el pulverizador. 3. Utilizar el pulverizador exclusivamente para la administración de vacunas. Limpiar minuciosamente después de su utilización. 4. Interrumpir la ventilación durante la vacunación. Cerrar también los impulsores de aire. 5. Seguir las recomendaciones del fabricante del pulverizador en cuanto al volumen de agua. 4.10 Sobredosificación (síntomas, procedimientos de emergencia, antídotos), si procede Una dosis 10 veces superior a la máxima resulta inocua para las especies de destino. 4.11 Tiempo(s) de espera Cero días. 5. PROPIEDADES INMUNOLÓGICAS Estimular la inmunización activa frente a Mycoplasma gallisepticum. Código ATCvet: QI01AE03 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Cloruro sódico, fosfato disódico dihidratado, dihidrogenofosfato potásico, dihidrogenofosfato de sodio dihidrato, sal monosódica del ácido L-glutámico, sacarosa, NZ Amine AS, hidrolizado de lactoalbúmina, gelatina y agua para inyección. 6.2 Incompatibilidades No mezclar con ningún otro producto inmunológico. 6.3 Período de validez En forma liofilizada: 21 meses. Tras la reconstitución: 2 horas. 6.4. Precauciones especiales de conservación Conservar entre 2°C - 8°C. Proteger de la luz. 6.5 Naturaleza y composición del envase primario Página 3 de 4 NOBILIS MG 6/85 - 1392 ESP – Ficha técnica F-DMV-01-03 MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD Agencia Española de Medicamentos y Productos Sanitarios Cajas que contienen 1 ó 10 viales de vidrio, calidad hidrolítica tipo I, de 20 ml que contienen 500, 1000 ó 2000 dosis de vacuna liofilizada. Los viales se cierran con un tapón de goma de halogenobutilo y se sellan con una cápsula de aluminio codificada. Es posible que no se comercialicen todas las presentaciones. 6.6 Precauciones especiales que deben observarse al eliminar el medicamento veterinario no utilizado o, en su caso, sus residuos Eliminar el material de desecho tras la ebullición, incineración o inmersión en un desinfectante, de acuerdo a los requerimientos nacionales. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Merck Sharp & Dohme Animal Health, S.L. Polígono Industrial El Montalvo I C/ Zeppelin, nº 6, parcela 38 37008 Carbajosa de la Sagrada Salamanca 8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN 1392 ESP 9. FECHA DE LA PRIMERA AUTORIZACIÓN O DE LA RENOVACIÓN DE LA AUTORIZACIÓN 10 de mayo de 2001 10. FECHA DE LA REVISIÓN DEL TEXTO Mayo 2014 PROHIBICIÓN DE VENTA, DISPENSACIÓN Y/O USO Página 4 de 4 NOBILIS MG 6/85 - 1392 ESP – Ficha técnica F-DMV-01-03 MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD Agencia Española de Medicamentos y Productos Sanitarios