Fiebre reumática aguda Cardiopatía reumática
Anuncio

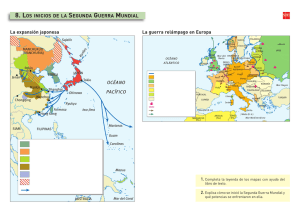
Fiebre reumática aguda y cardiopatía reumática e n p o b l a c i ó n in d í g e n a Andrew C. Steer, MBBS, BMedSc, FRACPa,b,, Jonathan R. Carapetis, MBBS, BMedSc, PhD, FRACP, FAFPHMc PALABRAS CLAVE Fiebre reumática aguda Cardiopatía reumática Streptococcus pyogenes La fiebre reumática aguda (FRA) es una enfermedad autoinmune que se caracteriza por la inflamación de varios tejidos que da lugar a las características clínicas típicas, entre las que se encuentran carditis/valvulitas, artritis, corea, eritema marginado y nódulos subcutáneos. Los efectos a largo plazo son mínimos en todos los tejidos, excepto en las válvulas cardíacas, en las que la fibrosis y las cicatrices pueden dar lugar a cardiopatía reumática crónica (CR). La carditis se presenta entre el 30 y el 80% de los pacientes con FRA y es más común en los pacientes de menor edad (90%) que en los adolescentes y adultos jóvenes. Al menos un 60% de los pacientes con FRA desarrollan CR.1–3 La FRA y la CR han sido descritas como «enfermedades clásicas de las injusticias sociales».4 Más del 80% de los casos de FRA y CR a nivel mundial se presentan en individuos que viven en países en vías de desarrollo.5 La FRA y la CR prácticamente han desaparecido de los países industrializados, y los casos que se presentan en indígenas de estos países ocurren con unas tasas desproporcionadamente altas. Se cree que la espectacular reducción de FRA y CR observada en el mundo industrializado en el siglo pasado ha sido resultado de las mejoras en las condiciones socioeconómicas, la higiene y el acceso a la asistencia médica, y la disminución del hacinamiento en las viviendas.6 Por consiguiente, se asume que los individuos que viven en países en desarrollo o los indígenas de países ricos no han tenido estas mejoras. Esta revisión resume la epidemiología y patogenia de la FRA y la CR y discute la práctica vigente en cuanto a su diagnostico y tratamiento, con énfasis en los temas relevantes para la a Department of Paediatrics, Centre for International Child Health, University of Melbourne, Flemington Road, Parkville, 3052, Melbourne, Victoria, Australia b Division of Infectious and Immunologic Diseases, Department of Pediatrics, University of British Columbia, 4480 Oak Street, Vancouver, V6H 3V4, Canada c Menzies School of Health Research, Charles Darwin University, Darwin, PO Box 41096, Casuarina, NT 0811, Australia T Autor para correspondencia. Division of Infectious and Immunologic Diseases, Department of Pediatrics, University of British Columbia, 4480 Oak Street, Vancouver, V6H 3V4, Canada. Dirección electrónica: andrew.steer@rch.org.au (A.C. Steer). Pediatr Clin N Am 56 (2009) 1401–1419 © 2010. Elsevier España, S.L. Reservados todos los derechos. 1402 Steer y Carapetis población autóctona de países ricos. Hay muchos indígenas en países de ingresos medios y bajos en el mundo, pero existen pocos datos sobre FRA y CR en estos grupos, por lo que no se abordan en este artículo. EPIDEMIOLOGÍA DE LA FIEBRE Y LA CARDIOPATÍA REUMÁTICAS EN POBLACIÓN INDÍGENA Una revisión de la magnitud global de la FRA y la CR publicada en 2005 calculaba que en el mundo existen por lo menos 15,6 millones de casos prevalentes de FRA, y que cada año se presentan 280.000 nuevos casos y 230.000 muertes a causa de estos padecimientos.5 Una actualización de 2008 de los datos de prevalencia de FRA en la población de Asia sugería que, dado que en las regiones con prevalencia alta surgen más datos, las cifras reales serían mucho más elevadas. Con los datos publicados en 2007, la cifra estimada de casos de FRA en niños en edad escolar en Asia duplica el cálculo original, basado en datos publicados en 2002.7 En la epidemiología existen diferencias regionales; las prevalencias más altas de FRA se encuentran en África (5,7 casos por 1.000 niños en edad escolar), el Pacífico (3,5 casos por 1.000) y Asia (3 por 1.000).3,7–11 La FRA y la CF son especialmente frecuentes en las poblaciones indígenas (tabla 1). La mejor calidad y el mayor volumen de datos provienen de estudios realizados en aborígenes australianos del Territorio del Norte de Australia y de los maoríes de Nueva Zelanda; estos datos sugieren que estas poblaciones presentan la incidencia más alta de FRA y una de las mayores prevalencias de CR de todo el mundo.12,13 Sin embargo, para la mayoría de las poblaciones indígenas existen pocos datos o ninguno sobre la magnitud de la FRA y la CR. La explicación de la llamativa disparidad en las tasas de FRA y CR entre indígenas probablemente sea multifactorial e incluya factores ambientales (especialmente sociales) y del huésped. Entre los factores ambientales importantes se encuentran el acceso a la asistencia médica, especialmente a la profilaxis secundaria (que se discute con mayor amplitud en la sección sobre prevención), la exposición persistente a la infección por estreptococo del grupo A (EGA) a través de la piel (que se discute en la sección de patogénesis) y el hacinamiento.14 Desde hace décadas se sabe que el hacinamiento es un factor importante en la epidemiología de la FRA.15 Los estudios clásicos durante los años cincuenta del siglo pasado en los barracones de las bases de la Fuerza Aérea de EE. UU. encontraron que las tasas de adquisición de infecciones estreptocócicas aumentaban cuando las camas se ponían juntas, lo que supuso la base biológica de la relación entre hacinamiento e incidencia de FRA.16 Los datos de los países en desarrollo también confirman al hacinamiento como factor de riesgo. En Kinshasa, República Democrática del Congo, se encontró que los niños que vivían en viviendas con más de ocho personas tenían una prevalencia cuatro veces más alta de FRA.17 En el Territorio del Norte de Australia, el hacinamiento es un problema perenne. En un estudio realizado en dos comunidades se encontró que la cifra media de personas por vivienda era de 14 a 17, y este hecho se consideró un factor que contribuía a las altas tasas de FRA y CR.4,18 PATOGENIA DE LA FIEBRE Y LA CARDIOPATÍA REUMÁTICAS La FRA es una enfermedad inflamatoria multisistémica mediada por mecanismos inmunológicos que se produce tras infección por EGA. El mecanismo patogénico de la FRA y la CR no ha sido completamente dilucidado, pero parece que la interacción entre una cepa del EGA «reumatogénica» y un huésped con susceptibilidad hereditaria da lugar a una respuesta inmunológica anómala con desarrollo de autoinmunidad (fig. 1).19 La gran magnitud de FRA y CR en la población indígena ha dado lugar a que los investigadores consideren que varios factores pueden contribuir a la susceptibilidad a la enfermedad, entre ellos la genética, así como la función potencial del impétigo por EGA en el caso de la FRA. La razón de que sólo un pequeño porcentaje (entre el 3 y el 5%) de individuos infectados con EGA reumatogénica desarrollen FRA se desconoce.21 La respuesta más probable es la Fiebre reumática aguda y cardiopatía reumática Tabla 1 Estudios seleccionados que apoyan la noción de que la fiebre y la cardiopatía reumáticas son más frecuentes en población indígena Población indígena Período del estudio Nativos de Alaska en Alaska100 1979–1988 Los nativos de Alaska tienen una tasa anual de mortalidad cardíaca debida a CR 2 veces mayor que los habitantes blancos de Alaska (tasa de mortalidad 8,5 por 100.000 frente a 4,2 por 100.000) Indígenas americanos nativos en EE. UU.101 1989–1992 La prevalencia de CR basada en cribado mediante ecocardiografía en indígenas americanos nativos entre los 45 y 74 fue de 4,6 por 1.000 (la prevalencia global de CR en países con economía de mercado establecida se estima en 0,3 por 1.000) Pueblos de Primeras Naciones en Canadá102 1970–1979 La incidencia de FRA en niños en Manitoba fue 3,5 veces superior que la de niños no nativos (tasas: 126 por 100.000 frente a 29 por 100.000) Indígenas fiyianos en Fiyi3,103 2005–2007 La incidencia de FRA en indígenas fiyianos fue 2,2 veces mayor (IC al 95% 0,9-6,1) que en poblaciones no indígenas (tasas: 6,4 por 100.000 frente a 2,5 por 100.000); la prevalencia de CR en niños indígenas entre 5 y 15 años fue 2 veces mayor (IC al 95% 0,8-5,1) que en niños no indígenas (prevalencia 10,3 por 1.000 frente a 4,4 por 1.000) Indígenas hawaianos en Hawái104 1980–1984 La incidencia de FRA en hawaianos mestizos fue casi 8 veces mayor que en población blanca (tasas: 18 por 100.000 frente a 2,3 por 100.000) Maoríes neozelandes en Nueva Zelanda11 1996–2005 La incidencia de FRA en población maorí de Nueva Zelanda fue 10 veces superior (IC al 95% 1,7-58,3) que en población de ascendencia europea (tasas: 8 por 100.000 frente a 0,8 por 100.000) Indígenas australianos en Australia10 1989–1993 La incidencia anual de FRA confirmada en población aborigen entre 5 y 14 años en la zona extrema del Territorio del Norte fue de 254 por 100.000, mayor que ninguna otra notificada en el mundo Comentarios Abreviaturas: CR, cardiopatía reumática; FRA, fiebre reumática aguda. susceptibilidad genética a la enfermedad, aunque la naturaleza de dicha susceptibilidad no esté clara.21 Existen pruebas epidemiológicas de que la proporción de aborígenes australianos que viven en el Territorio del Norte y son susceptibles al desarrollo de FRA es similar a la proporción de reclutas militares norteamericanos que sufrieron FRA tras los brotes de faringitis por EGA en campos militares en los años cincuenta del siglo pasado22; esto sugiere que la susceptibilidad podría no presentar diferencias sustanciales entre distintas poblaciones.20 Más pruebas que secundan este punto de vista provienen de un estudio en población predominantemente blanca de Melbourne entre 1938 y 1948, que encontró una incidencia anual de FRA de 242 por 100.000 en los grupos de nivel socioeconómico bajo, tasa similar a la incidencia actual entre aborígenes del norte y centro de Australia.23 Se han realizado múltiples estudios para investigar la naturaleza de la susceptibilidad genética a FRA y CR, entre los que se cuentan estudios de antígenos leucocitarios humanos, aloantígenos de linfocitos B y polimorfismos de genes inmunológicos (especialmente el factor a de necrosis tumoral). Hasta el momento, los datos no son concluyentes. En la población aborigen australiana se ha estudiado un marcador prometedor, un aloantígeno de los 1403 1404 Steer y Carapetis Antígeno de reactividad cruzada (3) FASE 1: Reconocimiento inmunitario APC EGA reumatógeno (1) Faringitis por EGA (2) CD4 MHC II TCR IL-2, TNF- α, otros FASE 2: Circulación de células inmunitarias Liberación de citocinas Linfocito B CD4 lar (4) Mimetismo molecu a23 Miosina, laminin FASE 3: Fijación de anticuerpos Válvula D4 VCAM-1 (5) as ad iliz sib sen sC lula Cé FASE 4: Reclutamiento de linfocitos T Infiltración de CD4 y CD8 Linfocitos Th1 → INF-γ, TNF-α FASE 5: Neovascularización (6) Reclutamiento de linfocitos T Difusión de epítopos Los linfocitos T responden a otras proteínas α-helicoidales, incluidas la tropomiosina y la vimentina Figura 1. Inmunopatogenia de la FRA y la CR. 1) Los estreptococos reumatogénicos clásicos parecen no existir en algunos grupos indígenas. 2) El impétigo por EGA puede cumplir una función como inicio de la infección en poblaciones indígenas en las que el impétigo es endémico. 3) No se ha identificado el antígeno de reactividad cruzada en el estreptococo del grupo A: entre los presuntos epítopos con reactividad cruzada están la proteína M y la N-acetil-glucosamina. 4) Se cree que la base patogénica de la reactividad cruzada con el huésped es el mimetismo molecular entre los antígenos de EGA y los tejidos del huésped humano, bien documentado en las proteínas a-helicoidales cardíacas, como miosina, laminina y vimentina. 5) La molécula de adhesión celular vascular-1 (VCAM-1) presenta regulación superior a nivel valvular y ayuda al reclutamiento e infiltración de linfocitos T. 6) La inflamación provoca neovascularización, lo que permite mayor reclutamiento de linfocitos T y conlleva la inflamación granulomatosa y el establecimiento de CR. (Adaptado de Guilherme L, Kalil J, Cunningham MW. Molecular mimicry in the autoimmune pathogenesis of rheumatic heart disease. Autoimmunity 2006;39:35; con autorización.) linfocitos B conocido como D8/17.24 Este estudio encontró que el 95% de los pacientes con antecedentes de FRA tenían positivo el antígeno D8/17, en comparación con el 50% de los parientes de primer grado y el 4% de los controles. Aunque se ha demostrado que este marcador tiene una fuerte asociación con FRA/CR en algunos países, entre los que se encuentran Israel y EE. UU.,25,26 el marcador no es universal y en estudios realizados en India la correlación es considerablemente menor.27,28 La función del antígeno D8/17 en la patogénesis de la FRA sigue siendo incierta. Los estudios tradicionales establecen que la FRA se produce después de la faringitis por EGA, pero no tras impétigo por EGA.29 Sin embargo, existen pruebas epidemiológicas, especialmente en Australia, que sugieren que las cepas de EGA de la piel pueden desempeñar una función en la patogénesis de la FRA. En poblaciones aborígenes de Australia con alta incidencia de FRA también existen una baja incidencia de faringitis por EGA (un estudio no encontró episodios de faringitis sintomática por EGA en más de 1.000 individuos seguidos retrospectivamente durante 23 meses),18 tasas bajas de portador de EGA en la vía respiratoria superior y alta incidencia de piodermia (en el mismo estudio, el 40% de los niños sufrieron al Fiebre reumática aguda y cardiopatía reumática menos un episodio de impétigo durante el estudio).18,30 Además, en el Territorio del Norte y en algunas poblaciones con incidencia alta de FRA, entre las que se encuentran los maoríes de Nueva Zelanda, no existen los clásicos serotipos M reumatogénicos de EGA (es decir, serotipos asociados con faringitis por EGA), lo que sugiere que otros serotipos pueden desempeñar una función, posiblemente asociados con impétigo por EGA.31–34 La función del impétigo en la patogénesis de la FRA es objeto de especulación, pero puede involucrar una causa directa de FRA tras la infección de la piel, un mecanismo inmunológico previo o paso de cepas de la piel a la garganta donde pueden causar FRA.35 La confirmación de esta hipótesis impétigo-FRA precisaría que se reconsideraran las estrategias preventivas primarias, porque la prevención primaria vigente sólo se centra en el tratamiento de la faringitis por EGA, no en el impétigo. En ámbitos tropicales el impétigo se debe, con frecuencia, a infección secundaria en una infestación por sarna,36,37 y por lo tanto una mayor implicación significaría, potencialmente, la necesidad de controlar la infección endémica de sarna para controlar la FRA. DIAGNÓSTICO DE LA FIEBRE Y LA CARDIOPATÍA REUMÁTICAS Cuando el médico se encuentra con un paciente con un posible diagnóstico de FRA, debe hacer una historia clínica detallada, una exploración física completa y solicitar pruebas clave. Dadas las altas tasas de FRA en la población indígena, la presencia de fiebre y poliartritis en niños supone un alto grado de sospecha. No existe una única prueba diagnóstica para la FRA, y el diagnóstico se basa en criterios clínicos conocidos como Criterios de Jones. Los criterios se dividen en manifestaciones mayores y menores, en función de la importancia diagnóstica de un hallazgo particular, y en la mayoría de los casos el diagnóstico precisa pruebas de una infección precedente por EGA (tabla 2).38 Los Criterios de Jones se publicaron por primera vez en 1944, con la pretensión de que sirvieran como guía diagnóstica de la FRA.39 Con la subsiguiente reducción de la incidencia de FRA en países industrializados, los Criterios de Jones han sido revisados varias veces para aumentar la especificidad y disminuir la sensibilidad de los mismos.38,40–42 Epidemiólogos y médicos clínicos de países en desarrollo, y aquellos que trabajan con población indígena en países industrializados, han observado que la aplicación estricta de los Criterios de Jones actualizados puede dar lugar a que en poblaciones con incidencias altas se escapen diagnósticos de FRA.43 En consecuencia, varios investigadores Tabla 2 Criterios de Jones actualizados en 1992 para diagnóstico del primer episodio de fiebre reumática aguda (el diagnóstico requiere de la existencia de pruebas de una infección previa por EGA más: o bien 1) dos manifestaciones mayores, o 2) una manifestación mayor y dos menores)38 Manifestaciones mayores Manifestaciones menores Pruebas que apoyan la presencia de infección estreptocócica 1. Carditisa 2. Poliartritis 3. Coreaa 4. Eritema marginado 5. Nódulos subcutáneos CLÍNICAS: 1. Cuantificación de anticuerpos estreptocócicos elevados o en aumento 2. Cultivo faríngeo positivo a EGA o prueba rápida de antígeno estreptocócico positiva 1. Artralgia 2. Fiebre Z39 1C DE LABORATORIO: 1. Reactantes de fase aguda elevados: velocidad de sedimentación globular, proteína C reactiva 2. Intervalo P-R prolongado en el electrocardiograma Abreviatura: EGA, estreptococo del grupo A. a La corea y la carditis de inicio insidioso no requieren pruebas de infección estreptocócica previa. 1405 1406 Steer y Carapetis han sugerido que los Criterios de Jones deben modificarse en estas poblaciones para aumentar la sensibilidad de criterios.44–46 Los hallazgos sometidos a mayor debate son las manifestaciones articulares, el diagnóstico de carditis y la definición de FRA recurrente. Manifestaciones articulares En la población indígena (y probablemente en muchos países en vías de desarrollo), la FRA puede presentarse de forma sutil, sin los hallazgos típicos de poliartritis.3,46,47 En un estudio de los hallazgos clínicos de la FRA en el Territorio del Norte de Australia, la monoartritis fue una presentación frecuente de FRA que se aparecía en el 17% de los casos confirmados y en el 35% de los casos bajo sospecha sin confirmación.46 Los investigadores concluyeron que, en poblaciones con tasas altas de FRA en las que las consecuencias de perder diagnósticos sobrepasan las de realizar diagnósticos erróneos, resulta aceptable la inclusión de la monoartritis como manifestación mayor. En otros ámbitos se ha encontrado que la monoartritis es un hallazgo de presentación.47,48 Un estudio en Nueva Zelanda sugiere que estos casos pueden ser consecuencia de la administración precoz de medicamentos antiinflamatorios, que enmascararían la evolución de la poliartritis reumática típica.49 Los investigadores del estudio australiano llegaron a una conclusión similar sobre la fiebre y consideraron aceptable una temperatura de 37,5 1C o mayor como prueba aceptable de fiebre (manifestación menor).46 Otra situación en la que se necesita tener un alto índice de sospecha de FRA es cuando un paciente de una población de alto riesgo de FRA presenta un cuadro clínico de artritis séptica en el que el líquido sinovial es estéril; se debe considerar que estos pacientes tienen FRA mientras no se demuestre lo contrario, y deben efectuarse los estudios adecuados para descartarla.47,48 Carditis El ecocardiograma es útil para el diagnóstico y tratamiento de la FRA, ya que puede confirmar los hallazgos de la auscultación y permite valorar la gravedad de la carditis. El ecocardiograma también puede detectar casos subclínicos de carditis (es decir, los que no presentan pruebas de un soplo cardíaco clínicamente significativo); esto es, el ecocardiograma tiene una sensibilidad mayor que la auscultación para valorar la carditis.50,51 La opinión de los expertos está dividida en cuanto a si los hallazgos ecocardiográficos de una carditis subclínica son prueba suficiente de carditis verdadera y si pueden considerarse como manifestación mayor.52–54 En muchos países en desarrollo y en poblaciones indígenas se usa cada vez más el ecocardiograma, y los médicos se están convirtiendo en expertos en interpretar pruebas ecocardiográficas de carditis.55,56 En Australia y Nueva Zelanda se recomienda el ecocardiograma en todos los pacientes con sospecha de FRA, y la carditis subclínica se considera una manifestación mayor. Por el contrario, en India no se considera que el ecocardiograma sea una prueba obligatoria, y la carditis subclínica no se considera un criterio mayor.57 La función del ecocardiograma en la evaluación de la carditis reumática aguda se está investigando actualmente en varios estudios realizados en ámbitos en los que la FRA es frecuente (incluyendo la población indígena). Diagnóstico de episodios recurrentes de fiebre reumática aguda Los Criterios de Jones sólo son aplicables en los ataques iniciales de FRA. Un comité de expertos de la Organización Mundial de la Salud (OMS) ha propuesto directrices sobre cómo modificar los Criterios de Jones en las recurrencias, como que una recurrencia de FRA pueda diagnosticarse sólo con las manifestaciones menores (junto a la evidencia de una infección por EGA reciente) en un paciente con antecedentes de CR, porque los pacientes con CR tienen un riesgo de carditis elevado en los ataques recurrentes de FRA.58 Fiebre reumática aguda y cardiopatía reumática Modificaciones de los Criterios de Jones Como consecuencia de las consideraciones discutidas, recientemente se publicaron tres directrices que sugieren cómo podrían modificarse los Criterios de Jones actualizados en 1992 en circunstancias o poblaciones particulares (tabla 3). Las nuevas directrices son un nuevo desarrollo a nivel internacional; hasta ahora los Criterios de Jones habían sido la norma de referencia aceptada para el diagnóstico en todas las poblaciones. Estas nuevas directrices destacan la necesidad por parte de los médicos que trabajan en poblaciones con tasas elevadas de FRA y CR, incluidas algunas poblaciones indígenas, de adaptar los Criterios de Jones a sus circunstancias locales o a interpretarlos a la luz de las necesidades y la experiencia local. Diagnóstico diferencial de la fiebre reumática aguda La lista de diagnósticos diferenciales para muchas de las manifestaciones clínicas de la FRA de presentación aislada es larga, especialmente para la poliartritis. La excepción a este hecho es la corea, que en poblaciones con alta incidencia casi siempre se debe a FRA. El eritema marginado y los nódulos subcutáneos también son específicos de FRA, pero ambos son raros. Un diagnóstico diferencial de poliartritis que merece mención es un síndrome conocido como artritis reactiva postestreptocócica (ARPE). Las características clínicas de la artritis de la ARPE presentan varias diferencias frente a la FRA. Puede manifestar una alteración articular prolongada (hasta 8 meses) simétrica no migratoria, que responde mal a los fármacos antiinflamatorios no esteroideos, incluyendo el ácido acetilsalicílico. Aunque en poblaciones en las que la FRA es rara puede contemplarse el diagnóstico de ARPE, en ámbitos de alta incidencia no debe considerarse, ya que es más probable que el diagnóstico sea FRA.12 La recomendación vigente de la American Heart Association para tratar la ARPE es realizar profilaxis con penicilina durante 1 año, con idea de suspenderla si en el ecocardiograma realizado al año no se evidencia afectación cardíaca. Los autores no recomiendan esta práctica en grupos indígenas donde la FRA es común, y sugieren que estos pacientes precisan un período de profilaxis más largo y un tratamiento igual al de los pacientes con FRA sin carditis (v. el apartado sobre tratamiento). Esto concuerda con las directrices australianas y neozelandesas.12,13 TRATAMIENTO DE LA FIEBRE REUMÁTICA AGUDA Aunque el tratamiento puede acortar la inflamación aguda de la FRA, todas las manifestaciones de la FRA se resolverán espontáneamente, excepto la carditis, que puede dejar daño valvular de larga duración o persistir con inflamación continua en el tejido valvular. Ningún tratamiento durante la fase aguda de la FRA ha demostrado interferir en la evolución de la carditis con claridad. Sin embargo, cumplir bien la profilaxis secundaria puede alterar positivamente la progresión de la CR. El objetivo inicial del tratamiento debería ser confirmar el diagnóstico de FRA y valorar la gravedad del episodio. La carditis grave precisa tratamiento urgente. Los medicamentos antiinflamatorios pueden acortar la fase inflamatoria aguda de la FRA y mejorar los síntomas, especialmente los de artritis. Un aspecto clave del tratamiento de la FRA es la educación del paciente y su familia, sobre todo en la importancia del cumplimiento terapéutico de la profilaxis secundaria. En la tabla 4 se resumen las modalidades terapéuticas de la FRA y la CR y las pruebas que apoyan su uso. Confirmación del diagnóstico de fiebre reumática aguda La mayoría de los pacientes con sospecha de FRA deberían ser hospitalizados. Esto permite valorar la gravedad del episodio, especialmente de la carditis, y valorar la respuesta al tratamiento. El ingreso hospitalario proporciona tiempo para la educación sanitaria y la preparación de la profilaxis secundaria. También es útil en pacientes que presentan monoartritis o artralgia, en los que deban descartarse artritis séptica y otras causas posibles, y puede interrumpirse 1407 1408 Steer y Carapetis Tabla 3 Modificaciones recientes de directrices para el diagnóstico de fiebre reumática aguda Criterios de la OMS, 2002–200358 Directrices australianas, 200512 Directrices de Nueva Zelanda, 200613 Diagnóstico de FRA recurrente basado en manifestaciones menores Sí, pero sólo en pacientes con CR preexistente Sí, en cualquiera con CR o historia previa de FRA Sí, pero sólo en pacientes con CR preexistente Directrices diferentes para subgrupos diferentes No Sí, los cambios en datos clínicos se refieren sólo a grupos de alto riesgo.a Para el resto de los grupos, similar a los Criterios de Jones y de la OMS No Carditis Similar a los Criterios de Jones Se acepta la carditis subclínica como manifestación mayor Se acepta la carditis subclínica como manifestación mayor Manifestaciones articulares Similar a los Criterios de Jones Se aceptan la monoartritis y la poliartralgia como manifestaciones mayores (si otras causas han sido excluidas) La monoartritis aséptica con historia previa de tratamiento con AINE suele aceptarse como manifestación mayor Fiebre No definida Definida como temperatura Z38 1C Definida como temperatura Z38 1C Reactantes de fase aguda VSG o leucocitos en sangre periférica elevados, pero no la PCR. Sin mayor definición VSG Z30 mm/h o PCR Z30 mg/l VSG Z50 mm/h o PCR Z30 mg/l Pruebas de infección por EGA Similar a los Criterios de Jones con la adición de escarlatina reciente. Sin mayor definición Similar a los Criterios de Jones, pero con rango de normalidad proporcionado mediante cuantificación serológica Similar a los Criterios de Jones, pero con rango de normalidad proporcionado mediante cuantificación serológica Abreviaturas: AINE, antiinflamatorios no esteroideos; CR, cardiopatía reumática; FRA, fiebre reumática aguda; PCR, proteína C reactiva; VSG, velocidad de sedimentación globular. a Los grupos de alto riesgo se definen como aquellos que viven en comunidades con tasas altas de FRA (incidencia W30 por 100.000 por año en niños de 5–14 años) o de CR (prevalencia para todas las edades W2 por 1.000). Fiebre reumática aguda y cardiopatía reumática Tabla 4 Pruebas de diversas terapias utilizadas en el tratamiento de la fiebre y la cardiopatía reumáticas Medicación o intervención Prevención Prevención primaria: fenoximetil penicilina oral (penicilina V) durante 10 días, o bencilpenicilina G intramuscular en dosis única Prevención secundaria: bencilpenicilina G intramuscular administrada semanalmente durante 3–4 semanas Artritis Ácido acetilsalicílico Naproxeno Carditis Ácido acetilsalicílico Glucocorticoides Inmunoglobulina intravenosa Corea Anticonvulsivos (valproato sódico o carbamacepina) Inmunoglobulina intravenosa Grado de la recomendación Calidad de las pruebas que la apoyan Recomendada para el tratamiento de la faringitis estreptocócica en población indígena (existen tratamientos alternativos para pacientes alérgicos a la penicilina) Recomendada para la prevención de la fiebre reumática recurrente en poblaciones indígenas (existen tratamientos alternativos para pacientes alérgicos a la penicilina) Fuerte Alta77,78,105 Fuerte Alta85,106 Recomendado como tratamiento de elección en el tratamiento sintomático de la artritis Recomendado como segunda elección en el tratamiento sintomático de la artritis para pacientes intolerantes al ácido acetilsalicílico Fuerte Alta67 Débil Baja59 No recomendado para el tratamiento de la carditis debido a que no tiene efectos a largo plazo sobre la evolución cardíaca Recomendados para el tratamiento de la carditis grave No recomendada para el tratamiento de la carditis Fuerte Alta67 Débil Moderada67 Fuerte Moderada67 Débil Baja73 Débil Moderada74 Recomendación Recomendado exclusivamente para el tratamiento de la corea grave No recomendada 1409 1410 Steer y Carapetis inicialmente el tratamiento con salicilatos (si se prueba alivio del dolor con codeína o paracetamol) y observar si el paciente desarrolla poliartritis, de forma que el diagnóstico pueda hacerse con mayor certeza.12 Tratamiento de la artritis El tratamiento antiinflamatorio es el pilar principal del tratamiento de artritis de la FRA. El tratamiento con salicilatos resulta efectivo (aunque en caso de artritis leve o artralgia pueden utilizarse analgésicos simples). Si en los primeros días del tratamiento la respuesta a los salicilatos es escasa o nula, debería cuestionarse el diagnóstico de FRA. En pacientes intolerantes al ácido acetilsalicílico puede utilizarse naproxeno. El ácido acetilsalicílico debe utilizarse inicialmente en dosis razonablemente altas (80–100 mg/kg y día en cuatro dosis al día, dosis máxima 4–8 g/día).12 Algunos pacientes sólo necesitan tratarse durante 2 semanas, y posteriormente el ácido acetilsalicílico puede irse disminuyendo o suspenderse, aunque los síntomas de «rebote» deben monitorizarse durante las 2 semanas siguientes a la suspensión del tratamiento.60–61 En episodios más graves, con frecuencia es necesario un ciclo total de 6 semanas. En este caso la dosis de ácido acetilsalicílico puede disminuirse de forma escalonada después de 2 semanas con dosis alta (p. ej., la dosis puede disminuirse a dos tercios en las 2 semanas la mitad del ciclo, y a la mitad las 2 últimas semanas). Si se produce un episodio de rebote, no debe considerarse recurrente y será adecuado realizar otro ciclo corto de ácido acetilsalicílico. Manejo de la carditis A todos los pacientes con sospecha de CR o CR confirmada se les debería realizar un ecocardiograma para confirmar el diagnóstico clínico, detectar lesiones clínicamente silentes y valorar la gravedad de la carditis.12,13 El ecocardiograma puede detectar una lesión que precise cirugía urgente, como la ruptura de una cuerda tendinosa, aunque esto es raro. No existen pruebas de que los fármacos antiinflamatorios afecten a la evolución de la carditis, y parece que la gravedad de la CR residual se relaciona directamente con la gravedad de la carditis en el episodio inicial de FRA y el número de episodios recurrentes.62,63 Aunque el tratamiento con salicilatos es efectivo para controlar los síntomas de la artritis de la FRA, no deben utilizarse específicamente para tratar la carditis, ya que no existen pruebas de que alteren la tasa de progresión hacia CR crónica.64–67 Ha sido investigada la función de los corticoides en el tratamiento de los pacientes con carditis.67–69 Su beneficio es mínimo o nulo en el tratamiento de carditis leva a moderada, por lo que en ese caso no están indicados.67–69 Sin embargo, algunos expertos recomiendan su uso en la carditis grave (es decir, carditis asociada con insuficiencia cardíaca) porque su efecto antiinflamatorio es más potente y, por consiguiente, puede dar lugar a una potencial resolución más rápida de la insuficiencia cardíaca. Esta recomendación no se basa en pruebas de que los corticoides disminuyan el riesgo de desarrollar lesiones valvulares en la carditis grave, pero debe observarse que las pruebas vigentes a favor o en contra de dicho efecto no se basan en estudios realizados después de que empezaran a utilizarse el ecocardiograma y los corticosteroides modernos.67 Deben considerarse los efectos colaterales potenciales de los corticosteroides, incluidos el riesgo de hemorragia gastrointestinal (debe pautarse una inhibición de la acidez gástrica), sobrecarga hídrica (con frecuencia se necesita administración concomitante de diuréticos) y estrongiloidiasis en zonas endémicas (puede ser necesaria la administración concomitante de fármacos como la ivermectina).70 Durante el tratamiento con corticosteroides puede suspenderse el ácido acetilsalicílico, porque los corticoesteroides controlarán el dolor articular y la fiebre. Al suspender los esteroides existe riesgo de rebote, por lo que habitualmente se necesita utilizar de nuevo el ácido acetilsalicílico 2 semanas más.60,61 Fiebre reumática aguda y cardiopatía reumática Manejo de la corea La corea es un fenómeno autolimitado.71,72 El tratamiento con antiinflamatorios no altera el curso clínico de la corea, y el tratamiento sintomático sólo debe prescribirse si el trastorno motriz llega a ser intenso y angustioso. Puede ser útil mantener un entorno tranquilo para evitar una estimulación excesiva, lo que puede empeorar la corea. Una pequeña comparación prospectiva de carbamazepina, ácido valproico y haloperidol para tratar la corea sugería que el ácido valproico era el fármaco más efectivo para suprimir los movimientos coreiformes;73 sin embargo, el ácido valproico puede causar hepatotoxicidad. Por consiguiente, si el tratamiento se considera necesario, la carbamazepina puede ser la primera elección, y el ácido valproico la segunda en casos refractarios. Basándose en las pruebas disponibles no puede recomendarse la inmunoglobulina; un pequeño estudio de inmunoglobulina intravenosa sugería una recuperación más rápida de la corea, pero no afectó la evolución cardíaca.74 La corea está fuertemente asociada a la carditis, y, por consiguiente, a todos los pacientes con corea se les debe realizar un ecocardiograma.12,75 La opinión de algunos médicos que trabajan en ámbitos de alta incidencia es que los trastornos conductuales asociados con frecuencia a la corea de Sydenham pueden ser prolongados y persistir mucho después de que el trastorno motriz haya remitido. Esto todavía no se ha confirmado. Tratamiento antibiótico Aunque la mayoría de los pacientes con FRA en el momento de la presentación ya no tienen infección activa por EGA, una gran parte de expertos recomiendan tratamiento antibiótico para erradicar toda infección residual por EGA en la faringe, incluso si los cultivos faríngeos son negativos.12,13,76 Un abordaje razonable es utilizar una dosis única de bencilpenicilina G como tratamiento de la faringitis y como primera dosis del régimen de profilaxis secundaria (v. el apartado sobre profilaxis secundaria). MANEJO DE LA CARDIOPATÍA REUMÁTICA El tratamiento médico y quirúrgico de la CR es complejo y depende en gran parte de la disponibilidad de fármacos para la insuficiencia cardíaca, medicación anticoagulante y pruebas de monitorización, instituciones para cirugía cardiotorácica e intervenciones cardíacas (y cirujanos y cardiólogos muy bien formados), sistemas de atención primaria integral y registros locales de CR y programas de control. Algunas revisiones recientes basadas en pruebas proporcionan más directrices.12,13 PREVENCIÓN DE LA FIEBRE Y LA CARDIOPATÍA REUMÁTICAS Existen dos métodos reconocidos para controlar la FRA y la CR: profilaxis primaria y secundaria. La profilaxis primaria se refiere al tratamiento oportuno y adecuado de la faringitis por EGA, y ha demostrado claramente ser efectiva para prevenir la FRA.77–79 La profilaxis secundaria consiste en la administración periódica de antibióticos (habitualmente bencilpenicilina G durante 3 o 4 semanas) durante un período determinado para prevenir la FRA recurrente. Esta estrategia ha demostrado dar lugar a la regresión de lesiones valvulares presentes y a disminuir la mortalidad por FRA.80,81 Prevención primaria La profilaxis primaria tiene la importante ventaja, en comparación con la secundaria, de prevenir el daño cardíaco que, de otra forma, se produciría. La profilaxis primaria es efectiva en el paciente individual.77–79 Sin embargo, en salud pública, los programas de prevención 1411 1412 Steer y Carapetis primaria son caros82 y, para tener éxito, necesitan superar importantes obstáculos logísticos. Una estrategia de profilaxis primaria efectiva se basa en tres supuestos: 1) que los pacientes con dolor de garganta soliciten asistencia; 2) que las clínicas a las que acudan tengan la capacidad de diagnosticar con certeza una faringitis por GEA, y 3) que una vez diagnosticado, el paciente sea tratado de forma adecuada y siga el tratamiento prescrito. Estos requisitos pueden ser difíciles de alcanzar en la población indígena, especialmente en grupos que viven en países en vías de desarrollo. No obstante, existen razones para seguir promoviendo la investigación y el tratamiento del dolor de garganta en ámbitos en los que sea factible. Prevención secundaria El enfoque actual de los esfuerzos globales para combatir la CR es el de fortalecer los programas de profilaxis secundaria, porque resultan viables y coste-efectivos.83,84 Sin embargo, en la práctica, existen diferencias considerables con respecto a la vía de administración, dosis, frecuencia y duración de la penicilina como profilaxis secundaria.12,57,58,76 Las inyecciones de bencilpenicilina G cada 2 a 4 semanas son superiores que la penicilina diaria por vía oral.85 En estudios realizados en Taiwán, la bencilpenicilina G tres veces por semana, en lugar de cuatro, redujo el número de recurrencias de FRA.86,87 Sin embargo, en muchas poblaciones es negativa la adherencia a una dosificación tan frecuente. Datos de Nueva Zelanda arrojan tasas bajas de recurrencia en poblaciones de alta incidencia, con buena adherencia a la dosis cuatro veces por semana, por lo que las directrices de EE. UU., Nueva Zelanda y Australia recomiendan como norma de referencia inicial la bencilpenicilina G parenteral cuatro veces por semana, y se reserva la pauta de tres inyecciones semanales para pacientes con un episodio recurrente de FRA pese a realizar adecuadamente la pauta de cuatro veces a la semana.12,13,76 La duración de la profilaxis depende de la gravedad de la lesión y la edad del paciente. El período mínimo de profilaxis recomendado en la mayoría de las directrices para pacientes con antecedentes de FRA sin carditis es al menos de 5 años, pero directrices recientes sugieren un mínimo de 10 años, o hasta los 21 años de edad, lo que sea más largo, y en caso de una enfermedad valvular más grave la duración es incluso mayor.12,57,58,76 En la tabla 5 se presenta la duración de la profilaxis secundaria según las cuatro directrices vigentes: Australia, Nueva Zelanda, EE. UU. y OMS. Desde un punto de vista de salud pública está claro que es necesaria una coordinación efectiva para que una profilaxis secundaria en múltiples pacientes tenga éxito. Los programas de prevención secundaria con registros centralizados han demostrado fomentar una coordinación efectiva en la profilaxis secundaria.88 Otros componentes clave de los programas de prevención secundaria de éxito son las estrategias par aumentar la adherencia a la profilaxis secundaria, programas que permitan la detección precoz de FRA y CR (incluyendo programas de cribado de CR) y programas de educación sanitaria y promoción de la salud para personal sanitario, pacientes y sus familias.89 Cribado de CR La OMS recomienda el cribado escolar de la CR para detectar pacientes que no hayan sido diagnosticados anteriormente en zonas y poblaciones de prevalencia alta.58 El fundamento del cribado es que la detección precoz de una enfermedad leve, más proclive a responder a la profilaxis secundaria, es una estrategia coste-efectiva. Existe cierto debate acerca de la mejor forma de cribado. Recientes avances tecnológicos han permitido desarrollar ecocardiógrafos pequeños, de fácil transporte y alta calidad, lo que significa que el cribado de campo con ecocardiograma se realiza cada vez más. Estudios en tres países (Mozambique, Camboya y Tonga) han mostrado que el ecocardiograma como herramienta primaria de cribado de CR es extremadamente sensible.55,56 De la misma forma, la prevalencia de CR detectada en el cribado con ecocardiograma en el estudio de Mozambique era 13 veces mayor que la Fiebre reumática aguda y cardiopatía reumática Tabla 5 Duración de la profilaxis secundaria de la fiebre y la cardiopatía reumáticas, según diferentes directrices Directriz Australia Duración 12 Sin carditis: 10 años o hasta cumplir 21 años (lo que resulte mayor tiempo). Carditis de FRA resuelta: 10 años o hasta cumplir 21 años (lo que resulte mayor tiempo). CR moderada: 35 años de edad. CR grave: 40 años de edad (o más) Nueva Zelanda13 Sin carditis: 10 años o hasta cumplir 21 años (lo que resulte mayor tiempo). Carditis moderada: 10 años o hasta cumplir 30 años (lo que resulte mayor tiempo). Carditis grave: 10 años o hasta cumplir 30 años (lo que resulte mayor tiempo); posteriormente el especialista lo revisará para considerar si ha de ser más prolongada o incluso para toda la vida EE. UU.76 Sin carditis: 5 años o hasta cumplir 21 años (lo que resulte mayor tiempo). FRA con carditis inicial pero sin CR residual: 10 años o hasta cumplir 21 años (lo que resulte mayor tiempo). FRA con carditis y enfermedad valvular persistente: 10 años o hasta cumplir 40 (lo que resulte mayor tiempo), a veces para toda la vida OMS58 Sin carditis: 5 años o hasta cumplir 18 años (lo que resulte mayor tiempo). FRA con carditis, curada o con regurgitación mitral: 10 años o hasta cumplir 25 años (lo que resulte mayor tiempo). CR más grave o cirugía valvular: toda la vida Abreviaturas: CR, cardiopatía reumática; FRA, fiebre reumática aguda. detectada con el cribado basado en la auscultación (prevalencia con ecocardiograma 30,4 casos por 1.000 niños cribados). Existe una clara necesidad de determinar y estandarizar el mejor método de cribado de CR y de establecer criterios aceptados y validados para el diagnóstico ecocardiográfico de CR (para evitar la posibilidad de diagnosticar en exceso). Actualmente se están realizando estudios para determinar la sensibilidad y especificidad del ecocardiograma como herramienta de cribado.83,90 PERSPECTIVAS DE VACUNA PARA LA FIEBRE REUMÁTICA Una vacuna contra el EGA podría prevenir la FRA y la CR al evitar la infección previa por EGA. Sin embargo, faltan varios años para desarrollar una vacuna efectiva ampliamente disponible.91,92 Se han completado ensayos de fase 2 de una vacuna específica tipo M multivalente que ha demostrado seguridad e inmunogenicidad.93 Sin embargo, la composición de esta vacuna puede significar que su efectividad sea limitada en la población indígena a causa de los distintos perfiles de tipo M.32,94,95 Una vacuna que utilizase un antígeno que se mantuviese en todos los EGA podría ser una estrategia más prometedora para algunos grupos indígenas, aunque ninguna de estas vacunas ha llegado a utilizarse en ensayos clínicos.96–99 Para desarrollar una vacuna específica contra la FRA y la CR sería fundamental que todos los ensayos se realizaran en poblaciones en las que la FRA y la CR son frecuentes, incluyendo poblaciones indígenas.91,92 RESUMEN Y CONCLUSIONES La FRA y la CR son enfermedades propias de situaciones socioeconómicas desfavorecidas y son frecuentes entre la población indígena. Las razones de las altas tasas entre indígenas no están claras, pero entre ellas pueden estar la función potencial del impétigo por EGA en la 1413 1414 Steer y Carapetis patogénesis de la FRA y la posibilidad de susceptibilidad genética. El diagnóstico de FRA se basa en varios criterios clínicos, y los médicos deben tener un alto índice de sospecha del diagnóstico potencial de FRA. El tratamiento de la FRA ha cambiado poco en los últimos 50 años, y el pilar del tratamiento sintomático de la FRA siguen siendo los fármacos antiinflamatorios simples, como el ácido acetilsalicílico. Ningún tratamiento utilizado en el tratamiento de la FRA afecta la evolución cardíaca a largo plazo, y son necesarias más investigaciones en este campo. Faltan años para disponer de una vacuna efectiva y ampliamente disponible contra el EGA. La prevención secundaria es la medida más efectiva para controlar la FRA y la CR en la actualidad. No existe un abordaje de la prevención primaria que se haya probado con claridad y que sea coste-efectivo a nivel poblacional, y aunque sea una estrategia importante sólo debería convertirse en enfoque de salud pública importante cuando se hayan establecido una profilaxis secundaria y un programa de control basado en registros. BIBLIOGRAFÍA 1. Sanyal SK, Berry AM, Duggal S, et al. Sequelae of the initial attack of acute rheumatic fever in children from north India. A prospective 5-year follow-up study. Circulation 1982;65:375–9. 2. Sanyal SK, Thapar MK, Ahmed SH, et al. The initial attack of acute rheumatic fever during childhood in north India; a prospective study of the clinical profile. Circulation 1974;49:7–12. 3. Steer AC, Kado J, Jenney AW, et al. Acute rheumatic fever and rheumatic heart disease in Fiji: prospective surveillance, 2005–2007. Med J Aust 2009;190:133–5. 4. Brown A, McDonald MI, Calma T. Rheumatic fever and social justice. Med J Aust 2007;186:557–8. 5. Carapetis JR, Steer AC, Mulholland EK, et al. The global burden of group A streptococcal diseases. Lancet Infect Dis 2005;5:685–94. 6. Quinn RW. Comprehensive review of morbidity and mortality trends for rheumatic fever, streptococcal disease, and scarlet fever: the decline of rheumatic fever. Rev Infect Dis 1989;11:928–53. 7. Carapetis JR. Rheumatic heart disease in Asia. Circulation 2008;118:2748–53. 8. Neutze JM. Rheumatic fever and rheumatic heart disease in the western Pacific region. N Z Med J 1988;101:404–6. 9. Chun LT, Reddy DV, Yim GK, et al. Acute rheumatic fever in Hawaii: 1966 to 1988. Hawaii Med J 1992;51:206–11. 10. Carapetis JR, Wolff DR, Currie BJ. Acute rheumatic fever and rheumatic heart disease in the top end of Australia’s Northern Territory. Med J Aust 1996;164:146–9. 11. Jaine R, Baker M, Venugopal K. Epidemiology of acute rheumatic fever in New Zealand 1996–2005. J Paediatr Child Health 2008;44:564–71. 12. National Heart Foundation of Australia (RF/RHD guideline development working group), the Cardiac Society of Australia and New Zealand. Diagnosis and management of acute rheumatic fever and rheumatic heart disease in Australia – an evidence-based review. Canberra: National Heart Foundation of Australia; 2006. 13. National Heart Foundation of New Zealand, Cardiac Society of Australia and New Zealand. Evidence-based, best practice New Zealand guidelines for rheumatic fever 1. Diagnosis, management and secondary prevention. Auckland: National Heart Foundation of New Zealand; 2006. 14. Steer AC, Carapetis JR, Nolan TM, et al. Systematic review of rheumatic heart disease prevalence in children in developing countries: the role of environmental factors. J Paediatr Child Health 2002;38:229–34. 15. Gordis L, Lilienfeld A, Rodriguez R. Studies in the epidemiology and preventability of rheumatic fever. II. Socio-economic factors and the incidence of acute attacks. J Chronic Dis 1969;21:655–66. Fiebre reumática aguda y cardiopatía reumática 16. Wannamaker LW. The epidemiology of streptococcal infections. In: McCarty M, editor. Streptococcal infections. New York: Columbia University Press; 1954. 17. Longo-Mbenza B, Bayekula M, Ngiyulu R, et al. Survey of rheumatic heart disease in school children of Kinshasa town. Int J Cardiol 1998;63:287–94. 18. McDonald MI, Towers RJ, Andrews RM, et al. Low rates of streptococcal pharyngitis and high rates of pyoderma in Australian Aboriginal communities where acute rheumatic fever is hyperendemic. Clin Infect Dis 2006;43:683–9. 19. Carapetis JR, Currie BJ, Good MF. Towards understanding the pathogenesis of rheumatic fever. Scand J Rheumatol 1996;25:127–31. 20. Carapetis JR, Currie BJ, Mathews JD. Cumulative incidence of rheumatic fever in an endemic region: a guide to the susceptibility of the population? Epidemiol Infect 2000;124:239–44. 21. Bryant PA, Robbins-Browne R, Carapetis JR, et al. Some of the people, some of the time. Susceptibility to acute rheumatic fever. Circulation 2009;119:742–53. 22. Rammelkamp CH, Wannamaker LW, Denny FW. The epidemiology and prevention of rheumatic fever. 1952. Bull N Y Acad Med 1997;74:119–33. 23. Holmes MC, Rubbo SD. A study of rheumatic fever and streptococcal infection in different social groups in Melbourne. J Hyg (Lond) 1953;51:450–7. 24. Harrington Z, Visvanathan K, Skinner NA, et al. B-cell antigen D8/17 is a marker of rheumatic fever susceptibility in Aboriginal Australians and can be tested in remote settings. Med J Aust 2006;184:507–10. 25. Khanna AK, Buskirk DR, Williams RC Jr, et al. Presence of a non-HLA B cell antigen in rheumatic fever patients and their families as defined by a monoclonal antibody. J Clin Invest 1989;83:1710–6. 26. Harel L, Zeharia A, Kodman Y, et al. Presence of the d8/17 B-cell marker in children with rheumatic fever in Israel. Clin Genet 2002;61:293–8. 27. Kaur S, Kumar D, Grover A, et al. Ethnic differences in expression of susceptibility marker(s) in rheumatic fever/rheumatic heart disease patients. Int J Cardiol 1998;64:9–14. 28. Taneja V, Mehra NK, Reddy KS, et al. HLA-DR/DQ antigens and reactivity to B cell alloantigen D8/17 in Indian patients with rheumatic heart disease. Circulation 1989;80:335–40. 29. Bisno AL, Pearce IA, Wall HP, et al. Contrasting epidemiology of acute rheumatic fever and acute glomerulonephritis. N Engl J Med 1970;283:561–5. 30. Carapetis JR, Currie BJ. Group A streptococcus, pyoderma, and rheumatic fever. Lancet 1996;347:1271–2. 31. Martin DR. Rheumatogenic and nephritogenic group A streptococci. Myth or reality? An opening lecture. Adv Exp Med Biol 1997;418:21–7. 32. Bessen DE, Carapetis JR, Beall B, et al. Contrasting molecular epidemiology of group A streptococci causing tropical and nontropical infections of the skin and throat. J Infect Dis 2000;182:1109–16. 33. Steer AC, Magor G, Jenney AW, et al. emm and C-repeat region molecular typing of betahemolytic streptococci in a tropical country: implications for vaccine development. J Clin Microbiol 2009;47(8):2502–9. 34. Martin DR, Voss LM, Walker SJ, et al. Acute rheumatic fever in Auckland, New Zealand: spectrum of associated group A streptococci different from expected. Pediatr Infect Dis J 1994;13:264–9. 35. McDonald M, Currie BJ, Carapetis JR. Acute rheumatic fever: a chink in the chain that links the heart to the throat? Lancet Infect Dis 2004;4:240–5. 36. Steer AC, Tikoduadua LV, Manalac EM, et al. Validation of an Integrated Management of Childhood Illness algorithm for the management of common skin conditions in Fiji. Bull World Health Organ 2009;87:173–9. 37. Lawrence GW, Leafasia J, Sheridan J, et al. Control of scabies, skin sores and haematuria in children in the Solomon Islands: another role for ivermectin. Bull World Health Organ 2005;83:34–42. 1415 1416 Steer y Carapetis 38. Guidelinesforthediagnosisofrheumaticfever.JonesCriteria,1992update.SpecialWritingGroupof the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young of the American Heart Association. JAMA 1992;268:2069–73. 39. Jones TD. The diagnosis of rheumatic fever. JAMA 1944;126:481–4. 40. Rutstein DD, Bauer W, Dorfman A, et al. Jones Criteria (modified) for guidance in the diagnosis of rheumatic fever; report of the Committee on Standards and Criteria for programs of care. Circulation 1956;13:617–20. 41. Committee of Rheumatic Fever and Bacterial Endocarditis of the American Heart Association: Jones Criteria (revised) for guidance in the diagnosis of rheumatic fever. Circulation 1984;69:204A–8A. 42. Stollerman GH, Markowitz M, Taranta A, et al. Committee report: Jones Criteria (revised) for guidance in the diagnosis of rheumatic fever. Circulation 1965;32:664–8. 43. Pereira BAF, da Silva NA, Andrade LEC, et al. Jones Criteria and underdiagnosis of rheumatic fever. Indian J Pediatr 2007;74:117–21. 44. Cherian G. Acute rheumatic fever–the Jones Criteria: a review and a case for polyarthralgia. J Assoc Physicians India 1979;27:453–7. 45. Padmavati S, Gupta V. Reappraisal of the Jones Criteria: the Indian experience. N Z Med J 1988;101:391–2. 46. Carapetis JR, Currie BJ. Rheumatic fever in a high incidence population: the importance of monoarthritis and low grade fever. Arch Dis Child 2001;85:223–7. 47. Mataika R, Carapetis JR, Kado J, et al. Acute rheumatic fever: an important differential diagnosis of septic arthritis. J Trop Pediatr 2008;54:205–7. 48. Harlan GA, Tani LY, Byington CL. Rheumatic fever presenting as monoarticular arthritis. Pediatr Infect Dis J 2006;25:743–6. 49. Wilson E, Wilson N, Voss L, et al. Monoarthritis in rheumatic fever? Pediatr Infect Dis J 2007;26:369–70. 50. Vasan RS, Shrivastava S, Vijayakumar M, et al. Echocardiographic evaluation of patients with acute rheumatic fever and rheumatic carditis. Circulation 1996;94:73–82. 51. Tubridy-Clark M, Carapetis JR. Subclinical carditis in rheumatic fever: a systematic review. Int J Cardiol 2007;119:54–8. 52. Narula J, Kaplan EL. Echocardiographic diagnosis of rheumatic fever. Lancet 2000;2001:358. 53. Wilson NJ, Neutze JM. Echocardiographic diagnosis of subclinical carditis in acute rheumatic fever. Int J Cardiol 1995;50:1–6. 54. Veasy LG. Time to take soundings in acute rheumatic fever. Lancet 2001;357:1994–5. 55. Marijon E, Ou P, Celermajer DS, et al. Prevalence of rheumatic heart disease detected by echocardiographic screening. N Engl J Med 2007;357:470–6. 56. Carapetis JR, Hardy M, Fakakovikaetau T, et al. High prevalence of rheumatic heart disease in Tongan school children, and evaluation of a screening protocol using portable echocardiography. Nat Clin Pract Cardiovasc Med 2008;5:411–7. 57. Working Group on Pediatric Acute Rheumatic Fever and Cardiology Chapter of Indian Academy of Pediatrics. Consensus guidelines on pediatric acute rheumatic fever and rheumatic heart disease. Indian Pediatr 2008;45:565–73. 58. Rheumatic fever and rheumatic heart disease: report of a WHO Expert Consultation Geneva. Geneva: World Health Organization; 2004. 59. Hashkes PJ, Tauber T, Somekh E, et al. Naproxen as an alternative to aspirin for the treatment of arthritis of rheumatic fever: a randomized trial. J Pediatr 2003;143:399–401. 60. Feinstein AR, Spagnuolo M, Gill FA. The rebound phenomenon in acute rheumatic fever. I. Incidence and significance. Yale J Biol Med 1961;33:259–78. 61. Holt KS. The rebound phenomenon in acute rheumatic fever. Arch Dis Child 1956;31:444–51. Fiebre reumática aguda y cardiopatía reumática 62. Carapetis JR, Kilburn CJ, MacDonald KT, et al. Ten-year follow up of a cohort with rheumatic heart disease (RHD). Aust N Z J Med 1997;27:691–7. 63. Rheumatic Fever Working Party. The natural history of rheumatic fever and rheumatic heart disease: ten-year report of a cooperative clinical trial of ACTH, cortisone, and aspirin. Circulation 1965;32:457–76. 64. Bywaters EGL, Thomas GT. Bed rest, salicylates and steroid in rheumatic fever. BMJ 1961;1:1628–34. 65. Dorfman A, Gross JI, Lorincz AE. The treatment of acute rheumatic fever. Pediatrics 1961;27:692–706. 66. Illingworth RS, Lorber J, Holt KS. Acute rheumatic fever in children: a comparison of six forms of treatment in 200 cases. Lancet 1957;273:653–9. 67. Cilliers AM, Manyemba J, Saloojee H. Anti-inflammatory treatment for carditis in acute rheumatic fever. Cochrane Database Syst Rev 2003;(2):CD003176. 68. Czoniczer G, Amezcua F, Pelargonio S, et al. Therapy of severe rheumatic carditis. Comparison of adrenocortical steroids and aspirin. Circulation 1964;29:813–9. 69. Albert DA, Harel L, Karrison T. The treatment of rheumatic carditis: a review and metaanalysis. Medicine (Baltimore) 1995;74:1–12. 70. Thatai D, Turi ZG. Current guidelines for the treatment of patients with rheumatic fever. Drugs 1999;57:545–55. 71. Lessof MH, Bywaters EG. The duration of chorea. Br Med J 1956;1:1520–3. 72. Carapetis JR, Currie BJ. Rheumatic chorea in northern Australia: a clinical and epidemiological study. Arch Dis Child 1999;80:353–8. 73. Pena J, Mora E, Cardozo J, et al. Comparison of the efficacy of carbamazepine, haloperidol and valproic acid in the treatment of children with Sydenham’s chorea: clinical follow-up of 18 patients. Arq Neuropsiquiatr 2002;60:374–7. 74. Voss LM, Wilson NJ, Neutze JM, et al. Intravenous immunoglobulin in acute rheumatic fever: a randomized controlled trial. Circulation 2001;103:401–6. 75. Veasy LG, Wiedmeier SE, Orsmond GS, et al. Resurgence of acute rheumatic fever in the intermountain area of the United States. N Engl J Med 1987;316:421–7. 76. Gerber MA, Baltimore RS, Eaton CB, et al. Prevention of rheumatic fever and diagnosis and treatment of acute streptococcal pharyngitis: a scientific statement from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Translational Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research: endorsed by the American Academy of Pediatrics. Circulation 2009;119:1541–51. 77. Del Mar CB, Glasziou PP, Spinks AB. Antibiotics for sore throat. Cochrane Database Syst Rev 2000;(4):CD000023. 78. Denny F, Wannamaker L, Brink W, et al. Prevention of rheumatic fever; treatment of preceding streptococci infection. JAMA 1950;143:151–3. 79. Robertson KA, Volmink JA, Mayosi BM. Antibiotics for the primary prevention of acute rheumatic fever: a meta-analysis. BMC Cardiovasc Disord 2005;31:11. 80. Stollerman GH, Rusoff JH, Hirschfeld I. Prophylaxis against group A streptococci in rheumatic fever; the use of single monthly injections of benzathine penicillin G. N Engl J Med 1955;252:787–92. 81. Tompkins DG, Boxerbaum B, Liebman J. Long-term prognosis of rheumatic fever patients receiving regular intramuscular benzathine penicillin. Circulation 1972;45:543–51. 82. Michaud C, Rammohan R, Narula J. Cost-effectiveness analysis of intervention strategies for reduction of the burden of rheumatic heart disease. In: Narula J, Virmani R, Reddy KS, et al, editors. Rheumatic fever. Washington, DC: American Registry of Pathology; 1999. p. 485–97. 1417 1418 Steer y Carapetis 83. Carapetis JR. Rheumatic heart disease in developing countries. N Engl J Med 2007;357:439–41. 84. Strasser T. Cost-effective control of rheumatic fever in the community. Health Policy 1985;5:159–64. 85. Manyemba J, Mayosi BM. Penicillin for secondary prevention of rheumatic fever. Cochrane Database Syst Rev 2002;(3):CD002227. 86. Lue HC, Wu MH, Hsieh KH, et al. Rheumatic fever recurrences: controlled study of 3-week versus 4-week benzathine penicillin prevention programs. J Pediatr 1986;108:299–304. 87. Lue HC, Wu MH, Wang JK, et al. Long-term outcome of patients with rheumatic fever receiving benzathine penicillin G prophylaxis every three weeks versus every four weeks. J Pediatr 1994;125:812–6. 88. McDonald M, Brown A, Noonan S, et al. Preventing rheumatic fever: the role of register based programmes. Heart 2005;91:1131–3. 89. Bach JF, Chalons S, Forier E, et al. 10-year educational programme aimed at rheumatic fever in two French Caribbean islands. Lancet 1996;347:644–8. 90. Carapetis JR. Pediatric rheumatic heart disease in the developing world: echocardiographic versus clinical screening. Nat Clin Pract Cardiovasc Med 2008;5:74–5. 91. Bisno AL, Rubin FA, Cleary PP, et al. Prospects for a group A streptococcal vaccine: rationale, feasibility, and obstacles–report of a National Institute of Allergy and Infectious Diseases workshop. Clin Infect Dis 2005;41:1150–6. 92. Group A streptococcal vaccine development: current status and issues of relevance to less developed countries. Geneva: World Health Organization, Department of Child and Adolescent Health and Development; 2005. 93. McNeil SA, Halperin SA, Langley JB, et al. A double-blinded, randomized, controlled phase II trial of the safety and immunogenicity of a 26 valent group A streptococcus vaccine in healthy adults. The XVIth Lancefield International Symposium on Streptococci and Streptococcal Diseases; 2005:25–29. September 2005; Palm Cove, Australia. 94. Steer AC, Jenney AWJ, Kado J, et al. Invasive group A streptococcal disease in Fiji: prospective surveillance 2005–2007. Emerg Infect Dis 2009;15:216–22. 95. Tewodros W, Kronvall G. M protein gene (emm-type) analysis of group A beta hemolytic streptococci from Ethiopia reveals unique patterns. J Clin Microbiol 2005;43:4369–76. 96. Sabharwal H, Michon F, Nelson D, et al. Group A streptococcus (GAS) carbohydrate as an immunogen for protection against GAS infection. J Infect Dis 2006;193:129–35. 97. Shet A, Kaplan EL, Johnson DR, et al. Immune response to group A streptococcal C5a peptidase in children: implications for vaccine development. J Infect Dis 2003;188:809–17. 98. Batzloff MR, Hayman WA, Davies MR, et al. Protection against group A streptococcus by immunization with J8-diptheria toxoid: contribution of J8-and diptheria toxoid-specific antibodies to protection. J Infect Dis 2003;187:1598–608. 99. Batzloff M, Yan H, Davies M, et al. Preclinical evaluation of a vaccine based on conserved region of M protein that prevents group A streptococcal infection. Indian J Med Res 2004; 119(Suppl):104–7. 100. Davidson M, Bulkow LR, Gellin BG. Cardiac mortality in Alaska’s indigenous and non-Native residents. Int J Epidemiol 1993;22:62–71. 101. Schaffer WL, Galloway JM, Roman MJ, et al. Prevalence and correlates of rheumatic heart disease in American Indians (The Strong Heart Study). Am J Cardiol 2003;91:1379–82. 102. Longstaffe S, Postl B, Kao H, et al. Rheumatic fever in native children in Manitoba. Can Med Assoc J 1982;127. 103. Steer AC, Kado J, Wilson N, et al. High prevalence of rheumatic heart disease by clinical and echocardiographic screening among children in Fiji. J Heart Valve Dis 2009;18:327–35. 104. Chun LT, Reddy DV, Yamamoto LG. Rheumatic fever in children and adolescents in Hawaii. Pediatrics 1987;79:549–52. Fiebre reumática aguda y cardiopatía reumática 105. Wannamaker LW, Rammelkamp CH Jr., Denny FW. Prophylaxis of acute rheumatic fever by treatment of the preceding streptococcal infection with various amounts of depot penicillin. Am J Med 1951;10:673–81. 106. Manyemba J, Mayosi BM. Intramuscular penicillin is more effective than oral penicillin in secondary prevention of rheumatic fever–a systematic review. S Afr Med J 2003;93:212–8. 1419