CINETICA QUÍMICA
Anuncio

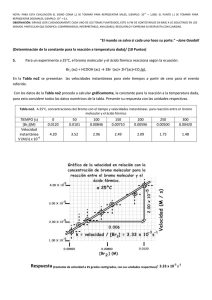
CINETICA QUÍMICA La Termodinámica nos indica si una reacción química puede ocurrir o no Pero no nos dice nada acerca de la velocidad a la cual ocurrirá Ej.: 1 H2 (g) + O 2 (g) → H2O(l) 2 ΔG = -56,69 Kcal ΔG < 0 ⇒ reacción espontánea Sin embargo, la reacción es muy lenta La Cinética es la rama de la Química que estudia la velocidad de las reacciones Cinética química La velocidad de una reacción se expresa como el cambio de las concentraciones en función del tiempo. A medida que se forman productos, comienza a producirse la reacción inversa. aA+bB cC+dD velocidad neta = velocidad directa – velocidad inversa (En el equilibrio las dos velocidades se igualan) Concentración molar Hidrógeno (reactivo) N2 + 3H2 Nitrógeno (reactivo) Amoníaco (producto) Tiempo 2NH3 Factores que afectan la velocidad de las reacciones químicas • Naturaleza de los reactivos • Concentración de los reactivos • Temperatura • Presencia de un catalizador • Área superficial de sólidos o líquidos reactivos Velocidades media e instantánea A→B Velocidad promedio vv = − tangente al tiempo t [A] t Δ [A] Δt Velocidad instantánea d [A] v=− dt Para el caso en el que sólo es importante la velocidad de la reacción directa: aA+bB→cC+dD v= − 1 d[A] = a dt − 1 d[B] = b dt 1 d[C] = c dt 1 d[D] d dt Ejemplos: NO + O3 → NO2 + O2 v=− d[O3 ] d[NO 2 ] d[O 2 ] d[NO] =− = = dt dt dt dt 2 HI(g) → I2(g) + H2(g) v=− 1 d[HI] d[H2 ] d[H2 ] = = 2 dt dt dt Leyes de velocidad aA+bB→cC+dD La velocidad de una reacción depende de las concentraciones de los reactivos: v = k [ A ]m [B]n v: velocidad k: constante de velocidad m: orden de reacción respecto de A n: orden de reacción respecto de B n + m: orden global de reacción n y m se determinan experimentalmente En general el orden de reacción no está relacionado con los coeficientes estequiométricos de la ecuación balanceada Ejemplos: I2(g) + H2(g) → 2 HI(g) v=− d[H2 ] = k[H2 ] [I2 ] dt Br2(g) + H2(g) → 2 HBr(g) v=− d[H2 ] = k[H2 ] [Br2 ]1/ 2 dt Leyes integradas de velocidad • Integrando la ley de velocidad podemos predecir las concentraciones de los reactivos y productos en función del tiempo • Tiempo medio de reacción (t1/2): tiempo necesario para que la mitad del reactivo se transforme en producto Para la reacción A → B: v=– d[A] =k dt d[A] = – k dt [A] t [A]0 t =0 ∫ d[A] = ∫ − k dt Tiempo Conc. de reactivo [ A ] – [A]0 = – kt [ A ] = [A]0 – kt Tiempo Reacciones de orden cero Tiempo medio [ A ] = [A]0 – kt Al tiempo medio : [A ] = [A ] 0 2 t1/2 = [A ] 0 2 = [A]0 – kt1/2 [A ] 0 2k Veloc. de reacción Reacciones de orden cero [A]0/2 Reacciones de primer orden Para la reacción A → B: v=– d[A] = k[A ] dt d[A] = – k dt [A] d[A] t = ∫ − k dt [A]0 [A] t =0 [A] ∫ ln [A] = – kt [A]0 Tiempo (minutos) ln[ A ] − ln[A]0 = – kt Reacciones de primer orden ln [ A ]t = − kt [ A]0 ln [ A]0 = − kt1 / 2 2[ A]0 ln 2 = t1 / 2 k (Independiente de [A]0) Concentración molar de A, [A] Tiempo medio k pequeña t1/2 largo t1/2 corto k grande Tiempo Reacciones de segundo orden Para la reacción A → B: d[A] = – k dt [A] 2 d[A] t = ∫ − k dt 2 [A]0 [A] t =0 [A] ∫ 1 1 = kt [ A ] [A]0 1 1 = + kt [ A ] [A]0 v=– d[A] 2 = k[A ] dt Reacciones de segundo orden Tiempo medio 1 1 = kt + [A] [A]0 Si t = t1/2, [A]t = [A]0/2 t1/2 = Orden 1 [A]0 k Ecuac. de veloc. Ecuac. integrada tiempo medio Cero v=k C - C0 = −k t t1/ 2 = C0 2k Uno v = k [A] ln C = −k t C0 t1/ 2 = ln 2 k t1/2 = 1 k C0 Dos Unidades de k v=k [A]2 1 1 − = kt C C0 Determinación experimental de las leyes de velocidad 1) Método de las velocidades iniciales Se determina la velocidad inicial a diferentes concentraciones iniciales de reactivo. Se determina el orden a través de la ecuación de velocidad: v = k [A]n [B]m Ejemplo: A+2B → C vinicial /Ms-1 [A]0 [B]0 5.50 x 10-6 2.20 x 10-5 1.65 x 10-5 0.10 0.20 0.10 0.10 0.10 0.30 v 1 5.50 × 10 −6 M/s 1 k(0.10 M)m (0.10 M)n = = = v 2 2.20 × 10 −5 M/s 4 k(0.20 M)m (0.10 M)n 1 ⎛ 1⎞ =⎜ ⎟ 4 ⎝2⎠ m m=2 v 1 5.50 × 10 −6 M/s 1 k(0.10 M)m (0.10 M)n = = = v 3 1.65 × 10 −5 M/s 3 k(0.10 M)m (0.30 M)n 1 ⎛ 1⎞ =⎜ ⎟ 3 ⎝3⎠ k= n n =1 5.50 × 10 −6 Ms-1 = 5.50 × 10 −4 M-2 s -1 (0.10 M)2 × 0.10 M v = 5.50 x 10-3 M-2s-1 [A]2 [B] Determinación experimental de las leyes de velocidad 2) Método de ensayo: se determina la concentración de reactivo a distintos intervalos de tiempo. a) Se reemplaza en la ecuación integrada de velocidad y se calcula k. Aquella ecuación que proporcione el valor más constante, es la que mejor corresponde al orden de reacción. b) Se grafican los valores de acuerdo a las ecuaciones integradas de velocidad. Ejemplo: para la reacción Br2(ac) + HCOOH(ac) → 2 Br-(ac) + 2 H+(ac) + CO2(g) se coloca un gran exceso de HCOOH y se mide la concentración de Br2 en función del tiempo: tiempo / s [Br2] 0 50 100 150 200 250 300 350 400 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296 tiempo / s [Br2] 0 50 100 150 200 250 300 350 400 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296 Orden cero: 0,0101 – 0,0120 = - k x 50 k = 1,98x10-4 M/s 0,00596 – 0,0120 = - k x 200 k = 3,02x10-5 M/s 0,00296 – 0,0120 = - k x 400 k = 2,26x10-5 M/s 0.014 0.012 [Br2] 0.010 0.008 0.006 0.004 0.002 0 100 200 t / seg 300 400 500 tiempo / s [Br2] 0 50 100 150 200 250 300 350 400 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296 ln [Br2] -4 Primer orden: ln 0.0101 = −k × 50 0.0120 k = 3.4 × 10 −3 s −1 ln 0.00596 = −k × 200 0.0120 k = 3.5 × 10 −3 s −1 ln 0.00296 = −k × 400 0.0120 k = 3.5 × 10 −3 s −1 -5 -6 0 100 200 300 400 500 t/s [Br2] 0 50 100 150 200 250 300 350 400 0,0120 0,0101 0,00846 0,00710 0,00596 0,00500 0,00420 0,00353 0,00296 1 / [Br2] tiempo / s 400 350 300 250 200 150 100 50 0 0 100 200 300 400 500 t/s Segundo orden: 1 1 − = k × 50 0.0101 0.0120 k = 0.31 1 1 − = k × 200 0.00596 0.0120 k = 0.42 1 1 − = k × 400 0.00296 0.0120 k = 0.64 Determinación experimental de las leyes de velocidad 3) Tiempo medio de reacción t1/ 2 = cte × 1 Cn0−1 Ejemplo: En la descomposición del acetaldehído gaseoso a 528 ºC se encontró que el tiempo necesario para descomponer la mitad del material era 410 s cuando la presión inicial era 363 torr y 880 s para una presión inicial de 169 torr. ¿Cuál es el orden de la reacción? ¿Cuánto vale la constante de velocidad? t 1/ 2 = 1 k C0 k= 1 t 1/ 2 C 0 1 = 6.7 × 10 −6 torr −1s −1 410 s × 363 torr 1 k= = 6.7 × 10 −6 torr −1s −1 880 s × 169 torr k= Mecanismo de reacción • La ecuación química proporciona información cuali y cuantitativa global sobre la reacción • El mecanismo de reacción proporciona los pasos a través de los cuales los reactivos se transforman en productos • Las reacciones elementales proceden a través de etapas • Etapa elemental: es una ecuación química o reacción que describe un proceso tal cual ocurre a nivel molecular. Un evento de reacción sencillo que ocurre en una simple colisión atómica o molecular. número de moléculas que • Molecularidad: intervienen en una etapa elemental de reacción. Los procesos pueden ser unimoleculares, bimoleculares o termoleculares. Mecanismo de reacción NO2 + CO → NO + CO2 k1 NO2 + NO2 → NO + NO3 k2 NO3 + CO → NO2 + CO2 Otro ejemplo: 2 N2O → 2N2 + O2 (reacción global) Molecularidad Número de moléculas de reactivo que intervienen en un proceso elemental Proceso unimolecular: Proceso bimolecular: Proceso termolecular: (son raros) La molecularidad coincide con el orden de reacción del proceso elemental Las reacciones o etapas elementales unimoleculares presentan leyes de velocidad de primer orden A → productos v = k [A] Las reacciones o etapas elementales bimoleculares presentan leyes de velocidad de segundo orden A + A → productos A + B → productos v = k [A]2 v = k [A] [B] Cuando un mecanismo de reacción está formado por una serie de etapas elementales la ley de velocidad global estará determinada por la etapa más lenta, llamada paso determinante de la velocidad Para la reacción: 3A+2B→C+D A+B → E+F A+E → H A+F → G H+G+B → C+D 3A+2B→C+D Si la primera etapa es la más lenta: − 1 d[ A ] = k 1[ A ] [B] 3 dt Un mecanismo de reacción propuesto debe dar lugar a una ley de velocidad que concuerde con aquélla determinada experimentalmente Para la reacción NO2 → 2 NO + O2 La ley de velocidad experimental es v = k[NO2]2 Se proponen dos mecanismos: • NO2 → NO + O O + NO2 → O2 + NO (lento) (rápido) • 2 NO2 → NO3 + NO NO3 → NO + O2 (lento) (rápido) ¿Cuál sería el “correcto”? • Un mecanismo es posible si: – da la correcta estequiometría global – predice la ley de velocidad correcta – parece “químicamente razonable” • Un mecanismo nunca puede ser probado en forma absoluta, pero se puede encontrar buena evidencia detectando alguno de los intermediarios postulados en él. Efecto de la temperatura sobre la velocidad de reacción En general la velocidad de una reacción química aumenta al aumentar la temperatura (al cambiar T cambia el valor de k) 2 N2O5 → 4 NO2 + O2 temp / ºC 25 45 65 k 3.46 x 10-5 4.19 x 10-4 4.87 x 10-3 Ecuación de Arrhenius k=Ae − Ea RT A (factor pre-exponencial): depende de la frecuencia de colisiones entre moléculas de reactivos y de la orientación que adoptan las mismas Ea (energía de activación): energía mínima que deben tener las moléculas de los reactivos para transformarse en productos Ambos son independientes de T, pero dependen de cada reacción en particular ln k = ln A − ln Ea RT k2 E ⎛ 1 1⎞ =− a⎜ − ⎟ k1 R ⎝ T2 T1 ⎠ Logaritmo de la constante de velocidad, ln k→ k = A e −Ea / RT Pendiente = -Ea/R 1/Temperatura, 1/T Midiendo k a dos temperaturas es posible conocer k Teoría de las colisiones Es una teoría enunciada para reacciones en fase gaseosa Al aumentar la temperatura las moléculas tienen mayor energía (de acuerdo a la Teoría Cinética de los Gases) y aumenta el número de colisiones Los reactivos necesitan chocar para reaccionar, pero no se produce reacción en todas las colisiones. Las moléculas deben tener una cierta energía mínima para reaccionar Teoría de las colisiones Las moléculas de los reactivos deben poseer la energía suficiente (llamada E de activación) para que pueda ocurrir la ruptura de enlaces, un reordenamiento de los átomos y luego la formación de los productos. Si no se dispone de la E suficiente las moléculas rebotan sin formar los productos. Teoría de las colisiones Fracción de moléculas Baja temperatura Alta temperatura kinetics1.swf Energía cinética La fracción del número total de moléculas que colisionan con una energía cinética mayor a Ea se muestran en las regiones sombreadas debajo de las curvas. Esta fracción aumenta rápidamente al aumentar la temperatura Teoría de las colisiones Además las moléculas de los reactivos deben tener la orientación adecuada durante el choque Reacción Sin reacción Cono de reacción Teoría de las colisiones Si la colisión cumple con estos dos requisitos (energía suficiente y orientación adecuada) se dice que es efectiva y ocurre la reacción. El factor pre- exponencial (A) está relacionado con el número de colisiones efectivas factor pre- exponencial (A) k = P σv rel N2A e −Ea / RT frecuencia de colisión requerimiento estérico P: factor estérico σ: sección eficaz vrel: veloc relativa media NA: número de Avogadro Teoría del complejo activado Puede considerarse una generalización de la Teoría de Colisiones que sirve también para soluciones (incluye el efecto del solvente) Cuando los reactivos se aproximan se produce la formación de un estado de transición de alta energía, inestable y de corta duración denominado complejo activado. La energía que necesitan los reactivos para alcanzar este complejo es la energía de activación. En el complejo activado los enlaces en los reactivos comienzan a debilitarse y los enlaces en los productos comienzan a formarse: activa2[1].swf Reacción exotérmica Reacción endotérmica N2O (g) + NO (g) → N2 (g) + NO2 (g) Catálisis Un catalizador es una sustancia que afecta la velocidad de la reacción pero cuya concentración no se modifica y por tanto no participa en el balance de reacción global Si el catalizador acelera la reacción se denomina acelerador o catalizador positivo Si el catalizador frena la reacción se denomina inhibidor o catalizador negativo Catalizadores: •Se recuperan al final de la reacción •Bastan pequeñas cantidades •Sufren cambios físicos pero no químicos Catálisis Los catalizadores proveen un camino de reacción alternativo con menor energía de activación Catálisis homogénea El catalizador y los reactivos están en la misma fase Ejemplo: Los iones Brcatalizan la reacción Catálisis heterogénea El catalizador y los reactivos están en distinta fase C2H4 + H2 → C2H6 ethylene8.html Otro ejemplo: síntesis de NH3 en presencia de Fe metálico: Fe N2 + 3H2 → 2 NH3 Catálisis enzimática Es un tipo particular de catálisis homogénea E+S E-S E+P