Encefalitis límbica paraneoplásica: una entidad de difícil diagnóstico
Anuncio

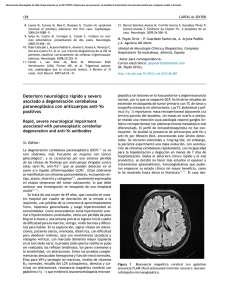
REVISIÓN Encefalitis límbica paraneoplásica: una entidad de difícil diagnóstico M. Ramos-Rivas a, G. Rojas-Velasco b, R. Acuña-Hidalgo a, O.A. Márquez-Valero a, R.H. Arellano-Bernal d, E. Castro-Martínez c ENCEFALITIS LÍMBICA PARANEOPLÁSICA: UNA ENTIDAD DE DIFÍCIL DIAGNÓSTICO Resumen. Introducción. Los síndromes paraneoplásicos pueden definirse como manifestaciones en sitios remotos a neoplasias malignas o sus metástasis, no relacionados con el crecimiento tumoral. La mayoría está ocasionada por sustancias secretadas por el tumor que simulan hormonas o interfieren con proteínas circulantes. Desarrollo. La frecuencia de los síndromes paraneoplásicos con sintomatología neurológica es menor a 0,5/100.000 por año, y afectan aproximadamente al 0,01% de los pacientes con cáncer. La patogénesis de los síndromes paraneoplásicos neurológicos se atribuye a la autoinmunidad por anticuerpos, al demostrarse la existencia de una gran variedad en relación con las alteraciones neurológicas asociadas. Sin embargo, la ausencia de anticuerpos no excluye el diagnóstico, así como su única presencia tampoco lo confirma. Los síntomas característicos de la encefalitis límbica paraneoplásica son confusión, cambios en el estado de ánimo, alucinaciones, deterioro de la memoria a corto plazo y crisis convulsivas; suelen desarrollarse en días a semanas, aunque en algunos casos pueden instaurarse súbitamente. Los estudios más útiles en el diagnóstico de los síndromes paraneoplásicos neurológicos son los de imagen, el examen de líquido cefalorraquídeo y las pruebas serológicas. El tratamiento requiere dos enfoques distintos. El primero mediante la supresión de la respuesta inmune generada por el daño neurológico. El segundo, mediante la remoción del tumor, como fuente del antígeno. Este último es frecuentemente el único efectivo. Conclusiones. La encefalitis límbica paraneoplásica es una entidad poco frecuente y de difícil diagnóstico, que puede confundirse fácilmente con trastornos psiquiátricos. El diagnóstico y tratamiento temprano es de suma importancia para evitar un daño neuronal irreversible. [REV NEUROL 2009; 48: 311-6] Palabras clave. Anticuerpos onconeurales. Encefalitis límbica paraneoplásica. Síndromes paraneoplásicos neurológicos. INTRODUCCIÓN Los síndromes paraneoplásicos se pueden definir como manifestaciones en sitios remotos a neoplasias malignas o sus metástasis [1], que no se relacionan con el crecimiento tumoral [2,3], infección, isquemia, alteraciones metabólicas o nutricias, cirugía u otras formas de tratamiento oncológico [3-6] (Tabla I). EPIDEMIOLOGÍA La frecuencia de los síndromes paraneoplásicos con manifestaciones neurológicas es menor a 0,5/100.000 por año [7]. La mayoría de los síndromes paraneoplásicos neurológicos (SPN) son poco frecuentes y afectan a alrededor del 0,01% de los pacientes con cáncer [6]. Dentro de los síndromes paraneoplásicos del sistema nervioso, los más frecuentes son el síndrome miasténico de LambertEaton, que afecta al 3% de los pacientes con cáncer de pulmón de células pequeñas; la miastenia grave, que se presenta en el 15% de los pacientes con timomas, y la neuropatía periférica desmielinizante. Dentro de esta última, en una de las formas raras de plasmocitoma conocida como POEMS (polineuropatía, organomegalia, endocrinopatía, proteína M y cambios cutáneos), se ha observado hasta en el 50% de los pacientes [6]. Los síndromes paraneoplásicos en el sistema nervioso central (SNC) tienen mayor incidencia en mujeres y en personas mayores de 50 años [3]. En el caso de la encefalitis límbica, no se puede establecer una incidencia real, pues hasta la fecha existen alrededor de 200 casos publicados, y se trata probablemente de una entidad subdiagnosticada. ETIOLOGÍA Y FISIOPATOLOGÍA La mayoría de los síndromes paraneoplásicos están ocasionados por sustancias secretadas por el tumor que simulan hormonas naturales, o bien que interfieren con las proteínas circulantes [6] (Tabla II). © 2009, REVISTA DE NEUROLOGÍA Inmunidad humoral La causa de la encefalitis límbica paraneoplásica permaneció sin explicación hasta la identificación de anticuerpos que reconocían antígenos presentes en neuronas y células tumorales en el suero de los pacientes afectados. Este hallazgo confirmó la teoría de que la encefalitis límbica paraneoplásica obedece a una causa inmune [4]. Las células tumorales expresan proteínas que usualmente se encuentran en las células del SNC, resguardadas del sistema inmune por la barrera hematoencefálica y una baja expresión de complejo mayor de histocompatibilidad. Los anticuerpos producidos en contra de la neoplasia provocan una reacción cruzada con los antígenos normales del sistema nervioso, por lo que la patogénesis de estos síndromes paraneoplásicos puede relacionarse con la autoinmunidad mediada por anticuerpos [8-10]. Sin embargo, la ausencia de anticuerpos no excluye el diagnóstico de un SPN, al no ser ésta la única condición necesaria REV NEUROL 2009; 48 (6): 311-316 311 Aceptado tras revisión externa: 08.01.09. a Facultad Mexicana de Medicina. Universidad La Salle. Tlalpan. b División de Medicina Interna. c Servicio de Neurología. División de Medicina Interna. d Servicio de Oncología Médica. División de Medicina Interna. Hospital General Dr. Manuel Gea González. México DF, México. Correspondencia: Dra. Melva Ramos Rivas. Facultad Mexicana de Medicina. Universidad La Salle. Fuentes, 17. Col. Toriello Guerra. CP 14000. Tlalpan, México. E-mail: melva_r2@hotmail.com M. RAMOS-RIVAS, ET AL para la definición de un síndrome neurológico como paraneoplásico. También pueden presentarse anticuerpos sin la existencia del SPN. Una gran variedad de anticuerpos contra células nerviosas se ha relacionado con las alteraciones neurológicas asociadas a los síndromes paraneoplásicos. Algunos de estos anticuerpos son característicos de ciertas lesiones malignas [2,11-14]. La presencia o ausencia de anticuerpos, así como el tipo de éstos, define distintos subtipos de SPN. Según los criterios diagnósticos propuestos por el panel internacional de expertos en neurología, se sugieren dos niveles de evidencia necesarios para definir un síndrome neurológico como paraneoplásico [15]: – Definido: a) Presencia de un síndrome neurológico clásico (encefalomielitis, encefalitis límbica, degeneración cerebelar subaguda, neuropatía sensorial, opsoclonía-mioclonía, pseudoobstrucción gastrointestinal crónica, síndrome miasténico de Lambert-Eaton o dermatomiositis) y desarrollo de cáncer dentro de los cinco años de diagnóstico del padecimiento neurológico. b)Presencia de un síndrome neurológico no clásico que resuelve o mejora de manera significativa posterior al tratamiento de cáncer sin inmunoterapia concomitante, sin que éste sea susceptible de remisión espontánea. c) Síndrome neurológico no clásico con presencia de anticuerpos onconeurales y desarrollo de cáncer dentro de los cinco años de diagnóstico del desorden neurológico. d)Síndrome neurológico con anticuerpos onconeurales bien caracterizados (Hu, Yo, CV2, Ri, Ma, anfifisina) sin presencia de cáncer. – Posible: a) Paciente con un síndrome neurológico clásico, sin anticuerpos onconeurales ni cáncer, pero con alto riesgo de desarrollar un tumor subyacente. b)Paciente con síndrome neurológico (clásico o no) con anticuerpos onconeurales parcialmente caracterizados y sin cáncer. c) Paciente con síndrome neurológico no clásico sin anticuerpos onconeurales y cáncer que se presenta dentro de los dos primeros años de diagnóstico. En el 75% de las encefalitis límbicas paraneoplásicas, el tumor primario es un carcinoma de células pequeñas del pulmón [16], pero puede ocurrir en asociación con otros tumores, como timoma, linfoma, adenocarcinoma de colon o carcinoma de testículo [15,16]. En personas menores de 40 años, los tumores que se presentan con mayor frecuencia son el linfoma de Hodgkin y el teratoma inmaduro [17]. Inmunidad celular Si bien se cree que la enfermedad neurológica puede surgir de la respuesta inmunológica mediada por anticuerpos al actuar contra proteínas extracelulares, la amplificación de la respuesta del sistema inmunológico, la respuesta contra el tumor y la mayor parte de la degeneración neuronal se da a través de las células T, que reconocen a los antígenos intracelulares [4,18]. A pesar de que las hipótesis iniciales sugerían que la expresión anormal de antígenos era suficiente para desencadenar la respuesta de autoinmunidad, posteriormente se descubrió que al menos algunos de los antígenos relacionados con los SPN son expresados comúnmente por algunos tumores. 312 Tabla I. Clasificación de los síndromes paraneoplásicos en el sistema nervioso central [3,4-6,15]. Localización del síndrome Síndrome clínico Encéfalo y nervios craneales Encefalitis límbica a Encefalomielitis a Encefalitis del tallo cerebral Degeneración cerebelosa a Opsoclonía-mioclonía a Retinopatía asociada a cáncer Neuritis óptica Corea Parkinsonismo Médula espinal Mielopatía necrosante Mielitis inflamatoria Esclerosis lateral amiotrófica Neuropatía motora subaguda Ganglio de la raíz dorsal Neuropatía sensorial a Nervios periféricos Neuropatía autonómica Neuropatía aguda sensorimotora Neuropatía crónica sensorimotora Neuropatía vasculítica Neuromiotonía Unión neuromuscular Síndrome miasténico de Lambert-Eaton a Miastenia grave Músculo Polimiositis o dermatomiositis a Miopatía necrosante Miotonía a Indica los definidos como síndromes clásicos, según Graus et al [15]. En un estudio se halló que el 100% de los tumores pulmonares de células pequeñas analizados expresaba el antígeno Hu, pero, a pesar de ello, únicamente el 15% de estos pacientes tenía títulos bajos de anticuerpo anti-Hu [19]. Este 15% tiene una respuesta inmunológica antitumoral al menos parcialmente eficiente, mientras que el 85% restante no construye una respuesta inmunológica antitumoral efectiva, lo que habla de una tolerancia de las células T hacia el tumor. Esta distinción entre activación o tolerancia de las células T CD8+ la determina respectivamente la presencia o ausencia de las células T CD4+ [18]. Este hallazgo es de importancia, ya que la activación de células T CD8+ podría modularse a través de medicamentos, lo que permitiría la inmunoterapia para el tratamiento de ciertas neoplasias [20]. DIAGNÓSTICO La encefalitis límbica paraneoplásica debe sospecharse tras descartar los diagnósticos de etiología tóxica, metabólica o infec- REV NEUROL 2009; 48 (6): 311-316 ENCEFALITIS LÍMBICA PARANEOPLÁSICA Tabla II. Anticuerpos asociados con síndromes paraneoplásicos [6]. Anticuerpos Cáncer asociado Anti-Ri Mama, cervicouterino, pulmón, estómago y vejiga Anti-Hu Pulmón, ovario, linfomas, tracto gastrointestinal, riñones, vejiga y próstata Anti-Ma1, anti-Ma2 Tumor germinal de testículo y anti-Ma3 Anti-Yo Ovario, mama y útero ciosa [21], así como metástasis al SNC, en una neoplasia previamente conocida [4] en pacientes que presentan confusión de inicio súbito, cambios en el estado de ánimo, alucinaciones y marcado deterioro de la memoria a corto plazo, así como la presencia de crisis convulsivas, que en ocasiones puede preceder a los síntomas cognitivos [1,14]. La encefalitis límbica paraneoplásica puede presentarse de forma aislada o en combinación con otros síndromes paraneoplásicos, por ejemplo, degeneración cerebelosa [22,23]. En muchas ocasiones, el diagnóstico del síndrome paraneoplásico precede al de la neoplasia [3]. Existen varias pruebas que pueden realizarse para el estudio y diagnóstico de un paciente con síndrome neurológico de origen paraneoplásico. Probablemente, las más útiles son el examen del líquido cefalorraquídeo (LCR), los estudios serológicos y los estudios de imagen [24. El examen del LCR permite descartar de forma inicial la posibilidad de metástasis a meninges en una neoplasia ya conocida, y de forma secundaria la detección de anormalidades inflamatorias que nos orientan hacia una alteración neurológica de origen infeccioso o inmune [25]. Este examen es anormal hasta en el 80% de los pacientes [4]. La evaluación del LCR puede mostrar una ligera pleocitosis [18], con cifras de 30-40 leucocitos/mm3, con predominio de células T, que pueden conformar hasta el 75% de estas células. Suele haber una ligera elevación en los niveles de proteínas (50-100 mg/dL), usualmente a expensas de la IgG [1,6]. La presencia de anticuerpos onconeuronales es una de las pruebas más eficaces para el diagnóstico de los SPN [1,13,26, 27]. Cerca del 60% de los pacientes con un SPN tiene niveles detectables de autoanticuerpos en el suero o en el LCR. Debido a que la detección de anticuerpos onconeuronales en el suero tiene una especificidad superior al 90%, se considera la mejor manera de diagnosticar un SPN [26]. Sin embargo, debe tenerse en cuenta que en ciertos SPN pueden detectarse autoanticuerpos en el LCR, sin que se encuentren en suero, por lo que siempre que sea posible debe buscarse su presencia en ambos espacios corporales [28]. La ausencia de anticuerpos detectables, que afecta a un 30% de los pacientes con SPN, o la presencia de anticuerpos atípicos en un 5-10% de éstos, no descarta la presencia de una encefalitis límbica de origen paraneoplásico, por lo que es necesario estudiar con mayor profundidad al paciente, investigando otros datos sugerentes de un síndrome neurológico de origen paraneoplásico y buscando una neoplasia subyacente [1,14,25,29-31]. En caso de encontrar autoanticuerpos, su tipificación puede servir como orientación para el estudio, tratamiento y pronóstico del paciente. Los autoanticuerpos van dirigidos contra los antígenos que originan la respuesta autoinmune en un SPN y que pueden dividirse en dos grandes categorías: REV NEUROL 2009; 48 (6): 311-316 – Antígenos intracelulares o clásicos: incluyen Hu, Ma2, CV2/ CRMP5 y anfifisina. Se relacionan esencialmente con neoplasias malignas, especialmente el cáncer de células pequeñas de pulmón (asociado a la presencia de anti-Hu y antiCV2/CRMP5 en suero y LCR) [32,33] y cáncer testicular (asociado a anti-Ma2). En los estudios patológicos se encuentra con frecuencia un infiltrado celular de linfocitos T, lo que sugiere una respuesta inmunológica de origen celular. Salvo por la encefalitis límbica asociada a anti-Ma2 en tumores testiculares, la respuesta al tratamiento es limitada. – Antígenos de membrana celular: incluyen los canales de potasio dependientes de voltaje y el receptor de N-metil-Daspartato (VGKC y NMDAR, respectivamente, por sus siglas en inglés). Con frecuencia se encuentran en asociación con un timoma (particularmente en presencia de antiVGKC, habitualmente no detectable en el LCR) o un teratoma (usualmente anti-NMDAR, que puede detectarse únicamente en el LCR y no en el suero). Sin embargo, hasta el 20% de los SPN relacionados con anti-VGKC pueden ser ocasionados por un cáncer de células pequeñas de pulmón, por lo que siempre debe buscarse una neoplasia maligna de base. La respuesta a la inmunoterapia resulta generalmente buena [34]. La presencia de autoanticuerpos no equivale al diagnóstico de un SPN, ya que son necesarios otros criterios para llegar a una conclusión. En pacientes con cáncer, pero sin manifestaciones neurológicas que indiquen un SPN, se han documentado niveles detectables de autoanticuerpos, aunque usualmente son inferiores a los que se encuentran en pacientes con un SPN [35]. La presencia de anticuerpos onconeuronales usualmente es un factor predictivo de buen pronóstico, y se relaciona con un estadio limitado de la neoplasia, una respuesta completa al tratamiento y mayor sobrevida [36]. En cuanto a los estudios de imagen, la tomografía computarizada suele ser normal y de poca ayuda en el diagnóstico. En algunas ocasiones puede mostrar una discreta dilatación del sistema ventricular, pero, evidentemente, esto no es específico de la encefalitis límbica paraneoplásica [21]. La resonancia magnética (RM) puede mostrar imágenes de utilidad para el diagnóstico [1,26]. En algunos pacientes, el estudio inicial puede ser normal, pero se encuentran alteraciones al repetirlo al cabo de 7 a 8 semanas. De acuerdo con lo comunicado por Rosenfeld et al, cerca del 70% de los pacientes con alteraciones neurológicas de origen paraneoplásico tiene anormalidades en la RM en regiones como el tálamo, el mesencéfalo, el puente, la región paraventricular y la paracueductal, así como en la médula [13]. La RM puede mostrar atrofia del hipocampo y de la amígdala de forma bilateral [1,24,37]. En la secuencia T1 es posible ver lesiones hipointensas o atróficas en las regiones temporal y límbica, que pueden mostrar realce al administrar medio de contraste (Fig. 1) [25,38]. Sin embargo, las secuencias T2 y FLAIR son más importantes, ya que permiten identificar con mayor claridad lesiones hiperintensas unilaterales o bilaterales en la corteza de los lóbulos temporales, hipocampo y núcleos amigdalinos (Fig. 2) [21,38-40]. Puede haber lesiones visibles en otras partes del SNC, como el hipotálamo y el tallo cerebral [21]. El 64% de los pacientes con encefalitis límbica paraneoplásica presenta alteraciones en la RM, de los cuales cerca del 90% tiene lesiones similares a las descritas anteriormente [25]. 313 M. RAMOS-RIVAS, ET AL Por otra parte, la tomografía por emisión de positrones con fluorodesoxiglucosa (PET-FDG) tiene una sensibilidad superior a la de la tomografía para la detección de la neoplasia oculta, pero la mayor utilidad de este estudio de imagen es su alto valor predictivo negativo, que se aproxima al 90%, lo que tiene peso para determinar que un paciente no tiene una neoplasia en el momento de la realización del estudio [41]. La PET-FDG puede ser de gran utilidad para detectar alteraciones sugerentes de encefalitis límbica paraneoplásica, es decir, zonas de hiperactividad en los lóbulos temporales, y también para encontrar una neoplasia subyacente que pudiera dar lugar al cuadro paraneoplásico [1,25]. Además, se han comunicado casos de encefalitis límbica paraneoplásica con RM sin alteraciones, pero hallazgos positivos mediante PET-FDG [42]. El electroencefalograma es útil en los casos de presentación en forma de cuadro confusional o con alteración del nivel de conciencia. Cerca del 50% de los casos puede mostrar actividad epileptiforme focal temporal unilateral o bilateral, o hallazgos más inespecíficos, como enlentecimiento generalizado o focal temporal. DIAGNÓSTICO DIFERENCIAL El punto más importante en el paciente con alteraciones neurológicas en el cual se han descartado las causas de origen vascular, infeccioso, tóxico y metabólico es considerar a la encefalitis límbica como uno de los diagnósticos diferenciales, situación que puede cambiar de manera radical el abordaje terapéutico del paciente. a b c d Figura 1. Comparación de cortes coronales de imágenes por resonancia magnética en secuenciaT1, en la amígdala (a y b) y en el hipocampo (c y d), que muestran una apariencia normal (a y c) o una atrofia bilateral grave, pero predominantemente izquierda (b y d). Reproducido con permiso de [1]. Enfermedad vascular cerebral La forma de presentación aguda de las alteraciones neurológicas y la presencia de crisis convulsivas pueden sugerir un origen embólico o trombótico de la sintomatología. Sin embargo, la ausencia de focalidad, así como la sintomatología de apariencia más bien psiquiátrica, descartan este diagnóstico [43]. Infección del sistema nervioso central La infección del SNC, en especial de origen vírico, debe considerarse como uno de los diagnósticos iniciales que se deben descartar cuando se presenta un paciente con la sintomatología descrita. La infección por virus herpes simple tiene predilección por los lóbulos temporales y el sistema límbico, lo que podría concordar con el curso clínico de ambas entidades. La infección del SNC puede descartarse por medio de análisis del LCR y métodos de imagen [43]. TRATAMIENTO El tratamiento de los SPN surge de un consenso general, sin existir aún recomendaciones basadas en la evidencia [44]. La fisiopatología autoinmune de la encefalitis límbica paraneoplásica permite que el abordaje sea en dos formas distintas. La primera, mediante la remoción de la fuente del antígeno, es decir, extirpando quirúrgicamente o tratando el tumor subyacente mediante radioterapia o quimioterapia. Las características clínicas del síndrome neurológico paraneoplásico y los resultados de los estudios ya mencionados pueden orientar al tumor de base que origina las manifestaciones. 314 Con frecuencia éste es el único tratamiento que detiene de manera efectiva la evolución del cuadro neurológico [6]. A pesar de que la evolución de la encefalitis límbica se estabiliza tras la resección del tumor subyacente, frecuentemente el daño neuronal es irreversible con el tratamiento [45]. Sin embargo, se han documentado algunos casos que comunican la presencia de tumores de ovario en pacientes jóvenes (15-20 años) con sintomatología paraneoplásica en el SNC que desaparecen por completo en un tiempo no mayor a un año posterior a la resección quirúrgica del tumor [8,46-48]. La segunda manera de abordar un SPN es a través de la supresión de la respuesta inmune que genera el daño neurológico. La respuesta a la inmunoterapia es variable y depende sustancialmente de si el daño neurológico está mediado por anticuerpos o por células. Cuando se detectan autoanticuerpos contra un antígeno intracelular (daño neurológico mediado principalmente por células), el manejo con inmunomoduladores no tiene efecto sobre la patología (salvo en el SPN de tumores testiculares asociado a Ma2, donde puede verse respuesta hasta en el 30% de los casos en los que se combina tratamiento inmunosupresor y manejo quirúrgico de la neoplasia) [49,50]. Por otra parte, la detección de autoanticuerpos contra un antígeno de membrana indica una buena respuesta al tratamiento con inmunomodulares [50]. No existen protocolos establecidos de medicamentos inmunosupresores para el tratamiento de los SNP y su manejo es controvertido, pero si después de tratar la neoplasia no hay mejoría o incluso se presenta deterioro del estado clínico del paciente, se pueden agregar fármacos, como corticosteroides, ci- REV NEUROL 2009; 48 (6): 311-316 ENCEFALITIS LÍMBICA PARANEOPLÁSICA a moral en el contexto de un síndrome neurológico paraneoplásico, es necesario ser cauteloso con la intensidad de inmunosupresión inducida [54]. Se desconoce si la evolución de los síndromes neurológicos de origen paraneoplásico se debe a una respuesta adecuada al tratamiento o si el cese de progresión o incluso la resolución del cuadro clínico se debe a la historia natural de la patología. b CONCLUSIONES Dentro de los SNP, la encefalitis límbica constituye una entidad poco frecuente y subdiagnosticada, que incluso puede confundirse fácilmente con algún trastorno psiquiátrico con progresión en un período Figura 2. Resonancia magnética en secuencia T2 en el nivel medio del cerebro, que muesde semanas a meses. Debido a ello, el conocimientra una atrofia del hipocampo (b) en comparación con una imagen normal (a). Reproducito de esta entidad resulta de suma importancia para do con permiso de [1]. médicos de atención primaria, atención de urgencias e internistas. clofosfamida, tacrolimus e incluso anticuerpos monoclonales, coA pesar de que existe la noticia de casos de encefalitis límmo rituximab [51,52], que actualmente se encuentra en estudio, bica paraneoplásica con remisión total del cuadro posterior a la o bien se puede recurrir al recambio plasmático o a la adminis- resección del tumor, la mejoría de estos pacientes se ha docutración de inmunoglobulina intravenosa [3,6,53]. mentado a partir de observaciones clínicas y no de pruebas neuA pesar de que no se ha reconocido que la inmunomodula- ropsicológicas. ción farmacológica sea un factor pronóstico adverso para la soEl diagnóstico y tratamiento temprano de la neoplasia resulbrevida, debido a la posibilidad de promover el crecimiento tu- ta de suma importancia para evitar el daño neuronal irreversible. BIBLIOGRAFÍA 1. Bak T, Antoun N, Balan K, Hodges J. Memory lost, memory regained: neuropsychological findings and neuroimaging in two case of paraneoplastic limbic encephalitis with radically different outcomes. J Neurol Neurosurg Psychiatry 2001; 71: 40-7. 2. Fadare O, Hart H. Anti-Ri antibodies associated with short-term memory deficits and a mature cystic teratoma of the ovary. Int Semin Surg Oncol 2004; 1: 11. 3. Candler P, Hart P, Barnett M, Weil R, Rees J. A follow up study of patients with paraneoplastic neurological disease in the UK. J Neurol Neurosurg Psychiatry 2004; 75: 1411-5. 4. De Beukelaar J, Sillevis-Smith P. Managing paraneoplastic neurological disorders. Oncologist 2006: 11: 292-305. 5. Muni R, Wennberg R, Mikulis D, Wong A. Bilateral horizontal gaze palsy in presumed paraneoplastic brainstem encephalitis associated with a benign ovarian teratoma. J Neuroophtalmol 2004; 24: 114-8. 6. Darnell R, Posner J. Paraneoplastic syndromes involving the nervous system. N Engl J Med 2003; 349: 1543-54. 7. Grant R. What the general neurologist needs to know about the paraneoplastic syndromes. BMJ 2002; 2: 318-27. 8. Taylor B, Mason W, Kong K, Wennberg R. Reversible paraneoplastic encephalomyelitis associated with a benign ovarian teratoma. Can J Neurol Sci 1999; 26: 317-20. 9. Dalmau J, Gultekin HS, Posner JB. Paraneoplastic neurologic syndromes: pathogenesis and physiopathology. Brain Pathol 1999; 9: 275-84. 10. Dalmau J, Bataller L. Clinical and immunological diversity of limbic encephalitis: a model for paraneoplastic neurologic disorders. Hematol Oncol Clin North Am 2006; 20: 1319-35. 11. Vernino S. Paraneoplastic neurologic syndromes. Curr Neurol Neurosci Rep 2006; 6: 193-9. 12. Dalmau J, Graus F, Rosenblum MK, Posner JB. Anti-Hu associated paraneoplastic encephalomyelitis/sensory neuronopathy: a clinical study of 71 patients. Medicine 1992; 71: 59-72. 13. Rosenfeld M, Eichen J, Wade D, Posner J, Dalmau J. Molecular and clinical diversity in paraneoplastic immunity to Ma proteins. Ann Neurol 2001; 50: 339-48. 14. Honnorat J, Antoine J. Paraneoplastic neurological syndromes. Orphanet J Rare Dis 2007; 2: 22. 15. Graus F, Delattre J, Antoine J, Dalmau J, Giornetto B, Grisold W, et al. Recommended diagnostic criteria for paraneoplastic neurological syndromes. J Neurol Neurosurg Psychiatry 2004; 75: 1135-40. 16. Elrington GM, Murray NM, Spiro SG, Newsom-Davis J. Neurological REV NEUROL 2009; 48 (6): 311-316 paraneoplastic syndromes in patients with small cell lung cancer. A prospective survey of 150 patients. J Neurol Neurosurg Psychiatry 1991; 54: 764-7. 17. Mori T, Yoshioka M, Kadooka Y, Kobayashi H, Iwatani K, Yoshimoto K. Mature teratoma combined with schizophrenia: report of a case. Kyobu Geka 2005; 58: 1166-8. 18. Albert ML, Darnell RB. Paraneoplastic neurological degenerations: keys to tumor immunity. Nat Rev Cancer 2004; 4: 36-44. 19. Dalmau J, Furneaux H, Gralla R, Kris M, Posner J. Detection of the anti-Hu antibody in the serum of patients with small cell lung cancer: a quantitative western blot analysis. Ann Neurol 1990; 27: 544-52. 20. Graus F, Saiz A, Lai M, Bruna J, López F, Labater L, et al. Neuronal surface antigen antibodies in limbic encephalitis: clinical-immunologic associations. Neurology 2008; 71: 930-6. 21. Rimmelin A, Sellal F, Morand G, Quoix E, Clouet PL, Dietemann Jl. Paraneoplastic limbic encephalitis images. J Radiol 1997; 78: 73-6. 22. Bakheit A, Kennedy P, Behan P. Paraneoplastic limbic encephalitis: clinico-pathological correlations. J Neurol Neurosurg Psychiatry 1990; 53: 1084-8. 23. Tsukamoto T, Mochizuki R, Mochizuki M, Noguchi M, Kayama H, Hiwatashi M, et al. Paraneoplastic cerebellar degeneration and limbic encephalitis in a patient with adenocarcinoma of the colon. J Neurol Neurosurg Psychiatry 1993; 56: 713-6. 24. Farrugia M, Conway R, Simpson D, Kurian K. Paraneoplastic limbic encephalitis. Clin Neurol Neurosurg. 2005; 107: 128-31. 25. Humayun S, Rosenfeld M, Voltz R, Eichen J, Posner J, Dalmau J. Paraneoplastic limbic encephalitis: neurological symptoms, immunological findings and tumour association in 50 patients. Brain 2000; 123: 1481-94. 26. Kashima Y, Shimojima Y, Fukushima K, Kaneko K, Yazaki M, Hashimoto T, et al. Paraneoplastic neurologic syndrome associated with small breast cancer: diagnostic value of FDG-PET for detection of underlying malignancy. Intern Med 2005; 44: 522-3. 27. Honnorat J. Onconeural antibodies are essential to diagnose paraneoplastic neurological syndromes. Acta Neurol Scand 2006; 113: 64-8. 28. Bernal F, Shams’ili S, Rojas I, Sánchez-Valle R, Saiz A, Dalmau J, et al. Anti-Tr antibodies as markers of paraneoplastic cerebellar degeneration and Hodgkin’s disease. Neurology 2003; 28: 230-4. 29. Alamowitch S, Graus F, Uchuya M, Rene R, Bescansa E, Delattre JY. Limbic encephalitis and small cell lung cancer: clinical and immunological features. Brain 1997; 120: 923-8. 30. Touzé E, Auliac JB, Carras P, Lecannelie G, Genero-Gygax M, Flocard 315 M. RAMOS-RIVAS, ET AL F. Limbic encephalitis and SIADH revealing small-cell anaplastic lung cancer: MRI and immunologic findings. Rev Neurol (Paris) 1998; 154: 539-41. 31. Rojas-Marcos I, Rousseau A, Keime-Guibert F, Reñé R, Cartalat-Caret S, Delattre JY, et al. Spectrum of paraneoplastic neurologic disorders in women with breast and gynecologic cancer. Medicine (Baltimore) 2003; 82: 216-23. 32. Cervantes-Arriaga A, Vargas-Cañas S, Rodríguez-Violante M. Uso clínico de autoanticuerpos en neurología. Rev Neurol 2008; 47: 89-98. 33. Latorre-González G, López de Silanes-De Miguel C, Escribano-Gascón AB. Encefalitis estriatal paraneoplásica asociada a anticuerpos antiCV2. Rev Neurol 2008; 46: 693-4. 34. Tuzun E, Dalmau J. Limbic encephalitis and variants: classification, diagnosis and treatment. Neurologist 2007; 13: 261-71. 35. Drlicek M, Bianchi G, Bogliun G, Casati B, Grisold W, Kolig C, et al. Antibodies of the anti-Yo and anti-Ri type in the absence of paraneoplastic neurological syndromes: a long-term survey of ovarian cancer patients. Neurology 1997; 244: 85-9. 36. Graus F, Dalmou J, Rene R, Tora M, Malats N, Verschuuren JJ, et al. Anti-Hu antibodies in patients with small-cell lung cancer: association with complete response to therapy and improved survival. Clin Oncol 1997; 15: 2866-72. 37. Prats J, Gaztañaga R, Palacio M. Encefalitis límbica no paraneoplásica. Rev Neurol 2003; 36: 335-7. 38. Fadul C, Stommel E, Dragnev K, Eskey C, Dalmau J. Focal paraneoplastic limbic encephalitis presenting as orgasmic epilepsy. J Neurooncol 2005; 72: 195-8. 39. Lawn ND, Westmoreland BF, Kiely MJ, Lennon VA, Vernino S. Clinical, magnetic resonance imaging, and electroencephalographic findings in paraneoplastic limbic encephalitis. Mayo Clin Proc 2003; 78: 1363-8. 40. Thieben M, Lennon V, Boeve B, Aksamit A, Keegan M, Vernino S. Potentially reversible autoimmune limbic encephalitis with neuronal potassium channel antibody. Neurology 2004; 62: 1177-82. 41. Patel RR, Subramaniam RM, Mandrekar JN, Hammack JE, Lowe VJ, Jett JR. Occult malignancy in patients with suspected paraneoplastic neurologic syndromes: value of positron emission tomography in diagnosis. Mayo Clin Proc 2008; 83: 917-22. 42. Dadparvar S, Anderson G, Bhargava P, Guan L, Reich P, Alavi A, et al. Paraneoplastic encephalitis associated with cystic teratoma is detected by fluorodeoxyglucose positron emission tomography with negative magnetic resonance image findings. Clin Nuclear Med 2003; 28: 893-6. 43. Dalmau J, González G, Lerwill M. Case 4-2007: a 56 year old woman with rapidly progressive vertigo and ataxia. N Engl J Med 2007; 356: 612-20. 44. Vedeler C, Antoine J, Giometto B, Graus F, Grisold W, Hart I, et al. Paraneoplastic neurological syndrome Euronetwork. Management of paraneoplastic neurological syndromes: report of an EFNS Task Force. Eur J Neurol 2006; 13: 682-90. 45. Duff M, Dusenbery K, Rodríguez F. Paraneoplastic encephalomyelitis: a case report and review of the literature. Gynecol Oncol 2006; 102: 593-5. 46. Okamura H, Oomori N, Uchitomi Y. An acutely confused 15-year-old girl. Lancet 1997; 350: 488. 47. Graus F, Sauz A. Encefalitis límbica: un síndrome probablemente infradiagnosticado. Neurología 2005; 20: 24-30. 48. Bloch M, Hwang W, Baehring J, Chambers S. Paraneoplastic neoplastic encephalitis: ovarian cancer presenting as an amnesic syndrome. Obstet Gynecol 2004; 104: 1174-7. 49. Graus F, Dalmau J. Paraneoplastic neurological syndromes: diagnosis and treatment. Curr Opin Neurol 20: 732-7. 50. Dalmau J, Bataller L. Encefalitis límbica: los nuevos antígenos de membrana y propuesta de una clasificación clinicoinmunológica con implicaciones terapéuticas. Neurologia 2007; 22: 526-37. 51. Shams’ili S, De Beukelaar J, Gratama J, Hooiskaas H, Van den Bent M, Van den Veer M, et al. An uncontrolled trial of rituximab for antibody associated paraneoplastic neurological syndromes. J Neurol 2006; 253: 16-20. 52. Esposito M, Penza P, Orefice G, Pagano A, Parente E, Abbadessa A, et al. Successful treatment of paraneoplastic cerebellar degeneration with rituximab. J Neurooncol 2008; 86: 363-4. 53. Basic-Jukic N, Kes P, Basic-Kes V, Brunetta B. Importance of plasmapheresis in the treatment of paraneoplastic cerebellar degeneration. Acta Med Croatica 2004; 58: 63-6. 54. Graus F, Keime-Guibert F, Reñe R, Benyahia B, Ribalta T, Ascaso C, et al. Anti-Hu-associated paraneoplastic encephalomyelitis: analysis of 200 patients. Brain 2001; 124: 1138-48. PARANEOPLASTIC LIMBIC ENCEPHALITIS: A DIFFICULT-TO-DIAGNOSE CONDITION Summary. Introduction. Paraneoplastic syndromes can be defined as manifestations in distant places of tumors or metastasis, which are not related with tumoral growth. Most of these syndromes are caused by substances secreted by the tumor, that mimic natural hormones, or interfere with plasma proteins. Development. The rate of paraneoplastic syndromes with neurological manifestations is less than 0.5/100,000 per year, and affect about 0.01% of cancer patients. The pathogenesis of neurological paraneoplastic syndromes is attributed to humoral autoimmunity, due to the existence of a great variety of antibodies in relationship with the neurological alterations associated. Nevertheless, the absence of antibodies does not exclude a neurological paraneoplastic syndromes, just as antibodies may be found without a neurological paraneoplastic syndrome. The characteristic symptoms of paraneoplastic limbic encephalitis are confusion of acute onset, mood changes, hallucinations, loss of short term memory, and seizures; these symptoms generally develop in days or weeks, but may present suddenly. Image studies, cerebral spinal fluid evaluation, and serologic tests are the most useful in diagnosing a neurological paraneoplastic syndrome. The treatment requires two different approaches. The first one is through the suppression of the immune response generated by neurological damage. The second, is by removing the tumor as the source of the antigen. The latter is often the only effective treatment. Conclusions. The paraneoplastic limbic encephalitis is an unusual and hard to diagnose entity, which can easily be confused with psychiatric problems. An early diagnosis and treatment is very important to avoid nonreversible neuronal damage. [REV NEUROL 2009; 48: 311-6] Key words. Onconeural antibodies. Paraneoplastic limbic encephalitis. Paraneoplastic neurological syndromes. 316 REV NEUROL 2009; 48 (6): 311-316