La materia y sus cambios
Anuncio

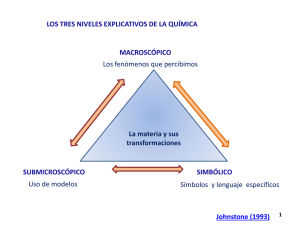
UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas. 1 ¿Química? • La química es el estudio integrado de la preparación, propiedades, estructura y reacciones de los elementos y sus compuestos, así como de los sistemas que forman. • Es una ciencia que genera sus propios objetos de estudio!! Gracias a los conocimientos químicos se han sintetizado muchísimas sustancias que NO existen en la Naturaleza. 2 LOS TRES NIVELES EXPLICATIVOS DE LA QUÍMICA MACROSCÓPICO Los fenómenos que percibimos La materia y sus transformaciones SUBMICROSCÓPICO Uso de modelos SIMBÓLICO Símbolos y lenguaje específicos Johnstone (1993) 3 MATERIA • Todo aquello que ocupa un lugar en el espacio, tiene una energía medible y está sujeto a cambios en el tiempo y a interacciones con aparatos de medida. • Se considera que es lo que forma la parte sensible de los objetos perceptibles o detectables por medios físicos. Es decir es todo aquello que ocupa un sitio en el espacio, se puede tocar, se puede sentir, se puede medir, etc. 4 Estados de agregación GAS LÍQUIDO SÓLIDO Sus partículas están muy separadas (en comparación con su tamaño). Las partículas están menos separadas que en los gases, pero más que en los sólidos. Disminuyen las distancias entre las partículas y las fuerzas de atracción son más dominantes. Están desordenadas. Están menos desordenadas que en los gases, pero más que en los sólidos. Las partículas ocupan posiciones relativamente fijas en el espacio. Se mueven más rápidamente que en los líquidos y en los sólidos. Los gases pueden comprimirse o expandirse fácilmente. Se pueden convertir en líquidos al T, o si P. Las distancias entre ellas se acortan y empiezan a atraerse entre sí, aumentan las fuerzas intermoleculares. No tienen forma propia (adoptan la del recipiente). Sí tienen volumen propio. Se comprimen mínimamente. Los sólidos tienen forma y volumen propios. El arreglo atómico origina sólidos que siguen un cierto orden y dan origen a los cristales, o bien los átomos se pueden acomodar al azar originando vidrios, el hule y muchos plásticos (sólidos amorfos). Son incompresibles. 7 ¿Qué es el plasma? En física y química, se denomina plasma a un gas constituido por partículas cargadas (iones) libres y cuya dinámica presenta efectos colectivos dominados por las interacciones electromagnéticas de largo alcance entre las mismas. Con frecuencia se habla del plasma como un estado de agregación de la materia con características propias, diferenciándolo de este modo del estado gaseoso, en el que no existen efectos colectivos importantes. 8 ¿Cómo podemos clasificar a la materia? • • • • • • • • Por colores Por olores Por tamaño o textura Por su temperatura Por su sabor En orgánica e inorgánica Por su estado de agregación… POR SU COMPOSICIÓN • MATERIALES: son todas las sustancias y mezclas de ellas, de que están hechos los objetos, seres y cuerpos. • SUSTANCIAS: son materiales de aspecto homogéneo constituidos por un solo componente. Cada sustancia tiene propiedades específicas que la distinguen de las demás. Están formadas por átomos, moléculas o iones. • MEZCLA: material conformado por dos o más sustancias que pueden separarse por métodos físicos. 10 Sustancias Elementales o simples Es toda aquella sustancia formada por un solo tipo de átomos; no se descomponen en otras sustancias más simples. Ejemplos: el O2 , Au., Pb. Compuestas Están formadas por átomos diferentes, enlazados en proporciones definidas. Es posible descomponerlas en otras sustancias más simples o sencillas por la acción del calor o la corriente eléctrica. Ejemplos: NaCl, H2O, HNO3. 11 Las mezclas y los compuestos están formados por grupos de átomos diferentes, pero en cada caso hay una interacción diferente. Sus componentes se pueden separar por métodos físicos, a partir de las propiedades características de cada gas. Las propiedades de la mezcla dependen de la proporción en que estén los componentes, pero cada elemento conserva su identidad. Para separar a los elementos que forman las moléculas, es necesario romper enlaces químicos. Las propiedades del compuesto siempre son las mismas independientemente de su procedencia o ruta de síntesis. Los elementos están en la proporción fija 2:1 Las propiedades del agua son diferentes a las del hidrógeno y del oxígeno. 12 TIPOS DE DISOLUCIONES 13 DISOLUCIONES • NO SATURADAS • SATURADAS • SOBRESATURADAS Solubilidad: máxima cantidad de soluto que se disuelve en 100 mL de disolvente a una temperatura determinada. 14 15 Análisis de una gráfica de solubilidad solubilidad (g/100 mL agua) Solubilidad Na2SO4 50 48 46 44 42 40 38 36 34 32 30 28 26 24 22 20 18 16 14 12 10 8 6 4 0 10 20 30 40 50 60 Temperatura (°C) 70 80 90 100 16 TIPOS DE COLOIDES 17 COLOIDES Robert Brown (1773-1858) fue el primero en estudiar el movimiento de los cúmulos coloidales, por eso a dicho fenómeno se le conoce como movimiento browniano: Los coloides también presentan el efecto Tyndall (John Tyndall, 1869) 18 19 ¿De qué están hechas las cosas? 20 ¿De qué están hechas las partículas químicas? • Están formadas por partículas aún más pequeñas que los átomos, que se denominan partículas subatómicas. • Las partículas subatómicas son los electrones, los protones y los neutrones. Partícula subatómica Símbolo Carga Masa en gramos Protón p+ 1+ 1.67 x 10-24 Dentro del núcleo Neutrón n° e- 0 1.67 x 10-24 Dentro del núcleo 1- 9.10 x 10-28 Fuera del núcleo Electrón Ubicación en el átomo 22