C O N T E N ID O S La electrólisis
Anuncio

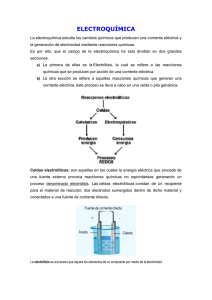
Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos constituyentes. Estos compuestos químicos, que evidencian la propiedad de disociación o ionización en disoluciones, se denominan electrolitos, y la reacción química de disociación se denomina electrólisis. Las reacciones de electrólisis son la base para concentrar y purificar el cobre del mineral donde se extrajo: método conocido como electroobtención. CONTENIDOS La electrólisis ELECTRÓLISIS tipo de reacción química donde los Electrolitos se disocian o ionizan en Iones Carga eléctrica positiva Carga eléctrica negativa llamados llamados Cationes Aniones Electrólisis La electrólisis es una reacción química donde las sustancias que se encuentran disueltas en agua (disolución) o fundidas son capaces de disociarse o ionizarse en sus componentes moleculares y/o atómicos constituyentes. La disociación produce estructuras químicas cargadas eléctricamente, por lo que las disoluciones electrolíticas se caracterizan por conducir la corriente eléctrica. Ejemplo de reacción electrolítica: CaCO3 Ca+2 + CO3-2 Electrolitos Los electrolitos son sustancias químicas capaces de disociarse o ionizarse cuando se encuentran en disolución o fundidas. Los electrolitos disociados permiten que el sistema conduzca la corriente eléctrica. Ejemplo de electrolitos: CaCO3 Iones Los iones son moléculas o átomos que presentan carga eléctrica. Resultan por la disociación del electrolito o por ganancia o pérdida de electrones. Ejemplo de iones: Ca+2 CO3-2 Carga eléctrica negativa La carga eléctrica negativa se refiere al estado eléctrico de una molécula o átomo que se produce por exceso de electrones. www.codelcoeduca.cl El anión es un ión que presenta carga eléctrica negativa. Cuando se encuentra bajo la influencia de electrodos que son polos eléctricos el anión migrará hacia el electrodo de signo contrario, en este caso, un ánodo (de signo positivo), debido a que cargas eléctricas opuestas se atraen. Ejemplo de anión: CO3-2 Carga eléctrica positiva La carga eléctrica positiva se refiere al estado eléctrico de una molécula o átomo por déficit de electrones. CONTENIDOS Aniones Cationes El catión es un ión que presenta carga eléctrica positiva. Cuando se encuentra bajo la influencia de electrodos que son polos eléctricos el catión migrará hacia el electrodo de signo contrario, en este caso, un cátodo (de signo negativo), debido a que cargas eléctricas opuestas se atraen. Ejemplo de catión: Ca+2 www.codelcoeduca.cl Juan tiene un gran recipiente de agua con electrodos (cátodo y ánodo) en sus extremos, como muestra la figura: Cátodo (-) Ánodo (+) Juan quiere separar un conjunto de sustancias químicas para agruparlas en cationes y aniones. La lista que posee es la siguiente: 1. KNO3 (Nitrato de Potasio). 2. NaOH (Hidróxido de Sodio). APLICACIÓN PRÁCTICA Un problema electrolítico: ¿cationes o aniones? 3. HCl (Ácido Clorhídrico). 4. CuSO4 (Sulfato de Cobre). 5. CO2 (Dióxido de Carbono). 6. NaCl (Cloruro de Sodio “sal común”). 7. C6H12O6 (Glucosa). 8. CuCO3 (Carbonato de Cobre). Reflexión y análisis Al disolver cada una de estas sustancias en el agua del recipiente, Juan no sabe como se comportarán cada una de ellas. a predecir dónde migrará cada uno de los iones de estas sustancias, aplicando tus conocimientos de • Ayúdalo la electrólisis y la formación de iones. • Busca información en la biblioteca y consulta a tu profesor o profesora de química. • Anota tus resultados en la tabla que se plantea a continuación: Ejemplo: CaCO3 (Bicarbonato de sodio) Cátodo (-) Ca+2 CaCO3 Recipiente con agua CO3-2 Ánodo (+) www.codelcoeduca.cl 1. Completa la tabla con la migración de los iones en la electrólisis para cada una de las sustancias que Juan tiene en la lista. Sustancia Migra hacia el Ánodo Migra hacia el Cátodo Ca Co3 Ca+2 CO3-2 KNO3 NaOH HCl CuSO4 CO2 NaCl C6H12O6 CuCO3 APLICACIÓN PRÁCTICA Resultados 2. ¿Hay algún compuesto de la lista que no migre? Si es así, ¿cuáles son y por qué no lo hacen? 3. ¿En qué se parece lo que quiere hacer Juan, con lo que se hace en la electroobtención del cobre? 4. ¿Qué finalidad práctica tiene la electrólisis en la electroobtención del cobre? 5. ¿Qué utilidad tienen los electrolitos en la vida diaria? www.codelcoeduca.cl Ciencia. Subsector: Estudio y Comprensión de la Naturaleza Nivel: Octavo Año Básico (NB 6) y 1er Año de Educación Media (NM1) Descripción general En el texto La electrólisis se dan a conocer las características y propiedades de esta reacción química, los fenómenos relacionados y su utilidad práctica. Este material puede ser utilizado para profundizar el concepto de reacción química abordado en la unidad Cambios de la materia (NB6) y en la unidad El agua (NM1) de los programas de estudio de esos niveles. Este contenido se relaciona con el proceso productivo del cobre en su etapa de electroobtención, ya que esta división del proceso se realiza gracias al principio químico de la electrólisis. Se ofrece una actividad práctica en la que los estudiantes ejercitan el concepto de electrólisis abordado mediante una resolución de problemas, con una mirada de utilidad práctica. Objetivos fundamentales NB6 Comprender los procesos de transformación físico-química de la materia y saberlos aplicar a principios de conservación. NM1 Experimentar, observar y analizar procesos químicos en contextos diversos. • • Objetivos transversales •Exponer ideas, opiniones, convicciones, sentimientos y experiencias de manera coherente y fundamentada. Resolver problemas a través del uso de herramientas y procedimientos basados en una actitud reflexiva y metódica. Analizar, interpretar y sintetizar información y conocimientos. • • Aprendizajes posibles • Explicar el fenómeno de la • • • • electrólisis y caracterizarla utilizando esquemas. Identificar electrolitos en una reacción electrolítica. Identificar iones, cationes y aniones, relacionándolos con sus cargas eléctricas. Explicar la migración de los iones en un sistema de electrólisis. Valorar la importancia de la química electrolítica en la minería y la industria. NB6 Cambios de la materia. Noción de reacción química. Identificación de reacciones químicas. NM1 Explicación de los cambios químicos ocurridos en la reacción de descomposición de agua, a partir de medidas de los gases obtenidos. • Otras oportunidades de aprendizaje • Observar y describir • • • Conceptos claves Contenidos • • • fenómenos con rigurosidad. Formular explicaciones a partir de las observaciones y utilizando diferentes fuentes bibliográficas. Extraer conclusiones a partir de los resultados y observaciones realizadas. Sintetizar ideas y comunicar información en forma de esquemas y diagramas. PARA EL DOCENTE Sector: •Electrólisis. •Electrolitos. •Carga eléctrica. •Ión. •Catión. •Anión. •Electrodos. •Ánodo. •Cátodo. •Disolución. Criterios de evaluación • Explica el fenómeno de la electrólisis mediante esquemas. • Caracteriza la electrólisis utilizando un lenguaje científico. • Identifica los electrolitos en una solución. • Identifica iones, distinguiendo cationes y aniones. • Relaciona cationes y aniones con el tipo de cargas eléctricas. • Explica la capacidad de migración de los iones. • Reconoce la importancia de • la química electrolítica en la minería e industria. Aplica el concepto de electrólisis a situaciones problemáticas. www.codelcoeduca.cl Nombre: Curso: 1. Fecha: Explica con tus propias palabras el fenómeno de la electrólisis. 2. PARA EL DOCENTE Evaluación Formativa Señala dos diferencias entre una sustancia electrolítica y una no electrolítica. 3. Nombra dos sustancias que sean electrolíticas y dos que no lo sean. Sustancias electrolíticas: a) b) Sustancias no electrolíticas: a) b) 4. ¿Qué relación existe entre electrolitos e iones? 5. ¿Qué relación existe entre iones, aniones y cationes www.codelcoeduca.cl ¿Qué relación existe entre la electrólisis y la electroobtención del cobre? 7. Una sustancia A electrolítica forma dos iones C y D. En una observación experimental el ión C se dirige al cátodo. La experiencia se termina abruptamente antes de verificar la migración del ión D. De acuerdo a esta información señala: El ión C es un porque migra al cátodo El ión D es un porque PARA EL DOCENTE 6. www.codelcoeduca.cl Las soluciones electrolíticas tienen las siguientes características: 1. Se genera conductividad eléctrica, esto quiere decir que la disociación o ionización forma un ambiente eléctrico en la disolución. 2. Se produce una alteración en las propiedades coligativas independiente de la naturaleza del electrolito. La ionización de los electrolitos aumenta el número de especies químicas en el sistema alterando las propiedades coligativas, ya que, al haber más partículas disociadas, entorpece la cinética molecular. Esto significa que: – Punto de fusión disminuye. – Punto de ebullición aumenta. – Presión de vapor disminuye. – Presión osmótica aumenta. 3. Las propiedades físicas y químicas de los electrolitos son diferentes a las que presentan sus iones disociados. De ahí que el sistema de electrólisis muestre características nuevas con respecto a su previa ionización. 4. La disociación de los electrolitos es reversible, estableciéndose un equilibrio químico. La disociación aumentará y se desplazará el equilibrio a medida que aumentemos la dilución de la disolución. 5. Un tipo importante de electrolitos son los ácidos y las bases. MATERIAL COMPLEMENTARIO Características de las disoluciones electrolíticas www.codelcoeduca.cl