R C O Cl
Anuncio

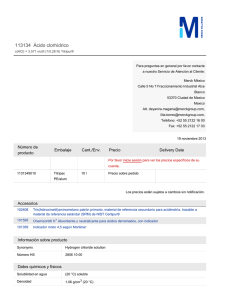
O R O OH R Ácido carboxílico O X R Halogenuro de ácido O O SR' Tioéster R O O R' R Anhídrido de ácido O R O R OR' Ester NH2 Amida O P O - OO Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el acilo O R O Y + :Nu- R Nu + :Y- Sustitución nucleofílica en el acilo Pueden transformarse en ácidos carboxílicos mediante una hidrólisis O R Grupos acilos O Y + H2O R O R C Grupo acilo O CH3 C acetil OH + HY IUPAC -ico -il Acético Halogenuros de ácidos O CH3CH2CH2 C Cloruro de butanoílo Cl O O CH3 C Acetil C Cl Cloruro de etanoílo Cl Cloruro de benzoílo Cloruro de acetilo El sufijo –ico se sustituye por el sufijo –ilo y se antepone el nombre del haluro. En los halogenuros de ácidos se retiene la “o” de la terminación –oico. Ésteres O O CH3 CH C O CH3 CH3 CH2 CH2 CH2 C O CH2 CH3 CH3 Pentanoato de etilo 2-metilpropanoato de metilo Isobutirato de metilo O CH3 CH2 C O C CH3 CH3 Feniletanoato de tert-butilo La primera palabra procede del ácido principal al que se la ha sustituido la terminación –ico por –ato y la segundo procede del nombre alquilo unido al oxígeno Amidas O O O N HN NH2 NH2 formamida O acetamida N-metilpropanamida N,N,3-trimetilbutanamida Se excluye el sufijo –ico u –oico del nombre del acido principal y se añade el sufijo –amida El nitrógeno sustituido se indica precediendo el nombre de la amida sencilla por N- seguido del grupo sustituyente Anhídridos de ácidos O O F O O Anhídrido acético F O O Anhídrido 3-metilpentanoico O O O F F O O F F Anhídrido trifluoroetanoico Anhídrido trifluoroacético (TFAA) O H O O Anhídrido fórmico acético O Anhídrido ftálico Se antepone la palabra anhídrido al nombre del ácido carboxílico correspondiente Múltiples funciones Ácido > éster > amida > nitrilo > aldehído > cetona > alcohol > amina > alqueno > alquino N HO O N O H2N O-cianobenzoato de etilo O 2-hidroxibutanonitrilo O 2-formilciclohexanocarboxamida Los 3 enlaces del C=O son coplanares. El orbital p del C del C=O, su oxigeno y el átomo X se solapan para formar un sistema extendido a través del cual los ese deslocalizan. La deslocalización electrónica estabiliza al C=O y decrece su carácter electrofílico. Átomo con un par de e- no enlazantes que pueden interactuar con el sistema π del C=O Menor electronegatividad de X, mejor capacidad de donar e- al C=O, mayor estabilización CLORUROS DE ACILO Los halogenos son muy electronegativos. Los orbitales 3p son relativamente grandes y se solapan probremente con los lobulos de los orbitales 2p del C del C=O (enlace C-Cl es 180 ppm, mayor de los C-X). Mayor electrofilia del C del C=O ANHIDRIDOS DE ÁCIDO El par de e- solitarios del O se encuentra compartidos por ambos C=O ESTER Solo un grupo C=O compite por la deslocalización de los e- del oxigeno. Menos reactivos que anhídridos. Anhídrido de ácido Ester Enlace C-N con carácter de doble enlace (135 pm) El N es menos electronegativo que el O y mejor donante de e- no enlazantes. Barrera de rotacion alta para un enlace simple, lo que indica que el enlace C-N tiene un significante carácter de C=N. Puntos de ebullición de derivados de ácidos graficados función de sus pesos moleculares. incluyen para su comparación alcoholes y alcanos lineales. los en Se los 2 H para formar puentes H Solubilidad Adición nucleofílica Sustitución nucleofílica en acilos Sustitución en alfa Condensación de carbonilos Se elimina el oxígeno. Nu O R Nu- Y HO Nu R Y Adición nucleofílica Protonación del oxígeno. Formación de alcohol O Nu X mal grupo saliente (R, H) R Y X buen grupo saliente (Cl, OMe, OAc) - Y R Intermediario alcóxido tetraédrico O YR Sustitución nucleofílica en acilos Nu Se reemplaza X por Nu- Adición nucleofílica Sustitución nucleofílica en acilos Sustitución en alfa Condensación de carbonilos ENOLATO Nucleófilo - O base Electrófilo C E+ O O C H ácido H C E E+ O C H+ Sustitución de un H por un E+ a traves de un intermediario enol o enolato Adición nucleofílica Sustitución nucleofílica en acilos Sustitución en alfa Condensación de carbonilos O O base H C - O O- O C C Participan dos compuestos carbonílicos, uno a través del C del grupo C=O y otro a través del C Adición nucleofílica Sustitución nucleofílica en acilos Sustitución en alfa Condensación de carbonilos Se elimina el oxígeno. Nu O R NuY Intermediario alcóxido tetraédrico R Y HO Nu R Y Adición nucleofílica Protonación del oxígeno. Formación de alcohol O Nu X mal grupo saliente (R, H) R Y X buen grupo saliente (Cl, OMe, OAc) - O YR Se reemplaza X por Nu- Sustitución nucleofílica en acilos Nu Mecanismo de la sustitución nucleofílica en el acilo La adición de un nucleófilo al grupo C=O, produce un intermediario tetraédrico O R :NuY lento O Nu R Y O R Nu - Intermediario tetraédrico :Y Un par de electrones del oxígeno desplaza al grupo saliente Y. Esto genera un nuevo compuesto carbonílico Sustitución de Y por NuDos pasos e involucra un intermediario tetraédrico Reactividad relativa de los derivados de ácidos carboxílicos Factores 1. Basicidad del grupo saliente 2. Estabilización por resonancias del carbonilo 3. Electrofilia del carbono carbonílico más reactivo menos reactivo +I O O R C Cl R C H O O .. C R .. R C O no requiere catálisis NO son derivados de ácidos; tiene una química diferente O R C R' Se necesita catálisis ácida solo con Nu débiles .. R C O .. R' O O .. R C NH2 Se necesita catálisis (la base puede ser usada para hidrolizar) caso especial (H ácido) O R C OH OH- O R C O requiere ácido (en la base conjugada el C=O esta desactivado) Interconversiones de derivados de ácidos Los derivados más reactivos “menos estables” se convierten fácilmente en los menos reactivos “más estables” Síntesis de los halogenuros de ácidos O R O R PBr3 OH R OH O O Br R SOCl2 O Cl R OH P rojo O O I2 R I R HF Cl O R F Tipos de sustituciones nucleofílicas en el acilo O R O OR' R NH2 R'OH NH3 O O OH R H Reducción [H-] R Y Hidrólisis Reacción adicional O R'MgX H2O R R Aminólisis Alcohólisis Reacción adicional O R' Reacción de Grignard Cloruros de ácidos O R O OR' Éster R R'OH NH3 O O H 2O R OH Ácido carboxílico NH2 Amida R O R'CO2H Cl Cloruro de ácido R O O R' Anhídrido de ácido Síntesis de los anhídridos de ácidos Mejor método O O R C Cl O - + R C O Na + R C O C R NaOH P 2O 5 O R C OH 2 R C OH Este método es eficiente con ácidos líquidos de bajo PM o diácidos que pueden resultan en anhídridos cíclicos O + R C O C R calor O Los RCOCl y los RCO2H pueden reaccionar directamente para formar el anhídrido, pero la reacción es mas eficiente si se lleva a cabo a través de la sal del carboxilato O O HCl Conversión de los RCO2H en anhídridos de ácido O 2 R O calor R OH O O R O O OH calor O + H2O OH La geometría es importante en la formación de anhídridos cíclicos O Anhídrido ftálico Ácido ftálico O O O calor OH O + H2O OH Ácido maleico O cis O Anhídrido maleico O OH HO Ácido fumárico trans O La anhídridos lineales son generalmente sintetizados por este método calor no reacciona Síntesis de esteres o ácidos carboxílicos a partir de cloruros de ácidos Cloruro de ácido : O: O: R C .. Cl .. : R' d- - .. .. R C .. Agua o alcohol .. H O R' + O .. .. .. R Cl : C Cl Muy reactivo No necesita catalizador H Ester o ácido carboxílico .. d+ O .. O: O: R C .. O .. R' R C .. +O R' H + HCl H .. O :-R' : Cl .. Síntesis de amidas a partir de cloruros de ácidos Se pierde un H+ situado sobre el N. Aminas terciarias no pueden dar amidas. Amina en exceso para neutralizar el HCl formado Síntesis de derivados de ácidos a partir de anhídridos de ácidos En las reacciones de adicion-eliminacion de anhiudridos de acidos el grupo saliente es un carboxilato Hidrólisis O O R C O C R + H-OH 2 equivalentes O + R C OH O HO C R Ácido O O R C O C R + O O R’-OH + R C OR' HO C R Ester .. R O O R C O C R + H N O .. R R C N R 2 equivalentes + R Amida -O O C R + R2NH2 Los anhídridos son menos reactivos que los cloruros de ácidos pero no requieren catálisis Esteres como fragancias O O O Acetato de isopentilo (banana) O Butirato de etilo (ananá) O O O O Propionato de isobutilo (rum) Acetato de octilo (naranja) O O O O Acetato de propilo (pera) Butirato de metilo (manzana) Preparación de esteres Método limitado a R’X primarios Método limitado a R’OH simples Método general Sustitución nucleofílica en el acilo catalizada por ácidos 1) H H O .. H + : O: R R C Y 2) + :O H R C Y .. :O H R C Nu lento slow C SIMPLIFICADA!!!!! Y .. :O H R C Y Nu + Nu: 3) + :O H Y H :O .. H : O: R C Nu + Y: + H3O+ Síntesis de esteres a partir de RCO2H Ácido Alcohol Éster • La reacción fue descrita por primera vez por Emil Fischer y Arthur Speier en 1895. • La mayoría de los RCO2H son aptos para la reacción.. • Los ROH debe ser un alcohol primario o secundario, ya que los 3° son susceptibles a la eliminación. • Los catalizadores mas comunes: H2SO4, HCl, Ácidos de Lewis. • Es necesario utilizar reactivos (ácido o alcohol) en exceso o eliminar agua para desplazar el equilibrio. • El método mas conveniente para sintetizar esteres es por reacción de un alcohol con un halogenuro de ácido. Síntesis de esteres a partir de RCO2H: Esterificación de Fischer El RCO2H es protonado en el oxigeno del C=O aumentando la electrofilia del C del C=O Se protona uno de los oxígenos de los grupos hidroxilos de este intermediario tetraédrico El intermediario pierde una molécula de agua para dar el éster protonado El ROH actúa como nucleófilo atacando al C del C=O El ion oxonio formado pierde un H+ para dar el intermediario tetraédrico neutro. Desprotonación para dar el éster deseado Preparación de esteres Esterificación intramolecular: Lactonizacion Síntesis de esteres a partir de esteres: Transesterificación O H + R C O R + R OH Mecanismo similar a la esterificación de Fischer O R C O R + O O C O CH3 + CH3 CH OH CH3 H + calor exceso Hidrólisis de esteres en medio ácido Protonacion del grupo carbonilo para activarlo… … para su posterior ataque nucleofilico por el gua para generar el intermediario tetraedrico La transferencia de un H convierte al grupo –OR’ en un buen GS. Expulsión del ROH para dar el RCO2H libre y regenerar el catalizador ácido H O R CH3 C O CH CH3 + CH3 OH Hidrólisis de esteres en medio básico: Saponificación Saponificación: Hidrólisis de esteres en medio básico Adición nucleofílica del –OH sobre el C del ester para dar el intermediario tetraedrico Eliminación del ion alcóxido para generar el ácido carboxílico El ion alcóxido abstrae el H del ácido para dar el anión carboxilato El ácido carboxílico se protona en un paso posterior por un ácido mineral Preparación de amidas O R NHR' R'NH2 O O NH3 R NH2 R O R'2NH2 Cl R NR'2 Conversión de amidas en ácidos carboxílicos: Hidrólisis Conversión de derivados de ácidos en alcohol: Reducción Conversión de amidas en aminas: Reducción