tema9
Anuncio
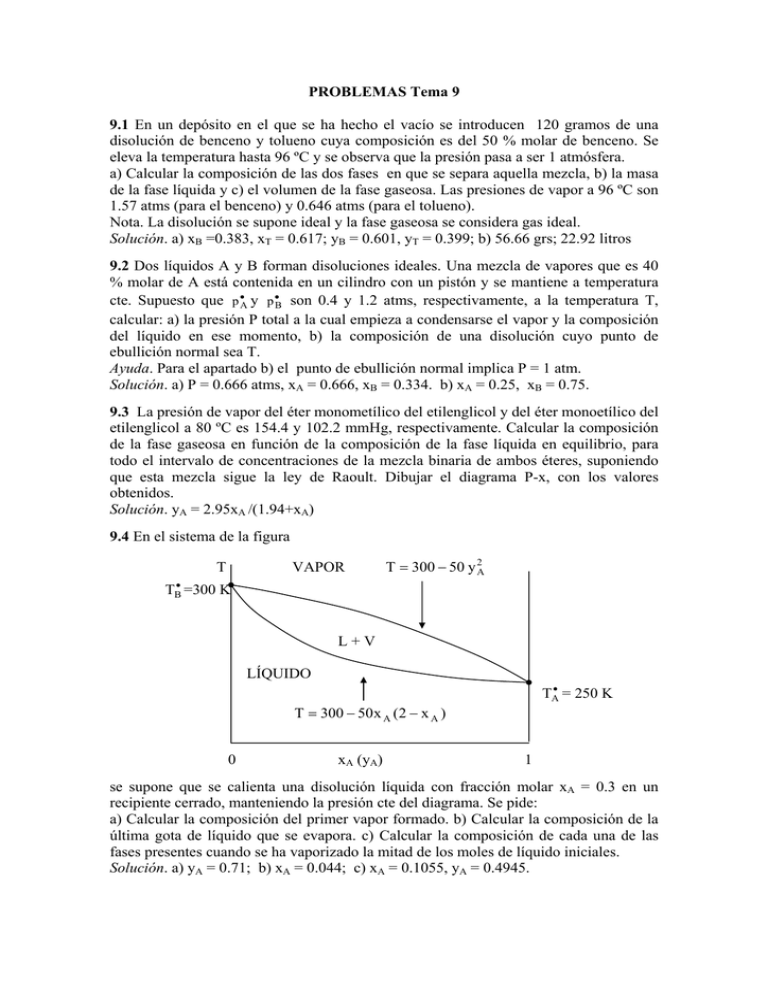
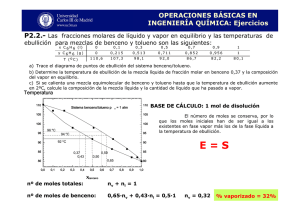
PROBLEMAS Tema 9 9.1 En un depósito en el que se ha hecho el vacío se introducen 120 gramos de una disolución de benceno y tolueno cuya composición es del 50 % molar de benceno. Se eleva la temperatura hasta 96 ºC y se observa que la presión pasa a ser 1 atmósfera. a) Calcular la composición de las dos fases en que se separa aquella mezcla, b) la masa de la fase líquida y c) el volumen de la fase gaseosa. Las presiones de vapor a 96 ºC son 1.57 atms (para el benceno) y 0.646 atms (para el tolueno). Nota. La disolución se supone ideal y la fase gaseosa se considera gas ideal. Solución. a) xB =0.383, xT = 0.617; yB = 0.601, yT = 0.399; b) 56.66 grs; 22.92 litros 9.2 Dos líquidos A y B forman disoluciones ideales. Una mezcla de vapores que es 40 % molar de A está contenida en un cilindro con un pistón y se mantiene a temperatura cte. Supuesto que p •A y p •B son 0.4 y 1.2 atms, respectivamente, a la temperatura T, calcular: a) la presión P total a la cual empieza a condensarse el vapor y la composición del líquido en ese momento, b) la composición de una disolución cuyo punto de ebullición normal sea T. Ayuda. Para el apartado b) el punto de ebullición normal implica P = 1 atm. Solución. a) P = 0.666 atms, xA = 0.666, xB = 0.334. b) xA = 0.25, xB = 0.75. 9.3 La presión de vapor del éter monometílico del etilenglicol y del éter monoetílico del etilenglicol a 80 ºC es 154.4 y 102.2 mmHg, respectivamente. Calcular la composición de la fase gaseosa en función de la composición de la fase líquida en equilibrio, para todo el intervalo de concentraciones de la mezcla binaria de ambos éteres, suponiendo que esta mezcla sigue la ley de Raoult. Dibujar el diagrama P-x, con los valores obtenidos. Solución. yA = 2.95xA /(1.94+xA) 9.4 En el sistema de la figura T VAPOR T = 300 − 50 y 2A TB• =300 K L+V LÍQUIDO TA• = 250 K T = 300 − 50 x A (2 − x A ) 0 xA (yA) 1 se supone que se calienta una disolución líquida con fracción molar xA = 0.3 en un recipiente cerrado, manteniendo la presión cte del diagrama. Se pide: a) Calcular la composición del primer vapor formado. b) Calcular la composición de la última gota de líquido que se evapora. c) Calcular la composición de cada una de las fases presentes cuando se ha vaporizado la mitad de los moles de líquido iniciales. Solución. a) yA = 0.71; b) xA = 0.044; c) xA = 0.1055, yA = 0.4945.