29. manejo del sindrome de distres respiratorio del adulto en
Anuncio

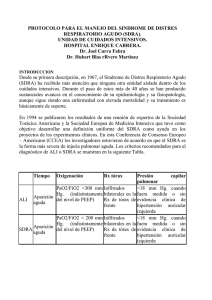
Sección Respiratorio Capítulo 29 - MANEJO DEL SINDROME DE DISTRES RESPIRATORIO DEL ADULTO EN URGENCIAS Francisco de Pablo Cillero, M.ª Teresa Rosell Abós, Lorena Martínez Romero CONCEPTO Fue descrito por primera vez por Ausbaugh en 1967. Actualmente se aplica la definición de la American European Consensus Conference on ARDS de 1994, ya que a lo largo de los años han existido múltiples variaciones, diferenciando entre lesión pulmonar aguda y SDRA, según la gravedad de la hipoxemia. Posee 3 características que convierten al SDRA en una entidad compleja: -se trata de un síndrome -no existe una prueba diagnóstica específica -la afectación es heterogénea La lesión aguda pulmonar (ALI) es un síndrome de inflamación aguda y persistente a nivel pulmonar, con aumento de la permeabilidad vascular, caracterizado por infiltrados pulmonares bilaterales que reflejan el edema intersticial y alveolar, una PaO2/FiO2 de 201-300 sin evidencia clínica de elevación de la presión de la aurícula izquierda o PCP < 18 si es medida. El síndrome de distrés respiratorio del adulto (SDRA) es el tipo más severo de lesión pulmonar aguda (ALI), con mayor grado de hipoxia, caracterizado por una relación PaO2/FiO2 < 200. Esta definición es algo controvertida, ya que las alteraciones radiológicas y fisiopatológicas propuestas aparecen en muchas otras entidades, de modo que es una definición poco concreta. Su incidencia varía según los diversos estudios y según las diferentes definiciones empleadas, en 3.5-8.3 casos/100000 habitantes, llegando a ser del 16% entre los pacientes con ventilación mecánica en una UCI convencional. FISIOPATOLOGÍA La principal alteración patogénica es la alteración de la función de la barrera alveolo capilar pulmonar, que origina la extravasación de plasma rico en proteínas, desarrollo de edema, se activa el sistema del complemento, la coagulación y las células inflamatorias. 363 Manual de Urgencias Cardiopulmonares La célula fundamental es el neutrófilo, si bien en los últimos estudios parece ser que su activación es más consecuencia que origen del daño pulmonar. La lesión producida en el epitelio alveolar ocasiona ocupación alveolar, perdida de la capacidad de eliminación del edema del espacio alveolar, daño en los neumocitos tipo II con alteración en la producción de surfactante, perdida de la barrera epitelial favoreciendo el paso de bacterias a la sangre y el desarrollo de shock séptico cuando el origen del SDRA es infeccioso. La lesión originada en el endotelio origina hemoconcentración, hipertensión pulmonar y alteración de la relación ventilación/perfusión. Posteriormente se producirá el colapso de las unidades alveolares, con disminución de la distensibilidad pulmonar, aumento de trabajo respiratorio e insuficiencia respiratoria 2ª a un mecanismo de shunt. El efecto shunt se debe a que una parte sustancia de la sangre que perfunde el parénquima no intercambia gases al pasar por alveolos no ventilados, debido a su ocupación por exudado. La disminución de la compliance pulmonar se debe a la ocupación del parénquima pulmonar por exudado y descenso del volumen aéreo pulmonar, modificándose sus características elásticas. ANATOMIA PATOLOGICA Histológicamente se caracteriza por la presencia de daño alveolar difuso, que es un patrón de reacción del parénquima pulmonar frente a una agresión difusa y grave, que cursa con insuficiencia respiratoria aguda. Macroscópicamente el pulmón se encuentra difusamente consolidado, con un gran aumento del peso total, con predominio de áreas sólidas, parduscas respetando la arquitectura broncoalveolar. Microscópicamente, la apariencia depende del tiempo de evolución del proceso, distinguiendo 3 fases que pueden superponerse, si bien en cualquier momento puede solucionarse el cuadro morfológico: -Fase exudativa o inicial (primeros 3 días), aparece edema localizado en los alveolos y en el espacio intersticial, con presencia de material fibrino-hemorrágico intraalveolar. Las células endoteliales de los capilares y los neumocitos tipo I sufren cambios degenerativos, con aumento de la permeabilidad vascular y descamación neumocitaria. Aparecen las estructuras más típicas de este proceso que son las membranas hialinas, son estructuras densas, eosinófilas, parcialmente laminadas que 364 MANEJO DEL SINDROME DE DISTRES RESPIRATORIO cubren la superficie alveolar desprovista de neumocitos, son el resultado de la mezcla de fibrina con residuos celulares. -Fase organizativa (días 3º - 10º), existe una progresión de las lesiones previas, que van siendo reemplazadas por reparación inflamatoria, que suele comenzar al 7º día de evolución. Los alveolos descamados comienzan a regenerarse y los neumocitos tipo II se diferencian hacia neumocitos tipo I dando lugar a hiperplasia neumocitaria. -Fase residual o fibrótica, en el espacio intersticial aparece un componente inflamatorio con linfocitos, histiocitos y células plasmáticas. Se acompaña de proliferación fibroblástica que va ocupando el espacio intersticial, generando acúmulos irregulares de fibras de colágeno originando una fibrosis intersticial difusa. ETIOLOGIA Son múltiples los procesos asociados al SDRA, siendo los más frecuentes sepsis, politraumatismo y aspiración del contenido gástrico. CAUSAS PULMONARES Aspiración de contenido gástrico Infección pulmonar (bacterias, virus, Pneumocystis jiroveci, Mycobacterium tuberculosis) Neumonía criptogenética organizada Post obstrucción de la vía aérea superior Contusión pulmonar Embolismo aéreo masivo Embolismo de líquido amniótico Neumonitis rádica Inhalación de humos o CO Ahogamiento Lesión por reperfusión Toxicidad por oxígeno Síndrome respiratorio agudo grave CAUSAS EXTRA PULMONARES Sepsis Politraumatismo grave con hipotensión prolongada o fracturas múltiples Pancreatitis aguda Shock Grandes quemados Politransfusión CID Embolia aérea o grasa Eclampsia Edema pulmonar de origen neurogénico, TCE Post trasplante de médula ósea Procesos neoplásicos hematológicos (linfoma, leucemia) Circulación extracorpórea Hipersensibilidad a fármacos Reacción transfusional por leucoaglutininas Fármacos y tóxicos (contrastes, barbitúricos, heroína, codeína, colchicina, citotóxicos, tromboliticos, salicilatos, paraquat) Etiología del SDRA. El SDRA de origen pulmonar tiene su mayor afectación en el epitelio de la membrana alveolo capilar mientras que en el SDRA extrapulmonar es el endotelio. En el SDRA pulmonar hay predominio de consolidación mientras que en el SDRA extrapulmonar predomina la atelectasia. 365 Manual de Urgencias Cardiopulmonares El riesgo de desarrollar SDRA aumenta al aumentar el número de posibles causas asociadas. En ausencia de traumatismo o quemaduras, la presencia de SDRA en un paciente previamente sano que no se encontraba hospitalizado suele deberse a infección, exposición a drogas ilegales, inhalación de gas tóxico o aspiración de contenido gástrico tras un suceso que conlleve pérdida de conciencia. En aquellos pacientes con antecedentes de infección de VIH, que se presenten con SDRA debemos sospechar infección por Pneumocystis jiroveci. Cuando aparece SDRA en un paciente hospitalizado previamente, lo más frecuente es que sea debido a sepsis o aspiración de contenido gástrico. Cuando la sepsis precede al SDRA, debemos pensar en el abdomen como el origen más frecuente de la infección; mientras que cuando la sepsis se desarrolla después del SDRA lo más frecuente es la infección pulmonar nosocomial. CLÍNICA El desarrollo del cuadro clínico es rápido, apareciendo a las 12-48 horas de comienzo del cuadro y raramente tarda más de 5 días de la causa desencadenante. Los síntomas respiratorios suelen preceder al desarrollo total de los infiltrados radiológicos, así la disnea y taquipnea son severas a pesar de que los infiltrados radiológicos sean pequeños en los momentos iniciales del cuadro, para posteriormente hacerse más evidentes. Otros síntomas respiratorios dependen de la causa desencadenante y su intensidad, si bien son poco frecuentes. La presencia de fiebre significativa, tos y esputo purulento nos debe hacer sospechar la presencia de neumonía; la presencia de sibilantes audibles y dolor pleurítico no es frecuente. En la exploración física destaca la presencia de un aumento del trabajo respiratorio con empleo de musculatura accesoria, taquipnea, taquicardia, estertores húmedos bilaterales a la auscultación, crepitantes o roncus, cianosis ocasionalmente. Con estos signos el paciente suele encontrarse agitado. La presencia de hipotensión arterial y signos de shock depende de la causa subyacente del SDRA (sepsis, traumatismo severo). A partir de la primera semana de ventilación mecánica puede aparecer neumonía asociada a ventilación por intubación y barotrauma. 366 MANEJO DEL SINDROME DE DISTRES RESPIRATORIO PRUEBAS COMPLEMENTARIAS -Rx tórax: aparecen inicialmente infiltrados intersticiales bilaterales de predominio basal y posteriormente, en menos de 12 horas, infiltrados alveolares bilaterales simétricos con presencia o no de broncograma aéreo, puede existir derrame pleural bilateral. No se acompaña de datos típicos de insuficiencia cardiaca como líneas de Kerley, cardiomegalia o cefalización del flujo. La Rx puede verse alterada por los efectos del tratamiento, así la fluidoterapia agresiva puede empeorar el edema alveolar mientras que los diuréticos pueden limitar o reducir el acumulo de líquido. La ventilación mecánica (en especial, presión espiratoria positiva. PEEP) al incrementar la presión media de la vía aérea puede reducir la densidad regional pulmonar al incrementar la insuflación, dando un aspecto radiológico de mejoría a pesar de persistir las anomalías del intercambio gaseoso. Cuando se requieren presiones aéreas elevadas para una ventilación efectiva, pueden aparecer signos radiológicos de barotrauma como enfisema subcutáneo, neumomediastino y neumotórax. Figura 1: Infiltrados alveolares bilaterales en paciente con SDRA. -Analítica de sangre: el dato más significativo es la presencia de insuficiencia respiratoria. Inicialmente aparece hipocapnia con alcalosis respiratoria y un aumento del gradiente alveolo arterial de oxígeno. En las fases más avanzadas aparece insuficiencia respiratoria severa que responde parcialmente a la administración de oxígeno y PEEP. Esta resis367 Manual de Urgencias Cardiopulmonares tencia a la oxigenoterapia indica que el shunt intrapulmonar es la principal causa de hipoxemia. -TAC torácico: aparecen zonas de ocupación y densidad alveolar, broncograma aéreo y atelectasias. En fases muy avanzadas pueden aparecer zonas de fibrosis. -Cateterismo pulmonar: aparece hipertensión pulmonar moderada-severa secundaria a hipoxemia, con PCP normal (< 18 mmHg), lo cual es fundamental para el Dx diferencial con EAP cardiogénico. -Pruebas funcionales: en las fases iniciales hay un predominio de patrón restrictivo, con reducción de la CPT y de la DLCO. Al cabo del año suelen normalizarse estas alteraciones, si bien la DLCO puede tardar algo más en recuperarse. En un 30% de pacientes descienden los flujos mesoespiratorios. Puede existir intolerancia al ejercicio con desaturación en el test de marcha por factores extra pulmonares como disfunción muscular y atrofia corticoidea, así como polineuropatía asociada a ingreso prolongado en UCI. -Lavado broncoalveolar: se realiza en ocasiones para descartar la presencia de infección oportunista, así en ausencia de infección, el hallazgo más característico es un aumento de polimorfonucleares (> 80%). DIAGNÓSTICO El diagnóstico es fundamentalmente clínico, aunque lo idóneo sería demostrar la presencia de daño alveolar difuso en un paciente que sospechemos SDRA, si bien es muy complicado obtener muestras pulmonares mediante biopsias en estos pacientes por su estado general. El SDRA se debe sospechar ante todo cuadro de insuficiencia respiratoria aguda de rápida evolución asociado a alguna causa predisponente, que se acompañe de infiltrados radiológicos bilaterales y difusos, una vez descartada la presencia de insuficiencia cardiaca. En caso de dudas con EAP cardiogénico, se debe emplear un catéter de Swan Ganz para medir la PCP enclavada, que será normal o disminuida en el caso de SDRA. CRITERIOS DIAGNÓSTICOS DEL SDRA Existencia de enfermedad desencadenante Signos clínicos de insuficiencia respiratoria severa Cociente PaO2/FiO2 < 200 Infiltrados radiológicos alveolares bilaterales Ausencia de insuficiencia cardiaca 368 MANEJO DEL SINDROME DE DISTRES RESPIRATORIO DIAGNÓSTICO DIFERENCIAL Se debe realizar frente a: -Insuficiencia cardiaca -Hemorragia alveolar difusa, se acompaña de anemia severa y el Dx se establece por broncoscopia -Neumonía intersticial aguda -Neumonía eosinófila aguda, se caracteriza por eosinofilia en BAL -Linfangitis carcinomatosa -Sarcoidosis -Síndrome de Goodpasture -Infiltración leucémica, linfoma COMPLICACIONES Sus complicaciones son propias de la insuficiencia respiratoria, de la ventilación mecánica y de la causa desencadenante. -Pulmonares: Barotrauma Fibrosis pulmonar Embolia pulmonar Neumonía asociada a ventilación mecánica Neumotórax Estenosis traqueal -Gastrointestinales: Hemorragia Traslocación bacteriana Neumoperitoneo -Cardíacas: Arritmias Cardiopatía isquémica -Renales: Fracaso renal agudo Balances hídricos positivos 369 Manual de Urgencias Cardiopulmonares -Nutricional: Malnutrición Déficit electrolítico -Sistémicas: Bacteriemia/Sepsis Fracaso multiorgánico TRATAMIENTO El tratamiento fundamental es el adecuado y precoz de la causa desencadenante, de modo que la falta de resolución de la misma conlleva la ausencia de resolución del SDRA. Las medidas que aquí se comentan son complementarias, destinadas a permitir la recuperación pulmonar sin inducir más complicaciones. VENTILACIÓN MECÁNICA Los principales objetivos de la ventilación mecánica en el SDRA son mantener un aceptable intercambio gaseoso y minimizar la presencia de efectos adversos. En la mayoría de casos es fundamental la ventilación mecánica para asegurar la oxigenación, así la VM con volúmenes corrientes bajos de 6-8 ml/kg para prevenir el daño pulmonar inducido por la ventilación mecánica (“ventilación protectiva”), que conlleva incremento de la PaCO2 (“hipercapnia permisiva”) ha demostrado mejorar la supervivencia en un 20% con respecto a volúmenes corrientes más elevados, tolerándose PaCO2 de hasta 70 mmHg. La VM suele requerir una PEEP elevada > 10 cmH2O para mejorar la insuficiencia respiratoria refractaria. La alteración del intercambio gaseoso debido al colapso alveolar por exudado puede mejorar mediante la aplicación de PEEP, de este modo se evita el colapso espiratorio de las unidades alveolares reclutadas al aplicar presión positiva durante la inspiración, aumentando la capacidad residual funcional y la superficie útil para el intercambio gaseoso, mejorando la PaO2 al disminuir el shunt intra pulmonar. Los efectos secundarios de la PEEP son la hipotensión por disminución de la precarga y el barotrauma. La PEEP puede aplicarse mediante mascarillas naso bucales (VMNI/CPAP) o ventilación mecánica. En la CPAP el paciente respira espontáneamente con un sistema de flujo de oxígeno elevado y presión positiva en las vías aéreas durante 370 MANEJO DEL SINDROME DE DISTRES RESPIRATORIO todo el ciclo respiratorio. Es necesario que el paciente no se encuentre fatigado, lo cual es complicado cuando la duración del proceso es >2 días. La VMNI tipo BiPAP permite reducir el esfuerzo inspiratorio, mejorar la oxigenación y la disnea, sobre todo al aplicar PEEP elevada, siendo este sistema preferible a la CPAP. En el caso de empleo de este sistema de ventilación es fundamental la selección adecuada de los pacientes, ya que una mala elección conlleva al fracaso de la VMNI y al retraso de la intubación orotraqueal. Los criterios de exclusión de la VMNI se señalan en la tabla siguiente. CRITERIOS DE EXCLUSIÓN DE VMNI Parada respiratoria Inestabilidad hemodinámica (shock, arritmia maligna) Imposibilidad de proteger la vía aérea Broncorrea Agitación psicomotriz Traumatismo facial, grandes quemados, alteraciones anatómicas Los factores predictores de fracaso de la VMNI son APACHE II > 34, edad avanzada, alteración pulmonar primaria y la imposibilidad de mejoría clínica-gasométrica tras 1 hora de VMNI. Mediante la ventilación mecánica, se puede establecer la PEEP óptima, que es el nivel de presión para el que se consigue mayor incremento de PaO2, con menor deterioro hemodinámico. La VM en decúbito prono mejora la oxigenación, al optimizar la ventilación alveolar regional, si bien su u efectividad se reduce con el paso del tiempo, por lo que de aplicarse, debe ser al principio, si bien no ha demostrado un aumento de supervivencia. TRATAMIENTO NO FARMACOLÓGICO La oxigenoterapia a elevadas concentraciones es fundamental por la severidad de la insuficiencia respiratoria, teniendo en cuenta la toxicidad del oxígeno a medio-largo plazo. Se debe administrar oxígeno para mantener SpO2 > 90%, habitualmente a concentraciones elevadas, con mascarillas con sistema Venturi en pacientes no intubados. En cuanto a la fluidoterapia, se ha demostrado que la restricción de líquidos sin inducir hipovolemia, para conseguir una PCP más baja compatible con un gasto cardíaco adecuado, durante los primeros días del SDRA puede mejorar la evolución posterior sin aumentar las complicaciones (fracaso renal, compromiso hemodinámico). 371 Manual de Urgencias Cardiopulmonares TRATAMIENTO FARMACOLÓGICO Existen muy pocas medidas farmacológicas útiles en esta entidad, se debe considerar el uso de corticoides durante la 2ª fase o fase fibroproliferativa, a dosis bajas de metil prednisolona, de modo que si ocurre respuesta, ésta es evidente en 3-5 días, reduciéndose gradualmente en 1-2 semanas. Si no existe respuesta inicial se pueden interrumpir. Un estudio no ha demostrado que modifique la supervivencia a los 60 días y su uso prolongado conlleva un pronóstico peor por la aparición de efectos secundarios no deseables. Los vasodilatadores pulmonares, empleados por la presencia de hipertensión pulmonar secundaria (diltiazem, nitroprusiato, análogos de la prostaglandina) no han demostrado mejorar el pronóstico del SDRA. El uso de NO inhalado (< 100 ppm) origina vasodilatación pulmonar selectiva, elevando la PaO2, permite disminuir la FiO2 y la toxicidad de la oxigenoterapia, si bien tampoco ha demostrado mejorar la mortalidad del SDRA. El empleo de antioxidantes como N acetilcisteína, tampoco ha demostrado mejorar la supervivencia, aunque podrían obtenerse beneficios en cuanto a duración de estancia en UCI y días de ventilación mecánica. El empleo de surfactante exógeno como en el síndrome del distrés respiratorio del recién nacido, no ha obtenido tampoco buenos resultados. PRONÓSTICO Su mortalidad es del 35-40%, disminuyendo en los últimos años por el desarrollo de los Cuidados Intensivos. Los factores asociados a un peor pronóstico son la edad avanzada, comorbilidad (sobre todo hepatopatía), sepsis y fracaso multiorgánico. En cambio la valoración del cociente PaO2/FiO2 al inicio del tratamiento no es un buen predictor de mortalidad Entre los pacientes que sobreviven son habituales los trastornos de la ventilación y un descenso de la DLCO. BIBLIOGRAFÍA Casan P, García Río F, Gea J. Fisiología y Biología Respiratorias. 462-473. Irwin and Rippe’s Intensive Care Medicine. 5ª Edición- 2003. Capítulo 47. Murray-Nadel. Textbook of Respiratory Medicine. 3ª Edición. 2000. 372