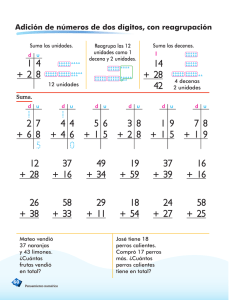
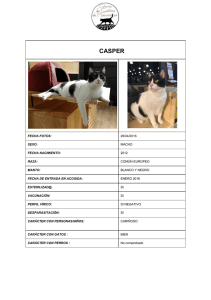
universidad nacional autónoma de méxico - Biblioteca, FES-C
Anuncio

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN “MASTOCITOMA GRADO I EN PACIENTE CANINO” SERVICIO SOCIAL ATENCIÓN MÉDICO-QUIRÚRGICA DE PACIENTES DENTRO DEL HOSPITAL DE PEQUEÑAS ESPECIES DE LA FES CUAUTITLÁN QUE PARA OBTENER EL TÍTULO DE: MÉDICA VETERINARIA ZOOTECNISTA P R E S E N T A: ANA LIDIA BARBA AGUILAR ASESOR: M.V.Z. JOSÉ FELIPE MORALES CABRAL Cuautitlán Izcalli, Estado de México 2014 AGRADECIMIENTOS A Dios por darme la oportunidad de estudiar y terminar esta hermosa carrera, por darme una familia maravillosa y por la oportunidad de conocer a gente extraordinaria en mi camino A mi mamá por ser mi pilar, mi fuerza, mi impulso, porque siempre ha estado conmigo apoyándome, cuidándome, porque a pesar de las dificultades siempre veló y se preocupó por nosotras y que gracias a ella he podido salir adelante, mi amor y admiración son infinitos. A mi hermana, por estar toda la vida conmigo, por tu amor, por siempre cuidarme, por ser mi amiga, por ser la mejor hermana, e incluso hoy me sigues procurando e impulsando a superarme y terminar mis metas. A mi papá por inculcarme valores importantes, por ser un ejemplo a seguir, por enseñarme que con dedicación, esfuerzo y disciplina se puede lograr lo que uno desea, gracias por el apoyo que me has brindado, por escucharme y preocuparte por mí. Al amor de mi vida Ricardo, gracias amor por tantos años de estar a mi lado, gracias por tu amor, tu paciencia, tu confianza, por siempre inspirarme a ser mejor persona, estudiante, profesionista, mejor médico, por enseñarme con tu ejemplo el amor por la medicina y por estar conmigo en las buenas y en las malas, no podría expresar todo mi amor y agradecimiento hacia ti, te amo muchísimo hoy y siempre. También le quiero agradecer a toda mi familia, mis abuelos y abuelas, mis tíos y primos por creer en mí y apoyarme cuando lo he necesitado, a Montse y Vale, las amo mucho pequeñas, a la señora Gloria y al señor Alfredo, por abrirme las puertas de su casa y recibirme como parte de su familia. A “Chato”† alguna vez te prometí dedicarte éste logro, gracias por enseñarme tantas cosas, gracias por tu compañía, siempre te recordaré, a mi hija Foogy por su incondicional compañía, por estar conmigo a lo largo de mi carrera y por mostrarme el amor sincero, a todas mis mascotas y a todos los amigos peludos que formaron parte de mi aprendizaje. A mis amigos: Belén, Carlos, Maresa, Yolotzin, Rosselli, Elisa, Laurita, Pablito, Pau Pau, Mario, Gaby, cada uno sabe cuánto lo quiero, y lo especial que han sido en mi vida, gracias por esos años de amistad y de apoyo, no lo hubiera podido lograr sin ustedes. A mis amigos del Hospital: Josefina, Rubí, Alan, Israel, Fernando, Alberto, por esos grandiosos momentos de alegrías, risas, estrés, desveladas, etc., gracias por su apoyo, por compartir esa experiencia conmigo. A amigo Ángel Lozada por todas las veces que quise tirar la toalla y estuviste ahí, tus consejos me ayudaron a seguir. Al Hospital de Pequeñas Especies de la FESC, por permitirme realizar mi servicio social, al Dr. Marco Antonio de Paz por la paciencia y conocimientos compartidos, a los doctores: Gerardo Alberto Hernández, David Ramírez, Juan Miguel Ibarra, Alfonso Zabre, Emilio López, por su ayuda en el Hospital y fuera de él, por su comprensión y ejemplo, al Dr. Ignacio Rangel por mostrarme el amor por el conocimiento, y por la disposición de enseñar y apoyar a los alumnos, por la paciencia y el tiempo que dedicó a este trabajo. A mi jefe, maestro y amigo José Felipe Morales, por darme la oportunidad de trabajar con usted, por todos los conocimientos que me ha compartido, por creer en mí, por sus consejos y su apoyo, y por ayudarme a la realización de esta meta. A mis profesores de la FESC por la paciencia y por todos los conocimientos que me transmitieron a lo largo de mi formación, y por enseñarme el amor por la facultad. A mis sinodales Dr. Rigoberto Hernández, Dra. Miriam Ramírez, Dr. Emilio López por el tiempo y paciencia que le dedicaron a mi trabajo. A mi querida facultad, por recibirme y dejarme ser parte de su comunidad. A la máxima casa de estudios, orgullosamente UNAM. ÍNDICE DE CONTENIDO INTRODUCCIÓN…………………………………………………………………………1 OBJETIVOS ……………………………………………………………………………..28 METODOLOGÍA…………………………………………………………………………30 DESCRIPCIÓN DE ACTIVIDADES……………………………………………………31 RESULTADOS………………………………………………………………………......92 DISCUSIÓN…………………………………………………………………………….124 CONCLUSIONES…………………………………………………………………..….132 RECOMENDACIONES……………………………………………………………..…133 BIBLIOGRAFÍA…………………………………………………………………………135 ANEXOS……………………………………………………………………………..….138 ÍNDICE DE IMÁGENES PÁGINA Imagen 1. Vista exterior del Hospital de Enseñanza en Medicina y Cirugía de la Facultad de Estudios Superiores Cuautitlán…………………………………………….………………..12 Imagen 2. Vista lateral del Área de Recepción del HEMyCPE………………………………14 Imagen 3. Consultorio general…………………………………………………………………..15 Imagen 4. Consultorio de Especialidades y Medicina Preventiva………………………..…15 Imagen 5. Vista lateral del Área de atención primaria ambulatoria……………………...…16 Imagen 6. Consultorio de Infecciosos…………………………………………………………..17 Imagen 7. Gabinete con ropa para ingresar al Hospital de Infecciosos…………………….17 Imagen 8. Hospital de Infecciosos………………………………………………………………18 Imagen 9. Área de Laboratorio Clínico…………………………………………………………18 Imagen 10. Equipo para hematología del área de Laboratorio Clínico……………………..19 Imagen11. Equipo para Citologías……………………………………………………………..19 Imagen 12. Equipo de Ultrasonido y Endoscopía……………………………………………..20 Imagen 13. Aparato de Rayos X………………………………………………………………..20 Imagen 14. Quirófano…………………………………………………………………………….21 Imagen 15. Sala de Preparación………………………………………………………………..21 Imagen 16. Sala de Recuperación…………………………………………………………...…22 Imagen 17. Área de CEYE………………………………………………………………………22 Imagen 18. Terapia Intensiva……………………………………………………………………23 Imagen 19. Área de Hospitalización……………………………………………………………23 Imagen 20. Jaulas del área de hospital general………………………………………………24 Imagen 21. Hospital de Gatos……………………………………………………………….….24 Imagen 22. Área de Fisioterapia………………………………………………………………..25 Imagen 23. Tina de hidromasaje………………………………………………………….…….25 Imagen 24. Sala de estudiantes………………………………………………………………...25 Imagen 25. Aula…………………………………………………………………………………..25 Imagen 26. Comedor……………………………………………………………………………..26 Imagen 27. Sanitarios y Vestidores…………………………………………………………….26 Imagen 28. Dormitorios……………………………………………………………………….….26 Imagen 29. Lavandería…………………………………………………………………………..26 Imagen 30. Preparación del paciente…………………………………………………………..39 Imagen 31. Procedimiento quirúrgico…………………………………………………………..39 Imagen 32. Paciente hospitalizado en el área de infecciosos……………………………….43 Imagen 33. Realización de fisioterapia a un paciente………………………………………..44 Imagen 34. Paciente hospitalizado……………………………………………………………..44 Imagen 35. Manejo de paciente en el área de medicina……………………………………..57 Imagen 36. Paciente hospitalizado en el área de terapia intensiva…………………………59 Imagen 37. Captura de datos demuestras de hematología en el analizador hematológico……………………………………………………………………………………... 76 Imagen 38.Revisión al microscopio de muestras de citología………………………….……76 Imagen 39. Realización de estudio radiográfico………………………………………………88 Imagen 40. Realización de endoscopía en el HEMyCPE……………………………………91 ÍNDICE DE TABLAS PÁGINA Tabla 1. División de las áreas del Hospital de Pequeñas Especies de la FESC……………………………….…30 Tabla 2. Cronograma de actividades realizadas en el Hospital de Pequeñas Especies de la FES Cuautitlán del periodo comprendido del 15 de marzo de 2012 al 15 de marzo de 2013………………………………….…..….31 Tabla 3. Determinación del riesgo quirúrgico dependiente del estado físico de los pacientes quirúrgicos….....34 Tabla 4. Descripción de actividades realizadas de las rotaciones en los procedimientos quirúrgicos………...37 Tabla 5. Constantes fisiológicas de caninos y felinos………………………………………………………………..52 Tabla 6. Calendario de Inmunización en caninos en el Hospital de Pequeñas Especies de la FESC………….60 Tabla 7. Calendario de vacunación en felinos en el Hospital de Pequeñas Especies de la FESC……………..61 Tabla 8. Resumen de antígenos vacunales caninos y guía de vacunación…………………………………….…63 Tabla 9. Resumen de antígenos vacunales felinos y guía de vacunación…………………………………………65 Tabla 10. Registro de cirugías durante el periodo comprendido del 15 de marzo al 11 de mayo de 2012 dentro de las instalaciones del Hospital de Pequeñas Especies de la FESC……………………………………………...93 Tabla 11. Pacientes sometidos a cirugía divididos por especie…………………………………………………..…94 Tabla 12. Motivo de cirugía…………………………………………………………………………………………..….94 Tabla 13. Cirugías de Medicina Preventiva del periodo del 15 de marzo al 11 de mayo de 2012………………95 Tabla 14. Cirugías de tejidos blandos divididas en aparatos o sistemas en el periodo del 15 de marzo al 11 de mayo de 2012……………………………………………………………………………………………………………..96 Tabla 15. Cirugías de tejidos blandos………………………………………………………………………………….97 Tabla 16. Cirugías ortopédicas realizadas en el periodo del 15 de marzo al 11 de mayo de 2012……………..98 Tabla 17. Pacientes sometidos a cirugía clasificados por sexo……………………………………………………..99 Tabla 18. Principales razas de pacientes caninos sometidos a cirugía…………………………………………..100 Tabla 19. Pacientes hospitalizados en el periodo del 14 de mayo al 13 de julio de 2012 divididos por especies………………………………………………………………………………………………………………….101 Tabla 20. Sexo de los pacientes hospitalizados……………………………………………………………………..101 Tabla 21. Principales razas de perros hospitalizados durante el periodo comprendido del 14 de mayo al 13 de julio de 2012…………………………………………………………………………………………………….……….102 Tabla 22. Razas de felinos hospitalizados durante el periodo comprendido del 14 de mayo al 13 de julio de 2012……………………………………………………………………………………………………………..………..103 Tabla 23. Registro de pacientes y área de hospitalización al que fueron internados…………………………...103 Tabla 24. Registro de pacientes hospitalizados durante el periodo del 14 de mayo al 13 de julio de 2012…104 Tabla 25. Registro de pacientes de consulta a mi cargo durante el periodo comprendido del 16 de julio al 14 de septiembre de 2012 dentro de las instalaciones del Hospital de Pequeñas Especies de la FESC.............107 Tabla 26. Relación de pacientes atendidos en el área de medicina divididos por especie…………………….108 Tabla 27. Razas de perros atendidos en el área de medicina durante el periodo del 16 de julio al 14 de septiembre de 2012…………………………………………………………………………………………………….108 Tabla 28. Pacientes atendidos en el área de medicina durante el periodo del 16 de julio al 14 de septiembre de 2012 divididos por sexo…………………………………………………………………………………………….109 Tabla 29. Aparatos o sistemas más afectados en pacientes atendidos del periodo del 14 de mayo al 13 de julio de 2012……………………………………………………………………………………………………………..110 Tabla 30. Registro de edades de pacientes atendidos en el área de medicina del periodo del 14 de mayo al 13 de julio de 2012……………………………………………………………………………………………………...111 Tabla 31. Enfermedades dermatológicas en pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012………………………………………………………………………...……112 Tabla 32. Registro de medidas preventivas realizadas a los pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012…………………………………………………....113 Tabla 33. Enfermedades digestivas diagnosticadas en pacientes durante mi rotación en el área de medicina…………………………………………………………………………………………………………….……114 Tabla 34. Pruebas diagnósticas más solicitadas durante mi rotación en el área de medicina…………………115 Tabla 35. Registros de laboratorio por especie durante el periodo del 17 de septiembre al 15 de noviembre de 2012……………………………………………………………………………………………………………...……….116 Tabla 36. Registros de laboratorio por sexo del paciente durante el periodo del 17 de septiembre al 15 de noviembre de 2012……………………………………………………………………………………………….…….117 Tabla 37. Registros de laboratorio por edad del paciente durante el periodo del 17 de septiembre al 15 de noviembre de 2012………………………………………………………………………………………………..……117 Tabla 38. Estudios de laboratorio realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012………………………………………………………………………………………………………………………119 Tabla 39. Estudios de ELISA realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012….120 Tabla 40. Registros de estudios radiográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013………………………………………………………………………………………………………..121 Tabla 41. Registros de regiones anatómicas proyectadas solicitadas durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013……………………………………………………………………………………....122 Tabla 42. Estudios ultrasonográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013…………………………………………………………………………………………………………...123 ÍNDICE DE GRÁFICAS PÁGINA Gráfica 1. Relación de pacientes sometidos a cirugía por especies………………………..…………94 Gráfica 2. Clasificación de los motivos de cirugía………………………………………………..……...95 Gráfica 3. Cirugías de Medicina Preventiva del periodo del 15 de marzo al 11 de mayo de 2012...96 Gráfica 4. Cirugías de tejidos blandos divididas en aparatos o sistemas afectados………………..97 Gráfica 5. Descripción de cirugías de tejidos blandos………………………………………………..…98 Gráfica 6. Cirugías ortopédicas……………………………………………………………………………99 Gráfica 7. Principales razas caninas de pacientes sometidos a cirugía……………………………..100 Gráfica 8. Principales razas de perros hospitalizados durante el periodo comprendido del 14 de mayo al 13 de julio de 2012……………………………………………………………………………….102 Gráfica 9. Pacientes hospitalizados por área de hospitalización durante el periodo del 14 de mayo al 13 de julio de 2012………………………………………………………………………………………104 Gráfica 10. Razas de perros atendidos en el área de medicina………………………………………109 Gráfica 11. Aparatos o sistemas más afectados en pacientes atendidos del periodo del 14 de mayo al 13 de julio de 2012…………………………………………………………………………….…110 Gráfica 12. Edades de los pacientes atendidos en consulta (años)………………………………….111 Gráfica 13. Edades de los pacientes atendidos en consulta (meses)…………………………….….112 Gráfica 14. Enfermedades dermatológicas en pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012……………………………………….113 Gráfica 15. Medidas preventivas realizadas a los pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012……………………………………….114 Gráfica 16. Enfermedades digestivas diagnosticadas en pacientes durante mi rotación en el área de medicina…………………………………………………………………………………………………115 Gráfica 17. Pruebas diagnósticas más solicitadas durante mi rotación en el área de medicina….116 Gráfica 18. Registros de edades (años) en estudios de laboratorio durante el periodo del 17 de septiembre al 15 de noviembre de 2012………………………………………………………………...117 Grafica 19. Registros de edades (meses) en estudios de laboratorio durante el periodo del 17 de septiembre al 15 de noviembre de 2012………………………………………………………………...118 Gráfica 20. Estudios de laboratorio realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012……………………………………………………………………………………...…119 Gráfica 21. Estudios de ELISA realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012……………………………………………………………………………………………………..120 Gráfica 22. Registros de estudios radiográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013………………………………………………………………………….121 Gráfica 23. Regiones anatómicas proyectadas solicitadas durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013………………………………………………………………………....122 Gráfica 24. Estudios ultrasonográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013……………………………………………………………………………………123 ÍNDICE DE ANEXOS PÁGINA Formato 1. Expediente clínico……………………………………………………………...… 138 Formato 2. Orden Clínica……………………………………………………………………....142 Formato 3. Orden Terapéutica…………………………………………………………………143 Formato 4. Hoja de Progreso…………………………………………………………………..144 Formato 5. Autorización de Hospitalización……………………………………………….…145 Formato 6. Autorización para procedimientos quirúrgicos………………………………….146 Formato 7. Calendario de Vacunación………………………………………………………..147 Formato 8. Solicitud de Estudio de Radiográfico………………………………………….…148 Formato 9. Carta Técnica de Estudios Radiográficos……………………………………....149 Formato 10. Solicitud de Estudio Ultrasonográfico………………………………………….150 Formato 11. Hoja de Dermatología……………………………………………………………151 Formato 12. Autorización de Servicio de Endoscopía……………………………………...152 Formato 13. Solicitud de Estudio de Laboratorio…………………………………………….153 Formato 14. Resultados Estudios de Hemograma………………………………………….155 Formato 15. Resultados Estudios de Urianálisis…………………………………………….156 Formato 16. Resultado de Bioquímica Sanguínea Perfil Básico emitido por Laboratorios QUIMILABCO.VET………………………………………………………………………………157 Formato 17. Solicitud de Estudio Histopatológico……………………………..…………….158 Formato 18. Reporte Electrocardiográfico……………………………………………………159 INTRODUCCIÓN En la actualidad el papel que desempeña el Médico Veterinario en la sociedad es muy importante ya que debe cumplir con el compromiso de salvaguardar la salud del hombre a través del cuidado de la salud y bienestar de los animales. Así mismo dentro del amplio campo de la Medicina Veterinaria las pequeñas especies conforman una necesaria y cada día más importante área del saber veterinario, siendo la especie más significativa, el perro. Desde tiempos inmemoriales el perro siempre ha prestado gran utilidad al hombre y por este motivo ha adquirido un valor sobre todo sentimental. Entre nuestros antepasados (30,000 y 15,000 años a.C.) se le dio importancia al grado que se piensa que el perro fue representado en las prehistóricas y famosas Grutas, como las de Altamira y Lascaux. Se ha señalado que un bronce de Cerdeña presuntamente del periodo paleolítico tiene forma de perro, que sería la representación más antigua que existe sobre la tierra. La pintura donde el perro parece haber hecho su aparición, ya con sus inconfundibles características, corresponde a un vasto fresco rupestre encontrado en una cueva cerca de Alpera (España), que data del periodo de la época glacial, 10,000 años a.C., aproximadamente.21 Con el paso de los años y a medida que la cultura de los países aumenta , la afición por los perros ha cobrado mayor importancia CLASIFICACIÓN ZOOLÓGICA DEL PERRO DOMÉSTICO El perro doméstico pertenece a la clasificación zoológica de Linneo llamada CANIS FAMILIARIS, la podemos encontrar en distintas razas, tamaños y pelajes. Al género “canis”, también pertenecen los lobos, coyotes, chacales, zorros, etc., comprendido a su vez, en el orden de los carnívoros colocados en la subclase de los placentarios al igual que el hombre dentro de la clase de mamíferos, los cuales 1 forman parte del tipo de los vertebrados, en general, pertenecen al subreino de los Metazoarios, es decir al grupo de animales pluricelulares. La escala clasificatoria del perro es la siguiente: ESPECIE: Perro doméstico GÉNERO: Canis familiaris FAMILIA: Canideos ORDEN: Carnívoros CLASE: Mamíferos SUBCLASE: Placentarios TIPO: Vertebrados REINO: Animal SUBREINO: Metazoarios El perro es descendiente de diversas especies hoy domesticadas, el primer animal llamado perro fue el CANIS FAMILIARIS PALUSTRIS, “Perro de Peat”, que existió sobre la Tierra durante el periodo del Pleistoceno. Las razas caninas que hoy conocemos presentan diferentes rasgos, cuya diversidad no sólo está en la tendencia natural del Canis familiaris y su variación, sino también por la intervención de la mano del hombre. La palabra “CAN” que significa PERRO, salió de las lenguas indoeuropeas, que originalmente es “Kuon”. En las lenguas neolíticas derivadas del latín, le llamaron CANIS.37 Al perro lo podemos encontrar en cualquier parte donde el hombre viva, y desde los albores de la civilización, el perro ha sido fiel e inseparable amigo del hombre. El hombre ha utilizado a las numerosas razas caninas en diferentes servicios, que le han facilitado el trabajo. Existen más de 350 razas en el mundo, de las cuales muchas de ellas aún no han sido reconocidas por algunas asociaciones cinológicas. 2 EVOLUCIÓN Y DOMESTICACIÓN Los fósiles sugieren que hace 40 millones de años, floreció un pequeño carnívoro mamífero llamado Miacis. El Miacis favoreció la aparición del Cynodesmus y Tomarctus, precursores de los canideos de nuestros días; lobos, zorros, chacales y coyotes. El proceso de domesticación es difícil de trazar debido a que no es posible distinguir al lobo “manso” de los primeros lobos domesticados. Evidencias razonables de perros totalmente domesticados han sido encontradas en sitios muy distantes entre sí, como en Israel (12,000 a.C), Idaho (10,400 a.C.), Inglaterra (9,000a.C.), Rusia (9,000a.C.), Australia (8,000a.C.), China (6,800 a.C.), Missouri (5,500a.C.). Los cementerios de perros han sido aceptados, como una indicación de que éstos tenían un estatus especial, en culturas de países como en Israel, México, Egipto, etc. Varias hipótesis han sido formuladas para explicar el propósito original de la demostración, entre las que se encuentran las de origen religioso, según ésta, los perros fueron mantenidos con propósitos ceremoniales o religiosos y gradualmente los fueron domesticando, ya que fueron criándose en cautividad. Desde Egipto se diseminó el culto al perro hacia otros lugares; en la mitología griega, Hades en su morada de la muerte, era resguardada por un perro gigante con tres cabezas, similar a los actuales mastines. Los romanos también realizaron cultos a Anubis (Señor de la ciudad de los muertos), y Procyon, la estrella menor de la constelación Canis minor (perro pequeño). En el primer siglo d.C. se tiene un escrito de una autoridad romana en agricultura que contiene consejos para la cruza de perros. En la Roma antigua los perros fueron totalmente domesticados, si bien las razas no eran tan diversas como hasta nuestros tiempos, sí tienen la primera clasificación zootécnica de que se tiene conocimiento, dividiéndolo en seis grupos, identificándolos más como perros de trabajo que como perros de compañía: 3 Perros guardianes de la casa (Villaticci) Perros de pastoreo (Pastorales Pecuari) Perros para el deporte (Venatici) Perros belicosos o de guerra (Pugnaces o Belicosi) Perros que van tras la pista (Nares Sagaces) Perros que corren tras la presa (Pedibus Céleres). Los perros mexicanos eran diferentes a los perros europeos; hubo varios historiadores, entre ellos el cronista real Felipe II, Antonio de Herrera, quienes afirmaron que el perro no existió en México antes de la conquista. Este magno error no fue exclusivo de los antiguos historiadores y cronistas, ya que persistió la idea hasta mediados de este siglo. La presencia del perro en muchas religiones y ceremonias místicas ponen de manifiesto el apego que se estableció entre el hombre y el perro. En muchas de las teorías se establece que esto se debe a cuestiones religiosas y otras tantas a las raíces neolíticas de nuestros antepasados, en donde el hombre y el perro convivieron estrechamente. Cómo pudo ocurrir este vínculo o domesticación, posiblemente por razones utilitarias, en donde el perro se encontraba siempre tras el hombre en sus cacerías esperando un poco de carroña, a cambio de ello el perro comenzó a indicarle el lugar en donde se encontraban las presas y a ayudarle en la cacería con el ataque, más tarde estos perros se encontraban en las cercanías de las cuevas y servían para dar aviso de la entrada de la presencia de extraños de tribus contrarias o de algún animal peligroso. Después, estos perros comenzaron a procrear cachorros siendo adoptados por el hombre. Es muy probable que por esta relación simbiótica se domesticó el primer animal en la historia del hombre. 4 EL PERRO DOMÉSTICO Y SU RELACIÓN CON EL HOMBRE El papel que desempeña el perro en la sociedad moderna es básicamente de animales de compañía. Los perros son por naturaleza animales sociales que forman lazos cercanos con los seres humanos. En la sociedad moderna las actitudes hacia los perros son muy variadas. En los países occidentales, por ejemplo, donde se han llevado a cabo la mayoría de las investigaciones, la actitud hacia los perros es de total humanización, hasta el punto de brindarles mayores cuidados que a los seres humanos, muchas personas que poseen perros establecen una relación de compañía hacia su animal. En una sociedad tan competitiva e individualista como la actual, el motivo más común para tener perros es la compañía ya que para muchas personas estos animales brindan un afecto incondicional. Las personas que no tienen animales consideran que se utilizan como reemplazos inferiores de la interacción social humana. Más aún, muchas de estas personas suelen creer que este tipo de dueños presenta un comportamiento social y emocional anormal. Si bien en casos aislados esta posición puede ser cierta, innumerable cantidad de estudios han demostrado que la mayoría de los dueños de perros son personas normales, cuyos compañeros animales mejoran su calidad de vida. Otro de los motivos por los cuales la gente tiene perros es su utilización como colaboradores en diferentes tareas, entre las que podemos mencionar las de ayuda a discapacitados tanto físicos como mentales, rescate de personas, detectores de drogas y explosivos, entre otras. En algunos casos, la crianza de perros de razas puras es un pasatiempo; en muchos otros, un símbolo del nivel socioeconómico de su propietario. Lo cierto es que las actitudes que las personas tienen para con sus perros suelen ser diferentes y muchas veces reflejan su personalidad. En un estudio realizado en Europa se evaluó el sentimiento público hacia la especie canina donde la mayoría de las personas encuestadas eran mujeres, el resultado obtenido acerca del motivo de tener un perro fue: 5 El mayor número tienen perro por necesidades psicológicas, por necesidad de seguridad, les confiere una situación de “estatus” o necesidad de poseer algo valioso, por falta de afecto o necesidad de compañía, así como sustitución de la relación humana y en ocasiones por problemas físicos. EL PERRO Y LA MEDICINA VETERINARIA Dado que desde el momento que el hombre domesticó a los animales, su relación con ellos dejó de ser algo más que la simple subsistencia alimenticia, y se comenzó a contemplar el cuidado mutuo, fue cuando el hombre comenzó a aportar a través de su raciocinio el dominio de un arte y ciencia, que es la veterinaria. En América el primer antecedente de un centro dedicado a la enseñanza y ejercicio de la medicina veterinaria se encuentra en México. Se inició formalmente cuando el presidente Santa Anna en 1853 fundó la Escuela Nacional de Agricultura y Veterinaria en San Jacinto, que más tarde pasó a llamarse Escuela Nacional de Medicina Veterinaria y Zootecnia (Hoy FMVZ-UNAM).3 La evolución industrial que se inició en el país después de la revolución mexicana, demando más productos de origen animal con el consiguiente riesgo e incremento de los mismos; son éstos los motores del desarrollo científico de la Medicina Veterinaria y Zootecnia. En 1929, luego del movimiento que otorgó la autonomía a la UNAM, la escuela de Medicina Veterinaria quedó incorporada a la Máxima Casa de Estudios. Con el paso de los años se generó la necesidad de un desarrollo profesional más especializado, dando lugar a la creación de asociaciones tales como el Colegio Nacional de Médicos Veterinarios Zootecnistas. Es importante resaltar que la zootecnia se encuentra incorporada al programa académico desde 1879. Debido a la importancia que fue adquiriendo la carrera, se abrieron otras escuelas y facultades en el país; así, en 1957 se crearon tres y en la década de los sesenta, seis escuelas más. Entre los años de 1970 y 1975 se sumaron nueve escuelas. 25 6 Es así como en 1974 surge la carrera de Medicina Veterinaria en la entonces Escuela Nacional de Estudios Profesionales Cuautitlán, ahora Facultad de Estudios Superiores. Su creación obedeció principalmente la necesidad de ofrecer esta carrera a los estudiantes que vivían en la zona norte de la Ciudad de México, así como en las delegaciones Gustavo A. Madero, Azcapotzalco y en el Estado de México. 2,3 Para finales de la década de los setenta se registró un incremento en la matrícula escolar que llegó a 580 estudiantes en el primer ingreso. Para los años ochenta proliferaron una gran cantidad de escuelas que impartían la carrera de Médico Veterinario Zootecnista; esto provocó que en la década de los noventa el porcentaje de la matrícula escolar se viera claramente reducida. Considerando la gran diversidad de especies que se estudian en la carrera de Medicina Veterinaria, es necesario crear áreas específicas para el desarrollo de prácticas de las mismas, y debido a la necesidad y gusto de las personas por tener una mascota, el campo de la Medicina Veterinaria nos exige una atención de mayor calidad hacia las especies de compañía. Por tal motivo, la Universidad Nacional Autónoma de México abrió las puertas del HOSPITAL DE ENSEÑANZA EN MEDICINA Y CIRUGÍA DE PEQUEÑAS ESPECIES (HEMyCPE), en la Facultad de Estudios Superiores Cuautitlán para complementar la educación de los alumnos y debido a la necesidad de formar profesionales capaces de realizar diagnósticos y tratamientos adecuados en las pequeñas especies, así mismo para que puedan servir a la comunidad aledaña mediante la prestación de un servicio de alta calidad y a un costo accesible. En este sentido el Hospital de Pequeñas Especies tiene como objetivo crear un espacio que permita la profesionalización en el área de pequeñas especies, brindando al estudiante la oportunidad de desarrollar habilidades en el área de medicina y cirugía y así favorecer la vinculación con la realidad laboral, con lo cual 7 la UNAM se coloca a la vanguardia de la investigación, la especialización académica y la atención médica de mascotas en América Latina. El objetivo es proporcionar al alumno una formación integral de alto nivel competitivo, orientado al diagnóstico de situación y a la aplicación del conocimiento para la solución de problemas concretos que afectan al campo de su actividad profesional. De igual manera que el alumno aporte sus conocimientos, habilidades y destrezas, equilibrado para realizar el examen clínico y el diagnóstico oportuno y certero de las enfermedades, para así estar en condiciones de aplicar un tratamiento médico-quirúrgico encaminado a restaurar la salud y evitar el sufrimiento de los animales y en su caso, establecer o recomendar las medidas pertinentes de control y prevención. Con base en lo anterior, el egresado será capaz de orientar a los propietarios o responsables acerca de los cuidados y el compromiso que implica la convivencia con los animales, así mismo sobre la conservación, selección y aplicación de los programas preventivos de las enfermedades, ya que la preparación idónea y pertinente del Médico Veterinario es fundamental en el logro de su aceptación como profesional útil y necesario para la solución de los problemas que le conciernen en la sociedad. El 27 de mayo de 2009 fue colocada la primera piedra del hospital de Pequeñas Especies en el Campo Cuatro de la Facultad de Estudios Superiores Cuautitlán. Ubicado en Carretera Cuautitlán-Teoloyucan Km 2.5 Colonia San Sebastián Xhala, C. P. 54714, Cuautitlán Izcalli, Estado de México. Se tenía planeado que el hospital que atendería a perros y gatos, empezara a funcionar en el mes de enero del 2010, lamentablemente no fue posible por diversos motivos en esta fecha, siendo hasta el mes de junio del 2011 cuando empezó a recibir pacientes y abriendo sus puertas hasta el mes de septiembre del 2011. 8 En sus instalaciones se capacita a estudiantes y egresados de Medicina Veterinaria y Zootecnia y se ofrece consulta para las mascotas de los vecinos aledaños a la FESC. Este hospital de enseñanza tiene cuatro objetivos fundamentales: 1.- Formar profesionales especializados en el área por medio de programas de servicio social, servicio social titulación y prácticas profesionales supervisadas. 2.- Brindar servicio médico quirúrgico a las mascotas, salvaguardando la vida. 3.- Educar a la comunidad por medio de material didáctico sobre temas referentes al adecuado manejo y cuidado de las mascotas, así como de aquellas enfermedades que se contagian al hombre (zoonosis) apoyando así la salud pública. 4.- Apoyar al MVZ de la zona, al ofrecer servicios que le ayuden a dar una consulta integral. MISIÓN Dignificación del gremio veterinario a través de la formación de profesionistas altamente calificados capaces de satisfacer las exigencias de la sociedad, convirtiendo al hospital en un centro de referencia en el área de pequeñas especies. VISIÓN Ser un centro reconocido nacionalmente y de referencia internacional por su calidad en la atención a la comunidad, formación de Médicos Veterinarios y generador de proyectos de investigación en el área de pequeñas especies. VALORES Calidad, Lealtad, Compromiso, Honestidad 9 El Hospital de Pequeñas Especies cuenta con una superficie construida de mil 863 metros cuadrados de áreas construidas y mil 893 metros cuadrados de áreas exteriores. El Hospital cuenta con diez consultorios, dos destinados exclusivamente a enfermedades infecciosas para evitar el contagio intrahospitalario; dos más especiales para gatos, otros dos para medicina preventiva, los cuales serán utilizados solamente para cachorros, esto con el fin de evitar que adquieran enfermedades de otros pacientes, y otros cuatro consultorios para consulta general. Además cuenta con un área de atención médica primaria donde se les da atención inmediata a los pacientes que requieran cuidados ambulatorios. En el área de cirugía se encuentran tres quirófanos, los cuales, cuentan con máquinas de anestesia inhalada, uno de los quirófanos es utilizado para las cirugías ortopédicas y dos quirófanos son destinados para cirugías de tejidos blandos, así mismo con respectiva área de preparación y la sala de recuperación la cual cuenta con seis jaulas para el manejo de cuidados postoperatorios, así como área de esterilizado donde se realiza la esterilización y se almacena el instrumental, material y ropa quirúrgica, y se dispone de un área de fisioterapia para la rehabilitación de los pacientes que lo requieran. Cuenta también con un área de laboratorio de análisis clínicos con todo el equipamiento para realizar los estudios necesarios de diagnóstico más comúnmente utilizados, el cual es aprovechado también por el hospital de equinos y por médicos externos de la zona los cuales requieran del servicio; una sala de Rayos X, donde se cuenta con dos máquinas de rayos X y un cuarto oscuro de revelado equipado con una reveladora automática y una tina para revelado manual; una sala de ultrasonido en la cual se cuenta con equipo para realizar estudios de imagen; se cuenta con equipo de primer nivel, para endoscopías y electrocardiogramas; todo esto con el fin de poder apoyar al clínico para realizar con mayor precisión y confianza un diagnóstico definitivo. 10 En cuanto a instalaciones para uso del personal se cuenta con dormitorios para el alumnado que cubra guardias nocturnas y de fin de semana, con dos habitaciones una para mujeres y otra para hombres, además de un comedor, baños con regaderas y vestidores, lavandería y área de estudio para los alumnos y médicos de guardia. Un salón de usos múltiples que es utilizado para diversas actividades académicas como congresos, jornadas médicas, cursos y clases con académicos y especialistas. En el aspecto académico en el Hospital de Pequeñas Especies se cuenta con la participación de académicos especialistas, los cuales brindan a los estudiantes clases en diferentes áreas. Durante mi servicio social dos médicos especialistas estuvieron a cargo de impartir clases dentro de las instalaciones del Hospital. Clases de Neurología impartidas por el MVZ Esp. Humberto Morales; clases de dermatología a cargo del M. en C. José Martín Acevedo Arcique. En la planta alta del Hospital se cuenta con 18 cubículos destinados a los académicos para asesorar a los alumnos de servicio social, prácticas profesionales y estancia, sala de juntas y un área de comedor para los académicos. En las áreas exteriores del hospital se encuentra un estacionamiento con espacios para el personal del hospital y para el público en general y una rampa de acceso. 11 Imagen 1. Vista exterior del Hospital de Enseñanza en Medicina y Cirugía de la Facultad de Estudios Superiores Cuautitlán. 12 MAPA DE HOSPITAL PEQUEÑAS ESPECIES PLANTA BAJA Figura 1. Mapa de distribución de las áreas del HEMyCPE de la FESC. 13 El trabajo dentro del hospital se divide en cinco grandes áreas: Medicina Cirugía Hospitalización Imagenología Laboratorio de Análisis Clínicos. DESCRIPCIÓN DE LAS DIFERENTES ÁREAS: Recepción: En esta área los propietarios y sus mascotas esperan la atención médica. Cuenta además con el servicio de caja, donde se realizan los pagos de los procedimientos a realizarse, y un espacio para el registro de pacientes en donde se comienza la entrevista para obtener los datos de este paciente. Se encuentran dos gabinetes donde se almacenan los expedientes de los pacientes, sanitarios para los propietarios que esperan consulta y un área de venta de productos veterinarios tales como alimento y medicamentos que no se encuentra aún en funcionamiento. Imagen 2. Vista lateral del Área de Recepción del HEMyCPE 14 Consultorios: Es el espacio donde se realiza la exploración general del paciente, a este nivel se levanta el Examen Cínico Orientado a Problemas (ECOP), comenzando por la anamnesis y se lleva a cabo la interacción médico-pacientepropietario, cuenta con mobiliario básico para la exploración física de los pacientes, mesa de exploración, negatoscopio, báscula para animales pequeños, oftalmoscopio; y es aquí donde se realiza el primer filtro de tratamiento hospitalario. Existen dos consultorios para gatos, y consultorios de especialidades, donde se realizan las consultas dermatológicas, y también aquí es donde se llevan a cabo las consultas de medicina preventiva. Imagen 3. Consultorio general Imagen 4. Consultorio de Especialidades y Medicina Preventiva 15 Área de atención primaria ambulatoria: Aquí es donde se discuten de primera mano los casos clínicos derivados de la consulta general, se sitúa en la parte media del hospital, además es donde se toman muestras para laboratorio, se preparan los pacientes para realizar su ingreso a hospitalización o que se le realice algún estudio en Imagenología. Es aquí donde se les realiza algún procedimiento médico ambulatorio y también cuenta con jaulas donde se les coloca mientras esperan a su propietario. Imagen 5. Vista lateral del Área de atención primaria ambulatoria. Consultorios de infecciosos y Hospital del área de infecciosos: En este lugar se confina a los pacientes cuyas características clínicas y de posterior diagnóstico, son corroborados como portadores de alguna enfermedad infectocontagiosa que requiere aislamiento, atención y tratamiento por las características de su enfermedad alejado del resto de la generalidad de pacientes, con el fin de evitar un posible contagio. Son dos consultorios que se encuentran separados de los de consulta general, los cuales tienen sus propias básculas. A la entrada de estos se encuentra un gabinete con batas, gorros y botas quirúrgicas especiales para ingresar al hospital de infecciosos (Imagen 8) , en este se encuentran las jaulas donde se ingresan a los pacientes por enfermedades como Parvovirus canino, 16 Distemper canino, Leptospirosis, etc., y una zona de sospechosos (pacientes que aún no se les ha diagnosticado la enfermedad), las cuales se encuentran separadas entre sí, además se localiza una mesa de exploración con toma de agua, refrigerador para cadáveres, y refrigerador para colocar medicamentos, lavabo y lavaojos. Imagen 6. Consultorio de Infecciosos Imagen 7. Gabinete con ropa para ingresar al Hospital de Infecciosos 17 Imagen 8. Hospital de Infecciosos Laboratorio clínico: En este lugar se realizan los análisis necesarios para el diagnóstico y seguimiento de los pacientes hospitalizados, para los ambulatorios y para pacientes remitidos por médicos externos, cuenta con los equipos y reactivos para las principales pruebas a realizar en la práctica clínica cotidiana, como son aparato para realizar Hemogramas, Bioquímica Sanguínea, Urianálisis, microscopios, centrífugas, refractómetro, tubos para recolección de muestras, etc. Imagen 9. Área de Laboratorio Clínico 18 Imagen10. Equipo para hematología Imagen 11. Equipo para Citologías del Área de Laboratorio Clínico. Área de Imagenología: Se le da atención al paciente en esta área cuando es necesario ampliar la batería de pruebas para corroborar el diagnóstico presuntivo obtenido al examen físico, con el cual se apoya al diagnóstico mediante ultrasonido principalmente, así mismo se encuentra el aparato para realizar endoscopías. Junto a esta sala se localiza el área destinada a los Rayos X, donde se encuentran la máquina de rayos X, negatoscopios, gabinetes donde se almacenan los expedientes radiográficos, así como los suplementos de seguridad necesarios para el personal, tales como chalecos, guantes, etc., en el área de revelado, se encuentra una reveladora automática, y una reveladora manual, áreas contiguas que son útiles en el tránsito del paciente por determinación del médico responsable del caso en este nivel. 19 Imagen 12. Equipo de Ultrasonido y Endoscopía Imagen 13. Aparato de Rayos X Quirófanos: El paciente que requiere como terapéutica algún procedimiento quirúrgico es derivado al área de tejidos blandos o de ortopedia según se requiera. En cada quirófano se encuentra una mesa de cirugía, lámpara, cámara que transmite la cirugía en tiempo real, negatoscopio, tanque de oxígeno, máquina de anestesia inhalada, donde se utiliza como agente anestésico Isoflurano. 20 Existe además una sala de preparación y una para la recuperación del paciente. Se encuentra un lavatorio y piletas de lavado de acero inoxidable con jabón quirúrgico, cepillos, etcétera. Imagen 14. Quirófano Sala de preparación: Es el área donde se realiza la preparación del paciente previo a entrar a cirugía como es rasurado y lavado, en este se encuentra una mesa de exploración con toma de agua, fármacos para realizar la inducción anestésica, material y equipo como laringoscopios, sondas endotraqueales, carrito de emergencias, materiales para la preparación de la piel, jabón quirúrgico, antisépticos, alcohol, torundas de algodón. Imagen 15. Sala de Preparación 21 Sala de recuperación: En esta se encuentran jaulas donde se colocan a los pacientes, posterior al procedimiento quirúrgico, aquí se mantienen bajo los cuidados del personal de cirugía hasta que se restablece el estado de salud del paciente y el médico determine que ya es posible colocarse en el área de hospitalización general. Imagen 16. Sala de Recuperación Área de CEYE (Central de Equipo y Esterilización): Es una subárea de cirugía donde se limpia, esteriliza y prepara el material e instrumental útil en las cirugías. Se cuenta con equipos de autoclave para la esterilización del instrumental y equipo. Lavadoras y secadoras, gabinetes para almacenamiento de instrumental, equipo y material quirúrgico. Imagen 17. Área de CEYE 22 Terapia intensiva: Es donde se brinda atención especial a los pacientes que así lo requieran como monitoreo y atención constante. Esta área es utilizada en pacientes que requieren tratamiento especializado durante los primeros momentos de algún proceso agudo que pone en peligro la vida, con vigilancia estricta de su estado de salud por parte de los médicos encargados, además se cuenta con jaulas especiales para conectarse a tanques de oxígeno en caso de ser necesario. Imagen 18. Terapia Intensiva Hospitalización: Es en esta área donde reside el paciente que requiere tratamiento intrahospitalario y vigilancia contínua, posterior a un tratamiento quirúrgico o de seguimiento ante algún manejo por parte de los médicos de medicina interna. Cuenta con tres mesas de exploración con toma de agua, jaulas de acero inoxidable para la estancia de los pacientes, tres jaulas fijas para pacientes de talla grande; existen lavabos, lavaojos, gabinetes para almacenamiento de insumos y materiales diversos. Imagen 19. Área de Hospitalización 23 Imagen 20. Jaulas del área de hospital general Hospital de Gatos: El área destinada a la hospitalización de gatos cuenta con 20 jaulas especiales, que se pueden comunicar entre sí, para que el paciente se pueda trasladar a su arenero y sea más cómoda su estadía, además existe una mesa de exploración de acero inoxidable con toma de agua, un gabinete para almacenamiento de insumos y materiales, lavabo, lavaojos y horno de microondas. Imagen 21. Hospital de Gatos Área de Fisioterapia: Es en esta área donde se realizan la rehabilitación física de los pacientes que lo requieran, tales como pacientes traumatológicos en su mayoría. Se cuenta con tina para hidromasaje y pisos de material suave para la rehabilitación de los pacientes. 24 Imagen 22.Área de Fisioterapia Imagen 23. Tina de hidromasaje INSTALACIONES PARA USO DEL PERSONAL Imagen 24. Sala de estudiantes Imagen 25. Aula 25 Imagen 26. Comedor Imagen 28. Dormitorios Imagen 27. Sanitarios y Vestidores Imagen 29. Lavandería 26 PERSONAL QUE LABORA EN EL HOSPITAL D. en C. Marco Antonio de Paz Campos Director del Hospital de Enseñanza en Medicina y Cirugía de Pequeñas Especies de la FESC MVZ Esp. Gerardo Alberto Hernández Alberto Coordinador Médico M. en C. Ignacio C. Rangel Rodríguez Coordinador del Área de Patología Clínica MVZ David Ramírez Martínez Coordinador del Área de Cirugía MVZ Juan Miguel Ibarra Mendoza Medicina general y Cirugía MVZ José Felipe Morales Cabral Medicina general e Imagenología MVZ Solón Alfonso Zabre Santamaría Medicina general y Cirugía MVZ Emilio López Rodríguez Imagenología 27 OBJETIVOS OBJETIVO GENERAL: Prestaré un servicio social (modalidad titulación) apoyando las actividades médicas y quirúrgicas que brinda el Hospital Veterinario de Pequeñas Especies optimizando la capacidad profesional mediante la enseñanza y práctica de la medicina y cirugía en el área de pequeñas especies. OBJETIVO ESPECÍFICO DEL ALUMNO: Apoyo a las diferentes actividades que se desarrollen dentro del hospital, en el área médica, aprender a realizar un correcto examen clínico, y llenar un expediente a través del ECOP Examen Clínico Orientado a Problemas, así como desarrollar procedimientos de diagnóstico, aprender el manejo de herramientas con dicho propósito, la terapéutica y tratamiento Médico-Quirúrgico hasta el alta definitiva del paciente. En el ámbito quirúrgico aprender a desarrollar los procedimientos de cada cirugía, desde la preparación, el manejo anestésico, la técnica y realización de la cirugía, así como el proceso de evolución hasta el alta del paciente. Familiarizarme con el manejo intrahospitalario, tener una mejor preparación para atender las necesidades que se dan en la práctica de medicina en las pequeñas especies, apoyándome de los conocimientos de los académicos y de las actividades que pueda realizar dentro del Hospital de Pequeñas Especies. Aprender a trabajar e interactuar con otros colegas, no solo de la propia facultad de Cuautitlán sino de otras facultades, así como obtener la titulación a través del programa. 28 OBJETIVOS ACADÉMICOS: Aplicar los conocimientos médicos y quirúrgicos relacionados con la clínica de pequeñas especies, para abordar los diagnósticos, tratamientos de las diversas patologías que aquejan a las pequeñas especies. La elaboración de una ronda médica con la cual, expondré un caso clínico ante mis compañeros y doctores del hospital, fortaleciendo los conocimientos adquiridos tanto en la facultad como dentro del hospital. OBJETIVOS SOCIALES: Contribuir al desarrollo de una conciencia ética y humanista en el médico permitiéndole la aplicación de conocimientos con responsabilidad, consciente de los cuidados que requiere un animal de compañía. Desarrollar un centro de atención médica de alto nivel donde la comunidad pueda recibir la atención que requieran sus mascotas en forma íntegra y adecuada. Fomentar la educación y concientización de los propietarios de mascotas, mejorando la calidad de vida de éstas y de esta forma una sana convivencia entre mascota-dueño. Evitar la propagación de enfermedades zoonóticas a través de medidas preventivas y terapéuticas. 29 METODOLOGÍA El programa de Servicio Social Titulación dentro del Hospital de Pequeñas Especies tuvo una duración de 12 meses, comprendiendo del 15 de Marzo de 2012 al 15 de Marzo de 2013, durante este tiempo realicé actividades en forma programada por las diferentes áreas en las que se divide el hospital: Medicina, Cirugía, Hospitalización, Imagenología y Laboratorio de manera rotacional participando activamente en cada una de ellas. Dichas actividades fueron supervisadas y evaluadas por el académico responsable en cada área. Realicé las 5 rotaciones con una duración de dos meses en cada una, las cuales se subdividen de la siguiente manera: MEDICINA AREA DE CIRUGÍA ÁREA DE HOSPITALIZACIÓN Medicina general Medicina preventiva Cirugía Hospital de Infecciosos Urgencias Anestesia CEYE Hospital de Gatos Hospital de Perros Terapia Intensiva LABORATORIO Área de Hematología Área de Citología Área de Bioquímica Clínica y Hemostasia Área de Urianálisis y Coprología IMAGENOLOGÍA Ultrasonografía Rayos X Endoscopía Rehabilitación Tabla 1. División de las áreas del Hospital de Pequeñas Especies de la FESC. 30 DESCRIPCIÓN DE ACTIVIDADES El programa de Servicio Social Titulación dentro del Hospital de Pequeñas Especies se realiza de una forma rotacional y programada por cada una de las áreas que conforman el hospital, con una duración de dos meses en cada una de ellas. El periodo en el que realicé mis actividades comprende del 15 de Marzo de 2012 al 15 de Marzo de 2013, el cual me permitió desarrollar varias tareas, que se llevaron a cabo de acuerdo a ciertas normativas que determina el encargado del área y del Hospital. CRONOGRAMA DE ACTIVIDADES ÁREA CIRUGÍA HOSPITALIZACIÓN MEDICINA LABORATORIO CLÍNICO IMAGENOLOGÍA CAPTURA DE DATOS FECHA 15 de marzo de 2012- 11 de mayo de 2012 14 de mayo de 2012-13 de julio de 2012 16 de julio de 2012-14 de septiembre de 2012 17 de septiembre de 2012-15 de noviembre de 2012 16 de noviembre de 2012-15 de enero de 2013 16 de enero de 2013-15 de marzo de 2013 Tabla 2. Cronograma de actividades realizadas en el Hospital de Pequeñas Especies de la FES Cuautitlán del periodo comprendido del 15 de marzo de 2012 al15 de marzo de 2013 31 ÁREA DE CIRUGÍA El área de cirugía juega un papel importante dentro del hospital ya que aquí se llevan a cabo procedimientos quirúrgicos programados o de urgencia; el área de cirugía está conformada por una sala de preparación de los pacientes, tres quirófanos, dos de ellos son para tejidos blandos y uno es para procedimientos ortopédicos, cuenta también con una sala de recuperación y CEYE Central de Equipo y Esterilizado. Debido al riesgo constante de contaminación de los pacientes quirúrgicos, el área de cirugía se divide en sectores “limpio”, “mixto” y “contaminado” claramente delineados. 39 a) Zona negra o áreas contaminadas: Se aplica a las instalaciones o espacios sucios, “contaminados”, también denominados sépticos. Como son baños, pasillos exteriores, instalaciones para lavado de ropa quirúrgica, y en especial la sala de preparación del paciente (antisepsia). b) Zona gris o áreas mixtas: Son sitios con un grado medio de contaminación. Por ejemplo, zona de cambio de ropa de cirujanos y ayudantes, lavamanos para cirujanos, pasillos de circulación para persona con la vestimenta básica de hospital, preferentemente la “pijama quirúrgica” o filipina, bata y zapato blancos. c) Zona blanca o área limpia: Se le asigna principalmente al quirófano, mismo que deberá permanecer estéril o con un grado mínimo de contaminación, a él se ingresará vestido igual que en la zona gris, además de poner sobre los zapatos blancos botas quirúrgicas de lona o tela estériles. También se encontrarán aparatos y accesorios adicionales que deberán reunir características de esterilidad. 34,39 32 Mi rotación por esta área tuvo una duración de dos meses que comprende del 15 de marzo de 2012 al 11 de mayo de 2012, periodo en el cual se realizaron un total de 43 cirugías, en las cuales participe realizando diversas actividades. VALORACIÓN PREOPERATORIA La selección y preparación del paciente quirúrgico requiere la atención de una serie de detalles. Siempre se debe proceder con un examen físico detallado, estudios de laboratorio y una anamnesis minuciosa. ANAMNESIS Los interrogatorios detallados colaboran en la evaluación del proceso morboso subyacente e identificación de otras anormalidades que podrían afectar durante el proceso quirúrgico o el resultado de este. EXÁMEN FÍSICO El animal debe ser evaluado en forma sistémica durante el examen físico incluyendo a todos los sistemas corporales. Considerar la condición general (condición corporal, actitud/estado mental). En algunos pacientes es necesario realizar exámenes neurológicos (pacientes traumatizados) y ortopédicos, evaluaciones respiratorias, gastrointestinales, cardiovasculares y de sistema urinario. Las emergencias pueden permitir sólo una exploración breve hasta que el paciente se encuentre estabilizado. A mayor deterioro del estado físico, más elevado es el riesgo de las complicaciones anestésicas y operatorias. 33 DATOS DE LABORATORIO El estado físico y el procedimiento a realizar dictaminan la extensión de la indagación clinicopatológica. Los datos adicionales del laboratorio dependen de los signos presentes y la enfermedad de base. La identificación de enfermedades asociadas o subyacentes influye en el manejo preoperatorio, procedimiento quirúrgico realizado, pronóstico y atención postoperatoria.10, 39 DETERMINACIÓN DEL RIESGO QUIRÚRGICO Nos permite emitir un pronóstico acerca del proceso quirúrgico dependiendo del estado de salud del paciente. ESTADO FÍSICO EN LOS PACIENTES QUIRÚRGICOS CONDICIÓN ESTADO FÍSICO EJEMPLOS DELPACIENTE Sano sin enfermedad Procedimientos I discernible facultativos (castraciones) Sano con enfermedad Luxación patelar, tumor II localizada o sistémica tegumentario leve Neumonía, fiebre, Enfermedad sistémica deshidratación, soplo III grave cardiaco, anemia Insuficiencia cardiaca, Enfermedad sistémica falla renal, insuficiencia IV grave que es riesgosa hepática, hipovolemia para la vida marcada, hemorragia profusa Moribundo; no se Choque endotóxico, aguarda que el paciente insuficiencia V sobreviva más de 24 multiorgánica, horas con o sin cirugía traumatismo grave Tabla 3. Determinación del riesgo quirúrgico dependiente del estado físico de los pacientes quirúrgicos. 39 34 Una vez que se ha realizado la valoración prequirúrgica se procede con la preparación del paciente y sus cuidados preoperatorios. PREQUIRÚRGICO Se debe realizar la preparación preoperatoria y la premedicación de los pacientes. Tres clases de fármacos deben ser considerados para usar como premedicación -Sedantes-Tranquilizantes -Agentes analgésicos Opiáceos -Anticolinérgicos34 PREMEDICACIÓN La anestesia general es comúnmente precedida por la premedicación con uno o más fármacos los cuales: Reducen la cantidad de anestésico requerido (inyectable o inhalado) por lo cual reducen sus efectos colaterales. Relajantes musculares Proveen analgesia y sedación Suprimen el reflejo de vómito Ayuda al manejo del paciente10 Actividades que realicé durante la rotación en el área de cirugía: Participé activamente en la elaboración de exámenes físicos prequirúrgicos generales y especiales a los pacientes. Elaboración de la autorización por parte del propietario para la realización del procedimiento quirúrgico (Formato 6), indicándole en qué consistía el acto quirúrgico y los riesgos del mismo, así como el riesgo quirúrgico. 35 Preparación del paciente prequirúrgico (control de ayuno del paciente, revisión de resultados de exámenes prequirúrgicos). Tranquilización del paciente (previamente se realizan los cálculos necesarios acerca de la correcta dosificación de los fármacos). Canalizar al paciente principalmente en vena cefálica. Realizar los cálculos para la terapia de fluidos que requerirá el paciente y posteriormente colocar el equipo de suero y venoclisis de acuerdo al paciente. Rasurado de la zona quirúrgica Lavado de la zona quirúrgica con jabón quirúrgico. Primera aplicación de anestésico fijo (previamente se realizaron los cálculos para la dosificación en mg y posteriormente en ml) Sondeo endotraqueal, utilizando como material de apoyo laringoscopio. Preparación del quirófano: Proveer del material (guantes, paquete de ropa estéril, paquete de campos estériles, instrumental estéril, suturas, navaja de bisturí) y equipo necesario (monitor, tanque de oxígeno, lámparas y mesa quirúrgica) para la realización de la cirugía. QUIRÚRGICO Participar como auxiliar a la preparación personal para la intervención quirúrgica al instrumentista, primer ayudante y cirujanos ROTACIONES EN EL ACTO QUIRÚRGICO Anestesista ACTIVIDADES REALIZADAS Estar a cargo del protocolo de inducción y de anestesia de acuerdo al paciente (realizando los cálculos para la dosificación y administración de los fármacos). Realizar el examen físico prequirúrgico del paciente. Monitorizar y evaluar al paciente durante 36 todo el acto quirúrgico. Tomar constantes fisiológicas del paciente (Frecuencia cardiaca, frecuencia respiratoria, temperatura), llenado de hoja de protocolo anestésico durante la cirugía. Llenado del Registro de Anestesia y anexarlo al expediente del paciente (Anexo 20). Revisar y evaluar al paciente hasta su recuperación anestésica. Apoyo al cirujano responsable tanto en cirugías de tejidos blandos como en las ortopédicas durante el acto quirúrgico. Dividir el instrumental de acuerdo con la función que cumple en: instrumental de diéresis o corte, separadores para exposición, instrumental de hemostasis, pinzas de prensión e Instrumental para síntesis. Proporcionarle el instrumental al cirujano o primer ayudante cuando éste lo indique. Lavado, empaquetado y esterilización del instrumental después de la cirugía. Apoyo en la preparación del paciente en actividades como lavado, rasurado. Asistir en el lavado y preparación del cirujano, primer ayudante e instrumentista. Apoyo al cirujano, primer ayudante o anestesista durante la cirugía. Realizar los cuidados postoperatorios (exámenes físicos, fisioterapia, etc.) Primer ayudante Instrumentista Circulante Tabla 4. Descripción de actividades realizadas de las rotaciones en los procedimientos quirúrgicos. POSTQUIRÚRGICO Área de recuperación posoperatoria: El sector de recuperación debe ser contiguo al área de cirugía pero separado de otros pacientes internados. Los pacientes deben ser alojados en jaulas individuales, calentadas y estar bajo supervisión hasta la recuperación completa. Se debe contar con un suministro de líquidos calentados y mantas para brindar calentamiento. 38 37 Una vez concluida la cirugía se coloca al paciente en la sala de recuperación, donde se mantiene bajo supervisión por parte del anestesista, donde se evalúa su respiración, temperatura, y estado de salud, hasta que el médico indique que es posible llevarlo al área de hospitalización. Mantuve los cuidados postoperatorios que requirieron los pacientes durante su hospitalización y hasta el alta de los mismos, además realice cada día exámenes físicos y anotando las observaciones en la Hoja de Progreso (Formato 4), la cual era revisada y firmada por el Coordinador de Cirugía, lleve a cabo los cuidados postoperatorios necesarios según lo requirieran como, cambios de vendajes, lavados, curaciones, manejo del dolor, etcétera. Realice el seguimiento de los pacientes que acuden después del procedimiento quirúrgico a revisión o a retiro de puntos de sutura. Así mismo realice la atención de fisioterapia de los pacientes que lo requerían; en este sentido daba la orientación al propietario, indicándole la manera en la cual se debían realizar los ejercicios físicos y cuidados en casa. Llevé el control de las citas y prescripción de los medicamentos que los pacientes iban a requerir para su terapia postoperatoria, así mismo su vigilancia externa vía telefónica. Apoye manteniendo limpios y ordenados los quirófanos, así como las demás áreas de cirugía. Realicé actividades en el CEYE como lavado de instrumental inmediatamente después de cada cirugía y esterilizado del mismo, realizar gasas y torundas de algodón para su esterilización y posteriormente su uso; lavado y doblado de la ropa quirúrgica, la preparación de bultos de ropa, campos e instrumental para su posterior esterilización en las autoclaves que se encontraban en sala de recuperación. Así mismo apoyé realizando los inventarios y control de materiales, fármacos y equipo del CEYE. 38 Imagen 30. Preparación del paciente. Imagen 31. Procedimiento quirúrgico ÁREA DE HOSPITALIZACIÓN: Esta área es de gran importancia debido a que muchos pacientes necesitan ser hospitalizados, algunos en condiciones de monitorización estrecha y supervisión constante. Es el caso de los pacientes que salen de una cirugía mayor y también de los padecen una enfermedad no quirúrgica que pone en peligro su vida. Los principales motivos de hospitalización de los pacientes son: Acuden a hospitalización con un desafío diagnóstico complejo, que no puede resolverse en forma segura o efectiva en clínicas particulares, por lo tanto son referidos a un hospital, como éste. Evaluación continua de los pacientes y medicación Recuperación de pacientes quirúrgicos Monitorización observación y cuidados intensivos Tratamiento y recuperación de diferentes patologías Rehabilitación Realización de procedimientos diagnósticos8,14 39 La hospitalización siempre debe ir acompañada de una comunicación clara con el propietario. La medicina hospitalaria casi siempre se enfoca en el diagnóstico y tratamiento de problemas médicos agudos, sin embargo la mayoría de los pacientes tiene problemas médicos múltiples que afectan distintos sistemas orgánicos y por lo tanto se deben prevenir complicaciones intrahospitalarias.4, 8 El área de hospitalización es muy importante ya que abarca: Hospital de perros Hospital de gatos Hospital de Infecciosos Terapia Intensiva Fisioterapia Mi estancia en ésta área abarcó del periodo de 14 de mayo de 2012 a 13 de julio de 2012, con duración de dos meses, en los cuales realice diferentes actividades que se llevan a cabo en el área como: Recepción del paciente hospitalizado, donde se le realiza canalización endovenosa, y se coloca al paciente en una jaula, el estudiante a cargo del caso debe realizar la Orden Clínica y Orden Terapéutica del paciente, ambas firmadas por el Coordinador Médico (Formato 3 y 4), y se colocan en la jaula del paciente, para tener mayor control acerca de las medicaciones y cuidados que requiere el paciente. Me encargué de la medicación de los pacientes en tiempo y forma según estaba establecido en la Hoja Terapéutica, en la cual, se encuentra 40 señalado el diagnóstico, las medicaciones que deben administrarse y otros cuidados necesarios. Lavado de heridas o curaciones. Cambios de vendajes Realización de enemas Realización de transfusiones sanguíneas a los pacientes que lo necesiten. Llevar el registro de ingresos al área de hospitalización Revisión y seguimiento de las Órdenes Terapéuticas, las cuales indican las medicaciones que requieren los pacientes, él o los fármacos, dosis en ml, forma de administración, y el horario en que se debe administrar, así como otros cuidados médicos especiales como su alimentación, realización de curaciones, cambios de vendajes, lavado de heridas y otros. Limpieza de las jaulas Limpieza y ordenamiento del área de hospitalización en general, limpieza de jaulas, mesas de exploración, anaqueles, etc. Realización de caminatas y paseos de los pacientes a las áreas externas del hospital. Dentro de las acciones que se realizan en esta área, también incluyen las actividades que se llevan a cabo en las guardias nocturnas, de fin de semana y días festivos, ya que en ellas se atendía la totalidad de los pacientes hospitalizados, tanto de pacientes del área de medicina, cirugía o infecciosos, asistiéndolos con todos los cuidados que el responsable del caso haya dejado indicado en la orden terapéutica, en estos se incluyen cuidados como la administración de medicamentos, lavados de heridas quirúrgicas o por traumatismo, fisioterapias, caminatas, así como ofrecer alimento y agua, la limpieza de la jaula y la realización de las nuevas órdenes terapéuticas, el reporte de cómo pasó la noche el paciente y la hoja de progreso, donde se incluye 41 subjetivamente la evolución del paciente, para posteriormente entregar la guardia al siguiente turno; todas estas actividades se realizan las diferentes áreas de Hospitalización (Hospital de caninos, Hospital de felinos, Hospital de infecciosos). TERAPIA INTENSIVA Cuando existe enfermedad grave es necesaria la vigilancia estrecha y frecuente de múltiples sistemas orgánicos. La atención inicial del paciente en estado crítico a menudo debe hacerse con rapidez y antes de integrar una historia clínica detallada. La estabilización fisiológica comienza con los principios del apoyo vital ventilación circulación, estado hidroelectrolítico, constantes fisiológicas, etcétera. 8 Las actividades que realicé en esta área fueron: Vigilancia constante de los pacientes, realizando exámenes físicos en los tiempos indicados, medicaciones, terapia de líquidos, indicaciones acerca de la nutrición, de acuerdo a la Hoja de Reporte de Terapia Intensiva (Formato 19). Los pacientes que requerían de se colocaban en jaulas especiales con oxígeno, indicando las características de administración, horarios, etc. Otras actividades que realice durante mi estancia fueron revisar diariamente el stock de los consultorios, es decir que no hiciera falta algún material, ya sean biológicos, equipo necesario para las consultas, rayos x, cirugías y hospitalización entre otros. RECEPCIÓN Informar sobre los servicios que se ofrecen así como los costos de cada uno de estos. 42 Los principales documentos que se manejan en la recepción son las hojas clínicas de nuestros pacientes que llegan día con día, hojas de progreso o evolución de los mismos. Por otro lado se realizan los recibos del servicio que requieren nuestros pacientes y se remite a pagar en la caja que se encuentra dentro de las mismas instalaciones. Búsqueda de expedientes de los pacientes. Estas labores se realizan esporádicamente ya que se cuenta con secretarias que realizan estas funciones. Realizar recetas, órdenes de laboratorio y remisiones a especialistas. También se cuenta en la recepción con llamadas telefónicas para asesoría médica a los propietarios disipando dudas y contestando preguntas frecuentes, y dando información general de los servicios que aquí se brindan, así como el seguimiento de pacientes que ya fueron dados de alta, para corroborar su buen estado de salud, cabe mencionar que el estudiante es el que lleva a cabo el seguimiento de estos casos, asesorado siempre del médico responsable. Imagen 32. Paciente hospitalizado en área de Infecciosos. 43 Imagen 33. Realización de fisioterapia a un paciente. Imagen 34. Paciente hospitalizado ÁREA DE MEDICINA Mi rotación por esta área tuvo una duración de dos meses, abarcando del periodo del 16 de julio al 14 de septiembre de 2012, estuve a cargo de 38 consultas. El área de medicina es muy importante dentro del Hospital de Pequeñas Especies. El avance de la medicina se lleva a cabo de acuerdo con dos procesos diferentes: el primero tiene que ver con la acumulación cuantitativa y cualitativa de conocimientos, el segundo se refiere a la metodología de la aplicación de dichos conocimientos médicos. Durante los últimos 50 años la enseñanza de la medicina bajo el sistema tradicional se ha caracterizado por la recolección mecánica de información, donde rara vez se hace discriminación de datos que orienten al descubrimiento de la enfermedad del paciente.24 Objetivos claros en el registro y análisis de los datos, que considera que lo coherente es partir de los problemas identificados en el enfermo, no a partir de la enfermedad, a través de un método de razonamiento, síntesis para llegar al diagnóstico. Con esta perspectiva, la dinámica del proceso de enseñanzaaprendizaje en medicina adquiere otra dimensión. Por otra parte, el complemento de la información teórica surge como una necesidad real en determinados pasos del método analítico: es necesario recopilar datos acerca de la patología de distintas afecciones, del cuadro clínico o de laboratorio, del pronóstico, de la 44 evolución. Entonces la búsqueda de esta información se hará con una motivación concreta: la solución integral de los problemas de ese paciente.5, 24 El acto médico aparece así como un proceso integrado por una serie de pasos sucesivos que corresponden a la secuencia seguida por el método científico. La identificación de problemas de salud le permite al médico seguir un camino de razonamiento y buscar de manera ordenada la información teórica necesaria para resolver el diagnóstico y actuar en consecuencia. La atención médica que se realiza en Hospital de Pequeñas Especies, se lleva a cabo mediante la realización del ECOP Examen Clínico Orientado a Problemas con lo cual se garantiza la integración y el razonamiento en cada uno de los casos. Esta metodología fue expuesta a finales de la década de los sesenta por el médico norteamericano Dr. Lawrence Weed, quien describe un método que conserva lo mejor del sistema tradicional y añade conceptos nuevos así surge el EXAMEN CLÍNICO ORIENTADO A PROBLEMAS (ECOP); ésta herramienta ha sido utilizada en todo el mundo, ya que tiene la virtud de simplicidad lógica y constituye un excelente instrumento para ayudar a mejorar la calidad de la atención médica, a la vez contribuye a la educación y a la investigación clínica en medicina. Sus principales elementos son: I. Base de datos II. Lista de Problemas III. Plan de acción IV. Notas y comentarios de evolución 45 I. Base de datos Es la historia clínica obtenida por la anamnesis y el examen físico II. Lista de problemas Se define como problema a todo trastorno o proceso orgánico que afecta la salud del paciente y que implica una evaluación diagnóstica o una decisión terapéutica por parte del médico. “Problema es todo aquello que requiera diagnóstico, manejo posterior, o interfiera con la calidad de vida” (Weed, 1966) Los problemas son identificados por el médico a partir de: Padecimientos concretos referidos por el propietario Alteraciones objetivadas durante la exploración física Pruebas complementarias anormales. Para la elaboración de la lista de problemas se debe de llevar cada problema al nivel más alto de resolución diagnóstica con la evidencia disponible en un momento dado, agrupada en síndromes si es posible, aunque se selecciona un núcleo de problemas guía para luego ir sustituyéndolos por un diagnóstico etiológico cuando éste haya sido confirmado. Esta se elabora a partir de la base de datos y de las notas de evolución; es el índice de los problemas del paciente, un resumen muy útil de la información contenida en la historia clínica. Los problemas se deben enumerar por orden de aparición, lo que permite identificarlos en la historia sin necesidad de leer cada evolución. III. Plan de acción Cada problema genera un plan de acción. Se debe disponer de una Hoja de Plan de Trabajo, éstas deben ser claras y bien organizadas, donde se señale el enunciado y la fecha de solicitud. Se debe de actuar de acuerdo al tipo de plan, que puede ser 46 Tipos de Planes: - Planes Diagnósticos: encaminados a llevar el problema al nivel óptimo de resolución diagnóstica. - Exámenes auxiliares: Pruebas de gabinete complementarias. - Procedimientos: Hospitalización, Procedimiento quirúrgico. IV. Notas y comentarios de evolución Registro del curso que sigue el paciente con su enfermedad. Debe ser en función de cada problema. Estas constan de cuatro partes: 1) Subjetivo 2) Objetivo 3) Evaluación 4) Plan 1) Subjetivo Aquí se consignan los datos recogidos por parte del médico al propietario durante el interrogatorio. Por lo tanto son todas las impresiones subjetivas, tanto del médico como del propietario. 2) Objetivo En este apartado se anotan los datos positivos y negativos del examen físico y/o exámenes complementarios. 3) Evaluación Una vez que se han recogido los datos a través del interrogatorio, el examen físico y los estudios complementarios, se evalúan y se expresan por medio del 47 enunciado de un problema, buscando un concepto y una “denominación” del problema. Además de la evaluación se pretende dar prioridad a los datos obtenidos y al problema principal que aqueja al paciente, sobre cuya base el médico tomará alguna acción para resolver o evaluar el problema. 4) Plan Es aquí donde se realiza la planificación acerca de las conductas que se tomarán -Plan diagnóstico Se consignan las pruebas solicitadas o que se solicitarán, con el fin de aclarar dudas en el diagnóstico. -Plan terapéutico: Se registran las indicaciones terapéuticas programadas para la resolución de los problemas que presenta el paciente: medicamentos, dieta, modificación en los hábitos. -Plan de seguimiento: Protocolo de acción que se utilizará para el control de la evolución de los problemas. -Plan de educación: Información que se le da al propietario acerca del problema que aqueja a su mascota, resolución de dudas, etc. Otros elementos son: Hoja de plan de trabajo Hoja de concentración de laboratorio Notas de interconsulta Son apartados de la historia clínica donde se registran los resultados de exámenes complementarios, medicaciones, etc. Estos registros nos permiten identificar rápidamente la evolución de un dato de interés sin tener que revisar toda la historia. 48 Actividades realizadas en el área de medicina Esta área está conformada por diez consultorios distribuidos de la siguiente manera: 4 consultorios de medicina general 2 consultorios de gatos 2 consultorios de medicina preventiva y especialidades 2 consultorios de infecciosos Consulta general: Cuando un propietario se presenta en el Hospital de Pequeñas Especies para que a su mascota se le de consulta, dependiendo del motivo de ésta, será la forma de abordarla. En caso de presentarse por primera vez a consulta, será recibido en recepción por la secretaria, la cual comenzará con el llenado del expediente (Formato 1), iniciando con la captura de los datos básicos y reseña, tanto del propietario como del paciente. Estos datos son: Número de Expediente y Fecha (dentro del hospital se lleva una numeración continua para control interno de los pacientes). Datos del propietario: Nombre, Dirección, Teléfono, correo electrónico. Reseña (Datos de la mascota): Nombre, Especie, Raza, Edad, Peso, Sexo, si se le realizado la castración, etc. Medidas de protección específica: Desparasitación y vacunación. Alimentación y frecuencia. Hábitat. 49 Antecedentes Médicos. Motivo de consulta Tratamientos (Previos, Dosis y Frecuencia) Estos datos son de suma importancia, ya que brinda al médico de primera instancia, identificar o reconocer enfermedades propias de una especie, identificar grupos de población con predisposición a ciertas enfermedades, afecciones raciales hereditarias, etcétera. Al iniciar la consulta es importante realizar una inspección general al paciente; la observación o inspección es una herramienta que si se realiza de forma detallada y ordenada orienta a identificar la posible patología que aqueja al paciente, y se considera el estado de conciencia, comportamiento, postura, marcha, condición corporal, posibles deformaciones óseas, alteraciones musculares, presencia de tos o secreciones. La anamnesis es importante ya que si se realiza de forma correcta nos ayuda a obtener cerca del 80% de nuestro diagnóstico presuntivo.16, 29 Es un interrogatorio que se basa en preguntas directas, sencillas, prácticas, bien formuladas con base en datos obtenidos directamente del propietario, donde se debe incluir tiempo de evolución de la enfermedad, orden cronológico en el que aparecieron los síntomas, manifestaciones patológicas observadas por el propietario, posibles causas de la enfermedad, tratamientos previos, antecedentes patológicos, patrones observados en cuanto a alimentación, consumo de líquidos, defecaciones, micciones, patrones respiratorios, actividad física, cambios de comportamiento, cualquier dato que pueda dirigir hacia el diagnóstico.29 Todos estos datos proporcionados por el propietario nos orientan un poco hacia donde se encuentra el problema físico del paciente y nos ayudan a integrar los signos clínicos de una manera más rápida y concreta. La capacidad de reunir información es un arte y debe hacerse de manera cuidadosa y sistemática. Con mucho la herramienta diagnóstica más importante que posee el veterinario es su capacidad para obtener una historia clínica completa y realizar un examen 50 físico detallado. Cuando ésta información se interpreta de manera correcta, es la base de un plan diagnóstico y terapéutico lógicos. Sin embargo, si la historia clínica o el examen físico se efectúan de manera descuidada, el clínico puede desviarse del problema pertinente del paciente y del diagnóstico apropiado. 5, 12 Exploración física general del paciente: Este es un aspecto muy importante dentro de la consulta ya que es aquí donde se llegan a detectar los principales signos de enfermedad que aqueja al paciente.3, 24 La exploración física es el punto clave para nuestra consulta, ya que en ella es dónde ponemos en práctica nuestras habilidades como MVZ, interactuando con el paciente, y sabiendo reconocer lo anormal de lo normal, es donde más enseñanza y práctica se pude obtener ya que sin duda es una de las partes más importantes de la medicina veterinaria. Se realiza mediante las herramientas de observación del paciente, la auscultación, palmopercusión, olfación y palpación, lo que se examina principalmente son: Constantes fisiológicas: Temperatura rectal del paciente. Se obtiene de manera rectal en las primeras etapas del examen para evitar elevación de la misma como resultado de ansiedad o excitación. Se debe registrar la presencia de melena o sangre sobre el termómetro. La temperatura normal de un perro de raza grande es de entre 37.5-38.6; perro de raza pequeña entre 38.639.2 y en el gato es de entre 37.8-39.2°C.16,24,38 Frecuencia Cardiaca. Ésta se mide mediante la auscultación y varía dependiendo de la conformación física, edad, raza, etc., además se escuchan los ruidos cardiacos normales: Ruido 1: Cierre de válvulas atrioventriculares (Mitral y Tricúspide), al inicio de la Sístole. Sonido 2: Cierre de válvulas semilunares (Pulmonar y Aórtica), al final de la Sístole. También se pueden identificar soplos cardiacos, los cuales se definen como el sonido producido por el flujo turbulento de la sangre durante el ciclo 51 cardiaco, una vez auscultado el soplo, debemos determinar el foco de origen, la fase del ciclo cardiaco que ocupa, la configuración del soplo y la intensidad del mismo.16,24,29.38 La intensidad del soplo se mide en una escala de I a VI - GRADO I: Soplo muy suave, de audición difícil - GRADO II: Soplo suave, audible tras auscultación cuidadosa - GRADO III: Soplo de intensidad leve a moderada - GRADO IV: De intensidad moderada a severa - GRADO V Soplo claramente auscultable, con frémito palpable (precordial) - GRADO VI: Soplo severo, con frémito detectable aun sin estetoscopio. 12 Frecuencia Respiratoria: Se mide auscultando la tráquea o los campos pulmonares, por inspección directa contando los movimientos de la cavidad torácica o abdominal, durante un minuto. Se evalúa el patrón respiratorio a medida que se toma la frecuencia. El aumento de esta frecuencia (taquipnea o polipnea), o disminución (bradipnea), a la dificultad respiratoria se le denomina disnea.3,7,29 ESPECIE FRECUENCIA CARDIACA FRECUENCIA RESPIRATORIA TEMPERATURA LLENADO CAPILAR CANINO 60-80 ppm 14-30 rpm 37.5-39 °C 1-2 seg CACHORRO CANINO 110-120 ppm 22-36 rpm 110-120/ min 38-40 °C 1-2 seg FELINO 100-120 ppm 20-30 rpm 100-120/ min 38-39.5°C 1-2 seg CACHORRO FELINO 130-140 ppm 24-34 rpm 130-140/ min 38.5-40.5 °C 1-2 seg PULSO 60-80/ min Tabla 5. Constantes fisiológicas de caninos y felinos.16, 38 52 Pulso y sus características: En perros y gatos, el pulso se explora por palpación directa a nivel de la arteria femoral, en la región inguinal sobre la cara media del muslo, en la arteria braquial por encima de la articulación del codo o en la arteria auricular a nivel del borde anterior de la oreja. La frecuencia cardiaca y el pulso se debe tomar al mismo tiempo y deben de coincidir en un ritmo de 1:1, esto es una pulsación por un latido cardiaco, además que éste deber ser fuerte, lleno y correspondiente a la frecuencia cardiaca.3,7,14,38 Se realiza también la exploración de las mucosas: Oral Conjuntival Palpebral Peneana/vaginal, Rectal Se examinan detectando palidez (que indicaría existencia de anemia o choque), hiperemia, petequias, cianosis, ictericia (debida a falla hepática y hemólisis), erosiones o ulceraciones; sequedad aparecen en estados febriles o deshidratación, y secreciones (purulenta, sanguinolenta), etc.3 Actitud: Normal, Deprimido, Comatoso, Estuporoso Reflejo Tusígeno: La tráquea se explora mediante palpación y auscultación. Si la tráquea está estrecha, colapsada o inflamada, la palpación desencadena el reflejo tusígeno, el cual es positivo si el paciente manifiesta tos.3,14 Reflejo Deglutorio: Al ejercer un poco de presión con la mano en la zona ventral del cuello, se estimula el reflejo de deglución, la deglución es dolorosa en procesos que cursan con inflamación de la faringe o esófago. Obstrucciones físicas, cuerpos extraños, estenosis del esófago, parálisis de la faringe se manifiestan por intentos de tragar. 14 53 Condición corporal. Un animal puede presentar un estado corporal normal o estar obeso o emaciado. La pérdida de peso superior al 10% del peso normal, no asociada con pérdidas de líquidos orgánicos, se considera significativas en perros y gatos. En la clínica de pequeñas especies, el estado corporal se valora por un sistema de puntuación (1-5).5 La auscultación de los campos pulmonares puede a veces indicar la naturaleza y localización de las lesiones, los cambios que se producen a lo largo del tiempo en el pulmón afectado.3,16,38 Tiempo de Llenado Capilar. Es un indicador útil de la perfusión de los tejidos periféricos y del sistema cardiovascular, debe ser inferior a los 2 segundos en animales sanos.3,5 Palpación de los linfonodos externos (Submandibulares, Preescapulares, Inguinales, Poplíteos). La linfadenopatía generalizada indica enfermedad sistémica (Infecciones micóticas sistémicas, enfermedades inmunomediadas, neoplasias), en tanto que el aumento de volumen local del linfonodo por lo general indica infección regional (absceso). Hidratación: Se debe observar si los ojos están hundidos o si los terceros párpados hacen protrusión bilateral. Debe observarse si las mucosas están secas o pegajosas. Se evalúa la turgencia de la piel, pellizcando suavemente la del tórax dorsal. Se mide el grado de deshidratación que puede ser menor al 5% cuando no es identificable, se puede diagnosticar con la medición del hematocrito. La escala varia, y se considera 5% a la pérdida ligera de elasticidad de piel; 6-8%, cuando existe un retraso definitivo para que la piel regrese a su posición normal, mucosas ligeramente secas; 10-12%, cuando la piel pellizcada no regresa a su posición normal, tiempo de llenado capilar prolongado, ojos hundidos, mucosas secas, signos de choque, pulso débil; mayor al 12%, si presenta signos de choque, colapso, depresión intensa, muerte inminente.3,5,7,38 Palpación abdominal 54 Se palpa procediendo sistemáticamente de craneal a caudal, en pacientes pequeños se realiza con una sola mano, mientras que en pacientes más grandes se necesitan ambas manos. El abdomen craneal se palpa en busca de distensión gástrica, el hígado puede ser difícil de palpar en el paciente normal. En el abdomen medio se localiza el bazo y no siempre es palpable a menos que haya una esplenomegalia, los nódulos linfáticos mesentéricos o se palpan, sólo que estén aumentados en gran medida como en casos de linfosarcoma. También se palpan asas intestinales, en felinos pueden palparse los riñones en la región dorsal, el riñón derecho tiende a estar más craneal que el izquierdo, en perros no se palpa con tanta facilidad. Se palpa el colon en el abdomen dorsocaudal. En el abdomen caudal central se palpa la vejiga urinaria, se evalúa tamaño, turgencia y grosor de la pared de ésta. El útero normal no se puede palpar, a menos que esté marcadamente aumentado a causa de piómetra o gestación tardía. La próstata en ocasiones puede palparse en el abdomen caudal, central al colon y caudal a la vejiga urinaria, si se encuentra se evalúa tamaño, forma e irregularidades de la superficie.3, 14, 12, 16,38 Una vez concluido el examen físico se procede a elaborar la Lista de Problemas, en donde se ubican todos los problemas identificados en la historia clínica o en el examen físico. Una vez terminada se integra la Lista Maestra, donde se identifican y agrupan los problemas en orden de importancia o trascendencia y su correlación con los demás problemas. Ya que se tiene la Lista Maestra es más sencillo establecer diagnósticos diferenciales y se debe registrar las pruebas de gabinete y laboratorio necesarias para confirmar o descartar los diagnósticos diferenciales. Realizando de manera sistematizada lo anterior es posible emitir un Diagnóstico Presuntivo. Es en este punto donde el médico en turno encargado del área de medicina evalúa al paciente y revisa las anotaciones realizadas, el caso se discute en el área de atención médica primaria y ayuda a identificar el diagnóstico, se realiza un Plan Terapéutico, una vez que ambas partes se encuentren de acuerdo se regresa al 55 consultorio para informarle al propietario acerca del problema detectado en el paciente y se le comenta el Plan de Acción a realizar para poder emitir un diagnóstico, esto es, las pruebas diagnósticas necesarias. Si el propietario accede a la realización de éstas, se remite al paciente al área correspondiente (Área de Imagenología, Área de Atención Medica Ambulatoria, Área de hospitalización); en caso contrario se establece un Plan Terapéutico, se realiza la receta, se dan las recomendaciones pertinentes y se agenda su próxima cita para revisión. Dependiendo el caso, una vez que se tienen los resultados de las pruebas de laboratorio, se le dan a conocer al propietario los resultados de éstas, así como el pronóstico, Plan Terapéutico de ser necesario y se agenda cita para revisión. Si el estado del paciente o el proceso patológico que presente indica que es necesario hospitalizarlo, se le informa al propietario, si éste accede a la hospitalización se le entrega una hoja de Autorización de Hospitalización (Formato 5), y se remite al paciente al área de hospitalización correspondiente. En el caso de revisiones donde al paciente en su primera visita se le abrió un expediente, en sus subsecuentes visitas se busca el expediente, y se le toma una Hoja de Progreso o Nota de Evolución, la cual se realiza de acuerdo al ECOP siguiendo la estructura de estas en orden del S. O. E. P. (Subjetivo, Objetivo, Evaluación, Plan), obteniendo datos subjetivos por parte del propietario acerca de la evolución de la enfermedad y estado de salud de la mascota (estado de ánimo, alimentación, etc.), realizando el examen físico, realizar la evaluación de éste y determinar si el tratamiento es el adecuado.(Formato 4) Esta área incluye el área de atención primaria ambulatoria o también conocida como área de transferencia, la cual está conformada por 4 mesas de exploración, que cuentan con sistema eléctrico e instalación hidráulica, lo que permite realizar los procedimientos con mayor facilidad. 56 Además en esta área se cuenta con jaulas para colocar a los pacientes de manera temporal para que su estancia ambulatoria sea más cómoda. Los procedimientos que se realizan en esta área son: Toma de muestras para diagnóstico (tomas de sangre para Biometría Hemática, Química Sanguínea, muestra de orina para la realización de Examen General de Orina, Raspados cutáneos, Citologías como Punción con Aguja Fina (Aspiración Citológica con Aguja Fina), Improntas) Curaciones Lavados Cambio de vendajes Aplicación de tratamientos Imagen 35. Manejo de paciente en el área de medicina. En esta sección las actividades que principalmente abordé se basaron de acuerdo a las características que conllevara la consulta. La principal función de los consultorios es la exploración general de nuestros pacientes y esta se divide en diferentes etapas dependiendo de la atención que requiera el paciente. 57 Pruebas de laboratorio: en caso de ser necesario se toman Biometría Hemática Completa, Química Sanguínea, Urianálisis, Punciones con Aguja Fina, Biopsias, Rayos x y Ultrasonido entre otros. Estudio Coproparasitoscópico en caso de requerirlo, este se realizaba directo de las heces del paciente. Otro motivo de las consultas generales es la llegada de pacientes en estados comatosos o en estado casi incompatible con la vida, es decir; urgencias. URGENCIAS En caso de urgencias se procede de la misma forma que en consulta general. Se busca el expediente del paciente y/o la elaboración de la reseña e historia clínica breve del paciente Exploración física general rápida del paciente Realizar anamnesis lo más clara posible Realización de un examen específico por aparato o sistema. Preparar al paciente para ser canalizado, sondeado, tranquilizado, etc. Administración de fármacos. Evaluar al paciente y determinar un pronóstico. En caso de ser necesario hospitalizar al paciente, se le informa al propietario, si este acepta el manejo médico se intenta estabilizar, estableciendo la terapia de fluidos, administración de los fármacos necesarios, preferentemente de manera intravenosa para su rápido efecto, además de la continua vigilancia y evaluación del paciente, por lo tanto se mantiene en hospitalización, en el área de terapia intensiva de ser necesario.33 58 Imagen36. Paciente hospitalizado en el área de terapia intensiva Todos los pacientes que acuden al hospital para que se les administre algún tratamiento algún tipo de terapia médica como Quimioterapia (Formato 21), o la realización de Fisioterapia ya cuentan con su hoja clínica archivada, por lo tanto se realiza de forma rutinaria la toma de constantes fisiológicas para verificar alguna posible alteración tanto fisiológica como metabólica, también se realiza una anamnesis por parte del clínico hacia el propietario y en este caso estará relacionada básicamente con la evolución de la enfermedad de nuestro paciente. Si el estado de salud de nuestro paciente es favorable entonces puede darse de alta, bajo observación y continuando su tratamiento hasta el término del mismo o hasta nueva indicación. MEDICINA PREVENTIVA Esta comprende la aplicación de biológicos a perros y gatos, desparasitaciones y orientación al propietario del correcto cuidado de las mascotas. Cuando llega un paciente para consulta de medicina preventiva se le da atención en los consultorios especiales para este fin, en caso de ser primovacunación se abre un expediente del paciente, y después de tomar los datos del paciente se 59 lleva a cabo un examen físico general para corroborar el estado de salud del paciente y determinar si puede aplicar la vacunación, se llenan dos formatos de Registro de Vacunación, uno se anexa a su expediente para revisar el registro médico del paciente, registrar las vacunas recibidas con anterioridad y las fechas de cada una de ellas, y otro se le da al propietario como carnet de vacunación (Formato 7) y se le hace la cita para su próxima vacunación. También en caso de requerirse se realiza la aplicación de desparasitantes por vía enteral, de acuerdo al peso del paciente. Así mismo se da orientación a los propietarios de las mascotas acerca de los cuidados que se deben tener, tales como la limpieza dental, y las recomendaciones pertinentes para mejorar la calidad de vida de éstas y las obligaciones y responsabilidades que debe cumplir al adquirir una mascota. El calendario de vacunación que se emplea en el Hospital de Pequeñas Especies de la FESC para cachorros caninos es el siguiente: PACIENTE Canino 8°semana de edad 10° semana de edad 12° semana de edad 14° semana de edad Vacuna Puppy Vacuna Puppy Vacuna P.V.C. P.V.C. Vacuna Quíntuple Distemper canino Distemper canino MHA2PPi Leptospira Séxtuple MHA2PPi Rabia Leptospira P.V.C. Parvovirus canino MHA2PPi Distemper canino, Hepatitis Infecciosa Canina, Adenovirus Tipo 2, Parvovirus canino, Parainfluenza Tabla 6. Calendario de Inmunización en caninos utilizado en el Hospital de Pequeñas Especies de la FESC. 60 Y se les informa la importancia de la revacunación anual, para poder mantener a la mascota correctamente protegida. En el caso de felinos el calendario de vacunación que se utiliza en el siguiente: PACIENTE FELINO 8ª semana de 10ª semana de 12ª semana de 14ª semana de edad edad edad edad Triple Felina Calicivirus, Rinotraqueitis Infecciosa Panleucopenia Felina Triple Felina Calicivirus, Rinotraqueitis Infecciosa Panleucopenia Felina Leucemia Leucemia Viral Felina Rabia Tabla 7. Calendario de vacunación utilizado en felinos en el Hospital de Pequeñas Especies de la FESC. 61 En la siguiente tabla se menciona los antígenos vacunales para perros y una guía de vacunación, así como recomendaciones CANINOS VACUNA PRIMOVACUNACIÓN (cachorro) <16 SEMANAS PRIMOVACUNACIÓN (ADULTO) >16 SEMANAS REVACUNACIÓN COMENTARIOS Altamente recomendada. VIRUS DEL DISTEMPER CANINO ADENOVIRUS CANINO-2 (MLV* O MUERTO) Administrar una dosis a los 2, 3 y 4 meses de edad Administrar una dosis a los 2,3 y 4meses de edad. Una dosis Una dosis si se utiliza MLV; dos dosis separadas por 3- 4 semanas si se usa vacuna muerta PARVOVIRUS CANINO (MLV) Administrar una dosis a los 2, 3 y 4 meses de edad Resulta adecuada una dosis (aunque se recomiendan dos dosis separadas por 3-4 semanas) PARVOVIRUS CANINO PVC**(MUERTO) Administrar una dosis a los 2, 3 y 4 meses de edad Dos dosis separadas por 3-4 semanas Anual A pesar de la recomendación de revacunación anual, los perros adultos están protegidos 7 años después de la vacuna. Un intervalo de revacunación de 3 años en perro adultos es razonable. Anual Recomendada. Inmunidad cruzada demostrada contra la hepatitis infecciosa canina (CAV-1) y (CAV2). Actualmente este producto no está disponible como vacuna monovalente. Los perros adultos quedan protegidos durante 7 años después de la vacunación CAV-2 MLV. Anual Altamente recomendada. Aunque las revacunaciones anuales están recomendadas por los fabricantes, los estudios han demostrado protección durante 7 años postvacunación con la MLV. Anual Recomendada. Una alternativa a la vacuna MLV de PVC. Los productos de PVC muertos son 62 susceptibles de interferencia de anticuerpos de origen materno en cachorros de hasta 16 semanas. Aunque los fabricantes recomiendan las revacunaciones anuales, los estudios han demostrado protección durante 16 meses posvacunación con la vacuna muerta. CORONAVIRUS CANINO (MUERTO Y MLV) Cada 2-4 semanas de edad hasta las 12 semanas de edad (MLV). Empezar a las 6 semanas de edad; cada 2-3 semanas con la última dosis a las 12 semanas de edad (muerta) Una dosis (MLV); dos dosis separadas por 2-3 semanas (muerta) Leptospira interrogans (L. canicola combinada con L. icterohaemorrag iae) bacterina muerta. Cepas disponibles grippotyphosa y pomona 12 y 16 semanas de edad. No administrar a perros menores de 12 semanas. Dos dosis separadas por 2-4 semanas RABIA (MUERTA) Una dosis a los 3 meses de edad Administrar una única dosis Anual Anual Perros con riesgo significativo de exposición cada 6 meses. Anual No recomendada. La prevalencia de los casos clínicos confirmados de infección por coronavirus canino no justifica la inoculación rutinaria a todos los perros. Las infecciones clínicas tienden a ocurrir en cachorros menores de 6 semanas. Los síntomas son moderados y suelen resolverse espontáneamente. Opcional. Incidencia de reacciones posvacunales (anafilaxia aguda) es elevada en cachorros (menores de 12 semanas) y razas pequeñas de perros. El uso sistemático de la vacuna debe posponerse hasta que los perros son >9 semanas de edad. Obligatoria. Las vacunas MLV no están disponibles. *(MLV) Virus Vivo Modificado **(PVC) Parvovirus Canino Tabla 8. Resumen de antígenos vacunales caninos y guía de vacunación 29 63 En la siguiente tabla se mencionan antígenos vacunales para gatos y guía de vacunación. FELINOS VACUNA PANLEUCOPENIA (MLV* O MUERTO) HERPESVIRUS FELINO- (FHV-1)** Y CALICIVIRUS FELINO (FCV)*** PRIMOVACUNACIÓN <16 SEMANAS 9 y 12 semanas de edad 9 y 12 semanas de edad PRIMOVACUNACIÓN > 16 SEMANAS Una dosis (MLV) o dos dosis separadas por 3-4 semanas (muerta) Una dosis (MLV) o dos dosis, separadas por 3-4 semanas (muerta) REVACUNACIÓN COMENTARIOS Revacunar al año, posteriormen te a intervalos no más frecuentes que cada 3 años Altamente recomendada. En la mayoría de los gatos la protección derivada de la administración de la vacuna se mantiene como mínimo 3 años y probablemente 5-6 años o más. Revacunar al año, después de la serie inicial y posteriormen te a intervalos de 3 años Altamente recomendada No se debe administrar en gatas preñadas. Recomendada VIRUS DE LEUCEMIA FELINA (MUERTO) Dos dosis separadas por 3-4 semanas, empezando a las 9 semanas de edad Dos dosis separadas por 3-4 semanas Anual Especialmente para gatitos, no limitados a un ambiente cerrado. Los gatos mayores a 6 meses muestran una significativa resistencia a la infección. Opcional para gatos adultos que sólo salen a la calle esporádicamente 64 RABIA Administrar una dosis a los 3 meses de edad. Administrar una dosis Anual Altamente recomendada para todos los gatos (MLV) VIRUS VIVO MODIFICADO (FHV-1) HERPES VIRUS FELINO (FCV) CALICIVIRUS FELINO Tabla 9. Resumen de antígenos vacunales felinos y guía de vacunación. 29 ÁREA DE LABORATORIO El laboratorio clínico o de Patología clínica, a menudo complementa el examen clínico del paciente veterinario. Los parámetros clinicopatológicos normales y anormales rinden información objetiva en el proceso del diagnóstico diferencial, supervisión del tratamiento y formulación de un pronóstico.13 En los últimos años el aumento en el uso y el mayor conocimiento de la biopatología clínica nos ha llevado a una detección más precisa de la enfermedad y al uso de enfoques terapéuticos racionales.13, 36 La biopatología clínica es el principio básico de la medicina interna. La selección cuidadosa, el procesamiento y el análisis de las muestras clínicas, y la correcta interpretación y aplicación de los resultados son esenciales para permitir la realización del diagnóstico y la prescripción del tratamiento apropiado.19 Mi rotación en el Área de Laboratorio Clínico comprendió del periodo del 17 de septiembre a 15 de noviembre de 2012, donde realicé diversas actividades en cada una de las diferentes áreas, que son: Área de hematología Área de citología Área de urianálisis y coprología 65 Para la realización de cualquier estudio, el estudiante a cargo del caso debía llenar una Solicitud de Estudio de Laboratorio (Formato 13) donde contiene los datos del paciente, historia clínica, diagnóstico presuntivo y marcaje de la prueba o estudio solicitado, este debe estar firmado por un médico del área de medicina y ser entregado junto con la muestra; ya con ésta, en el área laboratorio clínico se registra en una bitácora interna exclusiva del área, con una numeración consecutiva independiente del número de expediente Área de Hematología La Hematología estudia los elementos celulares de la sangre (eritrocitos, leucocitos y plaquetas) y la relación que guardan estos con los sistemas hematopoyético y vascular.36 Estudios de Sangre - Determinación del volumen de hematocrito Por este procedimiento se mide el paquete de glóbulos rojos aglomerados comparándolos con restantes constituyentes sanguíneos, leucocitos, plaquetas y plasma. Normalmente el volumen de eritrocitos está en proporción directa con el número de los mismos y con la cantidad de hemoglobina. Refleja de forma precisa el recuento de eritrocitos y si el volumen medio de los eritrocitos está dentro de los límites de referencia. - 19 Proteínas plasmáticas Se pueden medir utilizando el refractómetro, una vez que se ha anotado el valor del hematocrito, el tubo de microhematocrito se rompe por encima de la capa flogística, se deja caer una gota de plasma sobre el prisma y se lee el valor de proteínas totales en la escala del refractómetro de Goldberg, el cual tiene una escala interna para las proteínas plasmáticas y otra para medir la densidad de la orina.6, 19 66 - HEMOGRAMAS Para la realización de hemogramas se recibe la muestra y se marca el tubo con el número de diagnóstico (uso exclusivo del área de laboratorio) y el nombre del paciente. Se realizan dos frotis sanguíneos, a los cuales, se les realiza la tinción con DiffQuick; después se realiza el montaje de las laminillas con resina. A continuación se toma una muestra de sangre con tubos capilares y se coloca en la microcentrífuga, esto para realizar la medición de hematocrito y proteínas plasmáticas; ya que la muestra se centrifuga y se encuentra separado el plasma del paquete celular, se coloca el capilar al microscopio para observar la capa flogística y determinar la presencia de microfilarias de Dilofilaria immitis. En caso de muestras de equinos se coloca un tubo capilar en baño maría para determinación de fibrinógeno. Se realiza el conteo total de Glóbulos Rojos y Blancos, para determinarlos se utiliza la técnica del hemocitómetro o Cámara de Neubauer. Mediante diluciones de una muestra sanguínea, con líquidos que permitan el conteo de un tipo de células (leucocitos o eritrocitos), observándose al microscopio en cámaras especialmente graduadas y contando una cantidad de la muestra conocida en los lugares indicados para cada uno de ellos.6, 13,19 Recuento de formula roja (Glóbulos Rojos) El recuento se realiza aspirando sangre de la muestra en la pipeta de Thoma hasta la marca de 0.5 y aspirando de inmediato el líquido de dilución (solución de Hayem), una vez hecha la dilución se coloca la pipeta en un agitador automático por unos minutos, se llena uno de los espacios de la cámara de Neubauer, se deja reposar y se realiza el recuento de eritrocitos observando al microscopio con objetivo seco fuerte 40X. Se cuenta el número total de células en cinco cuadros de los 25 del centro de la cámara y la cifra obtenida se multiplica por 10 000. Este valor representa el número total de eritrocitos por mililitro.6 67 Recuento de fórmula blanca (Glóbulos Blancos) Para determinar este conteo durante mi estancia en el área se podían emplear dos maneras, de forma manual (Cámara de Neubauer) o mediante el analizador hematológico IDEXX VetAutoread. En el Hospital de Pequeñas Especies de la FESC se cuenta con el analizador hematológico IDEXX VetAutoread y la Estación de Información de Laboratorio IDEXX Vetlab Station, y otros equipos que facilitan y agilizan las pruebas de laboratorio. Se capturan los datos del paciente en el IDEXX Vetlab Station (Imagen 37), después se introduce la muestra en tubos especiales previamente centrifugada y se espera unos minutos los resultados impresos en los cuales proporciona un informe completo, con valores numéricos y gráficos del perfil de la capa leucocitaria verificando de esta manera los resultados numéricos, provee para cada muestra un análisis hematológico completo con 12 parámetros de recuentos celulares sanguíneos, como son: Hematocrito, hemoglobina, Concentración de hemoglobina, Recuento de leucocitos totales, Neutrófilos, Granulocitos, Eosinófilos, Linfocitos/Monocitos, Recuento de plaquetas, Eritrocitos nucleados, Fibrina, Reticulocitos. Al final se corroboran los resultados del analizador hematológico con los frotis sanguíneos. Para realizar el conteo de forma manual: Se utiliza la pipeta de Thoma para glóbulos blancos, se aspira la sangre hasta la marca, se succiona el líquido de dilución (diluyente de Türk) y se coloca en el agitador mecánico durante 2 o 3 minutos. La sangre se mezcla por completo y con la punta de la pipeta se toca un lado de la cámara y se deja escurrir una gota de líquido debajo de la cubierta de cristal, se deja reposar 1 o 2 minutos y se inicia el recuento de leucocitos en el microscopio. Después de contar todas las células de los cuatro cuadros mayores, el total se multiplica por 50, para así obtener leucocitos totales por microlitro. 6 68 - QUÍMICAS SANGUÍNEAS Durante el periodo por el cual estuve en el área de laboratorio clínico, no se contaba con el aparato para realizar este estudio, por lo tanto las muestras se remitían a un laboratorio externo QUIMILABCO.VET, el estudiante a cargo debía realizar la solicitud de estudio especial para el laboratorio externo y entregarla junto con la muestra de sangre, la muestra se centrifugaba para obtener el suero y se entregaba al laboratorio externo, los cuales entregaban los resultados en 48 horas (Formato 16). Área de Urianálisis y Coprología URIANÁLISIS Es una prueba de laboratorio simple, no invasiva y económica que proporciona información valiosa sobre el tracto urinario y otros sistemas corporales. 6, 19,36 Recepción de la muestra en frascos limpios y esterilizados de vidrio o plástico, protegidas de la luz, en caso de ser necesario se coloca en refrigeración. Se hace el marcaje de la muestra colocando el número de diagnóstico y nombre del paciente. Se procede a realizar el examen físico de la muestra que consiste en determinar la apariencia macroscópica el olor, color, aspecto o turbidez, coagulación, volumen y anotar las observaciones. Densidad específica. La densidad de la orina es un indicador útil de la capacidad de concentración del riñón.13 Se puede medir de forma fácil usando el índice de refracción, empleando el Refractómetro de Goldberg. La orina siempre tiene una densidad mayor a la del agua destilada. La densidad de la orina está incrementada por la presencia de grandes cantidades de glucosa, proteínas, lípidos y material de contraste.19, 36 Después se realiza el examen químico, el cual se realiza con tiras reactivas, éstas son tiras de plástico con porciones de fieltro impregnadas con reactivos, con las cuales se puede hacer la medición de pH, proteínas, glucosa, cuerpos cetónicos, bilirrubina, sangre y urobilinógeno: se capturan los datos del paciente en IDEXX 69 Vetlab Station, se colocan gotas de la muestra en una tira reactiva y esta se introduce en el Analizador de orina IDEXX VetLab UA, este analizador de orina garantiza resultados precisos y constantes, a través de una lectura automatizada de resultados. Examen microscópico del Sedimento Urinario Este tiene gran importancia clínica, siendo una herramienta diagnóstica valiosa para la detección y evaluación de trastornos renales y del tracto urinario; así como de otras enfermedades sistémicas.16, 33,36 Se colocaban la muestra en tubos cónicos y se centrifuga durante 10 minutos a 1500 rpm, se decanta el sobrenadante, utilizando únicamente la cantidad de orina que queda en la paredes del tubo, de esta forma se obtiene el sedimento y se colocan dos gotas de este con una pipeta Pasteur en un portaobjetos, una de las gotas se tiñe con Lugol, se le colocan a ambas encima un cubreobjetos y se observa al microscopio utilizando el objetivo seco débil (10x). El sedimento urinario se clasifica en sedimento organizado: células epiteliales, leucocitos, eritrocitos, microorganismos, cilindros; y en sedimentos no organizado como son cristales.6 ESTUDIOS COPROPARASITOSCÓPICOS Flotación 1 muestra y serie de 3 muestras: Se recibe la muestra, se hace el marcaje de la misma y se coloca en refrigeración de ser necesario. Se coloca una cucharada de muestra y mezcla perfectamente en un vaso de precipitados con agua, se deja pasar a través de un colador, se coloca en un tubo de ensaye a dos terceras partes con la muestra colada y se llena con agua, el tubo se centrifuga durante 10 minutos a 1 500 rpm, una vez centrifugado se decanta el sobrenadante, el tubo se llena con sulfato de zinc y se vuelve a centrifugar, una 70 vez realizado esto se coloca sulfato de zinc al tubo hasta el borde en la parte superior del tubo, se coloca un cubreobjetos y se deja reposar durante 20 minutos, se deja caer una gota de Lugol en un portaobjetos y se coloca el cubreobjetos del tubo y se observa al microscopio. Se realiza el mismo procedimiento de flotación en la serie de tres muestras, pero se coloca una cucharada de cada muestra de heces en el vaso de precipitados.6 ESTUDIOS COPROLÓGICOS Para la evaluación de la actividad enzimática del páncreas a nivel intestinal. 19 Consiste en realizar en las heces pruebas físicas (aspecto, color, detritus no digeridos, parásitos etc.), pruebas químicas y pruebas microscópicas (células epiteliales, eritrocitos, leucocitos, grasa, mucina). Prueba de la película radiográfica en heces Se adicionan a 4.5 ml de una solución de bicarbonato de sodio al 5%; la cantidad de heces necesaria para llegar a un volumen final de 5 ml, esta mezcla se agita y se le coloca una tira de película radiográfica dentro del tubo, se deja reposar por dos horas y media a temperatura ambiente, después se retira la película radiográfica y se lava a chorro fino de agua, la presencia de una zona clara indica la existencia de tripsina.6 Pruebas microscópicas Tinción con Sudán A una muestra de heces previamente homogeneizada se agregan dos gotas de agua, dos gotas de alcohol al 95% y dos gotas de solución saturada de Sudan IV, se le coloca un cubreobjetos y la preparación es observada con el objetivo seco fuerte, las grasas se tiñen de color rojo o naranja. Tinción con Lugol Se coloca una muestra de heces en un portaobjetos y se añade una gota de colorante de Lugol, se le coloca un cubreobjetos y se observa en el objetivo seco 71 fuerte y seco débil. En ésta prueba se pueden observar parásitos, células y fibras vegetales. ESTUDIOS CITOLÓGICOS Es el estudio microscópico de extendidos celulares, procedentes de pacientes vivos o muertos, con fines diagnósticos, pronósticos y de seguimiento. La principal ventaja de la Citología, es que es un método sencillo de realizar y menos invasivo que la Biopsia; pero su principal limitación es que es un método de presunción diagnóstica (diagnóstico orientativo), por lo que debe ser confirmado mediante Biopsia.5, 12,19 El principal objetivo de la Citología es reconocer los cambios que la enfermedad imprime a la célula e interpretarlos correctamente. La Citología o Citopatología no es otra cosa que la evaluación morfológica de los caracteres microscópicos de la célula (citoplasma, núcleo) y de sus componentes extracelulares.13 Las células se obtienen por descamación espontánea de un tejido mediante raspado, por lavado, por decantación, por métodos de enriquecimiento o por otros métodos menos invasivos que la biopsia.36 ACAF (Aspiración Citológica con Aguja Fina) ó PAF (Punción con Aguja Fina) Tipos de Citologías: Citología por Impronta Citología de Líquidos Citología Exfoliativa Como el nombre lo sugiere, este estudio se realiza con agujas de pequeño calibre (agujas de 20 a 25) montada en una jeringa de 10cc o jeringa pistola. No se utiliza anestesia local para realizarla. El corte producido por el filo de la aguja y la presión negativa ejercida por la aspiración permite la obtención de células o de un líquido sanguinolento que contiene grupos celulares. La principal ventaja de la PAF permite un diagnóstico con mínima invasión.7, 13,19 72 Indicaciones de una PAF: - Cuando hay lesiones inflamatorias o no inflamatorias palpables, incluyendo nódulos linfáticos. - Cuando hay lesiones neoplásicas no palpables pero imagenológicamente sospechosas de malignidad Técnica Paso 1: Identificación de la lesión y del mejor sitio de acceso para realizar la PAF Paso 2: Se mantiene la zona en tensión. Se inserta la aguja (punza la piel de la zona donde se halla la lesión). Simultáneamente ejerce presión negativa una vez que la aguja penetra la piel, se mantiene por un par de segundos, redireccionando la aguja varias veces para obtener muestras de múltiples áreas del tejido. Se libera la presión inmediatamente antes de remover la aguja. Se repite la maniobra (2 veces) usando diferentes agujas y jeringas. Paso 3: Se aplica presión en la zona para minimizar el hematoma postoperatorio Paso 4: Se recoge la muestra y se prepara los extendidos. a.- Identificar el portaobjeto: Marcar todos los portaobjetos recibidos o los líquidos con el número de caso de laboratorio o nombre del paciente. b. -Preparar los extendidos: Colocar el material en el portaobjeto: Preparar los frotis usando pequeñas cantidades de material con la menor cantidad de sangre posible.12 Realizar si es posible realizar 6 frotis, fijar inmediatamente: Fijación en húmedo: Sumergir en alcohol 95% durante 10 minutos, procurando que el alcohol cubra completamente el frotis. Fijación en seco: El frotis se deja secar al aire y se puede utilizar spray fijador de células (Citospray), rociándolo sobre el frotis a 20cm de distancia, una vez que el frotis esté seco. 73 Se realizan dos tipos de tinciones como la: Tinción de Diff-Quick: Para tinciones de laminillas fijadas en seco. Tinción de Papanicolaou: Para tinciones de laminillas fijadas en húmedo. Después se observan las laminillas al microscopio (Imagen 38). IMPRONTA Consiste en apoyar con cierta presión un portaobjetos sobre la superficie de corte de un material de Biopsia; tras lo cual se evalúan las células que adhieren al portaobjetos. Esta técnica se usa mayormente en patología linfoganglionar. ANÁLISIS DE LÍQUIDOS Son esencialmente un filtrado de sangre con poca proteína y que en condiciones patológicas, ya sea en trastornos metabólicos o en respuesta a agentes infecciones o neoplasias, tienden a cambiar tanto su composición como volumen, denominándose como efusión. 13,36 Una vez obtenida la muestra de líquido, es posible someterlo a diversos análisis: Examen Físico: se lleva a cabo mediante la observación. Color, turbidez, Coagulación, Olor y Densidad, éste último utilizándose el refractómetro de Goldberg.6 Examen Químico: se lleva a cabo por medio de tiras reactivas. Examen Citológico: el cual se coloca un poco de muestra en una laminilla y se observa al microscopio. Conteo celular total, donde se utiliza la pipeta de Thoma para glóbulos blancos y se añade diluyente de Türk y se hace el conteo en la cámara de Neubauer Conteo diferencial. Centrifugando el líquido, colocando una gota en un portaobjetos, se realiza el frotis, se realiza la tinción y se observa al microscopio. 74 ESTUDIOS HISTOPATOLÓGICOS Las muestras obtenidas se colocan en frascos de vidrio con formol al 10% y se envían al departamento de Histopatología de la FESC, junto con la hoja de examen solicitado (Formato 17), los resultados se obtienen en un periodo de aproximadamente dos semanas después de haber sido entregada la muestra en el laboratorio de Histopatología. Existe una variedad de métodos diferentes para la detección de anticuerpos séricos contra agentes infecciosos, como el análisis enzimoinmunoabsorbente o conocido como prueba de ELISA.25 Este tipo de pruebas pueden adaptarse para detectar respuestas de IgM, Ig G ó Ig A específicas. En el análisis de ELISA indirecto, el agente o antígenos infecciosos se adhieren a cubetas de una placa o membranas y los anticuerpos secundarios están unidos a una enzima. Un sustrato cambia de color cuando es expuesto a esta enzima; se incorpora para determinar si se unen los anticuerpos. Esta técnica tiene la ventaja de determinar qué antígenos están induciendo una respuesta humoral específica. La comparación de las respuestas IgM, Ig A e Ig G contra un agente infeccioso pueden aprovecharse para intentar probar una infección reciente o activa.25, 36 Pruebas de ELISA más comúnmente utilizadas en el Hospital de Pequeñas Especies de la FESC. PARVOVIRUS CANINO DISTEMPER CANINO GIARDIA SIDA FELINO LEUCEMIA VIRAL FELINA 75 Al concluir el procesamiento de cada muestra el Coordinador del Área de Laboratorio Clínico, el M. en C. Ignacio C. Rangel Rodríguez se encargaba de emitir el diagnóstico de laboratorio, capturaba los datos, hacia las interpretaciones e imprimía los resultados, éstos se emitían como en los siguientes formatos (Formato 14 y 15). Imagen 38. Revisión al microscopio de muestras de Citología. Imagen 37. Captura de datos de muestras de hematología en el analizador hematológico. ÁREA DE IMAGENOLOGÍA ÁREA DE RAYOS X Los factores de exposición, son el Miliamperaje, Kilovoltaje, Tiempo y Distancia, éstos van a controlar la densidad radiográfica; la variación de alguno de estos factores, requiere del ajuste de otro para conservar una adecuada densidad radiográfica.17 76 Las selecciones en el panel de control se basan en una evaluación del paciente, el grosor de la parte anatómica, el estudio a realizar y el tipo de accesorios utilizados. El miliamperaje mA determina el número de rayos x producido y por lo tanto la cantidad de radiación recibida, controla la temperatura del filamento. Con el tiempo de exposición se va a determinar todo el proceso de producción de rayos x; es decir la fase de calentamiento del filamento determinado por el mA., el flujo de electrones a través del tubo de rayos x y la salida de rayos x hacia el paciente.32 El tiempo se debe mantener tan corto como sea posible, con la finalidad de disminuir la pérdida de definición que resulta por el movimiento del paciente., el cual, se expresa en segundos, décimas de segundo, hasta milésimas de segundo. La cantidad de rayos x necesaria para una exposición se expresa mejor como el producto del mA y el tiempo de exposición resultando en Miliamperaje por segundo (mAs), por lo tanto a mayor mAs mayor obscurecimiento de la radiografía. El Kilovoltaje: Es el control primario de la calidad del haz de rayos x, es medido en kilovoltios. Al incrementar el kilovoltaje, provoca que los electrones crucen con mayor rapidez; ampliando la fuerza de colisión con el blanco, dando como resultado rayos x de longitud de onda más corta y con un mayor poder de penetración por lo tanto el kilovoltaje (kV) va a determinar el grado de penetración de los rayos x. El kV es el único factor de exposición que puede controlar las escalas de contraste: El KV se puede determinar con la regla de Sante que dice que el grosor del área de interés se multiplica por dos y se suma a (k), la cual es una constante que va a representar la distancia entre el tubo de rayos x y la película, pero expresado en 77 pulgadas; debido a que la distancia entre el tubo de rayos x y la película es generalmente de un metro la (k) más empleada es de 40 pulgadas. Por lo tanto: Grosor del tejido x 2 + 40 = kVp. El espesómetro es un aparato de medición del grosor de las partes anatómicas, que es necesario para determinar el valor de kVp necesario para realizar la exposición. La relación entre el mAs y el kV es inversamente proporcional ya que si se aumenta el valor del mAs se debe disminuir la cantidad de kV.17 Los análisis radiográficos rutinarios consisten como mínimo de dos proyecciones radiográficas, en algunas ocasiones puede necesitarse adicionar otras proyecciones en ángulos diferentes, esto se debe a que la radiografía es una imagen bidimensional de una estructura tridimensional. TERMINOLOGÍA DE POSICIONAMIENTO DORSAL (D): Área situada en el dorso o parte superior de los cuadrúpedos, también describe a los miembros a partir de las articulaciones de los tarsos y carpos. VENTRAL (V): Se refiere al aspecto inferior de la cabeza, cuello, tronco y cola, opuesto a dorsal. MEDIAL (M): Superficies internas de las extremidades. LATERAL (L): Superficies externas de la cabeza, tronco y extremidades. El rayo entra través del lado izquierdo o derecho del cuerpo y sale por el lado opuesto. CRANEAL (Cr): Estructuras o planos situados hacia la cabeza. CAUDAL (Cd): Estructuras o planos situados hacia la cola, antes se conocía como posterior pero al igual que “anterior” este término ya no se emplea. 78 ROSTRAL (R): Áreas de la cabeza situadas hacia la nariz. PROXIMAL (Pr): Cercano al punto de origen de alguna estructura. En el caso de las extremidades, proximal indica superior DISTAL (Di): Más alejado del punto de inserción u origen de alguna estructura. En el caso de las extremidades, distal indica inferior PALMAR (Pa): Superficie de apoyo de las extremidades torácicas. Se usa en lugar de caudal del carpo hacia distal. PLANTAR (Pl): Superficie de apoyo de las extremidades pelvianas. Se usa en lugar de caudal del tarso hacia distal.18 NOMENCLATURA RADIOGRÁFICA Se refiere a los términos usados para describir la proyección radiográfica indicando la dirección del rayo. Las primeras palabras provienen de aquellas partes del cuerpo por donde entra el rayo y después por donde sale. Por ejemplo la abreviatura VD se refiere a Ventro Dorsal, lo que se refiere a que el rayo entra a través del plano ventral del animal y sale por el plano dorsal. Los términos de dirección pueden combinarse para proyecciones oblicuas, DMPaLO del carpo indica que el carpo se rota a un ángulo seleccionado y que el rayo está centrado entre la superficie dorsal/medial y que sale por la parte palmar/lateral oblicua.17, 18 En esta sección durante mi periodo que abarco del 16 de noviembre del 2012 al 15 de enero de 2013, realice varias actividades, como fue: Recibir al paciente al que se le va a realizar el o los estudios radiográficos. El estudiante a cargo del caso deberá llenar la solicitud de Estudio 79 Radiográfico (Formato 8), donde indica el tipo de estudio radiográfico que requiere el paciente y datos del gabinete como: Fecha de toma del estudio, Nombre del Paciente, Especie, Nombre, Raza, Sexo, Número de Expediente, si es un caso remitido, se registra como EXTERNO, Datos del Propietario, etc. Encender el aparato de rayos X Cargar el casette o chasis para la toma de placa, se utilizan placas sensibles al verde Kodak y Fujifilm, existen de diferentes tamaños, como son placas de 8 x 10, 10 x 12, 11 x 14, 14 x 17 pulgadas Calibrar el aparato de rayos X de acuerdo a las características del paciente. Colocar en el aparato de rayos x, la técnica necesaria para el paciente, de acuerdo a su peso, raza, y medida de la zona a radiar, esto en base al Miliamperaje y Kilovoltaje, apoyándonos del uso de la regla de Sante, y colocar en la Ficha Técnica (Formato 9), las medidas empleadas en el estudio radiográfico . Revisar los planos radiográficos para cada radiografía solicitada Ayudar a la toma de la placa radiográfica colocando al paciente en la posición correcta dependiendo del estudio solicitado. Para asistir en el posicionamiento de un paciente pueden usarse dispositivos como bolsas de arena, bloques y cuñas de hule espuma. La cinta, gasas, cuerdas y bandas de compresión también son útiles. Colimación. Tener en cuenta cual es el área de interés para limitar la luz del colimador y así no tomar una radiografía de otra área o de cuerpo completo. Una vez que se haya tomado la placa, llevar el chasis al cuarto oscuro para revelarla de forma manual. Secado de la placa radiográfica. 80 Si la toma fue adecuada en cuanto a proyección requerida y que la técnica haya sido la ideal, se rotula la placa y se procede a su revisión para así obtener información y emitir un diagnóstico radiográfico. IDENTIFICACIÓN DE LA RADIOGRAFÍA Cada radiografía debe estar identificada de una manera que permita su localización posterior, debido a que en muchos casos se necesitan radiografías adicionales para hacer evaluaciones de una enfermedad, tratamiento. DATOS EN LA IDENTIFICACIÓN RADIOGRÁFICA Los datos que idealmente se deben encontrar en la identificación de una radiografía son: Fecha en que se realizó el estudio, nombre del paciente, número de expediente, región y estudio solicitado. Contribuir a la interpretación radiográfica de la placa del paciente con el médico responsable de turno, y se anexa la interpretación radiográfica al expediente clínico. Llevar un inventario semanal del número de placas que se utilizaron por paciente. Cambiar el agua del tanque de revelado, una vez por semana. Para la obtención de radiografías de calidad se deben seguir los siguientes pasos: 1. Asegurar la comodidad del paciente. 2. Obtener una completa inmovilización del animal, sobre todo del área de interés. 3. Evitar generar un mayor traumatismo en el área lesionada o en los tejidos adyacentes a ésta. 4. Asegurarse que la zona de interés esté lo más cercano al chasis. 5. El menor riesgo de exposición al personal que asiste al posicionamiento del paciente.18 81 Se debe contar con un sistema organizado de archivo; es obligatorio en cualquier clínica u hospital veterinario, el cual debe ser adecuado para evitar gastar tiempo en la búsqueda de estudios, esto se debe realizar en un solo lugar y no indiscriminadamente en una torre de radiografías tomadas anteriormente. Un método de archivo recomendado es colocar las radiografías en sobres los cuales deben llevar la identificación del paciente, tipo de estudio e ir colocando todas las radiografías que posteriormente se le tomen a ese paciente en ese sobre y colocarlo en un archivero o librero por número de expediente o por un código de colores para que sea fácil su ubicación.17, 18, 32 No es prudente entregar los estudios a los propietarios debido a que ellos pueden perderlos o no guardarlos para su posterior análisis. 17 La interpretación radiográfica es un estudio detallado de todas las anormalidades y alteraciones que se pueden presentar en un estudio radiográfico, esto es posible analizándolas y comparándolas con la anatomía normal, llegando a conclusiones para formar un diagnóstico radiográfico. 11 Al interpretar una imagen radiográfica se extrae de ella toda la información útil para el diagnóstico del paciente. La valoración de las radiografías de pobre calidad es no concluyente y puede ser engañosa, por lo que debe evitarse analizar este tipo de estudios. 17, 21 El médico debe basarse en los resultados de la exploración física, la signología y la historia clínica, para realizar una lista de diagnósticos diferenciales y así emplear los medios de diagnóstico más acertados para cada paciente. Se debe evitar la idea de que un examen radiográfico sirve para obtener un diagnóstico, ya que el fin de realizar este tipo de estudios es la confirmación de un diagnóstico clínico previo. Otro factor importante a tener en cuenta para hacer una interpretación exitosa es la calidad de las radiografías a interpretar. 82 El análisis del estudio radiográfico debe ser completo y no limitarse a una radiografía ni a una sola área. En la formación de imágenes influyen 4 factores: a) Detalle b) Densidad c) Contraste d) Distorsión a) DETALLE Se refiere al grado de definición de los bordes y de las estructuras anatómicas en las radiografías. Se pueden clasificar las causas que originan la pérdida de detalle en: 1. Tamaño del punto focal: A mayor tamaño, mayor pérdida de definición. 2. Distancia entre el punto focal y la película radiográfica: A mayor distancia, mayor definición. La distancia estándar en radiología de perros y gatos es de un metro. 3. Distancia entre el objeto y la película radiográfica. A mayor distancia, menor definición y se origina el fenómeno de amplificación que se refiere al aumento del tamaño de la imagen en relación a su tamaño real, por lo que la zona de interés debe estar lo más cerca posible a la película radiográfica, para evitar la ampliación y la pérdida de definición. 4. Contacto entre la película y la pantalla intensificadora. En las zonas dónde hay pérdida de contacto, hay pérdida de definición. Por este motivo se recomienda no apilar los chasises ya que el que queda abajo puede deformar y disminuir el contacto entre la pantalla y la película. 5. Movimiento: del tubo de rayos x, del paciente o del chasis 83 Lo ideal es que el grado de definición de las estructuras anatómicas sea óptimo. b) DENSIDAD La densidad radiográfica es el grado de ennegrecimiento de la radiografía, esta puede aumentarse, incrementando el mA, el tiempo de exposición o ambos. La densidad del paciente es la capacidad de los diferentes tejidos para absorber los rayos x. 32 Debido a las diferencias en la absorción de los rayos x se tienen objetos que absorben gran cantidad de rayos x llamados radiopacos, por lo que los fotones no pueden atravesarlos, produciendo un área clara que al ver la radiografía aparece blanca o gris clara; así mismo los objetos que permiten el paso de gran cantidad de radiación se denominan radiolúcidos y producen imágenes negras o gris oscuro. Por lo tanto en radiología diagnóstica, la absorción de los rayos x y la densidad física ayudan a clasificar la radiopacidad de los tejidos. La radiopacidad de los tejidos presenta cinco grados perceptibles: Aire: Absorbe una pequeña cantidad de radiación y produce una imagen negra intensa. Grasa: Su absorción de radiación es pequeña y ofrece imágenes gris oscuro. Tejido blando: Músculo, sangre y órganos parenquimatosos que están compuestos de agua, absorben igual cantidad de radiación por lo que da lugar a sombras radiográficas con variados tonos de grises. Hueso: Debido a su gran contenido de calcio, fósforo y otros minerales, tiene una densidad elevada, produciendo una imagen blanca. Metal: Tiene la más alta densidad radiográfica, por su elevado número atómico, absorbe la totalidad de los fotones de rayos x generando una imagen totalmente blanca. 84 El espesor y la radiopacidad están estrechamente relacionados, si el espesor aumenta, la densidad también. c) CONTRASTE RADIOGRÁFICO: Es el grado de diferencia perceptible entre 2 tonos, influenciado principalmente por el kilovoltaje; a mayor kilovoltaje, menor contraste y a menor kilovoltaje, mayor contraste. d) DISTORSIÓN: Se define como la deformación de las imágenes en las radiografías. Se debe a la forma en que inciden los rayos x en las estructuras anatómicas incluidas en las radiografías. 17,18 El informe radiográfico debe contener la siguiente información: 1. Fecha de realización del estudio. 2. Reseña e identificación del paciente. 3. Información relevante de la historia clínica, el examen físico, resultados de las pruebas de laboratorio, si es que se tienen. 4. Diagnóstico clínico presuntivo y nombre del médico que solicita el estudio. 5. Estudio y proyecciones radiográficas solicitadas. 6. Proyecciones radiográficas utilizadas. 7. Resultados del estudio radiográfico: a) Interpretación. b) Diagnóstico radiográfico. c) Recomendaciones: Se puede sugerir realizar otro tipo de estudios por imagen para llegar al diagnóstico definitivo cuando la imagen radiográfica no es muy clara, los estudios que se pueden proponer son: ultrasonografía, tomografía computarizada o resonancia magnética. Número y tamaño de las radiografías utilizadas en el estudio. 85 kVp y mAs utilizados, si se utilizó la rejilla, anotar el grado de exposición obtenido, la información es de gran utilidad para los casos que requieren estudios radiográficos de seguimiento. Nombre y firma del médico que realiza la interpretación Nombre de la clínica u hospital. Diagnóstico por imagen Las radiografías simples se emplean de forma rutinaria para explorar el aparato digestivo de pequeños animales. Las radiografías de tórax están indicadas si se sospecha de Megaesófago, Neumonía por aspiración, Metástasis. Las radiografías de abdomen pueden ser útiles en el diagnóstico de masas, cuerpos extraños radioopacos, dilatación-torsión gástrica, Hepatomegalia, Peritonitis. Por lo general las radiografías de colon aportan escasa información Las radiografías de contraste son importantes a la hora de detectar cuerpos extraños radiolúcidos, masas, estenosis, infiltración de la pared gastrointestinal, úlceras en la mucosa, problemas de motilidad y defectos de llenado que sugieren la presencia de enfermedad neoplásica o ulcerativa.11 El objetivo de la radiología es obtener radiografías con una mínima exposición, es por esto que la protección contra la radiación debe ser también un punto relevante dentro de la radiología, tomando en cuenta que durante la exposición se debe proteger al público en general, al paciente y al personal del hospital.20 En medicina veterinaria se debe implementar la cultura de seguridad que se refiere al conjunto de valores y actitudes que rigen la conducta de los individuos, para la protección y seguridad radiológica, para esto conviene instaurar y mantener un programa de protección radiográfica. 17 86 La importancia de la protección frente a la radiación ionizante radica en que la radiación ioniza el agua presente en el organismo liberando radicales OH que pueden dañar componentes imprescindibles de la célula como el ADN. La indumentaria de plomo ayuda a reducir la exposición del haz primario en un 25%. El mandil debe tener un espesor de al menos 0.5 mm de plomo cuando cubra solamente el frente del cuerpo o de al menos 0.25 mm cuando cubra completamente el frente, los costados del tórax y pelvis. Los guantes y el collarín para proteger la tiroides deben contar con el espesor de al menos 0.5 mm de plomo. Colgar los delantales y los protectores tiroideos, para evitar que se agrieten. Cuando se use un equipo móvil el operador mantendrá una distancia mayor a 1.8m del paciente y hacer uso del mandil plomado. REGLAS DE SEGURIDAD RADIOGRÁFICA 1) Mantener el mínimo de personal necesario durante la exposición, de ser posible rotar al personal que asiste en la toma de estudios radiográficos para disminuir el nivel de exposición. 2) Evitar que menores de 18 años y personas embarazadas permanezcan en el recinto cuando se esté tomando un estudio. 3) Siempre usar ropa protectora diseñada para absorber la radiación secundaria con un grosor de 0.5mm de plomo, para la protección de los ojos se debe llevar lentes con cristales plomados. Asegurar la vida máxima de la indumentaria protectora a través de un uso y cuidado apropiado. 4) Usar restrictores mecánicos cuando sea posible, como sacos de arena, vendas, cuñas o utilizar restrictores químicos tal como tranquilizantes y anestésicos. 87 5) Usar el colimador para disminuir el tamaño del campo y la radiación dispersa, ninguna parte del cuerpo debe estar en contacto con el haz primario ya que lo ropa de plomo no protege del haz primario. ) 6) Mantener los químicos del cuarto obscuro en buenas condiciones de operación. 7) Cuidar el tiempo y los valores de exposición.20 Imagen 39. Realización de estudio radiográfico ULTRASONIDO Se está volviendo rápidamente una modalidad de imagen aceptada en pequeñas especies. Es una técnica diagnóstica segura, no invasiva, que proporciona información acerca de la estructura interna de los órganos dentro del abdomen y tórax. El ultrasonido no tiene el objetivo de reemplazar a la radiografía diagnóstica, si no de complementarla. La calidad de la imagen y la información obtenida están directamente relacionadas con la habilidad de la persona que hace el estudio. Se trata de un procedimiento diagnóstico que emplea los ecos de una emisión de sonido, dirigida sobre el organismo del animal para formar una imagen de los órganos y masas internas a través de un sistema electrónico. 88 La ecografía médica utiliza ecos de ondas sonoras para crear imágenes y esta es la única modalidad de adquisición de imágenes de diagnóstico que no utiliza radiación electromagnética. Los principales componentes de un sistema de imagen de ultrasonido son: pulsador, transductor, recibidor, memoria y pantalla. Los pulsos eléctricos son producidos por el pulsador e impulsados hacia el trasductor. El transductor produce pulsos de ultrasonidos para cada pulso eléctrico que recibe. También produce pulsos eléctricos para cada pulso de ultrasonido reflejo que recibe de los tejidos. Los pulsos eléctricos van al recibidor, donde son convertidos a información que puede utilizar la memoria. La información de la memoria se muestra o impulsa en la pantalla, lo que produce una imagen Durante mi rotación por esta área las actividades en las que participe activamente fueron: Recibir y preparar a los pacientes que requieren que se les realice ultrasonido (rasurado y lavado), se recibe al paciente junto con su hoja de Solicitud de estudio Ultrasonográfico (Formato 10). El problema más común para obtener imágenes de buena calidad es el mal contacto entre la piel y el transductor. Se rasura el área a la que se le va a hacer el ultrasonido con una navaja núm. 40. El pelo tiende a atrapar aire, que actúa como barrera al ultrasonido. Se limpia la piel expuesta para quitar suciedad, aceite, detritus antes de aplicar el gen para obtener la mejor imagen. Apoye en el manejo del paciente durante la realización del ultrasonido, teniendo la oportunidad de aprender más sobre la interpretación de dicho estudio Realizar la hoja de interpretación del ultrasonido para con esto llenar expediente del paciente, y en caso de que lo solicite el propietario se le hace entrega del estudio ultrasonográfico en video formato DVD y la interpretación del mismo. 89 En general no se requiere tranquilización, pero el paciente siempre debe estar sujetado de manera adecuada. Es ultrasonido es una representación bidimensional de un objeto tridimensional. Refleja la anatomía tomográfica (en cortes transversales). Permite identificar la estructura de los órganos internos. USOS Biopsias con aguja guiada por ultrasonido para histopatología y cultivo. Aspirado con aguja fina guiada por ultrasonido para citología y cultivo. Cistocentesis (vejigas pequeñas, animales difíciles) Aspirados de vesícula biliar para cultivo. Diagnóstico y drenaje de abscesos Diagnóstico de quistes y drenaje. Toracocentesis.3 La ecografía abdominal es útil para valorar la presencia de derivaciones portosistémicas, ya que se puede establecer el tamaño, consistencia y vasculatura del hígado. También puede ayudar a diagnosticar el engrosamiento de la pared intestinal, ser útil para estudiar los contenidos presentes en la luz, el peristaltismo y para diagnosticar neoplasias e invaginaciones. 90 ENDOSCOPÍAS La endoscopia es uno de los mejores métodos para examinar cavidades orgánicas en un cuerpo vivo. Esta técnica empezó a utilizarse en los años setentas y permite de una forma mínimamente invasiva la visualización y extracción de cuerpos extraños, obtención de biopsias e incluso la elaboración de técnicas quirúrgicas. Actualmente la endoscopia es una técnica ampliamente difundida y se encuentra en constante evolución. El gran avance tecnológico en el tratamiento de imágenes, las innovaciones en los diferentes instrumentos y las mejoras introducidas en las diferentes técnicas hacen de la endoscopia una valiosa herramienta de diagnóstico y tratamiento.3 Para la realización de técnicas endoscópicas se requiere de tranquilización o sedación previa, generalmente se utiliza Acepromacina 0.02mg/kg. Imagen 40. Realización de endoscopía en el HEMyCPE 91 RESULTADOS Los resultados obtenidos son en base al número de servicios clínicos que se bridaron durante mi servicio social titulación desde el 15 de marzo del 2012 al 15 de marzo del 2013, tomando los datos de los expedientes de los pacientes. Área de Cirugía No Procedimiento Expediente Quirúrgico Osteosíntesis de fémur con AA0723 AA0734 AA0638 AA0757 AA0101 AA0770 AA0778 EXTERNO AA0707 AA0758 placa y tornillos Profilaxis dental Traquestomía y colocación de cánula Resección Intestinal Profilaxis dental OSH OSH Osteosíntesis de miembro pelviano derecho Mastectomía y OSH Retiro de lipomas de MPD y abdomen AA0783 AA0789 Desbridación de absceso AA0778 Desbridación de absceso de MPI OSH (Piómetra) AA0802 AA0484 AA0787 EXTERNO AA850 OSH con útero gestante Orquiectomía Sustitución extracapsular del ligamento cruzado del MPD Cánula Especie Raza Sexo Edad Canino Bóxer Macho 2 años Canino Canino Schnauzer Mestizo Hembra Hembra 9 años 9 años Canino Canino Canino Golden Retriever Poodle Mestizo Macho Macho Hembra Canino Conejo Bóxer California Hembra Macho 7 años 9 años 10 años 3 años 1 año Canino Canino Cocker Cocker Hembra Hembra Canino Felino Macho Hembra Canino Golden Retriever Europeo Domestico Bóxer 8 años 12 años 8 años 6 años Hembra 3 años Canino Canino Canino Labrador Pastor Alemán Maltés Macho Macho Hembra 7 años 8 años 7 años Canino Canino Mestizo Mestizo Macho Macho AA0749 Nodulectomía (MTD e intercostales) Canino Beagle Hembra AA0778 AA0834 OSH Canino Canino Bóxer Poodle Hembra Hembra 8 años 10 años 14 años 3 años 2 años Canino Labrador Macho 7 años AA0788 Hernia inguinal Resección de Glándula salival mandibular izquierda Nodulectomía 92 AA830 Profilaxis dental Felino AA0853 EXTERNO Desbridación de absceso AA0869 Ruptura de ligamento cruzado anterior de la rodilla Persistencia del 4to arco aórtico derecho Hembra 7 años Canino Canino Europeo Domestico Cocker Bulldog Macho Hembra 2 años Canino Labrador Macho 2 meses 11 meses 3 meses 11 años 10 meses 5 años AA0884 Gastrotomía Canino Bull Terrier Macho AA0890 Corrección quirúrgica de fractura de fémur Canino Golden Retriever Macho AA0887 Osteosíntesis (fractura del maxilar) Canino Chihuahueño Macho AA0908 Retiro de clavo de tibia de MPD Canino Doberman Hembra EXTERNO EXTERNO Profilaxis dental OSH Canino Felino Hembra Hembra AA0930 Laparatomía exploratoria Canino Schnauzer Europeo Doméstico Mestizo AA0858 Biopsia de hueso Canino Labrador Hembra AA0903 Nodulectomía del párpado superior del ojo izquierdo Corrección quirúrgica de fractura de tibia y fíbula Canino Setter Irlandés Macho Canino Bull Terrier Hembra OSH Útero con piómetra Felino Canino Persa Schnauzer Hembra Hembra AA0937 Hembra AA0936 Colocación de placa iliaca en pelvis AA0941 Amputación de pene y castración Canino Mestizo Macho AA0932 Amputación de dedo IV, V Canino Airdale Terrier Hembra AA0940 Enucleación Canino Chihuahueño Hembra 12 años 2.5 años 4 años 9 meses 7 meses 11 años 10 años 6 años Tabla 10. Registro de cirugías durante el periodo comprendido del 15 de marzo al 11 de mayo de 2012 dentro de las instalaciones del Hospital de Pequeñas Especies de la FESC. 93 ESPECIES SOMETIDAS A CIRUGÍA ESPECIE CANINOS FELINOS CONEJOS TOTAL CANTIDAD DE PACIENTES 36 4 1 41 Tabla 11. Pacientes sometidos a cirugía divididos por especie. Gráfica 1. Relación de pacientes sometidos a cirugía por especies. CLASIFICACIÓN DE CIRUGÍAS CIUGÍAS ORTOPÉDICAS CIRUGÍAS DE MEDICINA PREVENTIVA CIRUGÍAS DE TEJIDOS BLANDOS TOTAL DE CIRUGÍAS REALIZADAS CANTIDAD DE CIRUGÍAS 11 9 21 41 Tabla 12. Motivo de cirugía. 94 Gráfica 2. Clasificación de los motivos de cirugía. En la siguiente tabla se muestran las cirugías de medicina preventiva que en el periodo del 15 de marzo al 11 de mayo de 2012 fueron 9 cirugías entre profilaxis dental y castraciones. MEDICINA PREVENTIVA OOFOROSALPINGOHISTERECTOMÍA ORQUIECTOMÍA PROFILAXIS DENTAL TOTAL CANTIDAD DE CIRUGÍAS 4 1 4 9 Tabla 13. Cirugías de Medicina Preventiva del periodo del 15 de marzo al 11 de mayo de 2012. 95 Gráfica 3. Cirugías de Medicina Preventiva del periodo del 15 de marzo al 11 de mayo de 2012. La Tabla 14 nos muestra las cirugías de tejidos blandos que se realizaron en el HEMyCPE en el periodo del 15 de marzo al 11 de mayo de 2012 y su división por aparatos o sistemas afectados. APARATO O SISTEMA RESPIRATORIO DIGESTIVO GENITOURINARIO CARDIACO OJO OTROS (HERNIORRAFÍAS, NODULECTOMÍAS, ETC.) TOTAL CANTIDAD DE CIRUGÍAS 2 3 5 1 2 8 21 Tabla 14. Cirugías de tejidos blandos divididas en aparatos o sistemas en el periodo del 15 de marzo al 11 de mayo de 2012. 96 Gráfica 4. Cirugías de tejidos blandos divididas en aparatos o sistemas afectados. CIRUGÍAS DE TEJIDOS BLANDOS TEJIDOS BLANDOS COLOCACIÓN CÁNULA TRAQUEAL RESECCIÓN INTESTINAL MASTECTOMÍA DESBRIDACIÓN ABSCESO CUTÁNEO OSH CON ÚTERO GESTANTE OSH CON PIOMETRA CERRADA HERNIORRAFÍA NODULECTOMÍAS RESECCIÓN GLANDULA SALIVAL MANDIBULAR RETIRO DE LIPOMAS PERSISTENCIA DE 4°ARCO AÓRTICO GASTROTOMÍA LAPAROTOMÍA EXPLORATORIA AMPUTACIÓN DE PENE ENUCLEACIÓN TOTAL CANTIDAD 2 1 1 3 1 2 1 3 1 1 1 1 1 1 1 21 Tabla 15. Cirugías de tejidos blandos. 97 Gráfica 5. Descripción de cirugías de tejidos blandos. CIRUGÍAS DE ORTOPEDIA ORTOPEDIAS OSTEOSÍNTESIS DE FRACTURA DE FEMUR SUSTITUCIÓN EXTRACAPSULAR LIGAMENTO CRUZADO ANTERIOR DE RODILLA OSTEOSÍNTESIS DE FRACTURA DE MAXILAR RETIRO DE CLAVO DE MIEMBRO PELVIANO DERECHO BIOPSIA DE HUESO OSTEOSÍNTESIS DE FRACTURA DE TIBIA Y FÍBULA COLOCACIÓN PLACA ILIACA EN PELVIS AMPUTACIÓN DEDOS IV Y V TOTAL DE CIRUGÍAS ORTOPÉDICAS CANTIDAD 3 2 1 1 1 1 1 1 11 Tabla 16. Cirugías ortopédicas realizadas en el periodo del 15 de marzo al 11 de mayo de 2012. 98 Gráfica 6.Cirugías ortopédicas. SEXO DEL PACIENTE En la tabla 17 nos muestra que durante el periodo del 15 de marzo al 11 de mayo de 2012, se sometieron a cirugía en mayor medida a pacientes hembras que machos. SEXO CANTIDAD MACHOS 17 HEMBRAS 24 TOTAL 41 Tabla 17. Pacientes sometidos a cirugía clasificados por sexo 99 PRINCIPALES RAZAS DE PACIENTES CANINOS RAZA Bóxer Schnauzer Mestizo Golden Retriever Poodle Cocker Spaniel Pastor Alemán Maltés Beagle Labrador Bulldog Ingles Bull Terrier Ingles Chihuahueño Doberman Setter Irlandés Airdale Terrier TOTAL CANTIDAD 4 3 6 3 2 3 1 1 1 4 1 2 2 1 1 1 36 Tabla 18. Principales razas de pacientes caninos sometidos a cirugía. Gráfica 7. Principales razas caninas de pacientes sometidos a cirugía. 100 ÁREA DE HOSPITALIZACIÓN ESPECIE CANINO FELINO HURÓN TOTAL CANTIDAD 82 6 1 89 Tabla 19. Pacientes hospitalizados en el periodo del 14 de mayo al 13 de julio de 2012 divididos por especies. SEXO PACIENTES HEMBRAS 37 MACHOS 51 TOTAL 88 Tabla 20. Sexo de los pacientes hospitalizados RAZA Mestizo Bull Terrier Inglés Chihuahueño Bóxer San Bernardo Teckel Golden Retriever Yorkshire Terrier Cocker Spaniel Pit Bull Terrier Schnauzer Beagle Poodle Labrador Rottweiler Maltés Doberman Pastor Alemán Pastor Belga Mallinois Chow Chow CANTIDAD 15 5 5 4 1 3 6 1 3 3 6 3 5 7 2 1 1 2 3 1 101 Bull Dog Inglés Gran Danés Antiguo Pastor Inglés Basset Hound TOTAL 1 2 1 1 82 Tabla 21. Principales razas de perros hospitalizados durante el periodo comprendido del 14 de mayo al 13 de julio de 2012. Gráfica 8. Principales razas de perros hospitalizados durante el periodo comprendido del 14 de mayo al 13 de julio de 2012. 102 EUROPEO DOMÉSTICO MEXICANO DOMESTICO CANTIDAD DE PACIENTES 2 4 TOTAL 6 RAZAS DE GATOS Tabla 22. Razas de felinos hospitalizados durante el periodo comprendido del 14 de mayo al 13 de julio de 2012 Se puede observar en la Gráfica 8 la gran variedad de razas caninas, siendo estas solo una pequeña porción de la gran diversidad de razas que existen, siendo los perros criollos los que más acuden a consulta, contrariamente a lo que la mayoría de la gente pudiera pensar, ya que se cree que los perros de raza son más aceptados por la sociedad, es importante saber la frecuencia de las razas ya que ésta también es un factor predisponente a ciertas enfermedades, lo cual es una herramienta útil para un diagnóstico eficaz. También se muestra la cantidad de cada raza que se hospitalizaron por algún motivo, como lo muestra la tabla 23. ÁREA DE HOSPITALIZACIÓN HOSPITAL DE CANINOS HOSPITAL DE INFECCIOSOS HOSPITAL DE FELINOS TOTAL DE PACIENTES HOSPITALIZADOS Tabla 23. Registro de pacientes y internados. NUMERO DE PACIENTES 63 19 7 89 área de hospitalización a la que fueron 103 Gráfica 9. Pacientes hospitalizados por área de hospitalización durante el periodo del 14 de mayo al 13 de julio de 2012. MOTIVO DE HOSPITALIZACIÓN PROCEDIMIENTO MÉDICO PROCEDIMIENTO QUIRÚRGICO TOTAL NUMERO DE PACIENTES 51 38 89 Tabla 24. Registro de pacientes hospitalizados durante el periodo del 14 de mayo al 13 de julio de 2012. 104 ÁREA DE MEDICINA EXP NOMBRE ESPEC IE SEXO EDAD RAZA APARATO AA1107 ENANO Canino Macho 11 años Criollo Piel AA1204 DAISY Canino Hembra 2 meses Bull terrier Medicina preventiva Vacuna Puppy --- AA1205 SAMANT Canino Hembra 1 año 3 meses Chihuahueño Reproductor PARTO DISTÓCICO AA1207 BOLT Canino Macho 2.5 mese Chihuahueño Nervioso ENFERMEDAD NEUROMUSCULAR NEOPLASIA EN ESCÁPULA IZQUIERDA ENF NEUROMUSC DIAGNÓSTICO QUISTE SEROSO, HIPOTIROIDISMO AA1280 MOGIN Canino Hembra 5 años Mestizo Reproductor, piel, musculoesque lético AA1208 COFFEE Canino Macho 9 años Bóxer Nervioso AA1212 BETHOVEEN Canino Macho 2 meses San Bernardo Medicina preventiva Vacuna Puppy AA1215 COFFEE Canino Macho 9 años Teckel Tejidos Blandos HERNIA INGUINAL AA1217 TIBO Canino Macho 4 meses Golden Retriever Digestivo GIARDIASIS AA1228 POPPY Canino Hembra 1 año Mestizo Medicina Preventiva OSH AA1230 PARIS Canino Hembra 6 años Chihuahueño Reproductor Medicina Preventiva Desparasitacion Digestivo AA1235 JUNIOR Canino Macho 3 años Cocker Spaniel AA1239 CAMILA Canino Hembra 6 años Cocker Spaniel DIAGNÓSTICO DE GESTACIÓN PROCTITIS POLIPOIDE ACTIVA CRÓNICA 105 AA1253 WILLY Canino Macho 8 meses Golden Retriever Piel MORDEDURAS POR CONGENERE AA1300 ESTRELLA Canino Hembra 7 meses Pastor Australiano Nervioso DISTEMPER CANINO AA1305 BRUNO Canino Macho 1 año 1 mes Yorkshire Terrier Digestivo PARVOVIROSIS AA1308 LAKESH Canino Macho 11 meses Cocker Spaniel Ojo PROLAPSO GLÁNDULA HARDER Labrador Digestivo, Ojo, Piel ENF. PERIODONTAL, CATARATA, DERMATITIS ACRAL AA1316 ZUCCA Canino Hembra 11 años AA1323 PALOMA Canino Hembra 3 meses Pit Bull Terrier Digestivo GASTROENTERITIS AA0893 MAX Canino Macho 2 años Mestizo Dermatológico DERMATITIS ATÓPICA AA1030 CHOCOLATITO Felino Macho 1 mes Europeo Doméstico Digestivo GASTROENTERITIS INFECCIOSA PARASITARIA AA1163 CHAPET Canino Hembra 10 años Beagle Digestivo COLITIS AA0218 GUAPO Canino Macho 4 años Mestizo Dermatológico PIODERMA, DERMATOFITOSIS AA1201 WOLF Canino Macho 6 meses Doberman Pinscher Dermatológico DERMATOMICOSIS Piel, Endócrino, LIPOMAS/ ENFERMEDAD PERIODONTAL E2/ AA1109 FIGA Canino Hembra 8 años Basset Hound Digestivo AA0667 AA1221 CHATO XHALA Canino Canino Macho Hembra 5 años 2 meses Schnauzer Urológico Pastor Belga Mallinois Medicina Preventiva, Vacuna Puppy, Desparasitación HIPOTIROIDISMO UROLITIASIS 106 AA1054 KIPPER Canino Macho 10 años Labrador Digestivo INTOXICACIÓN POR AINEs AA1040 KABO Canino Macho 3 años Poodle Dermatológico SARNA DEMODÉCICA AA1282 BULET Canino Macho 6 años Bull Terrier Inglés Dermatológico CARCINOMA DE CÉLULAS ESCAMOSAS AA1261 BONIFACIO Canino Macho 2 años Schnauzer Digestivo COLITIS BACTERIANA AA1004 TERRI Canino Macho 13 años Golden Retriever Neurológico DISTEMPER CANINO AA1043 APOLO Canino Macho 7 meses Gran Danés Músculo/ HIGROMA EN MTD Esquelético Pastor Alemán Digestivo ENTERITIS INFECCIOSA PARASITARIAGIARDIOSIS AA1122 LUNA Canino Hembra 3 meses AA1116 WILSON Canino Macho 2 meses Beagle Digestivo PARVOVIROSIS AA0984 JACKE Canino Macho 1 año Labrador Digestivo CUERPO EXTRAÑO EN INTESTINO DELGADO AA1007 SALPI Canino Hembra 11 años Schnauzer Oncología MASTOCITOMA GRADO I, FALANGE MPI Nervioso SINDROME VESTIBULAR CENTRAL, CONJUNTIVITIS BACTERIANA BILATERAL AA1342 LANCE Canino Macho 13 años Golden Retriever Tabla 25. Registro de pacientes de consulta a mi cargo durante el periodo comprendido del 16 de julio al 14 de septiembre de 2012 dentro de las instalaciones del Hospital de Pequeñas Especies de la FESC. 107 La mayoría de los pacientes que recibí a consulta durante mi rotación en el área de medicina fueron 37caninos y tan sólo un paciente felino. ESPECIE CANTIDAD CANINOS 37 FELINOS 1 TOTAL 38 Tabla 26. Relación de pacientes atendidos en el área de medicina divididos por especie. RAZA Mestizo Bull Terrier Inglés Chihuahueño Bóxer San Bernardo Teckel Golden Retriever Cocker Spaniel Pastor Australiano Yorkshire Terrier Labrador Pit Bull Terrier Beagle Doberman Pinscher Basset Hound Schnauzer Pastor Belga Mallinois Poodle Gran Danés Pastor Alemán TOTAL CANTIDAD 5 2 3 1 1 1 4 3 1 1 3 1 2 1 1 3 1 1 1 1 37 Tabla 27. Razas de perros atendidos en el área de medicina durante el periodo del 16 de julio al 14 de septiembre de 2012. 108 Como se puede apreciar en la Gráfica 10, una vez más los perros mestizos o sin raza definida son los más comunes en cuanto a preferencia de la gente, en comparación con los perros de raza. Gráfica 10. Razas de perros atendidos en el área de medicina. SEXO SEXO MACHOS HEMBRAS TOTAL CANTIDAD 25 13 38 Tabla 28. Pacientes atendidos en el área de medicina durante el periodo del 16 de julio al 14 de septiembre de 2012 divididos por sexo. 109 APARATO O SISTEMA CANTIDAD DERMATOLÓGICO 10 ENDÓCRINO 2 MEDICINA PREVENTIVA 10 REPRODUCTOR 3 NERVIOSO 5 MUSCULOESQUELÉTICO 2 DIGESTIVO 14 OJO 2 RENAL 1 ONCOLOGÍA 2 TOTAL 51 Tabla 29. Aparatos o sistemas más afectados en pacientes atendidos del periodo del 14 de mayo al 13 de julio de 2012. Gráfica 11. Aparatos o sistemas más afectados en pacientes atendidos del periodo del 14 de mayo al 13 de julio de 2012. 110 EDADES EDAD Mayores de un año Menores de un año Total de pacientes CANTIDAD DE PACIENTES 24 14 38 Tabla 30. Registro de edades de pacientes atendidos en el área de medicina del periodo del 14 de mayo al 13 de julio de 2012. En la tabla 30 se puede observar que la mayoría de los pacientes que recibí como estudiante a cargo de los casos en el periodo del 14 de mayo al 13 de julio de 2012 fueron mayores de un año (63%), en la gráfica 12 se observa que la edad de mayor frecuencia es al año de edad, y en cuanto a meses, la mayor frecuencia de pacientes fue de dos meses de edad. Gráfica 12. Edades de los pacientes atendidos en consulta (años). 111 Gráfica 13. Edades de los pacientes atendidos en consulta (meses). DERMATOLOGÍA PATOLOGÍA CANTIDAD QUISTE SEROSO 1 NEOPLASIA 1 PIODERMA 2 MORDEDURAS POR CONGENERE 1 DERMATITIS ALERGICA AL PIQUETE DE PULGA 1 DERMATITIS ATÓPICA 1 DERMATOFITOSIS 2 LIPOMAS 1 SARNA DEMODÉCICA 1 CARCINOMA DE CÉLULAS ESCAMOSAS 1 TOTAL 12 Tabla 31. Enfermedades dermatológicas en pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012. 112 Grafica 14. Enfermedades dermatológicas en pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012. MEDICINA PREVENTIVA En cuanto a medicina preventiva lo que más realicé fue desparasitaciones, seguida de primovacunación a pacientes cachorros caninos. MEDICINA PREVENTIVA VACUNACIÓN DESPARASITACIÓN OOFOROSALPINGOHISTERECTOMÍA TOTAL DE PACIENTES CANTIDAD 4 5 1 10 Tabla 32. Registro de medidas preventivas realizadas a los pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012. 113 Gráfica 15. Medidas preventivas realizadas a los pacientes durante mi rotación en el área de medicina, del periodo del16 de julio al 14 septiembre de 2012. DIGESTIVO DIAGNÓSTICO HERNIA INGUINAL GASTROENTERITIS INFECCIOSA PARASITARIA (GIARDIASIS) PROCTITIS POLIPOIDE ACTIVA CRÓNICA GASTROENTERITIS INFECCIOSA VIRAL (PARVOVIROSIS CANINA) ENFERMEDAD PERIODONTAL COLITIS BACTERIANA CUERPO EXTRAÑO EN INTESTINO DELGADO INTOXICACION POR AINES TOTAL DE PACIENTES 1 2 1 3 2 1 1 1 12 Tabla 33. Enfermedades digestivas diagnosticadas en pacientes durante mi rotación en el área de medicina. 114 Gráfica 16. Enfermedades digestivas diagnosticadas en pacientes durante mi rotación en el área de medicina. En la gráfica 16 podemos observar que las pruebas complementarias para llegar a un diagnóstico más utilizadas fueron Hemograma, Química sanguínea y ELISA. PRUEBAS DIAGNÓSTICAS HEMOGRAMA QUÍMICA SANGUÍNEA URIANÁLISIS PUNCIÓN AGUJA FINA ULTRASONIDO COLONOSCOPÍA COPROPARASITOSCÓPICO PANEL DERMATOLÓGICO BIOPSIA RAYOS X PERFIL TIROIDEO ELECTROMIOGRAFÍA ELISA PRUEBA DE FLUORESCEÍNA CANTIDAD 7 7 5 2 3 1 4 5 1 3 2 1 7 2 Tabla 34. Pruebas diagnósticas más solicitadas durante mi rotación en el área de medicina. 115 Gráfica 17. Pruebas diagnósticas más solicitadas durante mi rotación en el área de medicina. ÁREA DE LABORATORIO CLÍNICO ESPECIE CANINO FELINO CAPRINO BOVINO TORTUGA EQUINO HURÓN TOTAL CANTIDAD 233 19 3 1 1 5 1 263 Tabla 35. Registros de laboratorio por especie durante el periodo del 17 de septiembre al 15 de noviembre de 2012. 116 SEXO DEL PACIENTE SEXO HEMBRA MACHO TOTAL CANTIDAD 129 134 263 Tabla 36. Registros de laboratorio por sexo del paciente durante el periodo del 17 de septiembre al 15 de noviembre de 2012. EDADES EDAD MENORES DE UN AÑO MAYORES DE UN AÑO SIN REGISTRO DE EDAD TOTAL NUMERO DE REGISTROS 53 204 6 263 Tabla 37. Registros de laboratorio por edad del paciente durante el periodo del 17 de septiembre al 15 de noviembre de 2012. Gráfica 18. Registros de edades (años) en estudios de laboratorio durante el periodo del 17 de septiembre al 15 de noviembre de 2012. 117 Gráfica 19. Registros de edades (meses) en estudios de laboratorio durante el periodo del 17 de septiembre al 15 de noviembre de 2012. PRUEBA O ESTUDIO SOLICITADO PRUEBA HEMATOCRITO PROTEÍNAS PLASMÁTICAS HEMOGRAMA QUÍMICA SANGUÍNEA PERFIL RENAL URIANÁLISIS PUNCIÓN AGUJA FINA EXÁMEN LÍQUIDOS CITOLOGÍA VAGINAL CULTIVO BACTERIANO Y ANTIBIOGRAMA COPROPARASITOSCÓPICO COPROLÓGICO BIOPSIA PANEL DERMATOLÓGICO PRUEBA DE ACETATO TRICOGRAFÍA RASPADO CUTÁNEO HISOPADO AGLUTINACIÓN LEPTOSPIRAS CANTIDAD 3 3 141 81 3 36 51 10 5 1 5 3 1 15 3 3 6 1 1 118 PRUEBA SUPRESIÓN DEXAMETASONA IMPRONTA TOTAL 1 2 375 Tabla 38. Estudios de laboratorio realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012. Gráfica 20.Estudios de laboratorio realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012 119 ELISA PARVOVIRUS CANINO DISTEMPER CANINO LEUCEMIA VIRAL FELINA/SIDA FELINO BRUCELLA PVC/CORONAVIRUS/GIARDIA TOTAL (PVC) PARVOVIRUS CANINO CANTIDAD 9 12 9 5 1 36 Tabla 39. Estudios de ELISA realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012 Gráfica 21. Estudios de ELISA realizados en el periodo del 17 de septiembre al 15 de noviembre de 2012. 120 IMAGENOLOGÍA RAYOS X ESPECIE CANTIDAD CANINOS 112 FELINOS 9 CONEJO 1 COCODRILO 1 TOTAL 123 Tabla 40. Registros de estudios radiográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013. Gráfica 22. Registros de estudios radiográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013. REGIÓN PROYECTADA MIEMBRO TORÁCICO IZQUIERDO COLUMNA TÓRAX MIEMBRO PELVICO DERECHO ABDOMEN FALANGES MIEMBRO TORÁCICO DERECHO CADERA CUELLO CANTIDAD 13 6 40 9 31 1 5 8 3 121 CARA RODILLA MIEMBRO PÉLVICO IZQUIERDO CRANEO TOTAL 1 1 8 4 130 Tabla 41. Registros de regiones anatómicas proyectadas solicitadas durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013. Gráfica 23.Regiones anatómicas proyectadas solicitadas durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013. 122 ULTRASONIDOS ULTRASONIDOS REALIZADOS ABDOMEN ABDOMEN ABDOMEN ABDOMEN ABDOMEN DIGESTIVO RENAL DIAGNÓSTICO DE GESTACIÓN HEPATICO BAZO 5 4 5 2 3 Tabla 42. Estudios ultrasonográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013. Gráfica 24. Estudios ultrasonográficos realizados durante el periodo del 16 de noviembre de 2012 al 15 de enero de 2013. 123 DISCUSIÓN Durante la realización de mi servicio social titulación en el Hospital de Pequeñas Especies de la FESC, efectuando diversas actividades a través de las diferentes áreas que conforman el hospital En el área de cirugía como se puede observar en la tabla 11, durante el periodo del 15 de marzo al 11 de mayo de 2012, se realizaron 41 cirugías en total, donde la mayoría de los pacientes eran caninos ocupando un 88% de las cirugías realizadas (Gráfica1), con un total de 36 pacientes, esto es de relevancia, ya que nos muestra la importancia de los caninos como mascotas, siendo la especie que las personas eligen para este fin, los felinos ocupando el segundo lugar con 4 pacientes, siendo el 10% del total de las cirugías realizadas y solo a una mascota no convencional, un conejo (Oryctolagus cuniculus) se le realizó un procedimiento quirúrgico de ortopedia, . De las 41 cirugías que se realizaron, la tabla 12 nos indica que la mayoría (51%) fueron cirugías de tejidos blandos, realizándose 21 cirugías, 11 ortopedias y 7 cirugías de medicina preventiva, la tabla 13 nos muestra que la cantidad de cirugía de medicina preventiva fueron: Ooforosalpingohisterectomías 4, limpiezas dentales 4 y una orquiectomía; esto indica el interés por los propietarios por la salud de sus mascotas. En el caso de las cirugías como Ooforosalpingohisterectomías y orquiectomías la indicación primaria para la realización de cirugía reproductiva es limitar la reproducción. La Ooforosalpingohisterectomía de forma electiva se realiza comúnmente para prevenir ciclos estrales y gestaciones no deseadas. Esto es de suma importancia, pues indica que en la actualidad existe mayor interés y educación para evitar la sobrepoblación de dicha especie.35 Los beneficios adicionales que brindan incluyen la prevención de piómetra y neoplasias ováricas y uterinas. La incidencia de tumores mamarios reduce dramáticamente cuando los animales son esterilizados a corta edad. El riesgo de neoplasia mamaria es del 0.5% y 8% para perras esterilizadas antes de su primer y segundo estro, respectivamente. La OSH 124 se realiza de manera terapéutica en casos de piómetra, distocias cáncer uterino u ovárico, hiperplasia vaginal o prolapso.10, 35,39 Las razones más comunes para realizar la castración en perros es la prevención de problemas de conducta inducidos por hormonas, gestaciones no deseadas y tumores testiculares, los cuales ocurren en 29% de perros intactos, está indicada en casos de testículos traumatizados torcidos o infectados y para prevención y tratamiento de adenomas perianales, quistes prostáticos, prostatitis, hiperplasia prostática benigna, abscesos prostáticos y alopecia asociada a hormonas sexuales.35 En perros con hiperplasia prostática benigna, la próstata disminuye su tamaño en un 50% después de la tercera semana después de la castración, los signos clínicos se resuelven a los 2 o 3 meses. La resolución de adenomas perianales se ha reportado en un 95% en perros después de la castración. 34 Como se puede observar en la Tabla 14 del total de las 21 cirugías realizadas de tejidos blandos, el mayor número de estas se trataron de nodulectomías, desbridación de abscesos, hernia inguinal (Tabla 15), en segundo lugar se encuentran las cirugías relacionadas a aparato genitourinario. En cuanto a las 11 cirugías ortopédicas que se realizaron, 3 de ellas corresponden a osteosíntesis de fémur, en estos casos la reducción de la fractura se realizó por medio de clavo intramedular. Es el método más accesible al médico veterinario, y de bajo costo, que permite buenos resultados en general, el cual se ha seleccionado como base para osteosíntesis en huesos largos dentro de la cirugía ortopédica. Se menciona además que en pequeñas especies, el hueso que con mayor frecuencia se fractura es el fémur. La mayoría de estas fracturas no pueden ser tratadas mediante la reducción cerrada, debido a lo cual en ocasiones se selecciona la reducción abierta. La fractura debe estabilizarse para permitir una consolidación apropiada, los yesos o férulas no están recomendados para las fracturas femorales, porque es difícil estabilizar adecuadamente al fémur con estos métodos.30, 34,39 125 En segundo lugar de cirugías ortopédicas, se encuentra la sustitución extracapsular de ligamento cruzado anterior de rodilla, con 2 procedimientos quirúrgicos realizados. Estudios recientes sugieren que las razas caninas más activas pueden estar predispuestas a la ruptura del LCA. Las reconstrucciones extracapsulares comprenden la colocación de suturas afuera de la articulación mediante orificios perforados en el fémur y/o tibia, comprenden la colocación de suturas afuera de la articulación o redirección del ligamento colateral lateral.34,39 En menor proporción se encuentra la osteosíntesis de fractura de maxilar, retiro de clavo intramedular de miembro pelviano derecho, biopsia de hueso, osteosíntesis de fractura de tibia y fíbula, colocación de placa iliaca en pelvis y amputación de dedos IV y V, todas ellas con una intervención quirúrgica. La tabla 17 nos muestra que del total de cirugías se realizaron más intervenciones en hembras 59% que en machos 41% y como nos muestra la tabla 18, las razas más comunes en intervenciones quirúrgicas fueron, Mestizos o perros sin raza (6 pacientes), Labrador y Bóxer (con 4 pacientes cada uno). Durante mi rotación por el área de hospitalización que abarco del periodo del 14 de mayo al 13 julio del 2012, se hospitalizaron un total de 89 pacientes, de los cuales el 92% se trataron de pacientes caninos, el 7% de pacientes felinos (6 pacientes) y un hurón (Mustela putorius furo), como podemos observar en la Tabla 19, de los 89 pacientes, el 58% fueron pacientes machos. Y la raza que con más frecuencia se hospitalizó son los Mestizos o perros sin raza con un total de 15 pacientes, seguida de la raza Labrador que con un total de 7 pacientes fue la segunda raza más común, les siguen razas como Golden Retriever, Schnauzer (con 6 pacientes respectivamente), y razas como Bull Terrier Inglés y Chihuahueño ambos con 5 pacientes fueron también comunes. Durante este periodo la mayoría de los pacientes fueron llevados al hospital de caninos en general, el 21% se hospitalizó en el área de infecciosos debido a una enfermedad infectocontagiosa como Parvovirus canino, Distemper canino entre 126 otras, el motivo de hospitalización del total de los 89 pacientes fue 51 hospitalizados para realizarse algún procedimiento médico y 38 pacientes dado que se les realizó un procedimiento quirúrgico. A pesar de la introducción de nuevas vacunas, de la mejoría de su técnica y de nuevas modalidades diagnósticas/terapéuticas introducidas en la medicina veterinaria durante los últimos 15 años, la morbilidad asociada a las enfermedades infecciosas entre los animales de compañía todavía representan un número significativo de los animales remitidos a la consulta veterinaria. La complicación más que la prevalencia de las enfermedades infecciosas, es el hecho de que los organismos patógenos no son estáticos. El desarrollo de resistencia microbianas, aparición de nuevas cepas de virus y el aumento de susceptibilidad a la enfermedad infecciosa justifican la constante vigilancia de las infecciones clínicas y subclínicas.25, 37 Durante la realización de mi rotación por el área de medicina estuve a cargo de 37 consultas, las cuales la mayoría fueron pacientes caninos 97% y sólo un paciente felino. Lo que nos dice la preferencia de la población por mascotas caninas sobre otras como felinos o incluso mascotas no convencionales como hurones, conejos, tortugas etc. En cuanto a los pacientes caninos que recibí la mayoría fueron pacientes sin raza definida o mestizos, lo que demuestra que en la población canina la diversidad genética que pueden traer estos pacientes, seguidos por razas como el Golden Retriever, Schnauzer, Cocker Spaniel, Labrador y Chihuahueño. Esto también nos muestra información relevante de la Historia Clínica, ya que muchos de los padecimientos tienen predisposición genética. La mayoría de las consultas fueron para pacientes machos (65%).Se tuvieron más consultas en pacientes mayores de un año, siendo precisamente el año de edad la mayoría de consultas, en cuanto a pacientes menores del año de edad, la mayor parte de los pacientes que requirieron consulta, tenían dos meses de edad. 127 En cuanto al aparato o sistema afectado se tuvieron más consultas de digestivo en segundo lugar dermatológico y consultas de medicina preventiva, y sólo una de renal (urolitiasis).3, 33,37 Las enfermedades gastrointestinales agudas pueden ser controladas de acuerdo a la semiología que se esté presentando. Las causas de estos problemas pueden ser muy variadas e incluir a la dieta (mala calidad, digestibilidad, etc.), problemas infecciosos como parasitarios, virales y bacterianos.12, 33 Las etiologías más frecuentes abarcan gastroenteritis infecciosas por parásitos gastrointestinales especies tales como helmintos y protozoarios; causas víricas como Parvovirus Canino, Coronavirus, Distemper Canino, intolerancia o alergia alimentaria, cambios bruscos de dieta (diarrea de tipo osmótica). Los signos en una enteritis infecciosa son variables y similares a los de una enteritis no infecciosa; no existen signos patognomónicos indicativos de trastornos infecciosos específicos. Dentro del manejo de los pacientes gastroentéricos, debemos de incluir el control de los signos clínicos como el uso de terapia de fluidos, analgésicos y antiespasmódicos, el uso de antimicrobianos, antiparasitarios y cambios de dieta.5, 25 En cuanto problemas dermatológicos, 12 consultas las enfermedades que más se presentaron fueron piodermas y dermatofitosis, otras enfermedades que se presentaron fueron quiste seroso, lipomas, sarna demodécica, carcinoma de células escamosas, se recibió una consulta en un canino con una neoplasia en piel, el cual se le indicó al propietario la necesidad de realizar pruebas complementarias para poder determinar el tipo de neoplasia del cual se trataba, a lo que le propietario se rehusó a realizarle dichas pruebas que eran Punción con aguja fina, principalmente por problemas económicos, no se realizaron las pruebas, y no se pudo llegar al diagnóstico definitivo. Los tratamientos que se manejan en dermatología van desde el control alimenticio, como tratamientos sistémicos (antibióticos, corticoides como antipruriginosos y ácidos grasos omega 3-6, antimicóticos) y tópicos (baños con componentes restauradores de piel y 128 medicados con Amitraz, geles, ungüentos, pomadas como hidratantes y estimulantes del sistema de defensa).1, 5,33 De las 51 consultas recibidas, 10 de estas fueron para medicina preventiva, en especial desparasitaciones y vacunaciones, esto nos indica la preocupación por los propietarios de que sus mascotas estén protegidos, ya que con estas medidas se previenen enfermedades infecciosas, esto relacionado a las consultas que se recibieron en cuanto a sistema digestivo, donde el 25% de estas se trataron de gastroenteritis infecciosa de origen viral por Parvovirus canino en cachorros promedio de dos meses de edad. Otra enfermedad común que se presentó fue gastroenteritis infecciosa parasitaria por Giardia, ambas enfermedades se previenen con una correcta vacunación y desparasitación, lo que trae beneficios para los propietarios a largo plazo y trae más beneficios que costos. Así mismo se recibieron dos pacientes con enfermedad periodontal progresiva, enfermedad que puede provocar enfermedades incluso sistémicas. Para retardar la recurrencia de placa y acumulación de cálculos se les hace a los propietarios la recomendación del cepillado diario, y en su caso la indicación de la exfoliación anual o semestral3, el mayor temor de muchos propietarios son las complicaciones de la anestesia, pero si el procedimiento se efectúa apropiadamente las complicaciones son mínimas. Para llegar al diagnóstico de las enfermedades se recurrió pruebas complementarias donde el Hemograma, Química sanguínea y las pruebas de ELISA fueron las principales, en segundo lugar pruebas como Urianálisis, Panel Dermatológico (Raspado cutáneo, Tricografía, Prueba de acetato), fueron también de importancia, este último debido al número de consultas dermatológicas. Las pruebas que se realizaron solo una vez fueron la colonoscopía, biopsia y la electromiografía, ésta última se contó con el apoyo del electromiógrafo del laboratorio de Fisiología General de la FESC. 129 En el área de laboratorio clínico en el periodo del 17 de septiembre al 15 de noviembre de 2012, se recibieron muestras de 263 pacientes, esto nos demuestra la importancia de las pruebas de laboratorio en el diagnóstico, incluso en mascotas no convencionales como el hurón (Mustela putorius furo) y tortuga. La edad es un factor importante la mayoría de las muestras eran de pacientes mayores de un año (Gráfica 18), donde la mayor cantidad de muestras eran de pacientes de 3 y 8 años, en segundo lugar pacientes de 10 años, en tercer lugar pacientes de dos años. De los 263 pacientes se realizaron 375 estudios de laboratorio, en primer lugar encontramos el hemograma con 141 estudios realizados, como lo mencionan varios autores la biometría hemática es uno de los estudios realizados que con más frecuencia se solicitan al laboratorio, tanto en los pacientes ambulatorios como en los hospitalizados, así mismo es el primer examen al que se enfrenta el clínico en la valoración diagnóstica de un paciente. Aunque se considera como un solo examen de laboratorio, se valoran tres líneas celulares, cada una con funciones diferentes entre sí, pero que comparten un origen común, la médula ósea: eritrocitos, leucocitos y plaquetas. 25,36 Las bioquímicas sanguíneas se encuentran como el segundo estudio más solicitado. El estudio de química sanguínea sirve para medir en el suero los elementos disueltos. Que en condiciones normales deben mantenerse en un rango determinado gracias a la homeostasis. Cualquier alteración en los valores resultantes comparados con el rango normal corresponde a una alteración que deberá ser identificada e interpretada. La punciones o aspirados tisulares con aguja fina se encuentra como tercer estudio más solicitado, esto es de importancia ya que indica que es aplicado en forma activa como una herramienta de utilidad diagnóstica en medicina veterinaria, el examen microscópico de un espécimen citológico es un método sencillo y de costo eficiente en medicina veterinaria.19 130 Parte importante de las pruebas de diagnóstico son las pruebas de ELISA, ya que son pruebas rápidas, donde se puede determinar si el animal tiene una enfermedad infecciosa, como podemos observar en la tabla 39, se realizaron 36 estudios, donde la prueba más empleada fue la de Distemper canino, seguida de Parvovirus canino y Leucemia Viral Felina/ SIDA felino. En el periodo comprendido del 16 de noviembre de 2012 al 15 de enero de 2013, en el área de Imagenología se recibieron 123 pacientes, a los cuales se les realizaron 130 estudios radiográficos (Tabla 40). El 91% de los pacientes fueron caninos (112 pacientes), 9 pacientes felinos (7%), un paciente conejo (Oryctolagus cuniculus) y un paciente cocodrilo (Crocodylus acutus). Al obtener información acerca de cuál fue la región a la que más estudios radiográficos se les realizaron, obtenemos información valiosa, en este periodo fue tórax y en segundo lugar abdomen, esto nos orienta acerca de la casuística del Hospital, en cuanto a las radiografías abdominales los pacientes son afectados del aparato digestivo y como se puede apreciar en la Tabla 33, la mayoría de las consultas son de trastornos digestivos, en cuanto a radiografías de tórax podría deberse a problemas respiratorios o cardiacos. Las enfermedades respiratorias constituyen un problema clínico, frecuente en la práctica veterinaria de pequeños animales, de los problemas respiratorios en el Hospital se encuentra más frecuente la Traqueobronquitis infecciosa. Respecto a enfermedades cardiacas son relativamente frecuentes en perros y gatos, las más diagnosticadas en el hospital, son Insuficiencia Cardiaca Congestiva Izquierda Y Derecha. Los beneficios que la sociedad obtiene con el funcionamiento del Hospital de Pequeñas Especies de la FESC, son numerosas, ya que además de que se trata de un Hospital con instalaciones y equipo de primer mundo, donde se realizan todos los procesos necesarios para el cuidado y preservación de la salud animal, a precios bastante accesibles para la comunidad que cuente con mascotas, además 131 de que se brindan asesorías sobre el cuidado de sus mascotas, preservando no solo la salud animal, sino también la humana, ya que muchas enfermedades son de tipo zoonóticas, es decir transmisibles al hombre, lo cual da un beneficio directo a la comunidad. CONCLUSIONES Durante la realización de mi servicio social titulación en el HEMyCPE de la FESC, a lo largo de un año, cumplí con los objetivos planteados, participe de forma activa en todas las áreas del Hospital, donde pude llevar a la práctica conocimientos adquiridos en la licenciatura, así como obtener nuevos, desarrollar mayor destreza en el manejo, cuidado de los animales y realización de procedimientos médicos y quirúrgicos; así como en la elaboración de exámenes físicos y métodos de diagnóstico, desarrollar una gran cantidad de actividades que se llevan a cabo en la práctica profesional, esto me ha motivado a seguir con mi desarrollo profesional en el área de la clínica de pequeñas especies. Siendo que a lo largo de los últimos años, se ha observado un incremento del interés de las personas hacia la salud y bienestar de las mascotas, por tal motivo el Médico Veterinario tiene la responsabilidad de mantenerse preparado para lograr el bienestar animal y social. La actividad hospitalaria en medicina veterinaria cobra una gran importancia para la carrera, ya que los procedimientos realizados en las distintas áreas son un potencial para el desarrollo de la capacitación en la medicina de perros y gatos, debido a que forman parte de la profesionalización en las pequeñas especies e integran parte de la medicina de vanguardia a nivel mundial, más aun, porque son un pilar importante en la generación de conocimiento en instituciones. Mi estancia en el Hospital definitivamente cumplió todas mis expectativas; ya que se me permitió desarrollar habilidades con las que no contaba, así mismo me surgieron nuevos objetivos, ya que el dedicarse a las pequeñas especies requiere 132 de médicos altamente preparados y dedicados, un ejemplo de esto son los médicos que laboran en el Hospital de Pequeñas Especies.. Me permitió adquirir nuevos conocimientos y complementar los obtenidos en la licenciatura, esto gracias a que los médicos responsables en turno de las diferentes áreas y el responsable del programa se encargaron de enriquecer mi preparación y de acuerdo a su experiencia laboral y conocimientos, se me permitió aportar mi opinión en los diferentes casos que se presentaron, esto con el único objetivo de llegar a un diagnóstico y tratamiento correcto, mediante la integración de todo lo aprendido. El programa de Servicio Social Titulación me parece una excelente herramienta para los estudiantes de Medicina Veterinaria que se quieran dedicar a las pequeñas especies, es además una excelente opción de titulación porque te brinda un panorama del desarrollo de la práctica médica en la vida profesional. RECOMENDACIONES Y SUGERENCIAS En un Hospital Veterinarios se tiene como principal objetivo el brindar atención médica destinada a la prevención, curación o rehabilitación de las mascotas, que por diversas razones encuentren comprometida su salud, y así reincorporarlas a su función zootécnica. Es por esto que recomiendo la capacitación de los integrantes de servicio social, servicio social titulación y prácticas profesionales, ya que en las diferentes áreas, se cuenta con equipo o aparatos, los cuales necesitan ser utilizados y manejados de forma correcta para optimizar el manejo médico que se realiza. Una molestia común por parte de los propietarios, es el prolongado tiempo de consulta, por lo cual recomendaría aumentar el personal, tanto de académicos que apoyan en las diferentes áreas, como los estudiantes que se encuentran realizando servicio social, prácticas profesionales e incluso como voluntarios, para 133 poder optimizar tiempos, trabajando en equipo, para disminuir un poco la carga de trabajo. Se debe mejorar la comunicación y organización entre las diferentes áreas, para brindar un mejor servicio a los clientes, ya que algunas veces entre los propios compañeros no existe una buena coordinación acerca de las actividades que se deben realizar en las áreas del hospital; así mismo considero que se debe unificar criterios entre los médicos respecto a ciertos tratamientos y manejos médicos. Referente al aspecto académico sugiero que se aumenten las clases, cursos y asesorías dentro de las instalaciones del Hospital, ya que fueron una buena herramienta durante la realización de mi servicio social titulación, y ayudó a reforzar los conocimientos adquiridos en la licenciatura. También recomiendo que se apoye a los alumnos mediante becas para la participación en cursos y congresos veterinarios nacionales e internacionales, como incentivo para la preparación del Médico Veterinario, así mismo se deberían aumentar los cursos veterinarios y congresos dentro de las instalaciones, para dar mayor difusión al Hospital de Pequeñas Especies de la FESC. 134 BIBLIOGRAFÍA 1. Aiden F. Manual de Dermatología en Pequeños Animales y exóticos. BSAVA. Barcelona. 2013. 2. Anónimo. Instituciones económicas y sociales. La labor desarrollada en la Escuela Nacional de Medicina Veterinaria en el año escolar de 1918. Revista Agrícola. Tomo IV p: 131-134 3. Anónimo. La creación de la Escuela Nacional de Veterinaria, Revista Agrícola. Tomo I. 4. Bonagura J. D. Terapéutica veterinaria de pequeños animales. XIII Edición. Mc Graw-Hill Interamericana de España, S.A.V. Vol. I y II. 2001. 5. NOM -157 – SSA1. Protección y Seguridad Radiológica en el Diagnóstico Médico con Rayos X. Diario Oficial de la Federación. México 1996. 6. Payró J. L, Gutiérrez C. A. Diplomado en Medicina, Cirugía y Zootecnia en Perros y Gatos. Módulo 13 Unidad Zootécnica General. Primera edición. UNAM, México 1997. 7. Dunn J. K. Textbook of Small Animal Medicine. Ed. W. B. Saunders. U.K. 2000. 8. Fritsch R., Gerwing M. Ecografía de perros y gatos. Editorial Acribia. España. 9. Hoad J. Minor Veterinary Surgery A Handbook for Veterinary Nurses. First edition. Elsevier. 2006. 10. Hudson, J. A. Abdominal Radiology for the Small Animal Practitioner. Ed. Teton NewMedia. 2002. 11. Jack C. M., Watson P. M. Guía de medicina veterinaria canina y felina. 2ª. Edición. Mc Graw-Hill. 2005. 12. Latimer K. S., Mahaffey E. A., Prasse K. W. Duncan & Prasse´s Patología Clínica Veterinaria. 4ª edición. Editorial Multi-Médica. Barcelona. 2005. 13. Manteca, J. (2003): Etología Clínica Veterinaria del Perro y del Gato. Multimédica Ediciones Veterinarias. 3ª Edición 14. Birchard, SJ. Sherdin, RG. Manual Clínico de Procedimientos en Pequeñas Especies. Segunda edición. Ed. Mc Graw Hill, 2000. 15. Manzo RM. Examen Físico en Perros y Gatos. (Tesis de Licenciatura). Veracruz. México. 16. Martínez HM., Lloréns P.P. Radiología veterinaria de pequeños animales 1° ed. Madrid España: Interamericana Mc Graw – Hill. 1992. 135 17. Méndez AR. Principios de interpretación radiográfica. Tema 8 de la signatura de Imagenología Veterinaria. Facultad de Medicina Veterinaria y Zootecnia UNAM 18. Meyer & Harvey. El Laboratorio En Medicina Veterinaria Interpretación y Diagnóstico. Segunda Edición, Editorial Inter-Médica. 19. O’Brien RT. Thoracic Radiology for the Small Animal Practitioner. First edition. Teton NewMedia. 2000. 20. Pedrosa CS, Gómez CR. Tratado de radiología clínica Vol.1. 2° ed. Madrid España: Interamericana Mc Graw – Hill, 1997. 21. Radostits, O. M., I.G. Mayhew, D. M. Houston. Examen y Diagnóstico Clínico en Veterinaria. Editorial Elsevier. Madrid 2002. 22. Ramsey IK. Manual de Enfermedades Infecciosas en Pequeños Animales. BSAVA. Barcelona. 2013. 23. Román de Carlos A.M. Historia de la Medicina Veterinaria. Biblioteca FMVZUNAM. 1998 24. Rubin A., Carr A. P. Canine Internal Medicine Secrets. Editorial MOSBY Elsevier. USA 2007. 25. Rubin IS., A. Carr. Canine Internal Medicine Secrets. Ed. Mosby. USA.2007 26. Schaer M. Medicina clínica del perro y el gato. Ed. Masson Elsevier. Barcelona.2006. 27. Slatter, D. Manual de cirugía en pequeñas especies. Editorial McGraw Hill, Interamericana 1997. 28. Tams TR. Handbook of small animal gastroenterology. 2a. Edición. Saunders. 2006. 29. Thrall D.E. Manual de radiodiagnóstico veterinario. 4° ed. Madrid España: Elsevier, 2003. 30. Tiller P.L., Smith W. K. La consulta veterinaria en 5 minutos canina y felina. 4ª edición. Editorial Inter-Médica, Argentina, 2008. 31. Tista OC. Fundamentos de Cirugía. Fascículos de Cirugía. FMVZ-UNAM. México.2002 32. Tobias, KM. Manual of Small Animal Soft Tissue Surgery. First edition. WileyBlackwell. USA. 2010. 33. Villers E, L. Blackwood. Manual de Diagnóstico de Laboratorio. Editorial BSAVA, España, 2013. 136 34. W. Nelson, R. & Couto, G. Manual of Small Animal Internal Medicine. 2a edición. Editorial Elsevier Mosby 2005. 35. Walker P. J. Aspectos Relevantes del Examen Físico en Perros (Canis familiaris). (Tesis de licenciatura). Morelia Michoacán. México. Universidad Michoacana de San Nicolás de Hidalgo. 2007. 36. Welch F. T. Cirugía En Pequeños Animales. Editorial Inter-Médica. Argentina 1999. 137 ANEXOS FORMATO 1. Expediente clínico 138 139 140 141 FORMATO 2. Orden Clínica 142 Formato 3. Orden Terapéutica 143 Formato 4. Hoja de Progreso 144 Formato 5. Autorización de Hospitalización 145 Formato 6. Autorización para procedimientos quirúrgicos. 146 Formato 7. Calendario de Vacunación 147 Formato 8. Solicitud de Estudio de Radiográfico 148 Formato 9. Carta Técnica de Estudios Radiográficos 149 Formato 10. Solicitud de Estudio Ultrasonográfico 150 Formato 11. Hoja de Dermatología 151 Formato 12. Autorización de Servicio de Endoscopía 152 Formato 13. Solicitud de Estudio de Laboratorio 153 154 Formato 14. Resultados Estudios de Hemograma 155 Formato 15. Resultados Estudios de Urianálisis 156 Formato 16. Resultado de Bioquímica Sanguínea Perfil Básico emitido por Laboratorios QUIMILABCO.VET 157 Formato 17. Solicitud de Estudio Histopatológico 158 Formato 18. Reporte Electrocardiográfico 159 MASTOCITOMA GRADO I EN UN PACIENTE CANINO DE ONCE AÑOS. REPORTE DE CASO CLÍNICO 160 ÍNDICE DE CONTENIDO 1. 2. 3. 4. 5. 6. 7. 8. INTRODUCCIÓN INCIDENCIA RESEÑA ETIOLOGÍA PRESENTACIÓN Y SIGNOS CLÍNICOS ESTADIFICACIÓN DIAGNÓSTICO PRONÓSTICO 8.1Grado tumoral 8.2Márgenes quirúrgicos 8.3Residencia tumoral 8.4Tumores múltiples 8.5 Estadificación tumoral 8.6Medición de la proliferación tumoral 9. TRATAMIENTO 9.1 Tratamiento quirúrgico 9.2 Terapia radiante 9.3 Terapias locales 9.4 Nuevas terapias 9.5 Terapia auxiliar 9.6 Inmunoterapia 9.7 Tratamientos sistémicos 9.8 Quimioterapia 10. CASO CLÍNICO a) Reseña b) Motivo de Consulta c) Historia Clínica d) Examen Físico e) Diagnósticos Diferenciales f) Plan Diagnóstico g) Plan Terapéutico 11. DISCUSIÓN 12. BIBLIOGRAFÍA PÁGINA 163 165 165 165 166 168 169 174 175 177 178 178 179 180 181 182 183 184 184 185 186 187 188 190 191 192 192 193 195 195 197 207 209 161 ÍNDICE DE FIGURAS PÁGINA Figura 1. Representación esquemática de un mastocito……………………………..…….164 Figura 2. Acción de los mastocitos………………………………………………………...….164 Figura 3. Degranulación de mastocito……………………………………………………...…170 Figura 4. Paciente canino, hembra, Schnauzer, “SALPI”……………………………..……191 Figura 5. Nodulación en miembro posterior izquierdo………………………………………192 Figura 6. Nodulación de 6 cm de diámetro aproximadamente, a nivel de los metatarsos y abarcando la articulación metatarsofalangeana……………………………………….…….194 Figura 7. Nodulación de 6 cm de diámetro aproximadamente, a nivel de los metatarsos y abarcando la articulación metatarsofalangeana………………………………………...…...194 Figura 8. Toma radiográfica lateral de miembro posterior izquierdo……………………....196 Figura 9. Toma radiográfica dorso-plantar de miembro posterior izquierdo…………..….197 Figura 10. Estudio Citológico de la nodulación en miembro pelviano izquierdo 100X (H&E)………...………………………………………………………………………………..….198 Figura 11. Citología de la nodulación. (100x, H&E)………………………………………....199 Figura 12. Estudio citológico de nodulación en parte ventral del cuello. (100x H&E)…..201 Figura 13. Estudio citológico “Quiste Epidermoide”, realizado 27 de abril de 2012. (100X H&E)…………………………………………………………………………………………..…..201 Figura 14. Estudio radiográfico lateral de tórax…………………………………………...…203 Figura 15. Estudio radiográfico ventro-dorsal de tórax…………………………………..….204 Figura 16. Estudio ultrasonográfico (hígado)……………………………………….………..205 Figura 17. Estudio ultrasonográfico…………………………………………………….……..205 Figura 18. Lesiones circulares hipoecoicas en lóbulo hepático……………………….…..206 Figura 19. Inflamación de la mucosa del estómago asociado a síndrome paraneoplásico del Mastocitoma…………………………………………………………………………….…..206 ÍNDICE DE TABLAS PÁGINA Tabla 1. Esquema de estadificación para los Tumores de Células Cebadas…………….109 Tabla 2. Esquema de graduación de Patnaik para los Mastocitomas…………………….176 Tabla 3. Criterio de clasificación del mastocitoma según la Organización Mundial de la Salud…………………………………………………………………………………………..….180 Tabla 4. Esquema de tratamiento para Tumor de Células Cebadas en perros……….…182 162 1. INTRODUCCIÓN Las células cebadas (“mastocitos”) normales derivan del tejido hematopoyético y conectivo. Se encuentran a través de todo el cuerpo en residencia perivascular, de manera particular en piel y tejido subcutáneo, parénquima pulmonar, conducto digestivo e hígado, donde cumplen un rol integral en las reacciones alérgicas y procesos inflamatorios. Las células cebadas se presentan en ocasiones en médula ósea y casi nunca en la circulación sistémica.14 Las células cebadas juegan un papel importante en la iniciación de la respuesta inmune, interviniendo en la migración y activación de neutrófilos, así como en reacciones de hipersensibilidad. Las células cebadas maduras presentan gránulos citoplasmáticos que contienen mediadores bioactivos. En su membrana, las células cebadas maduras presentan inmunoglobulina E (IgE) que se encuentra unida a un receptor de membrana. Cuando las IgE presenta uniones entrecruzadas causan la liberación de mediadores bioactivos contenidos dentro de los gránulos citoplasmáticos, que incluyen histamina, heparina, proteasas, leukotrienos y citoquinas como factor de necrosis tumoral alfa (TNF-α) e interleucinas (IL4, IL5 y IL6), induciendo un incremento de la permeabilidad vascular, vasodilatación, espasmo muscular, prurito, anticoagulación y activación de eosinófilos y neutrófilos; que en conjunto causan reacciones de hipersensibilidad localizadas y en casos severos reacciones de hipersensibilidad sistémica con la resultante vasodilatación, estasis sanguínea y edema. La histamina produce atracción quimiotáctica de eosinófilos, los cuales la neutralizan.2, 9,14 163 Figura 1. Representación esquemática de un mastocito. 24 Figura 2. Acción de los mastocitos. 25 Tumor de células cebadas cutáneo Considerando su comportamiento biológico impredecible, se prefiere la denominación “Tumores de Mastocitos” en lugar de “Mastocitoma” o “Sarcoma de Mastocitos”, (MCT Masto Cella Tumor).23 164 2. INCIDENCIA En los perros, el mastocitoma por lo común reside en el tejido cutáneo y subcutáneo, son tumores comunes de la piel (16-21% de los tumores cutáneos).1, 2, 9, 14, 15,19. En la mayoría de los casos son solitarios, pero cerca del 6% de los casos, la distribución es múltiple.1, 2 3. RESEÑA El Mastocitoma suele presentarse en perros gerontes (8.2 a los 10.5 años, edad promedio 9 años), sin embargo, pueden afectarse perros de apenas 6 meses, sin predilección sexual. 1, 2, 9, 14,19. Se presenta más en razas Braquicefálicas como Bóxer, Staffordshire Bull Terrier, Labrador, Golden Retriever, Weimeraner, Beagle, Schnauzer, Boston Terrier y Shar-pei.9 14 El Bóxer, Ridgeback Rhodesian, Pug, Boston Terrier, Pitbull Terrier y Weimaraner tienen riesgo aumentado (4 a 8 veces más riesgo que la población general), para el desarrollo de Mastocitoma. El Bóxer, Pug y Weimaraner muestran mayor tendencia al Mastocitoma múltiple que otras razas. Los Tumores de Células Cebadas o Mastocitomas en razas derivadas del Bulldog, como Bóxer y Pug y tal vez Golden Retriever, por lo usual son de menor grado microscópico (bien diferenciados), que en otras razas. El Shar-Pei, sobre todo los ejemplares jóvenes es escasamente diferenciado y de comportamiento biológico agresivo.1, 9 4. ETIOLOGÍA La causa es desconocida; sin embargo pueden ser de importancia la predisposición racial, la inflamación crónica y los virus. Se tienen informes que los sitios de inflamación crónica en perros pueden dar lugar a Mastocitomas.3 165 Alteraciones genéticas en la expresión del c-kit (receptor de membrana de células precursoras), capaz de provocar crecimiento de las células, y normalmente expresado en células hematopoyéticas y células cebadas, se han visto en algunos perros con Mastocitomas, y la expresión no regulada de c-kit puede contribuir al desarrollo de Mastocitomas.10 Estudios recientes encontraron que las mutaciones en el protooncogen c-kit pueden correlacionarse con un grado microscópico superior y posibilidades abiertas para las estrategias terapéuticas. Las mutaciones del c-kit también se pueden aprovechar para diferenciar entre Mastocitoma muy escasamente diferenciado y la variedad no granulada del linfoma.8, 9,11 5. PRESENTACIÓN Y SIGNOS CLÍNICOS En el perro es poco habitual identificar Mastocitoma sin afectación tegumentaria. Los Mastocitomas son muy variables en apariencia, y su aspecto clínico no permite predecir malignidad o comportamiento. El Mastocitoma es uno de los 5 tumores cutáneos principales, que aparecen como inocentes tumores de grasa, o como verrugas de base ancha y gruesa; pueden simular a la mayoría de las lesiones tegumentarias primarias y secundarias, incluyendo máculas, pápulas, nódulos, tumores y costras.12,14 La mayoría de los Mastocitomas cutáneos se presentan como nódulos intracutáneos, con un diámetro de 10 o más cm. Algunos causan ulceración de la epidermis superpuesta; otros son nódulos eritematosos, elevados, solitarios o múltiples, con alopecia de la piel superpuesta. Suelen originarse en la dermis y con frecuencia se extienden hacia el tejido subcutáneo y musculatura subyacente (la extensión suele ser más frecuente con las neoplasias de crecimiento rápido).9 Los perros con Mastocitomas por lo común son evaluados debido a una tumefacción difusa (edema e inflamación alrededor del tumor primario o su lesión metastásica), eritema o magullamiento del área lesional. Estos episodios pueden ser agudos, y ocurrir durante o brevemente después de la actividad física. Muchos Mastocitomas se presentan con edema local asociado, prurito y hemorragia. 15, 21 166 Los Mastocitomas cutáneos bien diferenciados, tienden a ser de crecimiento lento, alopécicos, son lesiones solitarias y puede estar presente por meses.18 Los Mastocitomas pobremente diferenciados, tienden a un rápido crecimiento, ulcerados y son lesiones pruríticas, con lesiones satelitales pequeñas cercanas. Puede haber evidencia de linfadenopatopatía local u organomegalia en la palpación abdominal.12 Algunos mastocitomas existen durante meses o años, antes de exhibir diseminación acelerada; otros se comportan de forma agresiva desde el comienzo. Aproximadamente el 30% son agresivos, rápidamente hacen metástasis a la piel adyacente, al drenaje linfático y a órganos distantes, en particular hígado, bazo y médula ósea.13, 15 Por lo común, los Mastocitomas residen en los miembros, la piel abdominal y torácica. Son menos habituales alrededor del rabo y lomo. Algunos Mastocitomas aparecen con rapidez en la cara, pies, axilas, que parecen picaduras de insectos. Aproximadamente el 50% de los tumores se localizan en el tronco y perineo, 40% en las extremidades y 10% en cabeza y región cervical. Alrededor del 6% de los casos son mastocitomas múltiples.1, 3 Los Mastocitomas primarios pueden ocurrir en otros tejidos: conjuntiva, tejido conectivo o tracto gastrointestinal. Los Mastocitomas no cutáneos son raros con un comportamiento biológico diferente.6 Otra característica biológica de los Mastocitomas caninos es que pueden volverse sistémicos, comportándose como una condición hematopoyética maligna. Estos perros por lo usual tienen antecedentes de un Mastocitoma cutáneo que ha sido escindido. La mayor parte de los pacientes con enfermedad de células cebadas sistémica (ECCS) son evaluados debido a letargia, anorexia, vómito y pérdida ponderal de peso, en asociación con esplenomegalia, hepatomegalia, palidez de mucosas, anemia y en ocasiones, masas cutáneas detectables.15 Los signos clínicos reflejan la extensión sistémica de la enfermedad, así como la presencia de signos desarrollados por la liberación de histamina, heparina y otras 167 sustancias vasoactivas. Algunos casos presentan signos gastrointestinales como anorexia, náusea, vómito, diarrea, melena, dolor abdominal y anemia microcítica e hipocrómica, causados por una hiperhistaminemia que estimula a los receptores H2 de las células parietales en estómago, causando una hipersecreción de ácido clorhídrico, además aumenta la motilidad gastrointestinal y la permeabilidad capilar que provocan una trombosis intravascular con una ulceración de la mucosa subsecuente. Otros desórdenes causados por la liberación de histamina, heparina y otras sustancias vasoactivas son inflamación peritumoral, hemorragia local prolongada y retraso de la cicatrización.16 Otros efectos sistémicos poco usuales incluyen colapso, hipotensión y dificultad respiratoria.21 Los Mastocitomas tienen gránulos intracitoplasmáticos que contienen sustancias vasoactivas (ejemplo proteasas, citocinas, heparina e histamina), estos gránulos metacromáticos pueden degranular en ocasiones, debido a la manipulación mecánica, durante el examen de estos tumores, que produce eritema y formación de ronchas. Este fenómeno (signo de Darier) se ha observado en caninos y felinos, y se considera de importancia diagnóstica. El mastocitoma puede crecer y contraerse con celeridad.3, El propietario puede comentar que el tumor se agranda de repente y luego disminuye de tamaño, durante un periodo de casi 24 horas. Este antecedente debería aumentar la sospecha de Mastocitoma.15 6. ESTADIFICACIÓN Todos los perros con Mastocitoma deben ser estadificados para determinar el alcance de su enfermedad. Esto es de especial importancia en los pacientes donde se considera la cirugía agresiva, como amputación o terapia radiante. El esquema de estadificación vigente. 168 ESTADIO 0 1 2 3 4 DESCRIPCIÓN Neoplasia escindida en forma incompleta (a enfermedad microscópica), sin afectación de ganglios linfáticos regionales. Neoplasia confinada a la dermis sin afectación de linfonodos regionales Neoplasia confinada a la dermis con afectación de linfonodos regionales. Múltiples neoplasias dérmicas o grandes infiltrativas con afectación de linfonodos regionales o sin ella. Cualquier neoplasia con metástasis distantes o afectación sistémica. Tabla 1. Esquema de estadificación para los Tumores de Células Cebadas. Ogilvie G.K., Moore A. S., Manejo del Paciente Canino Oncológico. Buenos Aires (Argentina). Intermédica, 2008, pp 815. 7. DIAGNÓSTICO La apariencia clínica del Mastocitoma canino es muy variable, pero el examen citológico de un aspirado de la neoplasia es un método sencillo y generalmente es suficiente para realizar el diagnóstico previo a la cirugía. Los hallazgos citológicos consisten en encontrar una población monomórfica de células redondas a poligonales, con citoplasma rosa pálido y con la presencia de gránulos intracitoplasmáticos azules o púrpuras (basofílicos), con manchas metacromáticas con tinción de Hematoxilina y Eosina (Figura 3). Con frecuencia se encuentran presentes eosinófilos y en ocasiones se puede observar la presencia de fibroblastos, debido a la liberación de factores quimiotácticos contenidos en los gránulos de las células cebadas.1, 12, 13,14 En algunos casos, cuando las tinciones tipo Diff-Quik son utilizadas, los gránulos no son teñidos adecuadamente, esto es importante en ser considerado, ya que el encontrar en un aspirado de un tumor cutáneo/subcutáneo la presencia de células redondas sin gránulos, pero que tengan semejanza a células cebadas, es recomendado realizar tinciones de Giemsa o Wright para evidenciar los gránulos y establecer el diagnóstico. Además en el caso de mastocitomas pobremente diferenciados pueden presentar pocos gránulos pequeños pobremente teñidos o incluso, no presentarlos.13, 14 169 El diagnóstico de los Mastocitomas a menudo se establece con la citología de la aspiración con aguja fina, pero la biopsia escisional es necesaria para la graduación microscópica exacta. La ACAF (Aspiración Citológica con Aguja Fina), no reemplaza a la Histopatología cuando se trata de predecir el comportamiento biológico. La graduación histopatológica se ha correlacionado con la recurrencia y sobrevida. Figura 3. Degranulación de mastocito (H&E, 100X) Morris J., Dobson J. Small Animal Oncology. Primera edición. Blackwell Science. USA. 2001 Los nódulos linfáticos regionales deben de ser evaluados cuidadosamente y ser aspirados en el caso de ser palpables (aunque se consideren de tamaño normal). Debido a que es normal la presencia ocasional de células cebadas en nódulos linfáticos normales o reactivos, se debe de tener cautela en la determinación de metástasis; generalmente las células cebadas malignas en los nódulos linfáticos tienden a presentarse en agregados y no como células únicas aisladas. Si existe la sospecha de metástasis, es recomendable remover quirúrgicamente el nódulo linfático en cuestión para ser evaluado histopatológicamente.1, 5,17 Estos tumores pueden elaborar sustancias bioactivas que desencadenan edema, eritema o magullamiento del área afectada. La ulceración gastrointestinal también puede ocurrir como resultado de la hiperhistaminemia (aproximadamente el 80% 170 de los perros sacrificados debido a mastocitomas avanzados tienen ulceración gastroduodenal). En consecuencia, todo paciente canino con Mastocitoma debería ser estudiado por sangre oculta fecal. El sangrado intra y posoperatorio profuso y el retardo cicatrizal se verifican en algunos casos como una consecuencia de las sustancias bioactivas liberadas desde las células cebadas5, 14, 17,22 Para establecer el estadio de un paciente canino con Mastocitoma cutáneo, se debe considerar lo siguiente: Historia clínica, exploración física, citología tumoral y de médula ósea y radiografías.14 HISTORIA CLÍNICA Permite saber durante cuánto tiempo ha estado presente la masa y la velocidad con que ésta crece. EXPLORACIÓN FÍSICA Una exploración física completa puede determinar la localización y el número de neoplasmas y de los linfonodos de drenaje; además se debe realizar palpación abdominal, radiología o ecografía para determinar si existe hepatoesplenomegalia. Si se detecta linfadenopatía, hepatomegalia o esplenomegalia, deberá realizarse un Aspirado Citológico con Aguja Fina del linfonodo o del órgano afectado, para detectar tumores metastásicos o mastocitosis sistémica.23 HEMOGRAMA COMPLETO: Puede revelar anemia o desviación a la izquierda sugestivos de sangrado o perforación gastrointestinal, respectivamente. Cualquiera de las dos puede ser el resultado de la liberación de histamina crónica desde el Mastocitoma. En los pacientes con mastocitosis sistémica es frecuente encontrar neutrofilia, que puede resultar de la inflamación por el tumor primario, debido a la producción de citosinas por los mastocitomas. En ocasiones también presentan eosinofilia y basofilia 171 periféricas, asociadas con la producción de IL5 generada por los mastocitos, además de grandes cantidades de células cebadas circulantes.23 ASPIRACIÓN DE LINFONODOS: En presencia de linfadenopatía se indica la Aspiración Citológica con Aguja Fina del linfonodo afectado. La presencia de acúmulos de células cebadas (y eosinófilos) señala que el Mastocitoma ya no está confinado a la residencia primaria. Las células cebadas pueden infiltrar un linfonodo regional en un perro con mastocitoma, como respuesta inflamatoria frente al tumor; en consecuencia, un resultado citológico sospechoso se debería confirmar con biopsia. 1, 5 RADIOLOGÍA Y ULTRASONOGRAFÍA: La esplenomegalia o hepatomegalia pueden indicar diseminación sistémica del Mastocitoma. Se puede identificar linfadenopatía (especialmente en linfonodos sublumbares para tumores perianales). Los aspirados pueden confirmar la sospecha de metástasis. La enfermedad metastásica pulmonar es excepcional en el mastocitoma. Un estudio ecográfico reciente demostró que si bien el hígado y bazo tenían agrandamiento subjetivo mostraban aumento difuso de la ecogenicidad y nódulos hipoecoicos, en presencia de Mastocitoma, ambos órganos también presentaron infiltrados de células cebadas indetectables para la ultrasonografía. Esto implica que la ecografía es de mayor utilidad para estadificar perros con Mastocitoma, si se acompaña con histopatología o citología. La enfermedad metastásica pulmonar del Mastocitoma cutáneo canino es rara en extremo; en consecuencia la radiología torácica pocas veces resulta de utilidad para la estadificación.4, 15 ASPIRADOS DE MÉDULA ÓSEA La presencia de más de 10 células cebadas/1000 células nucleadas, indica diseminación sistémica del Mastocitoma. Puesto que las células cebadas pueden estar acompañadas por eosinófilos, la presencia de eosinofilia medular debería motivar una investigación profunda por mastocitos. En un estudio de 16 perros con 172 mastocitosis sistémica (ECCS), los aspirados de médula ósea resultaron superiores a los extendidos de la capa flogística o sangre. 15,16 ESTUDIOS MISCELÁNEOS: En un estudio, 8 de 16 (50%) perros con enfermedad sistémica, tuvieron manifestaciones clínicas generales. De estos 8 perros, se efectuaron 5 necropsias, y 3 tuvieron ulceración gástrica (la histamina liberada por los Mastocitomas se fija a los receptores H2 estimulando la secreción de ácido clorhídrico por las células parietales, con la resultante ulceración y sangrado gastrointestinal). La prueba de sangre oculta fecal puede ser de utilidad en pacientes con enfermedad de células cebadas. En muchos casos, las heces pueden contener cantidades mínimas de sangre insuficientes para producir melena. La evidencia de sangrado gastrointestinal en el paciente con Mastocitoma es una indicación para el bloqueo farmacológico de la hiperhistaminemia inducida por las células cebadas (bloqueantes H2 como cimetidina, ranitidina, famotidina).16 EXTENDIDOS DE LA CAPA FLOGÍSTICA: Se debe tener cautela con la interpretación, porque la mastocitemia se ha comunicado en una variedad de procesos inflamatorios agudos caninos. Por tal motivo, algunos oncólogos creen en la actualidad que éste procedimiento, es de mínimo valor en la estadificación del Mastocitoma canino. (Ya no se recomienda como parte de la estadificación del Mastocitoma).3, 5,15 La mastocitosis sistémica se refiere a una enfermedad (ECCS) en la cual se presentan dos o más de las siguientes características, sumadas al TCC cutáneo: Afección hepática o esplénica. Afección ganglionar distante. Médula ósea que contiene >10 células cebadas/1000 células nucleadas. Presencia de células cebadas en extendidos de sangre o capa flogística (ya no se le otorga especificidad para el Mastocitoma). 173 Estos hallazgos por sí solos no establecen el diagnóstico de mastocitosis sistémica. En un estudio, los perros sanos tuvieron células cebadas en la citología ganglionar de 11 sobre 46 ejemplares (25%), con una mediana de 5 mastocitos/preparado; en médula ósea se identificó un mastocito en 2 de 51 perros normales (5%), y no hubo células cebadas en 53 extendidos de la capa flogística. En contraste cuando se categorizaron los perros con extendidos positivos, (capa flogística), solo el 27% de aquellos con Mastocitoma tuvo más de 10 células cebadas/preparado (promedio: 71), comparando con el 76% de los casos con enfermedad inflamatoria (promedio: 276). En más del 95% de las ocasiones el frotis de capa flogística positivo no fue indicativo de Mastocitoma, en consecuencia, este método no debe emplearse en la búsqueda de un Mastocitoma oculto.14 8. PRONÓSTICO La investigación clínica reciente condujo a la identificación de los factores pronósticos para perros sometidos a cirugía y radioterapia, y modificó el pensamiento acerca de conceptos previamente bien aceptados. En un estudio, los machos tuvieron el peor pronóstico luego de la quimioterapia para el Mastocitoma, y en otra serie, los perros con más de 8 años tuvieron casi 3 veces mayor probabilidad de morir por su enfermedad luego del tratamiento para el Mastocitoma. Los perros con tumores que crecen a un ritmo mayor de 1cm/semana tuvieron el peor pronóstico en un estudio preliminar de animales tratados sólo con cirugía.13, 14 Las metástasis a los linfonodos regionales son comunes, aunque en ocasiones un tumor "salta" el linfonodo satélite y hace metástasis en el segundo o tercer linfonodo regional, por ejemplo, un Mastocitoma digital se disemina hasta un linfonodo ilíaco o sublumbar, parece ser que los Mastocitomas en ciertas residencias anatómicas son más agresivos que los tumores en otras regiones, por ejemplo, los Mastocitomas distales, perineales, inguinales y extracutáneos (por ejemplo, orofaríngeos, intranasales) parecen tener un mayor potencial metastásico 174 que las masas de grado similar en otras ubicaciones (por ejemplo, tronco, cuello).14 8.1 Grado tumoral El grado microscópico desde hace tiempo ha sido considerado el factor pronóstico más importante para el paciente canino con Mastocitoma cutáneo. Si bien la graduación se puede establecer sobre especímenes citológicos, la histopatología continúa siendo el método más confiable para graduar un Mastocitoma canino. A pesar de que el grado histológico es muy importante y en la actualidad es el factor de mayor consistencia y confiabilidad para establecer el pronóstico en la mayoría de los mastocitomas.5, 9 En un estudio preliminar de 300 perros en los cuales el Mastocitoma había sido resecado con “bordes limpios a simple vista”, la recurrencia fue del 25% para los tumores bien diferenciados (grado I). Este porcentaje aumentaba hasta el 44% para los moderadamente diferenciados (grado II) y 76% para los indiferenciados (anaplásicos; grado 3). El tiempo de supervivencia también demostró depender del grado; el 6% de los perros con tumores de grado 3, 45% con grado 2 y 93% con grado 1, sobrevivieron 4 años luego de la escisión quirúrgica.17,18 Estudios recientes utilizando procedimientos quirúrgicos más agresivos e histopatología para examinar los bordes (más que la impresión clínica del cirujano) demostraron que los perros con Mastocitoma grado 2 tuvieron una tasa de recurrencia local mucho menor y tiempo de supervivencia más prolongado. No obstante. La graduación todavía es un factor pronóstico importante. En un estudio, los tumores grado 3, tuvieron mayor probabilidad de ser resecados en forma incompleta y hacer metástasis. En otro informe, los tumores grado 3 tuvieron 4 veces más probabilidad de causar muerte que aquellos grados más bajos. En un tercer estudio, el intervalo libre de enfermedad fue significativamente menor en perros con Mastocitoma de grado 3. Otro estudio británico de 280 perros con Mastocitoma, encontró que solo el 18% fue de grado 3, pero la sobrevida mediana para este grupo fue <10 meses; la sobrevida mediana para perros con tumores de 175 grados 1 o 2 fue >3,5 años. El crecimiento tumoral fue más probable en perros con tumores de grado 3 (19%) que en aquellos con grados 2 (6%) o 1 (1%). 15 El esquema de Paitnak para la graduación de Mastocitomas es el sistema más utilizado y es el siguiente GRADO 1 2 3 DESCRIPCIÓN Mastocitoma confinado a dermis y espacios interfoliculares. Las células son monomórficas con citoplasma amplio, límites definidos y gránulos intracitoplasmáticos de tamaño medio. No hay mitosis, el edema y necrosis son mínimos. Mastocitoma que infiltra o sustituye tejido dérmico inferior o subcutáneo. Las células son moderadamente pleomórficas, con células fusiformes y gigantes esparcidas. En gran parte, el citoplasma se distingue por gránulos finos y en ocasiones grandes, en ocasiones grandes, aunque no siempre es definido por estos. Las mitosis son raras (0-2 por campo de alto poder). Se presentan áreas de edema y necrosis difusas. Mastocitoma sustituye el tejido subcutáneo y profundo. Las células son pleomórficas con muchas binucleadas. El citoplasma es indefinido con gránulos finos o ausentes. Las mitosis son habituales (3-6 por campo de alto poder). Son comunes la hemorragia, edema y necrosis. Tabla 2. Esquema de graduación de Patnaik para los Mastocitomas. Patnaik A. K., Ehler W.J, MacEwen E.G. Canine Cutaneous Mast Cell Tumor: Morphologic Grading and Survival Time in 83 dogs. Vet. Pathol. 1984; 21:496-474. Aproximadamente el 80 al 85% de los mastocitomas grado dos se consideran curados con una escisión quirúrgica completa. Mientras que el aproximado 20% restante tiene el potencial de causar metástasis a nódulos linfáticos regionales y nódulos linfáticos y órganos distantes. Es por esto que existe un esfuerzo en poder subclasificar esta categoría en grado 2-bajo y grado 2-alto utilizando otros indicadores pronósticos, como marcadores proliferativos (Ki67, AgNOR, PCNA, localización de c-kit, mutación de c-kit) e índices proliferativos como el Índice Mitósico (IM) o Índice de Actividad Mitósica (IAM). Esto sugiere que es necesario realizar modificaciones al actual sistema de clasificación histológica, donde se 176 subclasifiquen los mastocitomas de grado bajo y grado alto basándose en marcadores e índices proliferativos.5, 8, 11,18 8.2 Márgenes Quirúrgicos La entereza de la escisión quirúrgica (bordes “limpios” o “sucios”) es un factor pronóstico significativo y también de importancia para determinar si se requiere cirugía adicional o terapia radiante adyuvante. A menudo existe discrepancia entre la valoración del cirujano sobre los bordes y los resultados de la histopatología. En un estudios, 22 de 59 tumores que se consideraron resecados por completo, resultaron en bordes cuestionables (10) o incompletos (12) sobre la base del examen histopatológico.14, 18 Otro estudio definió tres niveles de escisión quirúrgica sobre la base de la histopatología. Los tumores fueron seccionados en un plano y dos veces en un plano perpendicular a la primera, para obtener al menos 4 márgenes laterales y 1 profundo. Este procedimiento probablemente sea muy importante para determinar de un modo confiable la entereza de escisión quirúrgica. Los márgenes se consideraron completos si había más de 1 mm de tejido normal alrededor de las células tumorales, completos pero cercanos si eran < 1 mm, e incompletos si las células cancerosas estaban en el margen. Otros investigadores consideraron a los márgenes completos pero cercanos si el ancho era entre 1 y 10 mm. 14 En un estudio de 214 perros con bordes quirúrgicos examinados, hubo 23 recurrencias en el campo operatorio. Catorce de 83 perros (17%) con bordes incompletos tuvieron recrecimiento tuvieron recrecimiento, comparados con 2 de 41 perros (5%) y de 3 de 90 (3%) con márgenes completos.15 Otro estudio indicó que algunos perros con escisiones incompletas tenían mayor tendencia al desarrollo de la enfermedad metastásica. Debido a esta observación, y como la recurrencia tumoral todavía es más frecuente luego de la escisión quirúrgica incompleta, se deben lograr bordes limpios cuando sea factible, no confiando en las resecciones marginales.14 177 8.3 Residencia Tumoral En algunos estudios, los perros con neoplasias de las extremidades tuvieron un tiempo de supervivencia y período libre de enfermedad más extensos, que aquellos con TCC en el tronco, aunque no fue un hallazgo constante.15 Aunque a menudo se informaba que el Mastocitoma inguinal y perineal tenía pronóstico malo, prescindiendo del grado microscópico, en forma reciente se demostró que esta idea no siempre es verdadera. Si bien desde hace tiempo se consideró que los Mastocitomas en tales lugares suelen ser más recurrentes que aquellos en otras ubicaciones, la terapia local agresiva a menudo induce control a largo plazo, sin diferencias en la tasa de recurrencias, o tiempo de supervivencia, tiempo hasta la recurrencia, o tiempo de supervivencia comparado con los perros que tienen Mastocitomas en otras residencias.15, 18 Los Mastocitomas que tienen una alta actividad metastática ganglionar regional (60% de los evaluados) son los Mastocitomas del hocico.11 8.4 Tumores Múltiples Si bien el esquema de estadificación incluye a los tumores múltiples como el estadio más alto, su presencia no ha demostrado ser el peor factor pronóstico. En un estudio que comparó 145 perros con Mastocitoma solitario y 50 perros con Mastocitoma múltiple, no hubo diferencias significativas en el tiempo de supervivencia entre ambos grupos. Las tasas de sobrevida al año fueron del 88 y 86% para estos grupos. A los 2 años de la cirugía, el 83% de los perros con Mastocitoma solitario y el 86%de aquellos con Mastocitomas múltiples todavía estaban vivos. Mientras que 8 perros con estadio 2 (Mastocitoma solitario con metástasis ganglionar) tuvieron una sobrevida mediana de 431 días, aquellos con estadio 3 Mastocitoma múltiple y estadio 1 Mastocitoma solitario no alcanzaron una sobrevida mediana. Hallazgos preliminares similares fueron comunicados en otra investigación. En apariencia, se debería corregir el esquema de estadificación descrito para excluir el estadio 3.14 178 8.5 Estadio Tumoral Puede ser que la presencia de metástasis sea un indicador más preciso de pronóstico malo que el estadio, como se describiera. Tres estudios demostraron que la presencia de metástasis al momento del diagnóstico, más que el estadio clínico, fue el predictor de la escasa sobrevida; los perros con metástasis en linfonodos tuvieron 8 veces más probabilidad de morir por el Mastocitoma en un estudio, y el hallazgo de enfermedad metastática se correlacionó con 12 a 30 veces más probabilidad de muerte en otra serie. Un problema potencial con la estadificación en que se pueden encontrar pequeñas cantidades de células cebadas en circulación, bazo, hígado y medula ósea, de modo que su importancia es incierta. En un estudio, la presencia de algunas células cebadas en estos lugares no tuvo influencias sobre el tiempo de supervivencia en perros con Mastocitoma de grado 2. Las células cebadas pueden infiltrar un linfonodo regional en el paciente canino con mastocitoma, como respuesta inflamatoria contra el tumor; en consecuencia, la citología sospechosa se debería confirmar con histopatología.17, 21 La clasificación de Mastocitoma según la Organización Mundial de la Salud se muestra en la Tabla 3: ESTADIO CLÍNICO DEL MASTOCITOMA EN PERROS GRADO CARACTERÍSTICAS 0 Tumor solitario, incompleta escisión de la dermis I Tumor cutáneo solitario, sin metástasis a linfonodos regionales II Tumor cutáneo solitario, con metástasis que involucran linfonodos regionales Múltiples tumores cutáneos, tumores infiltrativos, con o sin metástasis a linfonodos regionales Estadios 0-III con metástasis distantes III IV 179 Sub estudio A Sub estudio B No hay signos de enfermedad sistémica, perro clínicamente normal Signos clínicos de enfermedad, perro clínicamente enfermo Tabla 3. Criterio de clasificación del mastocitoma según la Organización Mundial de la Salud. Dobson J. M., Duncan B., Manual of Canine and Feline Oncology. BSAVA. 2003 8.6 Medición de la Proliferación Tumoral Las regiones organizadoras nucleolares argirofílicas (AgNOR) se presentan en el núcleo, captan colorantes argénticos y son una medición indirecta de la proliferación celular. El número promedio de AgNOR/célula se correlaciona bien con el grado tumoral en especímenes de histopatología y citología, y parecer ser un predictor independiente de la muerte relacionada con el tumor. En un estudio. El recuento de AgNOR fue más alto en perros que experimentaron enfermedad metastásica.17, 19, 21 Otro método para medir la proliferación celular, coloración para el antígeno nuclear de células proliferativas (PCNA), también fue predictor de metástasis y escasa sobrevida en perros con MCT cutáneo. La asociación entre PCNA y tiempo de supervivencia fue menos evidente en otro informe. Los autores de una investigación propusieron el uso de combinado del grado microscópico, AgNOR y PCNA, para determinar el pronóstico exacto, no pudo ser establecido para el 20% de los perros con Mastocitoma, destacando la heterogeneidad de esta enfermedad. Un tercer método para medir la proliferación celular, coloración para Ki67, demostró buena correlación con el grado tumoral. El número promedio de células Ki67-positivas fue significativamente superior en perros que fallecieron por Mastocitoma. Por otra parte, cuando los perros con Mastocitoma de grado 2 fueron agrupados en función del Ki67, hubo correlación significativa con la sobrevida posoperatoria. Los perros con Mastocitoma que tuvieron un índice mitótico >10/10 campos de alto poder (400 X) mostraron mayor probabilidad de fallecer por mastocitoma que aquellos con menores puntajes.19, 20 180 El contenido de ADN de las células en los Mastocitomas resultó anormal en cerca del 30% de los tumores. Se notó la tendencia a un menor tiempo de supervivencia en los perros con contenido de ADN anormal.21 Estudios recientes encontraron que las mutaciones en el protooncogen c-kit pueden asociarse con un grado microscópico superior. Los patrones de coloración inmunohistoquímica para el c-kit tuvieron correlación con la recurrencia y sobrevida en perros con Mastocitoma manejados con tratamiento quirúrgico solo.8, 11,14 Los niveles de la proenzima metaloproteinasa de matriz 9 (MMP-9) fueron más altos en Mastocitoma de grado 3 que 2. Esto no resulta llamativo, porque las MMP toman intervención en la invasión tumoral del tejido circundante. Todavía no se comunica la correlación con el pronóstico.18 Las mutaciones en el gen supresor tumoral p53 se identificaron en casi el 50% de los Mastocitomas cutáneos en un estudio, y fueron menos comunes en tumores de grado 3. En otro estudio, las células con p53 mutado fueron más comunes en los tumores de grado 3. Si bien uno de estos informes menciono la correlación con el tiempo de supervivencia, la asociación no fue superior al vínculo entre grado y sobrevida. El otro estudio no demostró asociación entre el p53 y la sobrevida. 2, 15,21 9. TRATAMIENTO Se comunicó la regresión espontanea del Mastocitoma cutáneo múltiple en un cachorro, pero este es un fenómeno excepcional. El control del Mastocitoma canino consiste en el uso de cirugía, quimioterapia o terapia radiante, ya sea en forma individual o combinada (Ver Tabla 4).1, 10 181 CLASIFICACIÓN OMS GRADO PAITNAIK I I y II I III II I-III III y IV TRATAMIENTO RECOMENDADO Ablación quirúrgica Completa: Observación Incompleta: ablación más amplia o radioterapia Ablación quirúrgica Completa: Prednisona* Incompleta: ablación más amplia y Prednisona*, o Radiación más Prednisona* Ablación quirúrgica Completa: Prednisona* Incompleta: ablación más amplia y Prednisona*, o Radiación y Prednisona* o Prednisona* sola Terapia local si es posible, más alguno de los siguientes: Prednisona* Quimioterapia CVP† Vincristina‡ *Prednisona: 1-2 mg/kg, vía oral (SID) por una semana, luego 0.5-1mg/kg, SID, por tres semanas, después 0.5-1mg/kg días alternos por tres semanas, después reducir la dosis a 50% cada tres semanas †CVP: Ciclofosfamida 50 mg/m2 (1.6mg/kg), por vía oral, días alternos o cuatro días por semana; Vinblastina 2mg/m2 (0.06mg/kg), IV, una vez por semana; Prednisona, 20-40mg/m2 (1-2mg/kg), por vía oral, días alternos. ‡Vincristina: 0.5 a 0.75mg/m2, IV cada semana SID=Una vez al día Tabla 4. Esquema de tratamiento para Tumor de Células Cebadas en perros. Modificado de Dobson J. M., Duncan B., Manual of Canine and Feline Oncology. BSAVA. 2003 9.1 TRATAMIENTO QUIRÚRGICO La escisión quirúrgica se indica si el Mastocitoma es solitario y no hay evidencia de afección ganglionar o diseminación sistémica. La resección debe ser amplia y profunda hasta un margen mínimo de 2-3 cm alrededor de los límites tumorales observados, y en un plano fascial por debajo. Con esta modalidad agresiva, la recurrencia para los grados 1 y 2 es mínima. Un estudio reciente evaluó la entereza de la escisión quirúrgica en márgenes de 1, 2 y 3 cm desde los bordes en Mastocitomas de grados 1 y 2. Todos los tumores grado 1 fueron escindidos a 1 cm de los bordes del Mastocitoma, pero sólo el 75% de los grados 2 tuvieron escisión completa a la misma distancia. Todos los tumores grado 2 fueron escindidos a 2 cm de los bordes lesionales, con lo cual los autores especularon 182 que puede ser factible la resección completa con estos márgenes más estrechos que los regularmente recomendados.1, 14, 16,22 La escisión quirúrgica debe ser agresiva. Todo el tejido resecado debe ser remitido a patología para determinar la entereza de la escisión quirúrgica. Si el tumor es de grado 1 o 2 y la escisión es completa, no se requiere tratamiento adicional. La extensión del tumor más allá de los bordes quirúrgicos, o el informe de márgenes cercanos justifica una rápida escisión más amplia, si es posible. Una segunda intervención quirúrgica debe incluir el campo previo más márgenes laterales de 2-3 cm y tejido profundo adicional. Si esto no se puede llevar a cabo por la ubicación lesional u otros factores, o si el Mastocitoma es de grado 3, se indica terapia adicional. El paciente debe ser valorado por terapia radiante, si está disponible. La quimioterapia puede ser considerada si se detectan metástasis o el Mastocitoma es de grado 3.1, 14 9.2 Terapia Radiante Los Mastocitomas son sensibles a los efectos de la terapia radiante, incluso en dosis moderadas. En un estudio, el 44% de 23 perros tuvo respuestas satisfactorias a la terapia radiante, con un control tumoral >12 meses y longevidad promedio de 24 meses. Puede emplearse sola o combinada con otras modalidades terapéuticas para tratar los mastocitomas extirpados en forma incompleta o no extirpables. Dar una dosis total de 40 a 48 Gy en un periodo de tres a cuatro semanas. En otro estudio que empleó terapia radiante de rayo externo para tratar 95 Mastocitomas de 85 perros, se obtuvo una sobrevida mediana y tiempo mediano libre de enfermedad de 63 y 17 meses, respectivamente; el 79% estaba libre de enfermedad al año y el 77% a los 2 años. En esta serie el tiempo de supervivencia fue menor en perros con grados más altos, y la recurrencia y sobrevida fueron afectadas por la residencia tumoral. Los perros con neoplasias de los miembros tuvieron mayor tiempo libre de enfermedad y supervivencia que aquellos con tumor sobre el tronco. Los perros con tumores de grado 2 tuvieron un tiempo de 183 supervivencia más prolongado que aquellos con Mastocitoma grado 3. Si es necesario, irradiar los ganglios linfáticos regionales afectados.1, 14, 15, 16, 20,22 9.3 Terapias Locales La inyección de agua des ionizada en el sitio de la resección quirúrgica incompleta redujo la recurrencia local del tumor, comparando con la cirugía marginal sola.15 Para los TCC moderadamente diferenciados, examinados en un estudio, 7 de 27 tumores recurrieron en forma local luego de la inyección. Las inyecciones eran dolorosas si se empleaban volúmenes sustanciales, y algunos perros necesitaron sedación profunda o anestesia. En contraste, un estudio demostró que los perros operados y tratados con agua desionizada tenían mayor probabilidad de recurrencia, y que esta era más rápida que en los animales sometidos a tratamiento quirúrgico solo.15 La inyección de agua desionizada no se recomienda en el tratamiento de Mastocitomas. Las inyecciones intralesionales de Triamcinolona 1mg/cm de diámetro tumoral cada 2 semanas, produjeron buen control paliativo local. 9.4 Nuevas Terapias Las mutaciones en protooncogen c-kit, demostraron conducir a la fosforilación constitutiva del producto génico, y se piensa que las mismas son importantes en el desarrollo y progresión del Mastocitoma canino. No hay evidencia de asociación racial con tales mutaciones. Las anormalidades en el c-kit son más comunes en los tumores de grados 2 y 3, que en el Mastocitoma de grado 1, denotando un rol en el comportamiento biológico de la enfermedad. En un estudio las mutaciones fueron indicadas en más de un tercio de los perros con tumores de grados 2 o 3.1, 9,15 La importancia terapéutica de estos hallazgos es que los inhibidores de la cinasa pueden ser de utilidad. El Mesilato de Imatinib causó remisiones clínicas en pacientes humanos con similares mutaciones del c-kit, pero utilizado en perros produjo morbilidad seria y mortalidad, limitando su utilidad clínica en los pacientes veterinarios. 8,12 184 Los inhibidores de proteínas tirosina kinasa (TK), en específico inhibidores de Kit han demostrado ser eficaces en el tratamiento de mastocitomas. Kit es un receptor tirosina kinasa que se encuentra en células cebadas normales y neoplásicas, además de encontrarse en otras células normales del organismo como las células madre hematopoyéticas. El receptor Kit es específico para el ligando factor de células madre (Stem Cell Factor; SCF) que al unirse a Kit, induce la transducción de señal que promueve la diferenciación, sobrevivencia y función de las células cebadas. Los mastocitomas además pueden presentar una sobreexpresión o mutación de Kit (hasta un 30% de los mastocitomas presentan una mutación de Kit) que lleva a la inducción de la señalización a través de Kit en ausencia de SCF. Los fármacos orales para uso veterinario en perros que actualmente se encuentran disponibles Estados Unidos de América son el Masitinib (Kinavet) es un inhibidor principalmente de Kit y el receptor del factor de crecimiento derivado de plaquetas (PDGF-R) y el Toceranib (Palladia) que es un inhibidor de Kit, receptor del factor de crecimiento del endotelio vascular (VEGF-R) y PDGF-R, que juegan un papel importante en la angiogénesis. Estudios recientes han demostrado que el Toceranib presenta actividad biológica hasta en un 60% de los casos de mastocitomas de grado histológico 2 y 3. La dosis recomendada de toceranib en perros es de 2.75 mg/kg, vía oral, tres veces por semana y de Masitinib 10 a 12.5 mg/kg, vía oral, cada 24 horas y es recomendado en ambos casos, monitorear de manera cercana con hemograma, química sanguínea, examen general de orina y si es indicado una relación proteína-creatinina en orina. Con el uso de inhibidores de proteínas kinasa como únicos agentes o en combinación con quimioterapia es esperado obtener un mejor control de los casos de perros con mastocitoma.6, 9, 12,16 9.5 Tratamiento auxiliar La farmacoterapia auxiliar es importante en el Mastocitoma canino. Los animales con mastocitosis o Enfermedad de Células Cebadas Sistémica deben recibir bloqueantes H2, porque la rápida desgranulación de los mastocitos neoplásicos puede tomar lugar durante la intervención quirúrgica o quimioterapia. 3 185 La hiperhistaminemia sistémica también puede presentarse con la enfermedad recurrente. El objetivo terapéutico es prevenir la ulceración gastrointestinal asociada con los altos niveles de histamina, y tratar las ulceraciones ya presentes. Esto tiende a ocurrir en perros con procesos extensos y sustanciales, recurrencia de enfermedad cutánea o diseminación sistémica del Mastocitoma. La cimetidina reduce la producción de ácido gástrico mediante la inhibición competitiva de la acción de la histamina sobre sus receptores H2, en las células parietales. La ranitidina y famotidina, bloqueantes H2, con menor frecuencia de administración, pueden emplearse por efectos similares. El Omeprazol, que inhibe la producción de ácido gástrico por las células parietales, mediante el bloqueo de la bomba de protones, también puede ser utilizado. Los perros con evidencia de ulceración y sangrado gastrointestinal se pueden beneficiar con sucralfato en dosis de 0,5-1 g, cada 8 horas, vía oral. El sucralfato reacciona con el ácido estomacal formando una sustancia pastosa, altamente condensada, viscosa, adhesiva, que se fija a la superficie de las ulceraciones gástricas y duodenales. La barrera resultante protege a la úlcera de las potenciales propiedades ulcerogénicas de la pepsina, ácido y bilis, permitiendo su reparación. Los bloqueantes H1 como la Difenhidramina, se deberían considerar junto con la cimetidina, antes y después de la extracción del Mastocitoma, para prevenir los efectos negativos de la liberación de histamina local sobre la fibroplasia y reparación de la herida. Un bloqueante H1 de segunda generación, Loratadina, demostró ser muy efectivo inhibiendo la liberación de histamina al bloquear la desgranulación de las células cebadas caninas normales y, por lo tanto, puede ser una buena opción paliativa en perros con Mastocitoma.13, 14, 16,21 9.6 Inmunoterapia La recurrencia fue registrada en el 70% de los Mastocitomas luego de la inyección de un inmunomodulador inespecífico (Corynebacterium parvum) en el sitio de la escisión quirúrgica incompleta. Esta cantidad es coincidente con el comunicado para perros tratados con cirugía sola. Asimismo, un paciente canino con mastocitoma cutáneo múltiple tuvo control a largo plazo y regresión de las masas, 186 con el tratamiento intralesional de otro inmunomodulador inespecífico (Propionibacterium acnés; Inmunoregulin). Por lo tanto, existe suficiente información para recomendar la inmunoterapia en esta enfermedad. 15 9.7 Terapia Sistémica La enfermedad metastásica es más frecuente en perros con Mastocitoma de grado 3 y en pacientes con resecciones incompletas de los tumores cutáneos. Cuando los Mastocitomas hacen metástasis o se diseminan en forma sistémica, las terapias localizadas (cirugía o terapia radiante), sólo son adecuadas, como paliativos del malestar u obstrucción mecánico. Para estos pacientes se indica la terapia sistémica. Los glucocorticoides básicamente son paliativos, pero pueden suceder algunas respuestas a largo plazo. La Prednisona (2 mg/kg, vía oral, una vez al día, durante una semana, luego 0.5-1mg/kg, SID, por tres semanas, después 0.5-1mg/kg días alternos por tres semanas, después reducir la dosis a 50% cada tres semanas), se administra en tanto no haya progreso tumoral. Los perros libres de enfermedad después de 6 meses tuvieron menor incidencia de recurrencia; en consecuencia, la terapia suele suspenderse en ese momento.21 Se desconoce el mecanismo exacto de los efectos citotóxicos sobre los mastocitomas, aunque el proceso puede ser paralelo a la actividad de los glucocorticoides sobre los linfocitos (Los glucocorticoides disminuyen la cuenta de linfocitos circulantes y el tamaño de los ganglios linfáticos, por que inhiben la actividad mitótica linfocitaria. Al parecer, su acción primaria consiste en inhibir la producción de interleucina por los linfocitos T, con lo que detiene de manera eficaz la proliferación de los linfocitos). Los receptores de glucocorticoides se encuentran en el citoplasma de las células cebadas caninas; estos sitios podrían intervenir en la susceptibilidad de los mastocitomas a los corticosteroides. No interesa el tipo de glucocorticoide administrado, pero la aplicación intralesional puede ser más efectiva que la administración sistémica. Pocos efectos colaterales cushingoides se observan con los glucocorticoides de acción corta, como la Prednisona. La duración de la 187 remisión por lo usual es de 10 a 20 semanas. El único estudio controlado con el uso de Prednisona para tratar perros con mastocitoma mensurable informó que 5 de 21 perros (24%) demostraron respuestas objetivas (1 completa 4 parciales). De los 5 perros que respondieron, 2 tuvieron mastocitomas solitarios, 2 múltiples y 1 metástasis ganglionar regional.15 Aunque los receptores para progesterona y estrógenos fueron identificados en las células tumorales de perros con mastocitoma, todavía se debe investigar el rol de los esteroides sexuales en el tratamiento de la enfermedad. Llamativamente, las proteínas de resistencia a multidrogas (Glucoproteína-p y proteína asociada a resistencia multidrogas) fueron detectadas en el 25% de los mastocitomas cutáneos caninos. Estas proteínas son importantes en la resistencia de las células tumorales a los glucocorticoides y a gentes quimioterapéuticos, como Doxorrubicina y Vincristina. Ambas proteínas faltaban en los tumores de grado 3, lo cual es alentador, porque estos son los mastocitomas que con mayor asiduidad requieren quimioterapia.6, 13 9.8 QUIMIOTERAPIA Algunos artículos combinan los resultados de la quimioterapia adyuvante obtenidos con tumores de grados 2 y 3, de modo que es fácil interpretar a información con claridad para los casos que tienen sólo enfermedad de grado 3. Se han identificado varios agentes quimioterapéuticos con cierta eficacia objetiva contra el Mastocitoma canino, incluyendo Vinblastina y CCNU (Lomustina). La tasa de respuesta global para los protocolos que contienen estos agentes quimioterapéuticos varía entre el 40 y 50%, aunque algunas de las respuestas son de corta duración.1, 6, 10, 14 VINBLASTINA (2mg/m2, IV, semanal) y la Prednisona fueron utilizadas para tratar el TCC en una serie. La tasa de respuesta global en 15 perros con enfermedad mensurable fue del 47% (7 de 15 casos); hubo 5 respuestas completas y 2 parciales. La duración de remisión mediana fue de 5 meses. En un protocolo con los mismos dos agentes 188 quimioterapéuticos fue administrado en 15 perros con Mastocitomas resecados en forma inadecuada, solo el 7%, (un caso) tuvo recurrencia local, aunque éste y dos 2 más experimentaron nuevos tumores cutáneos. Otros 25 perros tratados con Vinblastina y Prednisona, luego de la escisión quirúrgica incompleta de Mastocitoma de grado 2, tuvieron una sobrevida mediana de 24 meses. La vinblastina es mielosupresora y se deben hacer hemogramas semanales antes de su administración en los intervalos entre aplicaciones. 14, 15, 21 En otro estudio, la vinblastina (2-3 mg/m2 IV, cada 3 semanas) y ciclofosfamida (250-300 mg/m2, vía oral durante 4 días, días 8 a 11, cada 3 semanas) se combinaron con prednisona (1mg/kg/día, vía oral). Todos los pacientes tratados tenían metástasis ganglionares. La tasa de respuesta global en 14 perros evaluados con enfermedad mensurable fue del 73% (11 de 15 casos). Todos tuvieron respuestas parciales, y la sobrevida mediana para estos 11 casos fue de 6 meses (en un rango de 4 a 10 meses). 14, 15 LOMUSTINA (CCNU) es un alquilante empleado para tratar neoplasias hematopoyéticas en seres humanos. Se administró en 19 perros en dosis de 90 mg/m2, vía oral, cada 4 semanas. Esta droga se puede combinar con seguridad con prednisona. Si se emplea CCNU, el hemograma completo y enzimología hepática, deben ser valorados antes de cada administración, suspendiendo su aplicación si hay trombocitopenia o hiperactividad enzimática hepática.15 VINCRISTINA no demostró eficacia en el tratamiento de Mastocitoma. En ese estudio, sólo 2 perros (7%) tuvieron remisiones parciales, y 9 (32%) debieron suspender la terapia por la toxicidad gastrointestinal pronunciada. La vincristina no forma parte de los agentes quimioterapéuticos de primera línea para el tratamiento del Mastocitoma canino.6, 13, 21 189 L-ASPARGINASA fue recomendada como droga activa en el tratamiento de perros con TCC. En una serie, 3 de 6 perros con TCC cutáneo demostraron respuestas objetivas, durante un intervalo breve de 1 a 2 meses. Uno de otros dos perros demostró respuesta objetiva durante 6 meses. 6, 13, 15, 20 DOXORRUBICINA y prednisona fueron empleadas en 9 perros con enfermedad mensurable. No hubo respuesta en 7 perros que habían recurrido luego de la quimioterapia combinada, y se nota una respuesta parcial en el animal que no había sido tratado. No se recomienda en el tratamiento del TCC canino.6, 15 190 10. PRESENTACIÓN DEL CASO CLÍNICO a) RESEÑA FECHA: 11 de abril de 2012 EXPEDIENTE: AA1007 ESPECIE: Canino NOMBRE: “SALPI” RAZA: Schnauzer SEXO: Hembra EDAD: 11 años COLOR: Sal y pimienta PESO: 6.3 kg Figura 4. Paciente canino, hembra, Schnauzer, “SALPI” MEDICINA PREVENTIVA: Calendario de vacunación y desparasitación completo. HÁBITAT: Vive dentro de casa, 2 veces por semana sale a caminar, convive con dos perros Cobrador de Labrador adultos. DIETA: Croquetas dos veces al día. Esterilizada hace 8 años 191 b) MOTIVO DE CONSULTA Nodulación en Miembro pelviano izquierdo a nivel de los metatarsos, que ha ido creciendo desde hace 20 días atrás. Figura 5. Nodulación en miembro posterior izquierdo c) HISTORIA CLÍNICA Los dueños refieren que hace 20 días aproximadamente, comenzó a claudicar y notaron el crecimiento de una nodulación en Miembro Pelviano Izquierdo, que se fue inflamando, fue llevada con MVZ externo, el cual no les dio diagnóstico, ni tratamiento. Así mismo refieren que la claudicación en los últimos días ha sido intermitente. La han notado triste y no quiere salir a caminar. 192 Posteriormente fue llevado al Hospital de Pequeñas Especies, donde al examen físico se encontró lo siguiente: d) EXAMEN FÍSICO Estado mental: Alerta Temperatura: 38.9°C Frecuencia cardiaca: 112 ppm Frecuencia respiratoria: 44 rpm Condición corporal: 2/5 Normohidratado TLLC: 2 seg. Mucosas: Rosadas Linfonodo poplíteo izquierdo aumentado de tamaño, 2:1 en relación con el linfonodo poplíteo derecho. A la auscultación se puede apreciar un Soplo 4/6, más audible en válvula mitral. En miembro pelviano izquierdo se encuentra una nodulación de 6 cm de diámetro aproximadamente a nivel de los metatarsos y abarcando la articulación metatarsofalangeana, nodulación de consistencia firme, con bordes bien definidos, no móvil, no se presenta dolor a la palpación, el miembro se apoya correctamente. 193 Figuras 6 y 7. Nodulación de 6 cm de diámetro aproximadamente, a nivel de los metatarsos y abarcando la articulación metatarsofalangeana. EXAMEN POR APARATOS Y SISTEMAS: Músculoesquelético: Presenta anormalidad al caminar de tipo intermitente, la cual incrementa con el ejercicio, en Miembro pelviano izquierdo. Sistema Tegumentario: Presenta lesiones en piel, desde hace 3 años, sobre todo en el vientre, simétricas, de presentación estacional, fue llevada con MVZ externo al Hospital de Pequeñas Especies, el cual le diagnosticó Dermatitis por contacto y le recetó tratamiento (el propietario no sabe cuál), mejoró con la medicación. 194 LISTA DE PROBLEMAS 1. Nodulación de 6 cm de diámetro, en MPI a nivel de metatarsos. 2. Depresión 3. Claudicación grado I de MPI 4. Linfonodo poplíteo izquierdo aumentado de tamaño 5. Soplo mitral 4/6 LISTA MAESTRA I. Nodulación en MPI a nivel de metatarsos II. Soplo 4/6 e) DIAGNÓSTICOS DIFERENCIALES Mastocitoma Carcinoma de células escamosas Linfoma cutáneo DIAGNÓSTICO PRESUNTIVO “MASTOCITOMA” f) PLAN DIAGNÓSTICO Debido a los hallazgos encontrados en el examen físico (nodulación en MPI, linfadenopatía) y a la historia clínica (rapidez de aparición, edad), se decide realizar Aspiración con Aguja Fina de la nodulación. Así mismo se realizó Estudio Radiográfico de Miembro Pelviano Izquierdo. 195 Figura 8. Toma radiográfica lateral de miembro posterior izquierdo. En la imagen de arriba se observa en las adyacencias del tejido óseo la presencia del tumor abarcando falange distal, media y proximal. 196 Figura 9. Toma radiográfica dorso-plantar de miembro posterior izquierdo. En la imagen se observa una reacción perióstica en la falange V, además de zonas de osteolisis inicial en diáfisis de la falange media del dedo V. g) PLAN TERAPEUTICO Se le administró Ranitidina (1ml) intralesional, y se le recetó Ranitidina suspensión (2.2mg/kg) cada 6 horas, hasta nueva indicación y se citó a la paciente para el día 16 de abril para revisión y realización de Electrocardiograma y toma de muestras para estudios de sangre Hemograma, Química sanguínea. 197 16 de abril de 2012 SUBJETIVO: La dueña refiere que a partir de la administración intralesional de Ranitidina, y la realización de la Aspiración Citológica con Aguja Fina el día 13 de abril del 2012, la nodulación se ha inflamado y ha aumentado su tamaño. Al examen físico se encuentra que el linfonodo poplíteo izquierdo aumentó su tamaño, respecto a la revisión realizada el día 13 de abril de 2012. Se realiza la toma de muestra sanguínea para Hemograma y Química Sanguínea, así mismo se realiza estudio Electrocardiográfico. Los resultados de la citología diagnóstica realizada el 13 de abril indican que se trata de MASTOCITOMA GRADO I (BIEN DIFERENCIADO) Figura 10. Estudio Citológico de la nodulación en miembro pelviano izquierdo 100X (H&E) 198 Figura 11. Citología de la nodulación. (100x, H&E) En la figura 10 y 11 se observa sobre un fondo proteináceo células redondas con citoplasma amplio y con elevada cantidad de gránulos basofílicos intracitoplasmáticos. Debido a la rapidez del aumento de tamaño del linfonodo poplíteo izquierdo y a los resultados de la citología se decide realizar cirugía de amputación de miembro posterior izquierdo, considerando el tipo de neoplasia, y a su riesgo de metástasis (15%). Se continúa con tratamiento de Ranitidina (2.2mg/kg), PO, QID. 16 de abril de 2012 Lo resultados de los estudios de Hemograma indican trombocitosis ligera asociada a hemorragia e hiperproteinemia asociada a hemoconcentración En la química sanguínea los resultaron revelaron hipocreatininemia indicativa de pérdida de masa muscular. Hiperamilasemia ligera por disminución en la filtración glomerular. CK ligeramente incrementada por lesión/catabolismo muscular. 199 Alteraciones proteicas asociadas a inflamación crónica (respuesta humoral). Obteniendo los resultados de laboratorio se cita a la paciente para cirugía el día 19 de abril de 2012, indicándole los cuidados preoperatorios (paciente ayunado 12 horas y bañado). 19 de abril de 2012 Se presenta la paciente para cirugía, se autoriza la misma por los dueños; se le realiza examen físico, donde se reporta mayor inflamación y crecimiento de la nodulación en el miembro posterior izquierdo, la cual le produce malestar a la paciente, así mismo se reporta prurito generalizado, el cual se sugiere puede deberse a Dermatitis alérgica, la cual se le había diagnosticado con anterioridad en un clínica veterinaria particular, y se procede a realizar la cirugía de amputación de miembro posterior izquierdo, la cirugía se realizó con éxito y se hospitalizó a la paciente y se mantuvo con tratamiento de: Terapia de fluidos, Enrofloxacina (10mg/kg), IV, SID; Carprofeno (3mg/kg), SC, SID; Tramadol (gotas), PO, BID; Compresas frías durante 15 minutos cada 6 horas. Para el día 20 de abril de 2012 se mantuvo en hospitalización, se le realizó el examen físico y se encontró deprimida y con dolor moderado, se decide dar de alta al paciente, se continúa con el mismo tratamiento anterior en casa. Se cita para el día 27 de abril para revisión. 27 de abril de 2012 En la revisión postquirúrgica la paciente presenta buena movilidad, orina y defeca con normalidad y tiene buen apetito. La herida quirúrgica no presenta secreción. En la parte ventral del cuello se encuentra una tumoración de 0.2 cm de diámetro, de consistencia firme, sin dolor a la palpación. En la hoja de progreso se reporta que debido a su historial clínico (Mastocitoma grado I en Miembro Posterior Izquierdo), la masa alojada en el cuello pudiera estar relacionada con el mastocitoma, por lo que se decide tomar muestra citológica de la nodulación. 200 30 de abril de 2012 Los resultados de la citología diagnóstica revelan que se trata de Quiste epidermoide, a pesar de que este tipo de lesiones son de carácter benigno, es conveniente su extirpación quirúrgica, ya que su ruptura generará una dermatitis a cuerpo extraño severa. Se le informan de los resultados a los propietarios y se les comunica de la necesidad de realizar la cirugía para extirpar el quiste epidermoide, los dueños deciden que se realice la cirugía el día 03 de mayo de 2012. Figura 12. Estudio citológico de nodulación en parte ventral del cuello. (100x H&E) Figura 13. Estudio citológico “Quiste Epidermoide”, realizado 27 de abril de 2012. (100X H&E) 201 En las figuras 12 y 13 se observan sobre un fondo eritrocítico, moderada cantidad de material proteináceo laxo y gran cantidad de células escamosas, anucleadas, queratinizadas y sin atípias, dispuestas en grandes grupos sobrepuestos. 03 de mayo de 2012 Se presenta la paciente con buen estado de ánimo, la dueña refiere que en el sitio donde se realizó la Aspiración Citológica con Aguja Fina presentó secreción purulenta, se continúa con el plan terapéutico, remoción quirúrgica del quiste epidermoide. Ese mismo día se de alta a la paciente con tratamiento de Amoxicilina PO, BID por 7 días y Meloxicam PO, SID durante 2 días. 26 de julio de 2012 La paciente se presenta de nuevo a consulta, debido a que ha presentado en los últimos 4 días vómito, ha bajado de peso y se encuentra deprimida. En el examen físico los linfonodos se encuentran normales, el peso de la paciente es de 4.9 kg, en la palpación abdominal se encuentra distendido el abdomen, dolor a la palpación en abdomen ventral craneal. Se le realiza Hemograma con carácter de urgente, el cual los resultados fueron: Leucocitosis por neutrofilia y desviación a la izquierda regenerativa. Inflamación severa focalizada. Trombocitosis leve por hemorragia asociada a inflamación, hiperproteinemia asociada a inflamación. Se le realizó estudios radiográficos de abdomen y tórax. 202 Figura 14. Estudio radiográfico lateral de tórax. La interpretación del estudio radiográfico reportó: Radiografía de abdomen-“se observa una estructura con densidad radiopaca en la región ilíaca de aproximadamente 3 x 5 cm, incidentalmente se observan asas intestinales dilatadas, y desplazamiento del colon en dirección ventral.” 203 Figura 15. Estudio radiográfico ventro-dorsal de tórax. Radiografía de tórax- “De acuerdo al índice de Buchannan’s encontramos 11.5 cuerpos vertebrales, sugerente de cardiomegalia.” Se realizó estudio complementario (ultrasonido abdominal) 204 Figura 16. Estudio ultrasonográfico (hígado) Figura 17. Estudio ultrasonográfico. 205 Figura 18. Lesiones circulares hipoecoicas en lóbulo hepático Figura 19. Inflamación de la mucosa del estómago asociado a síndrome paraneoplásico del Mastocitoma. 206 En el reporte del estudio ultrasonográfico se reportó: Se percibe una masa de ecogenicidad mixta con dimensiones de 2.7 x 5.7 cm y de bordes lobulados en la cercanía de la bifurcación ilíaca. Además se encontraron 2 lesiones circulares hipoecoicas en lóbulo hepático con dimensiones de 1.5 y 2 cm respectivamente. Interpretación ultrasonográfica: Metástasis a linfonodo mesentérico y a hígado. Debido al agravamiento de la salud de “Salpi”, los dueños deciden que se realice la eutanasia de la paciente. 11.DISCUSIÓN En el presente caso, el tumor diagnosticado en el miembro posterior izquierdo involucraba un nódulo linfático regional, por lo tanto la metodología diagnóstica y tratamiento de primera desafortunadamente por intensión razones empleados económicas no fueron se los realizó adecuados, el estudio histopatológico para determinar mejor el pronóstico y sobrevida. A pesar de que en la descripción citológica se trataba de un Mastocitoma Grado I Bien diferenciado y que su localización en extremidad, (incidencia del 40%) 5, 9, es de mejor pronóstico, porque en algunos estudios, los perros con neoplasias de las extremidades tuvieron un tiempo de supervivencia y período libre de enfermedad más extensos, que aquellos con TCC en el tronco. 9, 15 La decisión de una escisión quirúrgica completa de la extremidad fue adecuada, ya que se trataba de un TCC solitario y la escisión quirúrgica debía ser agresiva, debido a que la recurrencia para los grados 1 y 2 es mínima.13, 18 En los tumores de grado 1 o 2 si la escisión es completa, no se requiere tratamiento adicional.13, 15 En la historia clínica se obtuvo un dato importante, donde la aparición y crecimiento del tumor se desarrolló en un periodo corto de tiempo (20 días 207 aproximadamente), ya que como se ha podido observar en un estudio, los perros con tumores que crecen a un ritmo mayor de 1cm/semana tuvieron el peor pronóstico, en un estudio preliminar de animales tratados sólo con cirugía. 14, 17 No es posible establecer de manera exacta el pronóstico de todos los casos de mastocitomas, todos éstos deberán considerarse potencialmente malignos ya que pueden causar metástasis a nódulos linfáticos regionales y nódulos linfáticos y órganos distantes, como: bazo, hígado y médula ósea, aunque si ocurre metástasis a un linfonodo está asociado a peor pronóstico. Los perros con metástasis en linfonodos tuvieron 8 veces más probabilidad de morir por el TCC en un estudio.15 El comportamiento biológico de los TCC caninos puede resumirse en una sola palabra: Impredecible.13 Aproximadamente el 50% de los TCC son malignos, por lo tanto la decisión del tratamiento terapéutico utilizado debe de ser de manera individualizada, en cada caso, considerando múltiples factores que incluyen el estado clínico, grado histológico, marcadores proliferativos y presencia de mutación de Kit, presencia de factores pronósticos negativos, desarrollo de efectos secundarios, posibles complicaciones, respuesta o falla a la terapia previa, costo y disponibilidad del fármaco entre otros.20, 21 12.BIBLIOGRAFÍA 208 1. Argyle D.J., Brearley M.J. Turek M.M. Decision Making in Small Animal Oncology. Primer edición. Wiley-Blackwell. USA.2008. 2. Ayl R. D., Couto C.G. Hammer A.S., et.al. Correlation of DNA Ploidy to Tumor Histologic Grade, Clinical Variables, and Survival in dogs with Mast Cell Tumors. Vet. Pathol. 1992; 29:386-390. 3. Birchard, SJ. Sherdin, RG. Manual Clínico de Procedimientos en Pequeñas Especies. Segunda edición. Ed. Mc Graw Hill, 2000. 4. Book A. P., Fidel J., Wills T., et.al. Correlation of Ultrasound Findings, liver and spleen cytology, and prognosis in the Clinical Staging of high metastatic risk canine Mast Cell Tumors. Veterinary Radiology & Ultrasound 2011; Vol. 52, No. 5, 548554. 5. Cannas J.P., Schoning P. Canine mast cell tumors: a comparison of staining techniques. J.Vet. Invest. 1994; 6:458-465. 6. Dobson J. M., Duncan B. Manual of Canine and Feline Oncology. Second edition. England. 2003; 161-167 7. Elmslie R. E. Combination chemotherapy with and without surgery for dogs with high grade mast cell tumors with regional lymph node metastases. Vet. Cancer Soc Newsletter 1997; 20: 6-7. 8. Fujino T.Y., Fukushima Y., Watanabe K., et.al. Biological effect of tyrosine kinase inhibitors on three canine mast cell tumor cell lines with various KIT statuses. J.Vet. Pharmacol. Therap 2011; 35: 97-104. 9. Grabarevic Z., Spoljar J. B., Kurilj A. G., et.al. Mast Cell Tumor in Dogs-Incidence and Histopathological Characterization. Coll, Antropol. 2009; 33:253-258. 10. Hahn K.A. Veterinary Oncology. Butterworth-Heinemann. USA. 2002. 11. London C.A., Galli S. J., Yuuki T., et.al. Spontaneous canine mast cell tumors express tandem duplications in the proto-oncogene c-kit. Experimental Hematology 2009; 27:689-697. 12. Meuten D. J. Tumors in Domestic Animals. Iowa State Press. USA. 2002. 13. Morris J., Dobson J. Small Animal Oncology. Primera edición. Blackwell Science. USA. 2001. 14. North S., Banks T. Introduction to Small Animal Oncology. Saunders Elsevier. 2009. 209 15. Ogilvie G.K., Moore A. S., Manejo del Paciente Canino Oncológico. Guía práctica para la atención compasiva. Editorial Intermédica. Buenos Aires, Argentina 2008. 16. Ozaki K., Yamagami T., Nomura K., et.al. Mast Cell Tumors of Gastrointestinal Tract in 39 dogs. Vet. Pathol. 2002; 39: 557-564. 17. Patnaik A. K., Ehler W.J, MacEwen E.G. Canine Cutaneous Mast Cell Tumor: Morphologic Grading and Survival Time in 83 dogs. Vet. Pathol. 1984; 21:496-474. 18. Simoes J.P.C., Schoning P., Butine M. Prognosis of Canine Mast Cell Tumors: A Comparison of Three Methods. Vet. Pathol. 1994; 31:637-647. 19. Strefezzi R. De F., Xavier J. G., Catao-Dias J. L. Morphometry of canine cutaneous Mast Cell Tumors. Vet. Pathol 2003; 40: 268-275. 20. Strefezzi R. De F., Xavier J. G., Kleeb S. R., Catao-Dias J.L. Nuclear morphometry in cytopathology: a prognosis indicator for canine cutaneous mast cell tumors. J. Vet. Invest. 2009; 21: 821-825. 21. Tham D.H., Vail D.M. Withrow & MacEwen’s Small Animal Clinical Oncology. Saunders Elsevier. USA. 2007. 22. Villalobos A.Kaplan.Canine and Feline Geriatric Oncology Honoring the HumanAnimal Bond. Blackwell Publishing. USA.2007. 23. W. Nelson, R. & Couto, G. Manual of Small Animal Internal Medicine. 4a edición. Editorial Elsevier Mosby 2010. 24. http://www.ht.org.ar/histologia/NUEVAS%20UNIDADES/unidades/unidad3/ masto.htm 25. http://www.nature.com/nature/journal/v420/n6917/fig_tab/nature01324_F1.ht ml 210