Bases moleculares de la hiperplexia hereditaria
Anuncio

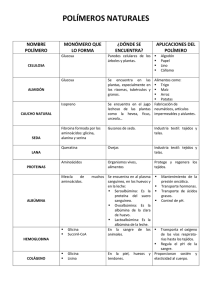
REVISIÓN Bases moleculares de la hiperplexia hereditaria C. Giménez a,b, F. Zafra a,b, B. López-Corcuera a,b, C. Aragón a,b BASES MOLECULARES DE LA HIPERPLEXIA HEREDITARIA Resumen. Introducción. La hiperplexia es un síndrome clínico poco común caracterizado por sobresaltos enérgicos y generalizados en respuesta a estímulos triviales generalmente acústicos o táctiles. La hiperplexia hereditaria se manifiesta justo después del nacimiento y los afectados tienen, durante el período perinatal, un alto riesgo de sufrir muerte súbita, debido a episodios de espasmos laríngeos y fallos cardiorrespiratorios. Objetivo. Revisar las bases genéticas y moleculares, conocidas hasta el momento, subyacentes a la hiperplexia hereditaria. Desarrollo. Aproximadamente en el 30% de los pacientes con hiperplexia hereditaria se ha identificado una mutación génica en el cromosoma 5q32. Este gen codifica la subunidad alfa del receptor de glicina sensible a estricnina, el cual regula el tono muscular en el tallo cerebral y la médula espinal, zonas donde desempeñan un papel fundamental las interneuronas inhibidoras glicinérgicas. El 70% de los pacientes con hiperplexia hereditaria no tiene mutaciones en el receptor de glicina, lo que sugiere que otros genes podrían estar implicados en la enfermedad. Recientemente se han encontrado mutaciones en el gen humano del transportador neuronal de glicina GLYT2 en familias con miembros diagnosticados de hiperplexia. Conclusiones. La hiperplexia hereditaria es una enfermedad genética compleja, en la que intervienen diferentes genes que codifican proteínas de vías glicinérgicas inhibidoras. Las proteínas más importantes implicadas en la hiperplexia son el receptor de glicina (GlyR) y el transportador neuronal de glicina GLYT2. No se descarta la implicación en la enfermedad de otras proteínas que interaccionen con GlyR o con GLYT2, tales como proteínas asociadas, proteínas de andamiaje o proteínas reguladoras. [REV NEUROL 2008; 47: 648-52] Palabras clave. Glicina. Hiperplexia. Neurotransmisión. Receptores. Transportadores. INTRODUCCIÓN La hiperplexia hereditaria o enfermedad del sobresalto (denominada en ocasiones ‘síndrome del bebé entumecido’, OMIM 149400) es un síndrome clínico poco común que se manifiesta muy pronto después del nacimiento (o incluso en el período intrauterino), caracterizado por sobresaltos enérgicos, exagerados y sostenidos en respuesta a estímulos triviales inesperados auditivos, somatosensoriales o visuales [1,2]. La reacción tras estímulos de este tipo es una apreciable rigidez de tronco y extremidades, puños apretados y frecuentes temblores, que en ocasiones pueden recordar actitudes o respuestas propias de ataques epilépticos tónicos, lo que puede llevar a un diagnóstico erróneo de daño cerebral perinatal con espasticidad y síntomas epilépticos [3]. Sin embargo, el electroencefalograma es normal, y existen una serie de test motores que ayudan a discriminar síntomas y permiten llegar a un diagnostico claro de la enfermedad [4,5]. Aunque con el paso de los meses tras en nacimiento algunos de los síntomas iniciales, como la rigidez muscular, puedan atenuarse, el riesgo de muerte súbita del bebé es alto, como consecuencia de fallos cardiorrespiratorios y espasmos laríngeos. Con un desarrollo mental generalmente normal, en los niños con hiperplexia hereditaria subsisten alteraciones motoras a lo Aceptado tras revisión externa: 05.11.08. a Centro de Biología Molecular Severo Ochoa. Universidad Autónoma de Madrid. Consejo Superior de Investigaciones Científicas. b Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER). Instituto de Salud Carlos III. Madrid, España. Correspondencia: Dr. Cecilio Giménez. Centro de Biología Molecular Severo Ochoa. Universidad Autónoma de Madrid. Nicolás Cabrera, 1. E-28049 Madrid. Fax: +34 911 964 420. E-mail: cgimenez@cbm.uam.es Trabajo financiado a través de la Dirección General de Investigación Científica y Técnica del Ministerio de Investigación e Innovación (SAF2005-03185, BFU2005-05931), el Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) del ISCIII, la Comunidad Autónoma de Madrid (S2006/SAL-0253), y una ayuda institucional de la Fundación Ramón Areces. © 2008, REVISTA DE NEUROLOGÍA 648 largo de la vida, más claramente hasta la adolescencia, como son los espasmos exagerados ante estímulos externos triviales. Por otra parte, los individuos afectados se mantienen erguidos con dificultad y caminan con una gran inseguridad, y requieren, en muchos casos, asistencia externa. Esta sintomatología se hace especialmente patente cuando se enfrentan ante un apuro, en una concentración de gente o si se ven, de algún modo, forzados por la prisa. Como consecuencia de estas situaciones, no son infrecuentes caídas fortuitas, con el consiguiente riesgo de lesiones importantes [6]. ALTERACIONES EN LA NEUROTRANSMISIÓN GLICINÉRGICA Aunque durante mucho tiempo se tuvo el convencimiento de que alteraciones en los sistemas de neurotransmisión gabérgica eran las responsables de alteraciones neuromusculares como la hiperplexia, análisis de ligamiento genético demostraron que la región distal del cromosoma 5q estaba relacionada con la hiperplexia hereditaria, y que mutaciones en el gen que codifica la subunidad α del receptor de glicina (GlyR), localizado en esa parte del cromosoma 5 [7,8], causaban formas autosómicas dominantes de hiperplexia. Más recientemente, se ha demostrado que la enfermedad también puede estar causada por mutaciones en el gen responsable de la síntesis de un transportador de glicina en neuronas glicinérgicas [9,10]. Todo ello ha puesto de manifiesto que la hiperplexia hereditaria está directa o indirectamente relacionada con alteraciones en las vías de neurotransmisión glicinérgica inhibidora (Fig. 1). La glicina es, desde el punto de vista estructural, el aminoácido proteinogenético más simple, pero desempeña numerosas funciones metabólicas importantes, especialmente en el sistema nervioso central de los mamíferos. Desde hace años, se ha demostrado que la glicina, al igual que el ácido γ-aminobutírico (GABA), actúa como un neurotransmisor inhibidor. La glicina es especialmente abundante en regiones dorsales del cere- REV NEUROL 2008; 47 (12): 648-652 HIPERPLEXIA HEREDITARIA una caída bifásica y lenta que corresponde a la inactivación y cierre asincrónico de los canales (GlyR) provocada por la retirada de glicina del espacio intersináptico a través de transportadores neuronales o gliales dependientes del sodio [15,16]. Se puede decir que el receptor de glicina se encuentra entre los mejores conocidos hasta el momento, gracias a numerosos estudios bioquímicos, electrofisiológicos, farmacológicos, inmunológicos, genéticos y de biología molecular [17,18]. Una parte importante del éxito en el estudio y conocimiento de este receptor se debe al hecho de que desde hace mucho tiempo se sabe que el GlyR se une fuertemente a estricnina, un alcaloide convulsionante que se extrae del árbol Strychnos nux vomica originario de la India, muy cerca del sitio de unión de la glicina, aunque los epítopos de reconocimiento de estas dos sustancias Figura 1. Esquema de una sinapsis glicinérgica inhibidora. Se indican elementos presinápticos, no coinciden exactamente. + – como el transportador de glicina GLYT2, su estequiometría con Na y Cl , y las proteínas asoSe trata de un canal de cloruro pentamériciadas sintenina, ULIP-6 y sintaxina. VIAAT es el transportador de glicina, y GABA, de vesícuco con un tamaño de poro de 5,2 Å y comlas sinápticas. SSV representa a vesículas sinápticas pequeñas. GLYT1 es el transportador glial de glicina. En el elemento postsináptico se indican los receptores pentaméricos de glicina GlyR puesto de dos tipos de subunidades, α (funy las proteínas asociadas gefirina y colibistina. cionales) y β (estructurales), con una estequiometría 3α:2β (aunque datos recientes subro, como el tallo cerebral, la zona pontinocerebelosa y la mé- gieren que la proporción de subunidades puede ser 2α:3β). Hasdula espinal. En estas regiones, la glicina se libera por las neu- ta el momento, se han identificado cuatro genes diferentes en ronas glicinérgicas de forma dependiente del calcio tras la lle- vertebrados (denominados Glra 1-4), que codifican subunidades gada de un potencial de acción; una vez en el espacio sináptico, GlyR α(1-4), los cuales muestran entre sí una identidad de seinteracciona y activa a los GlyR, que pertenecen, al igual que cuencia muy alta. Sin embargo, sólo se ha identificado un gen los receptores de GABAA/C, a la superfamilia de receptores (Glrb) que codifica la subunidad GlyR β. Unida fuertemente al pentaméricos del tipo acetilcolina (nAChR) [11]. En el tallo ce- GlyR se halla otra proteína que copurifica con ella, la gefirina, rebral y la médula espinal, las interneuronas glicinérgicas con- que le sirve de anclaje a la tubulina [19]. trolan la generación de ritmos motores, la coordinación de resCada una de las subunidades del receptor está constituida puestas reflejas espinales y el procesamiento de señales senso- por una cadena polipeptídica que atraviesa la membrana meriales. Las interneuronas espinales glicinérgicas del tipo Ia me- diante cuatro dominios, y que deja el extremo amino y el extredian circuitos reflejos de inhibición recíproca y permiten, de mo carboxilo hacia la parte extracelular a modo de antenas. El esta forma, la relajación de músculos antagónicos y la contrac- extremo amino, más largo que el carboxilo, se encuentra glicoción coordinada de músculos agonistas, mientras que las inter- silado. Se conocen con detalle los residuos de aminoácidos inneuronas de Renshaw regulan la excitabilidad de motoneuro- volucrados en la unión a ligandos tanto glicina como estricnina, nas mediante la producción de señales inhibitorias recurrentes la interacción con subunidades adyacentes y su unión con un a través de un sistema de retroalimentación negativa [12]. Por gran número de sustancias [18]. otra parte, la glicina es un importante neurotransmisor que inComo se ha indicado, desde hace algunos años se ha puesto terviene en el procesamiento de la información auditiva en los de manifiesto que la hiperplexia hereditaria se relaciona con núcleos cocleares, en el complejo de la oliva superior y en el mutaciones sin sentido que afectan al gen GLRA1 que codifica colículo inferior [13]. Además, neuronas glicinérgicas inhibito- la subunidad α1 del receptor de glicina, el cual se localiza en el rias están involucradas en el procesamiento de la información cromosoma 5q32 y puede presentar rasgos autosómicos dominantes o recesivos dependientes del tipo y posición de la mutavisual en la retina [14]. ción. La mayor parte de las mutaciones se encuentran alrededor del dominio transmembrana dos de la subunidad α (Fig. 2). De MUTACIONES EN EL RECEPTOR DE GLICINA entre las numerosas mutaciones con carácter autosómico domiLa unión de la glicina a los receptores postsinápticos del tipo nante encontradas, la más frecuente es la R271L o R271Q (susGlyR produce un incremento en la conductancia a iones cloruro titución de una arginina en posición 271 por una leucina o por por parte de la membrana plasmática de la neurona postsinápti- una glutamina). Las formas esporádicas autosómicas recesivas ca. Las sinapsis glicinérgicas median respuestas rápidas me- de la enfermedad están ligadas a una mutación producida en el diante corrientes que siguen un perfil de tiempo complejo. Típi- bucle intracelular dos, y consisten en la sustitución I244N (camcamente comienza con una primera fase de subida rápida, debi- bio de una isoleucina por una asparragina). Se han encontrado do a la apertura rápida y sincrónica de múltiples canales de clo- también formas recesivas de la enfermedad con mutaciones que ruro del tipo GlyR como consecuencia de la interacción de la dan como resultado la carencia de expresión de la subunidad α. glicina liberada al espacio sináptico con el receptor, seguida de A pesar de la ausencia de expresión de subunidades α en estos REV NEUROL 2008; 47 (12): 648-652 649 C. GIMÉNEZ, ET AL pacientes, los síntomas de la enfermedad no son más graves que los de pacientes en los que la subunidad α funciona sólo de manera parcial [16,18]. Más recientemente, se han descrito casos de la enfermedad causados por mutaciones en la subunidad tipo β del GlyR [20], así como mutaciones en genes que codifican proteínas asociadas al receptor de glicina, como gefirina (GPNH) y colibistina (ARHGEF9) [21,22]. Por todo lo descrito, a la hiperplexia se la consideraba incluida en el grupo de la canalopatías. Para casi todas estas mutaciones se han generado líneas de ratones mutantes, con el resultado de fenotipos muy similares a los hallados en la enfermedad en humanos [23-25]. MUTACIONES EN EL TRANSPORTADOR NEURONAL DE GLICINA GLYT2 A pesar de todas las mutaciones encontradas que afectan al funcionamiento del receptor de glicina en sinapsis inhibidoras, en alrededor del 70% de los pacientes diagnostica- Figura 2. Modelo esquemático de la estructura secundaria de la subunidad α1 receptor postsináptico de glicina GlyR. La proteína atraviesa la membrana dos de hiperplexia no se pudieron hallar mutaciones en los del mediante cuatro dominios y deja, a modo de antenas extracelulares, los extregenes Glyr, GPNH o ARHGEF9, lo que sugería que otros mos amino y carboxilo. El extremo amino está glicosilado. Se indica con puntos genes deberían estar involucrados en la enfermedad. Du- oscuros la localización aproximada de las mutaciones causantes de hiperplexia rante este tiempo, el grupo de Betz [26] describió que rato- encontradas hasta el momento. nes carentes del gen que codifica el transportador neuronal de glicina GLYT2 desarrollaban posnatalmente un fenotipo que recordaba todos los síntomas de hiperplexia en humanos. Como se indicaba antes, recientemente se han descrito vaLa glicina liberada al espacio sináptico no posee sistema al- rias mutaciones en el gen SLC6A5, localizado en el brazo corto guno de inactivación enzimática. Se retira por transportadores del cromosoma 11, que codifica el transportador presináptico específicos (GLYT), localizados en la membrana plasmática de de glicina, y que causan hiperplexia. El gen posee 16 exones las neuronas o de las células de glía adyacentes, a través de un distribuidos en una región de aproximadamente 21,4 Mb, en la proceso activo, electrogénico, acoplado al gradiente electroquí- que sólo el primer exón contiene el sitio de iniciación de la tramico de Na+ y dependiente de Cl–. Existen dos variantes de ducción. GLYT2 es una proteína politópica con 12 dominios transportadores de alta afinidad para glicina en el sistema ner- transmembrana, que tiene los extremos amino y carboxilotermivioso central de los mamíferos, llamados GLYT1 y GLYT2, de nales en el interior celular, y posee un gran bucle extracelular los cuales, a su vez, existen varias isoformas producidas me- altamente glicosilado (Fig. 3). diante procesamiento alternativo o bien por el uso de diferentes De los 16 exones del gen SLC6A5, en varios de ellos se han promotores. encontrado mutaciones relacionadas con hiperplexia [9,10]. La Los transportadores de glicina son miembros de una super- mayor parte tienen carácter recesivo, aunque en un caso era dofamilia de transportadores de neurotransmisores que incluye a minante. Algunas de estas mutaciones generan un transportador las aminas biógenas (norepinefrina, dopamina y serotonina), truncado y, por tanto, inactivo (Y377X, V432F+fs97, Q630X, GABA, osmolitos (GABA, betaína, taurina y creatina), amino- P108L+fs25). Otras son mutaciones puntuales o sinsentido que, ácidos como la propia glicina y la prolina, y una serie de trans- aunque producen una proteína que se expresa en la membrana portadores sin sustrato fisiológico conocido hasta el momento plasmática, es una proteína inactiva, por fallos en la unión de alllamados ‘transportadores huérfanos’. guno de sus ligandos glicina (mutación W482R) o Na+ (muGLYT1 y GLYT2 difieren en localización, estequiometría y tación N509S), o por estar la sustitución en regiones cruciales papel fisiológico [27-29]. GLYT2 reside principalmente en la para la actividad de transporte (T425M, Y491C, N511S). En médula espinal y el tallo cerebral, mientras que GLYT1 se en- otros polimorfismos de hiperplexia hereditaria, se produce un cuentra, además, en otras muchas partes del cerebro y en tejidos GLYT2 que no puede escapar de los compartimentos intraceperiféricos, como el páncreas y, especialmente, el hígado. Por lulares, como el mutante S512R, cuyo tráfico intracelular está otra parte, GLYT2 se localiza exclusivamente en la presinapsis alterado. Se ha sugerido el posible papel de dominante negativo del de neuronas glicinérgicas, mientras que el GLYT1 glial se encuentra principalmente asociado a vías glutamatérgicas [30-32]. tráfico de GLYT2 para el mutante S512R, probablemente meRecientemente, se ha descrito la existencia de GLYT1 en neuro- diante retención del transportador silvestre en un oligómero conas glutamatérgicas asociado físicamente a receptores de gluta- mún. También se han descrito algunas mutaciones que aparenmato del tipo NMDA [33,34]. GLYT1 es el principal regulador temente se toleran bien y producen transportadores aparentede los niveles de glicina en el espacio sináptico, por lo que su si- mente activos y funcionales, para los que se piensa que el defeclenciamiento génico aumenta la función glicinérgica inhibidora. to se relaciona no ya con su actividad de transporte, sino con su Sin embargo, la supresión de GLYT2 disminuye esta neurotrans- capacidad de interacción con proteínas accesorias necesarias misión, debido a su papel en el reciclado de la glicina y rellena- para el tráfico de GLYT2 hacia la membrana en el sistema nerdo de las vesículas sinápticas en la terminal presináptica [26,35]. vioso (mutantes L306V, A89E, G767R) [9,10]. 650 REV NEUROL 2008; 47 (12): 648-652 HIPERPLEXIA HEREDITARIA tejido cerebral [38]. La sintaxina está implicada en la regulación de GLYT2 por la actividad neuronal, al modular el número de transportadores en la membrana plasmática. La despolarización de la membrana en presencia de calcio induce el tráfico rápido de GLYT2 a la membrana en asociación con sintaxina. El estímulo despolarizante mantenido promueve la retirada del transportador hacia el interior celular, de modo independiente de la asociación con proteína SNARE [39]. Por otra parte, ULIP6, una proteína específica de cerebro y codificada por el gen DPYSL5, interacciona con el doFigura 3. Esquema de la estructura secundaria del transportador neuronal de glicina GLYT2. Se trata de una proteína politópica con 12 dominios transmembrana y un bucle extracelular altamente glicosilado. minio aminoterminal intracelular de Los extremos amino y carboxilo se encuentran localizados en el interior celular. Se indica con puntos GLYT2 [40]. Esta interacción, depenoscuros la posición de mutaciones causantes de la hiperplexia hereditaria. diente de fosforilación, parece ser bastante específica, puesto que otros miembros de la misma familia génica, como PERSPECTIVAS DE FUTURO ULIP1-5, no interaccionan con GLYT2. La proteína ULIP6 está A pesar de los avances experimentados en poco tiempo en cuanimplicada en el tráfico intracelular de GLYT2, es decir, regula la to al conocimiento de las bases genéticas que subyacen a la hivía de inserción en la membrana plasmática, su permanencia en perplexia hereditaria, aún quedan enfermos diagnosticados de ella y su posterior reciclaje. Es un proceso muy importante en la la enfermedad que son negativos a mutaciones en los genes vida y funcionalidad de GLYT2 y, por lo tanto, de las sinapsis GLRA1, GLRB, ARHGEF9, GPHN y SLC6A5. Esto sugiere que donde se encuentra. Mutaciones en esta proteína, u otras similaotros genes, aún no determinados, deben estar involucrados en res, tendrían una gran repercusión en las sinapsis glicinérgicas y, la etiología de la enfermedad, y confirma la heterogeneidad gepor lo tanto, en la hiperplexia. nética de la hiperplexia. Otro posible candidato a estar involucrado en la hiperplexia Estudios de proteómica con GLYT2 pueden arrojar luz aceres el transportador VIAAT, codificado por el gen SLC32A1 y loca del camino que se debe seguir para investigar nuevos genes calizado en el cromosoma 20q11.23. Se trata del transportador relacionados con la enfermedad. Es frecuente que las proteínas vesicular de glicina y GABA al interior de las vesículas sináptide membrana involucradas en la actividad de la sinapsis como cas en terminales glicinérgicos y gabérgicos. VIAAT acumula receptores, canales o transportadores se encuentren asociadas a glicina en el interior de las vesículas sinápticas mediante un prootras proteínas accesorias que actúan en la localización, posiceso activo dependiente de un gradiente de protones. Formas cionamiento correcto de la proteína en cuestión o en su reciclaaberrantes de esta proteína que impidieran el correcto almacenaje. Es el caso del receptor de glicina con proteínas como la gefimiento del neurotransmisor en vesículas provocarían alteraciorina o la colibistina, a las que se encuentra asociada para su annes importantes en el funcionamiento de la sinapsis glicinérgica. claje correcto a las densidades postsinápticas y al citoesqueleto. Hasta el momento, se han descrito tres proteínas accesorias CONCLUSIÓN que interaccionan con el transportador de glicina GLYT2. Se trata de la sintenina-1, la sintaxina 1A y ULIP-6. La sintenina-1 La hiperplexia hereditaria es una enfermedad genética compleja es una proteína con dominios PDZ que se asocia no sólo a en la que pueden estar implicados diferentes genes (GLRA1, GLYT2, sino también a otras proteínas de terminales sinápticos GLRB, ARHGEF9, GPHN y SLC6A5) que codifican proteínas como receptores de glutamato metabotrópicos, receptores AMPA involucradas en el funcionamiento de las vías glicinérgicas inhiy cainato, sindecanes, neurexinas y efrina B. La unión de la sinbidoras. Hasta el momento, las dos proteínas más importantes tenina-1 a estas proteínas puede estar involucrada en su correcidentificadas como responsables de la hiperplexia son el recepto posicionamiento en la membrana y en la regulación de su tor de glicina sensible a estricnina (GlyR) y el transportador transporte y tráfico en el interior celular [36,37]. neuronal de glicina GLYT2. No se descarta la implicación en la La proteína SNARE sintaxina 1A interacciona física y funenfermedad de otras proteínas que interaccionen con GlyR o cionalmente con GLYT2, coinmunoprecipitando con los transcon GLYT2, tales como proteínas asociadas, proteínas de andaportadores de glicina tanto en sistemas heterólogos como en el miaje o proteínas reguladoras. BIBLIOGRAFÍA 1. Suhren O, Bruyn G, Tynman J. Hyperekplexia. A hereditary startle syndrome. J Neurol Sci 1966; 3: 577-605. 2. Saenz-Lope E, Herranz-Tanarro FJ, Masdeu JC, Chacón-Peña JR. Hyperekplexia: a syndrome of pathological startle responses. Ann Neurol 1984; 15: 36-41. 3. Praveen V, Patote SK, Whitehall JS. Hyperekplexia in neonates. Postgrad Med J 2001; 77: 570-2. REV NEUROL 2008; 47 (12): 648-652 4. Meinck HM. Startle and its disorders. Neurophysiol Clin 2006; 36: 357-64. 5. Forcadas-Berdusán MI, Valle-Quevedo E. Síndromes epilépticos ambiguos: perspectivas desde el adulto. Rev Neurol 2006; 43 (Supl 1): S173-6. 6. Tijssen MA, Shiang R, Van Deutekom J, Boerman RH, Wasmuth JJ, Sandkuil LA, et al. Molecular genetic revaluation of the Dutch hyperekplexia family. Arch Neurol 1995; 52: 578-82. 651 C. GIMÉNEZ, ET AL 7. Shiang R, Ryan SG, Zhu YZ, Hahn AF, O’Connell P, Wasmuth JJ. Mutations in the α1 subunit of the inhibitory glycine receptor cause the dominant neurologic disorder, hyperekplexia. Nat Genet 1993; 5: 351-8. 8. Rees MI, Andrew M, Jawad S, Owen MJ. Evidence for recessive as well as dominant forms of startle disease (hyperekplexia) caused by mutations in the α1 subunit of the inhibitory glycine receptor. Hum Mol Genet 1994; 3: 2175-9. 9. Rees MI, Harvey K, Pearce BR, Chung SK, Duguid IC, Thomas P, et al. Mutations in the gene encoding GlyT2 (SLC6A5) define a presynaptic component of human startle disease. Nature Genet 2006; 38: 801-6. 10. Eulenburg V, Becker K, Gomeza J, Schmitt B, Becker CM, Betz H. Mutations within the human GLYT2 (SLC6A5) gene associated with hyperekplexia. Biochem Biophys Res Commun 2006; 348: 400-5. 11. Zafra F, Aragón C, Giménez C. Molecular biology of glycinergic neurotransmission. Mol Neurobiol 1997; 14: 117-42. 12. Legendre P. The glycinergic inhibitory synapse. Cell Mol Life 2001; 58: 760-93. 13. Wenthold R, Hunter C. Immunochemistry of glycine and glycine receptors in the central auditory system. In Ottersen OP, Storm-Mathisen J, eds. Glycine neurotransmission. Chichester: John Wiley; 1990. p. 391-415. 14. Pourcho RG, Goebel DJ. Autoradiographic and immunocytochemical studies of glycine containing neurons in the retina. In Ottersen OP, Storm-Mathisen J, eds. Glycine neurotransmission. Chichester: John Wiley; 1990. p. 355-89. 15. Eulenburg V, Armsen W, Betz H, Gomeza J. Glycine transporters: essential regulators of neurotransmission. Trends Biochem Sci 2005; 30: 325-33. 16. Betz H, Laube B. Glycine receptors: recent insights into their structural organization and functional diversity. J Neurochem 2006; 97: 1600-10. 17. Rajendra S, Lynch JW, Schofield PR. The glycine receptor. Pharmacol Ther 1997; 73: 121-46. 18. Lynch JW. Molecular structure and function of the glycine receptor chloride channel. Physol Rev 2004; 84: 1051-95. 19. Laube B, Maksay G, Schemm R, Betz H. Modulation of glycine receptor function: a novel approach for therapeutic intervention at inhibitory synapses? Trends Pharmacol Sci 2002; 23: 519-27. 20. Rees MI, Lewis TM, Kwok JB, Portier GR, Govaert P, Snell RG, et al. Hyperekplexia associated with compound heterozygote mutations in the beta-subunit of the human inhibitory glycine receptor (GLRB). Hum Mol Genet 2002; 11: 853-60. 21. Rees MI, Waldvogel HJ, Ward H, White JH, Evans L, Duguid IC, et al. Isoform heterogeneity of the human gephyrin gene (GPHN), binding domains to the glycine receptor, and mutation analysis in hyperekplexia. J Biol Chem 2003; 278: 24688-99. 22. Harvey K, Duguid IC, Alldred MJ, Beatty SE, Ward H, Keep NH, et al. The GDP-GTP exchange factor collybistin: an essential determinant of neuronal gephyrin clustering. J Neurosci 2004; 24: 5816-26. 23. Mulhardt C, Fischer M, Gass P, Simon-Chazottes D, Guenet JL, Kuhse J, et al. The spastic mouse: aberrant splicing of glycine receptor beta subunit mRNA caused by intronic insertion of L1 element. Neuron 1994; 13: 1003-15. 24. Saul B, Schmieden V, Kling G, Mulhardt C, Gass P, Khuse J, et al. Point mutation of glycine receptor alpha 1 subunit in the spasmodic mouse affects agonist responses. FEBS Lett 1994; 350: 71-6. 25. Buckwalter MS, Cook SA, Davisson MT, White WF, Camper SA. A frameshift mutation in the mouse alpha 1 glycine receptor gene (Glra1) results in progressive neurological symptoms and juvenile death. Hum Mol Genet 1994; 3: 2025-30. 26. Gomeza J, Ohno K, Hulsmann S, Armsen W, Eulenburg V, Richter DW, et al. Deletion of the mouse glycine transporter 2 results in a hyperekplexia phenotype and postnatal lethality. Neuron 2003; 40: 796-806. 27. Aragón C, López-Corcuera B. Glycine transporters: crucial roles of pharmacological interest revealed by gene deletion. Trends Pharmacol Sci 2005; 26: 283-6. 28. Eulenburg V, Armsen W, Betz H, Gomeza J. Glycine transporters: essential regulators of neurotransmission. Trends Biochem Sci 2005; 30: 325-33. 29. Aragón C, López-Corcuera B. Structure, function and regulation of glycine transporters. Eur J Pharmacol 2003; 479: 249-62. 30. Jursky F, Nelson N. Localization of glycine transporter (GLYT2) reveals correlation with the distribution of glycine receptor. J Neurochem 1995; 67: 336-44. 31. Zafra F, Aragón C, Olivares L, Danbolt NC, Giménez C, Storm-Mathisen J. Glycine transporters are differentially expressed among CNS cells. J Neurosci 1995; 15: 3952-69. 32. Zafra F, Gomeza J, Olivares L, Aragón C, Giménez C. Regional distribution and developmental variation of the glycine transporters GLYT1 and GLYT2 in the rat CNS. Eur J Neurosci 1995; 7: 1342-52. 33. Cubelos B, Giménez C, Zafra F. Localization of the GLYT1 glycine transporter at glutamatergic synapses in the rat brain. Cereb Cortex 2005; 15: 448-59. 34. Cubelos B, González-González MI, Giménez C, Zafra F. The scaffolding protein PSD-95 interacts with the glycine transporter GLYT1 and impairs its internalization. J Neurochem 2005; 95: 1047-58. 35. Gómez J, Hulsmann S, Ohno K, Eulenburg V, Szoke D, Richter DW, et al. Inactivation of the glycine transporter 1 gene discloses vital role of glial glycine uptake in glycinergic inhibition. Neuron 2003; 40: 785-96. 36. Ohno K, Koroll M, El-Far O, Scholze P, Gomeza J, Betz H. The neuronal glycine transporter 2 interacts with the PDZ domain protein sybtenin-1. Mol Cell Neurosci 2004; 26: 518-29. 37. Hiberc H, Perestenko O, Nishimune A, Meyer MG, Nakanishi S, Henley JM, et al. The PDZ proteins PICK1, GRIP, and syntenin bind multiple glutamate receptor subtypes. Analysis of PDZ binding motifs. J Biol Chem 2002; 277; 15221-4. 38. Geerlings A, López-Corcuera B, Aragón C. Characterization of the interactions between the glycine transporters GLYT1 and GLYT2 and the SNARE protein syntaxin 1A. FEBS Lett 2000; 470: 51-4. 39. Geerlings A, Núñez E, López-Corcuera B, Aragón C. Calciun and syntaxin 1-mediated trafficking of the neuronal glycine transporter GLYT2. J Biol Chem 2001; 276; 17584-90. 40. Horiuchi M, Loebrich S, Brandstraetter JH, Kneussel M, Betz H. Cellular localization and subcellular distribution of Unc-33-like protein 6, a brain specific protein of the collapsing response mediator protein family that interacts with the neuronal glycine transporter 2. J Neurochem 2005; 94: 307-15. MOLECULAR BASES OF HEREDITARY HYPEREKPLEXIA Summary. Introduction. Hereditary hyperekplexia is a rare clinical syndrome typically characterized by sudden and generalized startle in response to trivial but unexpected tactile or acoustic stimulations. Typically it is accompanied by a temporally but complete muscular rigidly, and usually it manifests shortly after birth. Some affected infants die suddenly from lapses in cardiorespiratory function. Mental development usually is normal. Aim. To summarize and update the molecular bases underlying the hereditary hyperekplexia syndrome. Development. Approximately 30% of the individuals suffering hereditary hyperekplexia show mutations on a gene located on chromosome 5q32 with a dominant or recessive trait. This gene encodes the alpha subunit of the strychnine-sensitive glycine receptor, which plays a crucial role in inhibitory glycinergic neurotransmission that process sensory and motor information. About 70% of the patients with hyperekplexia do not show genetic defects in the glycine receptor gene; this suggested that additional genes might be affected in this disease. Recent studies have reveals that mutations in the neuronal glycine transporter GLYT2 are a second major cause of hyperekplexia. Conclusions. Hereditary hyperekplexia is a complex genetic disease in which several genes can be implicated, all of them directly or indirectly involved in inhibitory glycinergic neurotransmission. Two major proteins involved in hyperekplexia are the strychninesensitive glycine receptor (GlyR) and the neuronal glycine transporter GLYT2. Implication of secondary additional accompanying or interacting proteins in glycinergic terminals are not ruled out. [REV NEUROL 2008; 47: 648-52] Key words. Glycine. Hyperekplexia. Neurotransmission. Receptors. Transporters. 652 REV NEUROL 2008; 47 (12): 648-652