clase 01: Primera y Segunda Ley Combinada 1. Primera y
Anuncio

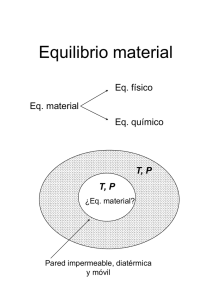
Termodinámica del equilibrio Profesor: Alı́ Gabriel Lara clase 01: Primera y Segunda Ley Combinada 1. Primera y segunda ley combinada Para iniciar un estudio termodinámico debemos establecer los lı́mites de nuestro sistema. Para ello supongamos que tenemos un sistema arbitrario al cual entra y sale masa, reciba energı́a en forma de calor desde los alrededores y haga un trabajo sobre los alrededores. Evc = U + EK + EP me (u + ek + ep) W ms (u + ek + ep) Q Aplicando el primer principio de la termodinámica a este sistema, obtendremos: δ Q̇ − δ Ẇ + (u + ek + ep )e δme − (u + ek + ep )s δms = dEV C = (d U + d EK + d EP )V C Por otra parte, el trabajo total realizado lo podemos definir como; Ẇ = Ẇsist + Ẇflujo Donde Ẇsist es el trabajo que realiza el sistema sobre sus alrededores a través de ejes rotatorios, expansión, compresión, etc. y se denomina trabajo de eje. Ẇflujo es el trabajo asociado con las masas δme y δms que cruzan la frontera del sistema y se refiere al trabajo hecho por un diferencial de masa para entrar o salir del sistema. sistema F me F ms y se define como Ẇflujo = Ps vs − Pe ve ⇒ Ẇ = Ẇs + Ps vs − Pe ve sustituyendo en el balance de energı́a, nos queda; (u + ek + ep + P v)e δme − (u + ek + ep + P v)s δms + δ Q̇ − δ Ẇs = (dU + dEK + dEP ) (1) Como podemos ver, en los términos de energı́a asociados al flujo de masa de la entrada y la salida aparece una cantidad de la forma u + P v que es muy común en termodinámica. En vista que todas estas cantidades son propiedades son funciones de estado del sistema se encontró conveniente definir una nueva propiedad extensiva llamada entalpı́a (H), la cual se expresa como; H = U + PV clase 01-1 (2) si ahora sustituimos el término de entalpı́a en el balance (1), nos queda; (ek + ep + h)e δme − (ek + ep + h)s δms + δ Q̇ − δ Ẇs = (dU + dEK + dEP )V C (3) La ecuación (3) es la expresión más general de la primera ley. Si el sistema es cerrado, es decir, sin masa entrante ni saliente y suponiendo que no presenta cambios en la EK y EP y que los cambios de ek y ep son despreciables con respecto a h, entonces la ecuación (3) se simplifica a: dU = δQ − δW (4) si ahora introducimos la definición de trabajo para un sistema cerrado reversible, nos queda; dU = δQ + Pext dV ≡ δQ − Psist dV = δQ − P dV (5) Ahora veamos como nos queda el balance de entropı́a para este sistema. Como recordaremos la entropı́a es una propiedad de estado que se define como; ( ) δQ dS ≡ (6) T rev Si ahora nuestro sistema está en equilibrio térmico interno, entonces podemos escribir (6) como; δQ = T dS (7) Ahora si combinamos las ecuaciones (5) y (7) nos queda; dU = T dS − P dV (8) La cual se conoce como relación combinada de la primera y segunda ley de termodinámica y es muy importante porque relaciona todas las propiedades termodinámicas primarias P , V , T , U , S y es válida para cualquier sistema cerrado y que sufra cambio entre estados de equilibrio. Sabiendo que bajo ciertas restricciones podemos escribir que: H = U + PV (9) dH = dU + d(P V ) = dU + P dV + V dP (10) De esta manera; Combinando esta expresión con (8); P dV + P dV + V dP dH = T dS − = T dS + V dP (11) De la energı́a de Helmholtz; F dF dF dF = U − TS = dU − d(T S) = dU − T dS − SdT − − SdT − P dV = T dS T dS = −SdT − P dV clase 01-2 (12) Finalmente, de la energı́a libre de Gibbs G = H − TS dG = dH − d(T S) = dH − T dS − SdT − SdT + V dP − T dS dG = T dS dG = −SdT + V dP (13) De esta manera, el conjunto completo de estas funciones serı́a dU = T dS − P dV → U = U (S, V ) dH = T dS + V dP → H = H(S, P ) dF = −SdT − P dV → F = F (T, V ) dG = −SdT + V dP → G = G(T, P ) (14a) (14b) (14c) (14d) Es importante recordar que para deducir estas expresiones se ha supuesto equilibrio interno tanto mecánico como térmico. Además, hemos supuesto que único trabajo que se realiza en el sistema es de expansión y ocurre en forma reversible. Por otra parte, las ecuaciones (14) nos indica las variables naturales de cada uno de las propiedades termodinámicas. Es decir, por ejemplo S y V son las variables naturales de U . La utilidad es que bajo ciertas circunstancias la variación ∆U , ∆H, ∆F y ∆G son magnitudes tangibles que representan el trabajo útil. Por esta razón suelen denominarse propiedades energéticas. Aunque, estrictamente hablando, solo la energı́a interna representa la energı́a en cualquier circunstancia. Al ser las propiedades termodinámicas vistas hasta este momento funciones de estado no dependen del tipo de proceso sino del estado inicial y final, por lo tanto son independientes del camino recorrido. Si hacemos las diferenciales totales resulta; ( ( ) ) ∂U ∂U dU = dS + dV (15) ∂S V ∂V S ( ( ) ) ∂H ∂H dH = dS + dP (16) ∂S P ∂P S ( ( ) ) ∂F ∂F dF = dT + dV (17) ∂T V ∂V T ( ) ( ) ∂G ∂G dG = dT + dP (18) ∂T P ∂P T Comparándolas con las ecuaciones (14) resulta que; ( ) ( ) ∂U ∂H T = = ∂S V ∂S P ( ) ( ) ∂U ∂F −P = = ∂V S ∂V T ( ) ( ) ∂H ∂G V = = ∂P S ∂P T ( ) ( ) ∂F ∂G −S = = ∂T V ∂T P clase 01-3 (19) (20) (21) (22) Este conjunto de ecuaciones pueden ser consideradas como definiciones termodinámicas de T , P , V y S. Resumiendo los tipos de propiedades tenemos propiedades primarias, las cuales se usan como propiedades de referencia T , P , V , S y x utilizadas para definir el estado de un sistemas de las cuales T , P y x son intensivas mientras que V y S son extensivas. Tenemos propiedades energéticas U , H, F , G que son propiedades extensivas cuyo valor puntual solo se conoce con respecto a un estado de referencia arbitrario y dependen solo del estado inicial y final del sistema. Finalmente, tenemos propiedades del proceso Q y W que representan la forma como cambian las propiedades del sistema y dependen de la trayectoria del proceso. clase 01-4