Teórica 26-08 Dispersiones
Anuncio

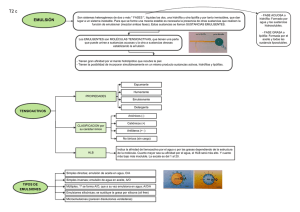
Química de los Alimentos Sistemas alimentarios Agua Hidratos de carbono Lípidos Proteínas Enzimas Vitaminas y minerales Pigmentos y propiedades sensoriales Aditivos Alteraciones Métodos analíticos de uso general Macrocomponentes Alteraciones y adulteraciones macro componentes Evaluación de propiedades funcionales Sistemas alimentarios Dispersiones. Fenómenos de superficie, surfactantes. Interacciones coloidales. Angulo de contacto. Dispersiones líquidas y fenómenos de agregación. Geles. Emulsiones. Espumas. Formación y estabilidad de las distintas dispersiones. Bibliografia Sistemas dispersos: consideraciones básicas. P Walstra. Capítulo 3. (O F Fennema. Q í i de Química d Alimentos. Ali t Ed. Ed Acribia. A ibi 2000. 2000 Dispersiones alimenticias. W Powrie y M Tung. Capitulo 12. (O Fennema. Química de Alimentos. Edición en español. Ed Reverte. 1982. Estado de dispersión. J. G. Montejano Gaitán. Capítulo 10. Química de Alimentos. S Badui Dergal. Pearson Education. 2006. 4º Edición. 1 Sistemas dispersos alimentos Tejidos comestibles vegetales corte mecánico cárnicos Dispersiones Sistema formado por 2 o mas fases Clasificación de las dispersiones Tamaño de partícula: •coloidales 1 nm y 0,2 μm •groseras >0,2- 0,5 μm 2 Propiedades de los sistemas coloidales La fase interna por su tamaño le confiere al sistema propiedades características: cinéticas, ópticas y eléctricas. Propiedades ópticas: - Dispersión de la luz (Efecto Tyndall) Propiedades cinéticas: - Movimiento Browniano Propiedades eléctricas: - Las partículas coloidales están cargadas eléctricamente con respecto al medio dispersante Clasificación de los coloides a) Estado físico de las partículas: fase dispersa (fd), fase continua (fc) b) Afinidad entre las partículas de las fases Fase Interna – Dispersa – Discontinua Fase Externa – Dispersante – Continua Estado físico de las partículas para sistemas de 2 fases no miscibles 3 Sistemas multifásicos Constan de 2 o mas fases dispersas en una continua emulsión-suspensión-espuma emulsión suspensión espuma fase continua: solución acuosa ketchup Crema batida fases dispersas: fases dispersas: aceite, aire, sólidos de tomate aceite, aire, agregados proteicos, ggrasa sólida Mayonesa fases dispersas: aceite, aire, agregados proteicos Afinidad entre las partículas de las fases: Liofílicos Liofóbicos Interacciones electrostáticas 4 Consecuencias de los estados dispersos •No hay equilibrio termodinámico: Inestabilidad física •Hay compartimentalización de componentes (ej flavor, aditivos) • Sistemas con comportamiento reológicos específicos • Impacto sobre la apariencia ya que presencia de partículas > a 50 nm provocan dispersión de la luz Fenómenos de superficie y de interfase: determinan la estabilidad de un coloide γ = tensión superficial o interfacial Fuerzas responsables: •en compuestos polares ptes H y Van der Waals •en compuestos no polares Van der Waals Fuerzas de atracción entre moléculas en la superficie y en el seno de la fase liquida 5 Efecto de la temperatura sobre la tensión superficial Efecto de la temperatura sobre la tensión interfacial entre agua y aceites Formación y estabilización de emulsión γ < 10 dyn/cm 6 Efecto de los solutos sobre la tensión superficial del agua Solutos tipo I soluciones l i de d sales l inorgánicas i á i comp con OH- adsorción - ; conc de soluto en el seno del líq es mayor que en la superficie Solutos tipo II soluciones de tensioactivos adsorción + ↓ energía libre necesaria para que las moléculas se desplacen a interfase Surfactantes Sustancias tipo jabón Polímeros Sustancias tipo jabón: Macromoléculas moléculas antipáticas pequeñas sintéticas o proteínas se ubican en la interfase forman micelas 7 Formación de micelas Fig. 3 Cdo la región interfacial esta llena y el excedente de tensioactivo forma micelas, se supero la CMC Surfactantes: clasificación Según la naturaleza de l parte la t hidrofílica hid fíli •noionicos •anionicos •cationicos Según origen •naturales •sintéticos 8 SURFACTANTES IONICOS • Sales de ácidos grasos • Ácidos grasos Na N - + O Oleatos de sodio y potasio O No se usan usualmente •Esteres del ácido láctico: se utilizan en panadería •Fosfolípidos Lecitina que contiene O N(CH + 3 )3 PO 2 - O Fosfatidilcolina, fosfatidiletanolamina, fosfolípidos de inositol O O O SURFACTANTES NO IONICOS •Monogliceridos y Digliceridos O HO HO O O O O HO O 9 • Esteres grasos del sorbitan (spans®) Se usan en panadería •Esteres de polioxietileno y sorbitan tweens®) OH ( O O )a O ( O )b OH O C O Se usan en aderezos para ensalada O O ( O ) OH c Mecanismo de adsorción de distintos surfactantes Mecanismo de adsorción de surfactantes en una interfase aceite-agua o aire-agua 1 jabón, 2 tween, 3 polímero pequeño, 4 proteína globular 10 Proteínas como surfactantes Buena hidrofobicidad de superficie Alto grado de flexibilidad Buena difusión hacia interfase Propiedades de las proteínas adsorbidas Muchos alimentos contienen surfactantes (ácidos grasos, monoacilgliceridos, fosfolípidos) Surfactantes modifican las propiedades de las proteínas adsorbidas afectan estabilidad de emulsiones y espumas Selección del surfactante adecuado Balance hidrofilico-lipofilico Método HLB % relativo de grupos funcionales hidrofilicos e hidrofobicos en la molécula del surfactante HLB estimar la atracción simultánea que experimenta por las fases acuosa y oleosa. Ecuaciones para calcular valores de HLB para algunos tipos d surfactantes de f t t no iónicos ió i HLB=20 (1-S/A) S índice de saponificación del éster A índice de acidez del ácido 11 Contribución de los grupos al valor de HLB HLB=Σ (n º grupos hidrofílicos)- Σ (nº grupos lipofílicos)+7 BALANCE HIDROFÍLICO-LIPOFÍLICO (HLB) HLB bajo b j HLB alto Relación estructura HLB Cadena alifática larga < valores de HLB Mayor cantidad de grupos polares y/o grupos polares mas grandes > valores de HLB 12 Emulsiones agua en aceite Surfactantes con HLB 3 y 6 Emulsiones aceite en agua Surfactantes con HLB 8 y 18 Números de HLB Emulsifican 3-6 Agua en aceite Agentes 6-10 dispersantes 8-18 Emulsifican aceite en agua 13 Combinaciones de emulsionantes 2 emulsionantes A y B para conseguir HLB intermedio, HLBx % A= 100 (HLBx-HLBB)/HLBA-HLBB % B=100-% A Estabilidad de una emulsión depende del HLB y de los emulsionantes evaluar experimentalmente emulsiones para igual HLB y distintos emulsionantes Angulo de contacto Cuando dos fluidos están en contacto con un sólido y entre ellos existe una línea de contacto entre las 3 fases Hay un balance entre las tensiones que actúan en el plano de la superficie del sólido Ecuación de Young Θ γ s-a= γ l-s+ γ a-l cos Θ a partir del balance de tensiones superficiales se establece t bl ell ángulo á l de d contacto t t Θ cos Θ= (γ s-a - γ l-s)/ γ a-l Angulo de contacto de una gota de liquido si Θ = 0 sólido es humedecido completamente sobre la superficie de un sólido si Θ =180 no hay humedecimiento 14 Partícula sólida localizada en la interfase aceite - agua Sólidos sin propiedades surfactantes pueden actuar como estabilizantes: •partículas de hidróxido de Mg, Al, Ca •tierra de diatomeas Se adsorben en la interfase y evitan la unión de •silicatos las gotas de aceite •proteínas coaguladas Distribución de las partículas depende del balance de las tensiones de interfase γ sólido-agua, γ agua-aceite, γ sólido-aceite ACEITE ACEITE 15 Estabilidad coloidal Sedimentación velocidad de sedimentación o cremado v= g.a2 (ρ1- ρ2)/18 η g fuerza de gravedad 9,8 9 8 m/seg2 para separación centrifuga es r.w2 ( r= radio del rotor y w velocidad angular) a diámetro de la partícula ρ1 densidad de la partícula; ρ2 densidad del medio, η viscosidad del medio de dispersión Velocidad de sedimentación se puede disminuir: ↓ diámetro de partícula ↓Δ densidad ↑ viscosidad fase dispersante 16 Validez Ec Stokes: esferas rígidas, aisladas y el medio homogéneo Desviaciones a Ec Stokes velocidad ↑ por: interacciones entre partículas floculadas con > diámetro velocidad ↓: colisiones entre ppartículas próximas p movimiento Browniano Fenómenos de agregación: floculación o coalescencia La ocurrencia de floculación o coalescencia depende de las fuerzas de atracción y repulsión entre las partículas Hay 5 tipos posibles de fuerzas: • fuerzas electrostáticas de repulsión •Fuerzas de Van der Waals •Fuerzas repulsivas de corto alcance •fuerzas estéricas •fuerzas de solvatación 17 Formación y estabilidad de las distintas dispersiones Soles dispersión S/L Emulsiones dispersión L/L Espumas dispersión G/L Soles según diámetro partículas: •soles coloidales 1nm-0,5 μm compuestos por macromoléculas proteínas, polisacáridos, lípidos (gomas, yema de huevo) •soles groseros o suspensiones > 0,5 μm compuestos por cristales, fragmentos de paredes celulares (manteca de maní, ketchup) 18 Preparación de soles Aumento del tamaño de partículas de fd ppor agregación g g de moléculas en forma controlada: cristalización controlada de azúcares y grasas precipitación isoeléctrica desnaturalización térmica de proteínas Disminución del tamaño de partículas de fd (peptización) adición de agentes (H+, sales, enzimas) medios mecánicos (molienda trituración, picado) • Uso de soles sol agentes espesantes y gelificantes Calor gel modificación química 19 Geles uniones Agua inmovilizada Moléculas se agregan parcialmente p gel Uniones: electrostáticas, covalentes, ptes H, regiones micocristalinas Fuerza del gel Longitud zona de unión Fortaleza unión Geles termo reversibles: Uniones electrostáticas, electrostáticas pte H ej gelatina, gel de agar Geles termo irreversibles: Uniones por enlaces covalente, interacciones hidrofóbicas ej clara de huevo cocida, embutidos cárnicos, alginatos 20 Representación esquemática de distintos tipos de geles Geles Punto de vista reológico 21 Ensayo de compresión •Módulo de Young (E):. pendiente de zona donde el esfuerzo es proporcional a la deformación: E = σ/e •Esfuerzo a la ruptura (σr): Es el máximo esfuerzo antes de la ruptura. ruptura •Deformación a la ruptura (εr): Es la deformación porcentual en el punto de ruptura • •Resistencia o firmeza del material cociente entre el esfuerzo y la deformación a la ruptura: Firmeza = σr/e r módulo de Young (N) 300000 200000 100000 0 0.0 0.5 1.0 1.5 2.0 2.5 % de k-carragenano Propiedades funcionales 22 Formación de emulsiones Dispersión p mecánica de una fase en otra Entregar un trabajo para formar la interfase se necesitan 250.000 erg para dispersar 1 ml de aceite de oliva en gotas de 5 μm en 10 ml de agua con un surfactante (emulsionate) γ disminuye de 22.9 a 3 dinas/cm ↓el trabajo a 36000 erg Identificación del tipo de emulsión Método del colorante Leche Azul de metileno/Sudan III Leche (O/W) Crema Crema (O/W) Mayonesa (O/W) Manteca (W/O) Manteca Añadir la mezcla de colorantes y mezclar bien Margarina (W/O) Margarina Mayonesa Azul de metileno Hidrosoluble O/W Azul Sudan III Rojo Liposoluble W/O 23 Mecanismos de inestabilización en emulsiones aceite en agua Estabilidad de emulsiones Agentes estabilizantes •surfactantes •partículas finamente divididas adsorbidas en la interfase •hidrocoloides Hidrocoloides: aumentan la viscosidad de la fase continua y pueden formar películas de interfase alrededor de gotas 24 Emulsiones alimenticias • Aderezos, mayonesa – Yema de huevo aporta la lecitina que actúa como emulsificante – Emulsión aceite de agua (> 60% aceite) • Emulsiones cárnicas protein gel matrix protein film • productos de repostería -red de almidón y proteínas Espumas Dispersión G/L (o semisólido) diámetros burbujas 1 μm a cm mucho mas inestables que emulsiones (> diámetro y > Δρ) gas retenido (baja densidad) gran superficie entre fases paredes rígidas, rígidas semirígidas y elásticas Lamelas reflejan la luz (opacas) 25 Espumas crema batida, helados, pan, malvavisco, merengue, espuma de la cerveza Formación de una espuma sustancia espumante en la fase continua antes de dispersar el gas el espumante debe adsorberse en la superficie del líquido y ↓ γ evitar coalescencia mediante la formación de una lamela resistente Espumantes: •lípidos tensioactivos •glucósidos derivados de la celulosa •Proteínas Formación de una espuma dispersión condensación Se disuelve gas a presión Se inyecta gas (orificios o batido) en la sol espumante en la sol espumante al ↓P parte del gas disuelto se libera y hay expansión (crema en aerosol) Presión del gas en una burbuja: P= Pa + 2 γ/R Burbujas pequeñas > P Pa presión atmosférica, γ tensión superficial, R radio de curvatura de la burbuja 26 Estabilidad de una espuma Persistencia: tiempo que una unidad de volumen de gas permanece en la espuma Tipos de inestabilidad A) Maduración de Ostwald: difusión de gas desde las burbujas pequeñas a las grandes o a la atmósfera B) Drenado de líquido desde y a través de la capa de espuma por acción de la gravedad C) Coalescencia de las burbujas por la inestabilidad del film que las separa Efecto de sistemas dispersos sobre la velocidad de las reacciones Sistema disperso componentes están á en compartimentos i velocidad de reacción Coeficiente de Reparto Transporte de reactivos entre compartimentos Adsorción de reactivos en interfases 27 Coeficiente de reparto sistema de dos fases, aceite y agua hay componentes que pueden ser solubles en ambas fases [HA]aq [HA]oil P=Caceite/Cagua Paparente =concentración total de ácido (disociado y sin disociar) Antimicrobianos en emulsiones aceite en agua: 28 Coeficiente de reparto Antioxidantes en emulsiones aceite en agua: antioxidantes lipofílicos se orientan hacia la interfase aceite-agua y ejercen acción antioxidante i id hidrofílico hid fíli se disuelve di l en la l fase f acuosa y resulta l menos efectivo f i en emulsión Antioxidantes en un aceite antioxidante hidrofílico es mas efectivo ya que se ubican en interfase aceite-aire Flavor en un líquido: P=Cg/Cp Cg: conc de odorante en la fase gaseosa Cp: conc. De odorante en el seno del líquido P varía con la composición del líquido: Agregado de 1 % de hidrato de carbono o proteína Agregado de lípido para odorantes hidrofóbicos ↓ flavor Transporte de reactivos entre compartimentos Reacciones químicas involucran transporte de reactivos entre compartimentos t transporte t de d reactivos ti depende: d d de la distancia a recorrer movilidad molecular cuando el solvente esta inmovilizado la velocidad de reacción disminuye L= D. t0,5 L distancia; D coeficiente de difusión; t0,5 tiempo para reducir a la mitad la diferencia de concentraciónt 29 Adsorción de reactivos en interfases •disminuir su concentración efectiva y reactividad •aumentar la reactividad si ambos reactivos se adsorben en la interfase Interacción entre surfactantes y polipeptidos Resumen •Introducción a los sistemas dispersos, clasificación, características •Fenómenos F ó dde superficie fi i e interfase i f •Efecto de la temperatura y de los solutos sobre la tensión interfacial •Surfactantes, tipos, HLB, mecanismo de adsorción , comparaciones •Angulo de contacto •Estabilidad de sistemas coloidales •Formación F ió y estabilidad bilid d de d distintas di i dispersiones di i líquidas: lí id geles, emulsiones y espumas Efecto de sistemas dispersos sobre la velocidad de las reacciones 30